外源NO对镧胁迫下燕麦幼苗活性氧代谢和矿质元素含量的影响
2017-05-23刘建新王金成刘秀丽
刘建新, 王金成, 刘秀丽
(陇东学院生命科学与技术学院,甘肃省高校陇东生物资源保护与利用省级重点实验室, 甘肃 庆阳 745000)
外源NO对镧胁迫下燕麦幼苗活性氧代谢和矿质元素含量的影响
刘建新*, 王金成, 刘秀丽
(陇东学院生命科学与技术学院,甘肃省高校陇东生物资源保护与利用省级重点实验室, 甘肃 庆阳 745000)
为探讨外源NO对稀土元素镧(La)胁迫下燕麦幼苗生理响应的调节作用,采用水培方法,研究了NO供体硝普钠(SNP)对20 mmol/L La3+胁迫下幼苗生长、活性氧代谢和矿质元素吸收的影响。结果表明,La3+胁迫下燕麦幼苗根长、株高和植株干重明显下降,根系和叶片活性氧(O2·-和H2O2)水平及丙二醛(MDA)含量显著提高,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性降低,抗坏血酸过氧化物酶(APX)活性及抗坏血酸(AsA)和谷胱甘肽(GSH)含量提高;施加100 μmol/L SNP能显著缓解La3+胁迫对燕麦幼苗生长的抑制作用,降低La3+胁迫下燕麦幼苗根系和叶片O2·-、H2O2、MDA、AsA和GSH含量,提高SOD、CAT、POD和APX活性。La3+胁迫提高了燕麦幼苗根系和叶片La和铜(Cu)的富集量,抑制了钾(K)、钙(Ca)、镁(Mg)、铁(Fe)、锌(Zn)、锰(Mn)的吸收;施加100 μmol/L SNP可显著抑制燕麦从根系向叶片La的转运,缓解La3+胁迫对K、Ca、Mg、Fe吸收的抑制及对Cu吸收的促进效应,使根系中Zn、Mn含量下降,叶片Zn、Mn含量增加。由此表明,外源NO能够通过提高抗氧化酶活性及影响La的转运和矿质元素吸收,缓解La3+胁迫对燕麦幼苗的氧化伤害和生长抑制。
一氧化氮;镧胁迫;燕麦;活性氧代谢;矿质元素
中国稀土资源丰富,稀土作为微肥施用广泛应用,20世纪末施用面积已达667万hm2[1]。大量研究证明,合理施用稀土不仅能够增强植物的抵抗力[2],还能改善作物品质和提高产量[3]。然而,随着稀土微肥的大量使用,属于重金属的稀土元素在环境中积累产生的生态毒害效应已备受关注。镧(La)是17种稀土元素中性质最活泼的一种,研究减缓稀土元素La负面效应的措施,对合理施用稀土微肥具有重要意义。
一氧化氮(nitric oxide,NO)是植物中的一种第二信使,在调节植物重金属胁迫抗性方面具有重要作用[4],但NO缓解重金属毒害的机理仍不明了。有研究认为,NO是通过增强植物抗氧化能力和抵抗重金属吸收缓解了重金属胁迫伤害。如NO通过提高抗氧化防护增强了番茄(Lycopersiconesculentum)对铜、镉胁迫的耐性[5];逆转了锰胁迫下水稻(Oryzasativa)抗氧化物质含量的下降和抗氧化酶活性的升高,减轻了H2O2积累对膜脂的过氧化损伤[6];通过诱导根部IRTI基因的表达,增加了拟南芥(Arabidopsisthaliana)根系对镉的截留,从而减少了地上部镉积累的毒害[7]等。但另有研究认为,NO对重金属胁迫的缓解并不是通过抑制植物对重金属的吸收而发挥作用,如外源NO供体硝普钠处理能够缓解铅胁迫对拟南芥的毒害,但不能减少拟南芥对铅的积累[8];外源NO供体亚硝基谷胱甘肽能够增强龙葵(Solanumnigrum)对镉胁迫的抗性,却促进龙葵根系对镉的吸收[9]。这些研究表明NO可能存在多种调控机制参与不同植物对重金属胁迫响应的调节。
燕麦(Avenanuda)是燕麦属喜阴凉、耐贫瘠的一种小杂粮作物,对控制血糖、血压和血脂升高有独特功效[10]。我国燕麦主要分布在内蒙古、山西、河北和甘肃等省区,年种植面积约55万hm2。目前关于NO缓解重金属胁迫的研究多以主要粮食作物或药用植物为主,以小杂粮作物为对象的研究并不多见,未见NO对燕麦La胁迫响应调节的研究报道。本试验研究外源NO供体硝普钠(sodium nitroprusside,SNP)对La胁迫下燕麦幼苗生长、活性氧代谢和矿质元素积累的影响,探讨NO提高La胁迫抗性的作用及其生理机制,旨在为应用NO减轻稀土对燕麦伤害提供参考。
1 材料与方法
1.1 供试材料
试验于2015年5-10月在甘肃省高校陇东生物资源保护与利用省级重点实验室和生物科技园日光温室进行。供试燕麦品种‘定莜6号’种子由甘肃省定西市旱作农业科研推广中心提供。Hoagland营养液组成为Ca(NO3)2·4H2O、NH4NO3、KNO3、KH2PO4、MgSO4、微量元素,所用试剂均为分析纯。氯化镧(LaCl3·2.5H2O)提供La3+。NO供体SNP([Na2Fe(CN)5]NO),用蒸馏水配成400 μmol/L母液,5 ℃避光保存,用时按所需浓度稀释。
1.2 氯化镧和硝普钠实验浓度的筛选
选大小均一的饱满燕麦种子,用0.5% NaClO消毒后播种在瓷盘珍珠岩中于培养箱25 ℃暗培养,待种子露白后挑选100个发芽一致的种子转移至培养皿(直径12 cm)珍珠岩中在25 ℃光周期14 h/10 h(光照/黑暗)和光照强度150 μmol/(m2·s)条件下浇水培养,待幼苗2叶1心时浇灌浓度分别为0,2.5,5,10,20,30,40,50 mmol/L氯化镧(LaCl3·2.5H2O)溶液,浇灌量每个培养皿每天15 mL,重复3次。培养12 d后从培养皿中取出幼苗,洗净珍珠岩并吸干表面水分后用电子天平称量植株鲜重,计算幼苗单株鲜重(总鲜重/株数),结合培养期间幼苗外观变化特征选出氯化镧胁迫浓度。在选出的氯化镧溶液(20 mmol/L)中分别添加0,10,25,50,100,150,200,250,300 μmol/L SNP溶液用同样的方法在同样条件下进行培养,培养12 d后根据幼苗生长速率选出进一步实验的SNP浓度(100 μmol/L)。幼苗生长速率(GR)的计算:GR=(W2-W1)/(T2-T1)。式中:W1表示处理第0 天30株幼苗的干重;W2表示处理第12 天 30株幼苗的干重;T2和T1分别表示2次测定的时间(d)。
1.3 试验设计
燕麦种子播种在塑料盆(口径200 mm,高140 mm)珍珠岩中,播量每盆约150粒,浇水后置温室培养,温度21~36 ℃,湿度60%~82%,光照度530~770 μmol/(m2·s),幼苗长至2片叶子时选100株生长一致的植株洗净根部珍珠岩转入4 L水培箱中用1/2 Hoagland溶液培养,培养7 d后换成完全营养液培养,此后每2 d更换一次营养液,当幼苗具3片叶子时根据筛选的LaCl3·2.5H2O和SNP浓度进行胁迫缓解试验,营养液培养和处理期间用电动气泵连续24 h 通气。试验设4个处理:1)对照(CK),Hoagland完全营养液;2)La,含20 mmol/L LaCl3·2.5H2O的Hoagland营养液;3)La+SNP,含20 mmol/L LaCl3·2.5H2O和100 μmol/L SNP的Hoagland营养液;4)SNP,含100 μmol/L SNP的Hoagland营养液。每个处理重复4次,随机排列。处理期间每天更换处理液,并调节pH至6.0±0.32。处理12 d后分别剪取植株根系和倒数第2~3片功能叶用液氮速冻后-80 ℃保存,测定相关生理指标。
1.4 测定指标与方法
1.4.1 植株生长状况的测定 处理12 d后取出植株,用蒸馏水冲洗干净后用直尺测量幼苗主根长度和植株高度,并将根系和地上部分开,在(105±1) ℃烘箱杀青20 min,80 ℃烘干至恒重,电子天平称量干重。
1.4.2 超氧阴离子(O2·-)、过氧化氢(H2O2)和丙二醛(MDA)含量的测定 分别称取0.500 g 根系和叶片样品,用5 mL pH 7.0的50 mmol/L磷酸缓冲液冰浴研磨,12000 r/min 4 ℃离心30 min,上清液为待测提取液。然后按Sui等[11]的方法测定O2·-含量,采用Moloi等[12]的方法测定H2O2含量,按Predieri等[13]的方法测定MDA含量。结果计算以单位材料鲜重为基础。
1.4.3 抗氧化酶活性和抗氧化物质含量的测定 分别称取0.500 g 根系和叶片用5 mL 50 mmol/L磷酸缓冲液(pH 7.0)冰浴研磨,15000 r/min冷冻离心15 min,取上清液按陈建勋等[14]的方法测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性。分别称取0.200 g根系和叶片依次用2.0 mL 5%三氯乙酸和15%偏磷酸研磨,匀浆液18000 r/min离心20 min,上清液定容至2.0 mL。分别采用Ellman[15]和Arakawa等[16]的方法测定谷胱甘肽(GSH)和抗坏血酸(AsA)含量。以单位材料鲜重为基础计算结果。
1.4.4 植株矿质元素含量的测定 分别称取根系和叶片烘干磨细过0.18 mm筛孔样品各0.250 g,置微波消化系统中加10 mL HNO3-HClO4(8∶1)消化,定容至50 mL,采用DRE型电感耦合等离子体原子发射光谱仪(美国Lee man公司)测定La、钾(K)、钙(Ca)、镁(Mg)、铁(Fe)、铜(Cu)、锌(Zn)、锰(Mn)含量。以单位材料干重为基础计算结果。
1.5 数据分析
数据以平均值±标准差表示,用SPSS 20.0软件方差分析,Duncan法多重比较(显著水平P<0.05)。
2 结果与分析
2.1 氯化镧和SNP实验浓度的筛选
由图1可见,20 mmol/L氯化镧(LaCl3·2.5H2O)处理与对照(0 mmol/L LaCl3·2.5H2O)相比,燕麦幼苗鲜重显著下降,但幼苗仍保持正常绿色;当氯化镧浓度≥30 mmol/L时,植株枯黄甚至死亡,鲜重急剧下降。因此,氯化镧胁迫浓度选择燕麦幼苗受到胁迫但能承受的最高浓度20 mmol/L。在20 mmol/L氯化镧胁迫下添加50~200 μmol/L SNP均能显著提高燕麦幼苗的生长速率,其中100 μmol/L SNP处理提高的幅度最大,所以进一步实验的SNP浓度选用100 μmol/L。
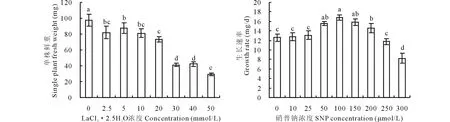
图1 不同浓度氯化镧胁迫下燕麦幼苗单株鲜重和不同浓度硝普钠对20 mmol/L氯化镧胁迫下燕麦幼苗生长速率的影响Fig.1 Single plant fresh weight of oat seedlings under different concentration of LaCl3·2.5H2O stress and effect of different concentration of sodium nitroprusside (SNP) on growth rate of oat seedling under 20 mmol/L LaCl3·2.5H2O stress 不同字母表示处理间差异显著(P<0.05). Different letters are significantly different at P<0.05.
2.2 外源NO对La胁迫下燕麦幼苗根长、株高和干重的影响
由表1可知,与CK相比,La胁迫下燕麦幼苗根长、株高及根系和地上部干重分别下降了34.8%,28.3%,32.1%和31.0%;La+SNP处理的根长和株高分别比单独La处理增加了31.3%和23.4%,根系干重和地上部干重分别增加了26.7%和13.8%;SNP单独处理的根长和根系干重与CK无显著差异,但株高和地上部干重分别提高了7.4%和12.8%。

表1 镧胁迫下外源NO对燕麦幼苗根长、株高和干重的影响Table 1 Effect of exogenous NO on roots length, plant height and dry weight of oat seedling under La stress
注:同列不同字母表示差异显著(P<0.05),下同。
Note:The different letters in the same column indicate significant differences atP<0.05, the same below.
2.3 外源NO对La胁迫下燕麦幼苗O2·-、H2O2和MDA含量的影响
由表2可见,与CK相比,La胁迫下燕麦幼苗根系和叶片中O2·-、H2O2和MDA含量显著提高;La+SNP处理与La处理相比,O2·-、H2O2和MDA含量在根系中分别下降了43.8%,40.6%和31.4%,叶片中分别下降了24.8%,25.3%和31.0%;SNP单独处理的根系和叶片中O2·-和H2O2含量比CK分别下降32.3%,15.0%和28.0%,40.8%,根系中MDA含量与CK差异不明显,叶片中MDA含量比CK显著下降了38.9%。
2.4 外源NO对La胁迫下燕麦幼苗抗氧化系统的影响
从图2可见,与CK相比,La胁迫明显降低了燕麦幼苗根系和叶片SOD、CAT和POD活性,却显著提高了APX活性;La+SNP处理的燕麦根系和叶片中SOD、CAT、POD和APX活性在根系中分别比La单独处理显著提高了22.1%,124.6%,38.4%和26.0%,叶片中分别提高了31.3%,32.3%,67.4%和21.3%;SNP单独处理下根系和叶片SOD、APX活性、根系CAT及叶片POD活性与CK无明显差异,而叶片CAT活性下降了11.0%,根系POD活性则提高了11.8%。

表2 镧胁迫下外源NO对燕麦幼苗O2·-,H2O2和丙二醛含量的影响Table 2 Effect of exogenous NO on contents of O2·-, H2O2 and MDA in oat seedling under La stress

图2 外源NO对镧胁迫下燕麦幼苗根系和叶片抗氧化酶活性和抗氧化物质含量的影响Fig.2 Effect of exogenous NO on antioxidant enzyme activities and antioxidants content in oat seedling under La stress 不同字母表示同一器官不同处理间差异显著(P<0.05),图3同。Different letters are significantly different at P<0.05 within the same organ,the same as Fig.3.
与CK相比,La处理的燕麦幼苗AsA和GSH含量在根系中分别提高了46.7%和42.3%,叶片中分别提高了51.4%和275.0%;La+SNP处理的AsA和GSH含量在根系中分别比La单独处理下降了32.5%和8.1%,叶片中分别下降了26.7%和75.6%;SNP单独处理的根系和叶片中AsA含量比CK分别提高了21.6%和39.1%,根系中GSH含量变化不大,但叶片中GSH含量下降了50.0%。
2.5 外源NO对La胁迫下燕麦幼苗La含量的影响
由图3可见,与CK相比,La胁迫下燕麦根系和叶片La含量显著提高,分别提高了20.4倍和55.6倍;增添SNP对La胁迫下燕麦根系La含量没有明显影响,却显著降低了叶片La含量,下降了44.3%;SNP单独处理的燕麦根系和叶片La含量与CK无显著差异。
2.6 外源NO对La胁迫下燕麦幼苗矿质元素含量的影响
从图4可知,La胁迫显著降低了燕麦幼苗根系和叶片K、Ca、Mg、Fe、Zn、Mn含量,却提高了Cu含量。La胁迫下添加SNP后燕麦根系和叶片K、Ca、Mg等大量元素明显增加,根系中分别比La单独处理提高了24.8%,57.3%和20.6%,叶片中分别提高了38.6%,81.5%和94.3%;根系和叶片微量元素Fe分别比La单独处理提高了88.8%和62.8%,根系中Cu、Zn含量却下降了42.0%和31.3%,叶片Cu含量下降了27.4%,Zn含量则提高了29.0%,根系中Mn含量下降了20.1%,叶片Mn含量却提高了92.1%。SNP单独处理与CK相比显著提高了根系Ca含量,却降低了叶片K含量,对根系K、叶片Ca和根系、叶片Mg等大量元素含量无明显影响;对根系Fe、Zn、Mn等微量元素含量无显著影响,却提高了根系Cu含量;对叶片Cu、Mn含量无明显影响,却显著降低了Fe、Zn含量。
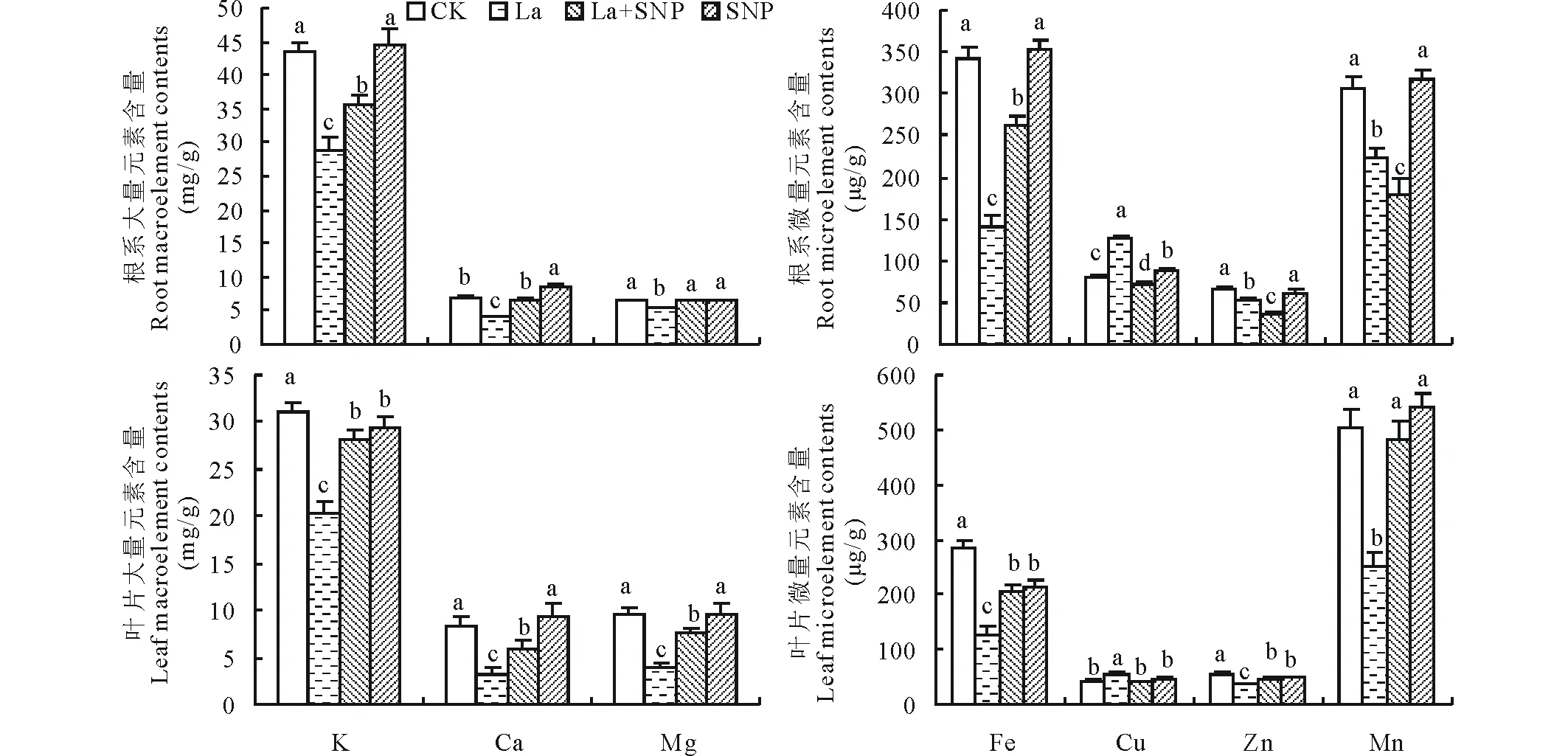
图4 外源NO对镧胁迫下燕麦幼苗矿质元素含量的影响Fig.4 Effect of exogenous NO on the mineral element contents in oat seedlings under La stress 不同字母表示同一元素含量在不同处理间差异显著(P<0.05)。Different letters are significantly different at P<0.05 within the same mineral element.
3 讨论
生长受抑是植物遭受重金属胁迫的普遍反应,NO信号能够缓解重金属胁迫对植物生长的抑制[4]。Wang等[17]研究发现,100 μmol/L SNP有效减轻了100 μmol/L CdCl2胁迫对黑麦草(Loliumperenne)生长的抑制程度。本试验表明,100 μmol/L SNP可使20 mmol/L稀土重金属La3+胁迫下燕麦幼苗根长和株高分别提高31.3%和23.4%,植株干重增加18.4%(表1)。这可能与外源NO能够促进重金属胁迫下内源NO的合成[18],NO通过质外体作用于细胞壁使之松弛并提高膜的流动性和离子选择性[19]有关,从而使La3+胁迫下燕麦生长受抑得到缓解。
活性氧积累诱导的膜脂过氧化是重金属胁迫下植物产生伤害的重要原因[4]。王建等[20]研究证实,外源NO能够缓解Cu胁迫对番茄的氧化伤害。然而NO减缓重金属毒害的抗氧化机制目前仍认识不一。一种观点认为外源NO通过提高抗氧化系统活性,增强了其活性氧清除的能力,从而缓解了重金属诱导的氧化伤害[17,19];另一种观点则认为外源NO的抗氧化作用并非是提高抗氧化系统活性而是通过直接清除活性氧来实现的,如Singh等[21]的研究表明,外源NO能够降低镉诱导的小麦(Triticumaestivum)根部H2O2和MDA积累,但阻止了镉胁迫下SOD、CAT、GPX和GR等酶活性的升高;Hsu等[22]发现,外源NO能够逆转镉诱导水稻AsA、GSH含量下降以及SOD、CAT、APX、GPX和GR活性升高,从而抑制H2O2积累。本研究中,外源NO供体SNP显著降低了La3+胁迫下燕麦幼苗O2·-和H2O2等活性氧的积累,并降低了膜脂过氧化产物MDA的含量(表2),有效增强了幼苗根系和叶片的SOD、POD和APX活性,降低了AsA和GSH含量,且根系AsA含量降幅大于叶片,但叶片GSH含量的降幅大于根系(图2)。表明外源NO是通过增强抗氧化酶活性和调节抗氧化物质含量,减缓La3+胁迫诱导的活性氧积累对燕麦幼苗造成的膜脂氧化伤害。这与Panda等[23]的外源NO提高水稻SOD、CAT、POD和GR活性并抑制镉诱导AsA和GSH含量升高,从而增强水稻镉胁迫抗性的研究结果类似。外源NO能够提高重金属胁迫下植物抗氧化酶活性的原因可能与其增强编码SOD、CAT、POD和APX基因mRNA的表达量有关[24]。而NO降低La3+胁迫下燕麦幼苗AsA和GSH含量可能是因为APX活性提高后增加了AsA-GSH循环中AsA和GSH消耗所致[25]。
重金属离子积累和矿质营养失衡是重金属胁迫下植物受害的重要因素。Wang等[17]研究报道,100 μmol/L CdCl2胁迫显著提高了黑麦草(Loliumperenne)幼苗根系和地上部Cd2+的积累,50~200 μmol/L SNP明显降低了Cd从黑麦草根系向地上部的转运,并有效缓解了Cd胁迫对K, Ca, Mg,Fe, Cu, Zn吸收的抑制。本研究表明,100 μmol/L SNP并不能抑制20 mmol/L La3+胁迫下燕麦根系对La3+的吸收,却能有效抑制La3+由根系向叶片的运输(图3)。这与肖强等[26]以水稻为材料的研究结果一致。其原因可能与NO能够调节植物细胞壁成分代谢有关[27],进而促进了根部细胞壁对La3+的束缚,降低了向叶片的运输。外源NO使La胁迫下燕麦根系和叶片K、Ca、Mg含量提高,且叶片增幅大于根系,Fe含量也明显增加,但根系的增幅大于叶片,而Cu含量在根系和叶片均下降,Zn、Mn含量在根系中下降,叶片中显著增加(图4)。表明NO参与La胁迫下燕麦对矿质元素的吸收积累。其可能的机制是NO与矿质元素结合形成亚硝基复合物后影响了矿质元素的吸收[28],或者是NO通过提高质膜H+-ATP酶和5′-AMP酶活性后加速了ATP水解而产生大量H+并泵出胞质,从而提高了矿质离子的次级跨膜转运速率[29]。然而,NO调控重金属胁迫下植物矿质元素吸收转运的机制可能在不同植物中存在差异,且比较复杂[4],尚需进一步深入探究。
4 结论
20 mmol/L La3+胁迫诱导燕麦活性氧代谢紊乱并引发膜脂过氧化,干扰矿质元素吸收和积累,植株生长受到抑制。100 μmol/L NO供体SNP缓解了La3+胁迫对燕麦的氧化伤害和生长抑制,其可能机理有:1)通过提高SOD、CAT、POD、APX等抗氧化酶活性,降低了La3+胁迫诱导的活性氧积累。2)通过降低La3+从根系向叶片的转运,增加了K、Ca、Mg、Fe的吸收,降低了Cu的积累,并调节Zn、Mn在根部和叶片的合理分布。
References:
[1] Gong D H, Wang Z Z, Ji X. Effects of lanthanum on growth and physiological characteristics of spirulina under lead stress. Journal of the Chinese Rare Earth Society, 2015, 33(4): 487-493. 巩东辉, 王志忠, 季祥. 重金属铅胁迫下镧对螺旋藻生长及生理特性的影响. 中国稀土学报, 2015, 33(4): 487-493.
[2] Gao Y S, Xu X L, Wu J Q,etal. Physiological regulation of exogenous europium on salt tolerance in cyperus esculentus seedlings. Journal of the Chinese Rare Earth Society, 2012, 30(5): 605-611. 高永生, 徐晓丽, 吴俊清, 等. 外源铕对油莎豆幼苗耐盐性的生理调控作用. 中国稀土学报, 2012, 30(5): 605-611.
[3] Yu H B, Wang J S, Liu Z,etal. Effect of rare earths of agriculture, wide-narrow row spacing cultivation on components of yield and quality in fresh eating maize. Journal of the Chinese Rare Earth Society, 2013, 31(1): 102-107. 余海兵, 王金顺, 刘正, 等. 农用稀土施用量、宽窄行配置对鲜食糯玉米产量构成因素及品质的影响. 中国稀土学报, 2013, 31(1): 102-107.
[4] Xia H W, Shi G X, Huang M,etal. Advances on effects of nitric oxide on resistances of plants to heavy metal stress. Acta Ecologica Sinica, 2015, 35(10): 3139-3147. 夏海威, 施国新, 黄敏, 等. 一氧化氮对植物重金属胁迫抗性的影响研究进展. 生态学报, 2015, 35(10): 3139-3147.
[5] Cui X M, Wu X B, Li X Y,etal. Responses of growth, functional enzyme activity in biomembrane of tomato seedlings to excessive copper, cadmium and the alleviating effect of exogenous nitric oxide. Journal of Plant Nutrition and Fertilizer, 2011, 17(2): 349-357. 崔秀敏, 吴小宾, 李晓云, 等. 铜、镉毒害对番茄生长和膜功能蛋白酶活性的影响及外源NO的缓解效应. 植物营养与肥料学报, 2011, 17(2): 349-357.
[6] Srivastava S, Dubey R S. Nitric oxide alleviates manganese toxicity by preventing oxidative stress in excised rice leaves. Acta Physiologiae Plantarum, 2012, 34(2): 819-825.
[7] He Y K, Tang R H, Yi H,etal. Nitric oxide represses theArabidopsisfloral transition. Science, 2004, 305(5692): 1968-1971.
[8] Phang I C, Leung D W M, Taylor H H,etal. The protective effect of sodium nitroprusside (SNP) treatment onArabidopsisthalianaseedlings exposed to toxic level of Pb is not linked to avoidance of Pb uptake. Ecotoxicology and Environmental Safety, 2011, 74(5): 1310-1315.
[9] Xu J, Wang W J, Sun J H,etal. Involvement of auxin and nitric oxide in plant Cd-stress responses. Plant and Soil, 2011, 346(1/2): 107-119.
[10] Drzikova B, Dongowski G, Gebhardt E. Dietary fibre-rich oat-based products affect serum lipids, microbiota, formation of short-chain fatty acids and steroids in rats. British Journal of Nutrition, 2005, 94(6): 1012-1025.
[11] Sui N, Liu X, Wang N,etal. Response of xanthophylls cycle and chloroplastic antioxidant enzymes to chilling stress in tomato over-expressing glycerol-3-phosphate acyltransferase gene. Photosynthetica, 2007, 45(3): 447-454.
[12] Moloi M J, Westhuizen A J. The reactive oxygen species are involved in resistance responses of wheat to the Russian wheat aphid. Journal of Plant Physiology, 2006, 163(11): 1118-1125.
[13] Predieri S, Norman H A, Krizek D T,etal. Influence of UV-B radiation on membrane lipid composition and ethylene of evolution in ‘Doyenne d’Hiver’ pear shoots grown in vitro under different photosynthetic photo fluxes. Environmental and Experimental Botany, 1995, 35(35): 151-160.
[14] Chen J X, Wang X F. Plant Physiology Experimental Guidance[M]. Guangzhou: South China University of Technology Press, 2006. 陈建勋, 王晓峰. 植物生理学实验指导[M]. 第二版. 广州: 华南理工大学出版社, 2006.
[15] Ellman G L. Tissue sulfhydryl groups. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77.
[16] Arakawa N, Tsutsumi K, Sanceda N G,etal. A rapid and sensitive method for the determination of ascorbic acid using 4, 7-diphenyl-1, 10-phenanthroline. Agricultural Biology and Chemistry, 1981, 45(5): 1289-1290.
[17] Wang Q H, Liang X, Dong Y J,etal. Effects of exogenous nitric oxide on cadmium toxicity, element contents and antioxidative system in perennial ryegrass. Plant Growth Regulation, 2012, 69(1): 11-20.
[18] Verma K, Mehta S K, Shekhawat G S. Nitric oxide (NO) counteracts cadmium induced cytotoxic processes mediated by reactive oxygen species (ROS) inBrassicajuncea: cross-talk between ROS, NO and antioxidant responses. Biometals, 2013, 26(2): 255-269.
[19] Leshem Y Y, Hamarat E. The characterization and contrasting effects of the nitric oxide free radical in vegetative stress and senescence ofPisumsativumLinn. forage. Journal of Plant Physiology, 1996, 148(3/4): 258-263.
[20] Wang J, Yu S X, Zhang M,etal. Exogenous NO mediated GSH-PCs synthesis pathway in tomato under copper stress. Chinese Journal of Applied Ecology, 2014, 25(9): 2629-2636. 王建, 于世欣, 张敏, 等. 外源NO介导Cu胁迫下番茄GSH-PCs合成途径. 应用生态学报, 2014, 25(9): 2629-2636.
[21] Singh H P, Batish D R, Kaur G,etal. Nitric oxide (as sodium nitroprusside) supplementation ameliorates Cd toxicity in hydroponically grown wheat roots. Environmental and Experimental Botany, 2008, 63(1/3): 158-167.
[22] Hsu Y T, Kao C H. Cadmium toxicity is reduced by nitric oxide in rice leaves. Plant Growth Regulation, 2004, 42(3): 227-238.
[23] Panda P, Nath S, Chanu T T,etal. Cadmium stress-induced oxidative stress and role of nitric oxide in rice (OryzasativaL.). Acta Physiologiae Plantarum, 2011, 33(15): 1737-1747.
[24] Wang L N, Yang F J, Wang X F,etal. Effects of exogenous nitric oxide on growth and transcriptional expression of antioxidant enzyme mRNA in tomato seedlings under copper stress. Acta Horticulturae Sinica, 2010, 37(1): 47-52. 王丽娜, 杨凤娟, 王秀峰, 等. 外源NO对铜胁迫下番茄幼苗生长及其抗氧化酶编码基因mRNA转录水平的影响. 园艺学报, 2010, 37(1): 47-52.
[25] Jin Y H, Tao D L, Hao Z Q,etal. Environmental stresses and redox status of ascorbate. Acta Botanica Sinica, 2003, 45(7): 795-801.
[26] Xiao Q, Ru Q M, Wu F H,etal. Nitric oxide alleviation for oxidative stress caused by lanthanum in rice leaves. Journal of the Chinese Rare Earth Society, 2007, 25(6): 745-750. 肖强, 茹巧美, 吴飞华, 等. 一氧化氮对水稻叶片中由镧引起的氧化胁迫的缓解作用. 中国稀土学报, 2007, 25(6): 745-750.
[27] Correa-Aragunde N, Lombardo C, Lamattina L. Nitric oxide: an active nitrogen molecule that modulates cellulose synthesis in tomato roots. New Phytologist, 2008, 179(2): 386-396.
[28] Graziano M, Beligni M V, Lamattina L. Nitric oxide improves internal iron availability in plants. Plant Physiology, 2002, 130(4): 1852-1859.
[29] Cui X M, Zhang Y K, Wu X B,etal. The investigation of the alleviated effect of copper toxicity by exogenous nitric oxide in tomato plants. Plant Soil and Environment, 2010, 56(6): 274-281.
Effect of exogenous nitric oxide on active oxygen metabolism and mineral contents in oat seedlings under lanthanum stress
LIU Jian-Xin*, WANG Jin-Cheng, LIU Xiu-Li
CollegeofLifeSciencesandTechnology,LongdongUniversity,UniversityProvincialKeyLaboratoryforProtectionandUtilizationofLongdongBio-resourcesinGansuProvince,Qingyang745000,China
The pollution of agricultural systems by rare earth elements has become one of the most serious environmental deterioration problems worldwide. The signaling molecule nitric oxide (NO) is involved in the plant response to heavy metals. The aim of this study was to investigate the regulating effect of exogenous NO on the physiological response of oat seedlings to lanthanum (La) stress. We conducted a hydroponic experiment in which the exogenous NO donor sodium nitroprusside (SNP) was applied to oat seedlings under a 20 mmol/L La3+treatment and plant growth, active oxygen metabolism, and the absorption of minerals were investigated. The root length, plant height, and dry weight of oat seedlings were significantly lower in La3+-stressed seedlings than in control seedlings. Compared with control plants, those treated with La3+showed significantly increased active oxygen (O2·-and H2O2) and malondialdehyde (MDA) contents in roots and leaves, decreased activities of superoxide dismutase (SOD), catalase (CAT), and peroxidase (POD), and increased ascorbate peroxidase (APX) activity and ascorbic acid (AsA) and glutathione (GSH) contents. Addition of 100 μmol/L SNP to oat seedlings under La3+stress significantly alleviated the La3+-inhibition of growth. Compared with La3+-treated seedlings, those treated with La3++ SNP showed reduced contents of O2·-, H2O2, MDA, AsA, and GSH in roots and leaves, and increased activities of SOD, CAT, POD, and APX. Seedlings under La3+stress showed increased La and copper (Cu) accumulation in the roots and leaves, but decreased absorption of potassium (K), calcium (Ca), magnesium (Mg), iron (Fe), zinc (Zn), and manganese (Mn). Compared with La3+-treated seedlings, those treated with La3++ SNP showed significantly lower La translocation from roots to leaves, increased absorption of K, Ca, Mg, Fe, increased Cu uptake, lower Zn and Mn contents in roots, and higher Zn and Mn contents in leaves. Consequently, exogenous NO could alleviate the oxidative damage and growth inhibition of oat seedlings under La3+stress by increasing the activities of antioxidant enzymes and altering La translocation and mineral absorption.
nitric oxide; lanthanum stress; oat (Avenanuda); active oxygen metabolism; mineral elements
10.11686/cyxb2016241
http://cyxb.lzu.edu.cn
2016-06-13;改回日期:2016-09-29
甘肃省庆阳市科技计划项目(KZ2014-19)资助。
刘建新(1964-),男,甘肃通渭人,教授,本科。E-mail: liujx1964@163.com*通信作者Corresponding author. E-mail: liujx1964@163.com
刘建新, 王金成, 刘秀丽. 外源NO对镧胁迫下燕麦幼苗活性氧代谢和矿质元素含量的影响. 草业学报, 2017, 26(5): 135-143.
LIU Jian-Xin, WANG Jin-Cheng, LIU Xiu-Li. Effect of exogenous nitric oxide on active oxygen metabolism and mineral contents in oat seedlings under lanthanum stress. Acta Prataculturae Sinica, 2017, 26(5): 135-143.
