刈割次数对紫花苜蓿镉吸收影响及生理响应
2017-05-23李娜孙宁骁宋桂龙濮阳雪华周述琼赵克奇蒋凯
李娜,孙宁骁,宋桂龙*,濮阳雪华,周述琼,赵克奇,蒋凯
(1.北京林业大学草坪研究所,北京 100083;2.深圳市铁汉生态环境股份有限公司,广州 深圳 518040)
刈割次数对紫花苜蓿镉吸收影响及生理响应
李娜1,孙宁骁1,宋桂龙1*,濮阳雪华2,周述琼2,赵克奇2,蒋凯2
(1.北京林业大学草坪研究所,北京 100083;2.深圳市铁汉生态环境股份有限公司,广州 深圳 518040)
采用盆栽试验研究了4种镉(Cd)浓度(0,10,25,50 mg/kg)下,刈割次数(1次,2次,3次)对紫花苜蓿生长和Cd累积量的影响及其生理响应。结果发现,多次刈割提高了紫花苜蓿地上部分的生长速率,促进了地上部分生物量的累积,3次刈割下地上部平均生长速率可达61.6 mg/(株·d),但3次刈割显著抑制了根系的生长(P<0.05)。生长季内2次和3次刈割可以促进根系Cd吸收,增加地上部分Cd累积量,进而提高紫花苜蓿Cd富集量,单株最大镉积累量出现在25 mg/kg Cd浓度的2次刈割处理中,达到75.98 μg/株。同时,2次或3次刈割会降低紫花苜蓿相对电导率、MDA含量,增加脯氨酸含量,改善紫花苜蓿在Cd胁迫下的生理状况。综合分析表明,当土壤Cd浓度不高于25 mg/kg时,紫花苜蓿生长季内2次刈割可以提高Cd污染土壤修复效率。
紫花苜蓿;刈割;Cd吸收;植物修复;生理变化
近年来,由于工业开采频繁、过度施肥、化石燃料的燃烧和污水处理操作不当等原因,导致土地及水体的重金属污染问题日趋严重[1-2],其中镉(Cd)污染成为环境污染的一个热点问题[3-4]。针对当前的土壤Cd污染状况,植物修复是一项既环保又节约治理成本的技术。研究表明,紫花苜蓿(Medicagosativa)因其生物量大和生长迅速,对多种重金属表现出一定的耐受性及累积潜力等特点,成为现在重金属修复研究的重要植物[5-8]。王新等[9]研究指出,紫花苜蓿在高剂量重金属土壤中地上部Cd迁移总量达到了对照的1348.7%,表现出对Cd污染土壤有一定的修复能力。有研究发现,紫花苜蓿在Cd、Cu、Ni、Zn浓度均为50 mg/kg的复合污染土壤上生长,地上部Cd的浓度可以达到202 mg/kg[10]。
在植物修复中,植物对重金属的去除效率主要取决于植物地上部对重金属的富集总量,即植物地上部的生物量和植物体内所含重金属的浓度的乘积[11-14]。刈割作为一种草本植物栽培调控农艺措施,不仅能提高牧草等植物的地上部再生能力;且通过增加植物生物量的积累,促进植物对重金属的吸收,进而提高了修复效率。傅大放等[15]指出,刈割能够促进黑麦草(Loliumperenne)对Pb的吸收和累积。裴昕等[12]的研究表明,刈割提高了龙葵(Solanumnigrum)富集Cd的能力,轻度刈割单株积累量明显增加,重度刈割的刈割部分Cd积累量达总量的1/4。李文学等[11]则指出,多次刈割并没有降低蜈蚣草(Pterisvittata)对As的累积速度,适当增加刈割次数是提高蜈蚣草对As污染土壤的修复效率的一种重要措施。而关于紫花苜蓿作为重金属土壤修复研究的潜力植物,刈割处理是否能提高紫花苜蓿对Cd的吸收总量,刈割频次的增加产生的植物生长的“相对稀释效应”是否影响紫花苜蓿对Cd吸收速率及其含Cd浓度,相关研究报道很少见。
本试验通过研究Cd胁迫下不同刈割频次对紫花苜蓿生长、Cd吸收累积情况及相关生理指标变化情况的影响,分析探讨合理的刈割方式促进紫花苜蓿对土壤中重金属Cd的吸收及富集,为紫花苜蓿在Cd污染土壤修复的应用提供参考。
1 材料与方法
1.1 供试材料及试验地概况
紫花苜蓿种子来自绿冠集团,品种为内蒙古准格尔苜蓿。
供试土壤取自北京市昌平区白浮村,土壤性质为pH 6.8,有机质含量27.1 g/kg,全氮含量2.37 g/kg,有效钾含量28.4 mg/kg,有效磷含量23.1 mg/kg,Cd含量1.61 mg/kg。盆栽实验在温室进行,温室温度控制在25 ℃左右,平均相对湿度控制在60%左右。
试验采用直径20 cm、高50 cm PVC管,每盆装土23 kg。重金属以CdCl2·2.5H2O(分析纯)固体粉末形式按比例(以Cd2+)加入土壤,充分混合均匀,制成含不同Cd浓度的土壤,浇自来水,保持田间持水量的60%左右,自然放置两周。
1.2 试验设计
采用完全随机区组试验设计,试验共12个处理。Cd浓度设置4个水平,即0,10,25,50 mg/kg,刈割处理设置3个水平,即一个生长季1次刈割、2次刈割、3次刈割。每个处理4次重复。
紫花苜蓿在草炭∶蛭石=1∶1混合的基质中育苗,出苗12 d后移栽至加Cd花盆中,恢复两周后选取长势一致的植株定苗,每盆5株,将定苗后的植株均修剪至留茬10 cm,每次刈割处理的留茬高度为10 cm。刈割试验开始时间为2014年8月18日,1次刈割处理为90 d后,2次刈割时间间隔为45 d,3次刈割为30 d。最后一次刈割时,也同时取留茬的新鲜叶片进行相关生理指标的测定。
1.3 指标测定及方法
1.3.1 相对电导率测定 利用电导仪法测定[16]。取紫花苜蓿新鲜叶片剪成1 cm小段,取0.1 g置于含25 mL蒸馏水的试管中,完全浸没,封口膜封口,室温下摇床(180 r/min)振荡24 h,用电导率仪测电导率EL1;然后将试管(封口,扎孔透气)置于沸水浴30 min,冷却至室温测电导率EL2;将无样品的蒸馏水进行振荡、沸水浴,测定降到室温时的电导率作为对照,记为EL0。其计算公式为相对电导率=[(EL1-EL0)/(EL2-EL0)]×100%。
1.3.2 脯氨酸含量测定 利用酸性茚三酮法测定[17]。称取新鲜叶片0.1 g,用3%磺基水杨酸浸提,用2.5%酸性茚三酮进行显色处理,最后用2.5 mL甲苯萃取,在520 nm下使用721型分光光度计比色测定。
1.3.3 丙二醛(MDA)含量测定 采用硫代巴比妥酸法进行测定[18]。取新鲜叶片剪成2 mm小段,取0.05 g研磨成粉末,加2 mL 0.25% 硫代巴比妥酸(TBA)充分磨成匀浆,完全转移至2 mL离心管中,敞口,沸水浴30 min后迅速冰浴冷却,离心(8000 r/min)10 min,提取上清液,使用721型分光光度计于600和532 nm波长处进行比色测定。
1.3.4 生物量及生长速率测定 将刈割处理结束后的地上留茬部分,刈割收获的每一茬和根系用蒸馏水清洗,吸净表面水分,105 ℃杀青15 min,并在80 ℃下烘至恒重,用电子天平称取各部分干重即生物量。计算刈割处理下每天单株紫花苜蓿地上部分生长量即生长速率。
1.3.5 紫花苜蓿Cd含量及吸收速率测定 植物样品采用硝酸∶高氯酸=4∶1湿法消解。采用原子吸收分光光度计(Varian Spectrum AA220)火焰吸收法测定Cd含量[7]。紫花苜蓿地上部分吸收速率为刈割处理下每天单株紫花苜蓿地上部分的Cd富集量(Cd含量与干重的乘积)。
转运系数=地上部分Cd积累浓度/根系Cd积累浓度
1.4 数据分析
采用SPSS 17.0软件对数据进行统计分析,对不同Cd浓度的刈割次数处理的各指标进行方差分析,并用Duncan法对各测定数据进行多重比较,采用Excel 2016制图。
2 结果与分析
2.1 刈割处理的不同Cd胁迫下紫花苜蓿生长特征
2.1.1 紫花苜蓿生物量 从图1A中看出,紫花苜蓿的地上生物量随刈割频次的增加变化显著(P<0.05),表现为3次>2次>1次。其中不加Cd处理中,3次刈割的生物量达到了35.3 g/盆,为1次刈割的2.67倍,添加Cd 10,25,50 mg/kg时,3次刈割处理的地上生物量为1次的2.28,1.26,1.70倍,说明2次和3次刈割可以促进紫花苜蓿地上部分的生物量积累。
而根系生物量变化情况则相反,随刈割频次的增加出现明显减少的趋势(图1B)。不加Cd和Cd 10 mg/kg浓度下,根系生物量变化表现为1次刈割>2次刈割>3次刈割,且差异显著(P<0.05),其中3次刈割的根系生物量为1次的25%和36%。加Cd 25,50 mg/kg时,3次刈割处理的生物量显著小于1次和2次刈割(P<0.05),3次刈割的根系生物量为1次的63%和65%,而2次刈割相对1次差异不显著。

图1 Cd胁迫下刈割对紫花苜蓿生物量积累的影响Fig.1 Effects of harvesting on biomass of M. sativa under Cd stress 图中不同字母表示差异显著(P<0.05),下同。Different letters indicate significant difference (P<0.05), the same below.
2.1.2 生长速率 由于各刈割处理的紫花苜蓿生长期不同,采用紫花苜蓿单位时间地上部分的生长量(生长速率)表征刈割频次对紫花苜蓿地上部分再生的影响(表1)。从表1中可以看出,3种刈割处理下紫花苜蓿的平均生长速率存在明显差异,3次刈割显著高于1次和2次刈割(P<0.05),其中3次刈割的平均生长速率为61.6 mg/(株·d),表明多次刈割对紫花苜蓿地上部的再生起到积极作用。相同刈割处理下,紫花苜蓿生长速率对不同Cd浓度胁迫的响应与生物量的变化趋势完全相同,即与10,25 mg/kg Cd处理对比,高浓度(50 mg/kg)Cd处理下紫花苜蓿地上部的再生速率显著下降(P<0.05)。

表1 Cd胁迫下刈割次数对紫花苜蓿地上部生长速率的影响Table 1 Changes in growth rate in shoot of M. sativa by different cutting times under Cd stress mg/(plant·d)
注:同列不同字母表示差异显著(P<0.05),下同。
Note: Different letters in the same column indicate significant difference (P<0.05), the same below.

图2 Cd胁迫下刈割处理对紫花苜蓿体内Cd积累的影响Fig.2 Cd content and accumulation in shoot and roots in M. sativa by different cutting treatment under Cd stress
2.2 刈割处理的不同Cd胁迫下紫花苜蓿Cd富集特征
2.2.1 紫花苜蓿Cd积累量 由于刈割频次的增加并未引起地上部Cd含量的显著性变化,因此本研究中未做图表阐述。其中添加Cd 25和50 mg/kg时,地上部分的Cd含量在2次刈割时相对1次和3次有所增加,达到9.79和11.78 mg/kg。紫花苜蓿地上部分及根系的Cd积累量变化如图2所示。如图2A所示,随刈割频次的增加,紫花苜蓿地上部的Cd积累量显著增加(P<0.05),表现为3次>2次>1次。添加Cd 0,10,25,50 mg/kg下,3次刈割的Cd积累量为1次刈割的2.32,2.23,1.70,1.72倍,且添加Cd 25 mg/kg时,紫花苜蓿地上Cd积累量达到最大(247.09 μg/盆)。而当添加Cd 50 mg/kg时,Cd总积累量出现显著性降低(P<0.05),为Cd 25 mg/kg时的57%。
根系Cd含量随刈割频次的增加显著性增加(P<0.05),表现为3次>2次>1次(图2B)。添加Cd 0,10,25,50 mg/kg时,3次刈割的根系Cd含量为1次的1.46,1.30,1.23,1.23倍,其中Cd 50 mg/kg时,3次刈割的根系Cd含量达到了72.75 mg/kg,说明多次刈割促进了根系对Cd的吸收。根系中Cd的积累量由根系Cd含量与生物量的乘积决定,如图2C所示,4种Cd浓度下,根系Cd积累量1次和2次刈割显著大于3次(P<0.05),而1次和2次刈割的变化不显著。添加Cd 50 mg/kg时,根系Cd积累量达到最大,为249.46 μg/盆。
2.2.2 转运系数及单株Cd积累量 如图3A所示,不添加Cd时,1次刈割的转运系数显著高于2次和3次,Cd 10,25 mg/kg时,1次和2次刈割显著高于3次,而Cd 50 mg/kg时,3种刈割的转运系数无显著变化。说明多次刈割随添加Cd浓度的增加对紫花苜蓿体内Cd的转运影响程度减小,甚至变化不显著(P>0.05)。而图3B所示,不加Cd处理下,3种刈割处理的单株Cd积累量无明显差异,10 mg/kg Cd时,2次和3次刈割处理显著高于1次(P<0.05)。25 mg/kg Cd时,2次刈割处理显著高于1次(P<0.05)。50 mg/kg Cd时,2次刈割处理显著高于1次和3次(P<0.05)。其中25,50 mg/kg Cd时,2次刈割处理的单株Cd积累量达到了75.98和72.92 μg/株。

图3 刈割处理下紫花苜蓿Cd的转运系数和单株Cd含量的变化情况Fig.3 Variation in translocation factor and Cd content per plant in M. sativa by cutting treatment under Cd stress
2.2.3 紫花苜蓿Cd吸收速率 如表2所示,随刈割频次的增加,紫花苜蓿对Cd的平均吸收速率显著递增(P<0.05),3种刈割处理的紫花苜蓿地上部对Cd的平均吸收速率分别为0.187,0.286,0.353 μg/(株·d)。相同刈割处理下,紫花苜蓿的吸Cd速率随Cd胁迫的增加呈现先上升后下降的趋势,在Cd浓度为50 mg/kg时,吸Cd速率迅速下降。而不同刈割处理下紫花苜蓿的吸Cd速率均在25 mg/kg Cd浓度时达到最大值。
2.3 刈割处理的不同Cd胁迫下生理指标变化情况
2.3.1 相对电导率 从表3可以看出,紫花苜蓿叶片相对电导率1次刈割处理最大,在添加Cd 10,25 mg/kg时,与2次和3次刈割处理有显著性差异(P<0.05),结果表明刈割频次的增加会降低紫花苜蓿叶片的相对电导率。随着Cd浓度的增加,各刈割处理的叶片相对电导率递增,与不加Cd处理对比,50 mg/kg Cd浓度的相对电导率分别增加了33%,59%,35%。
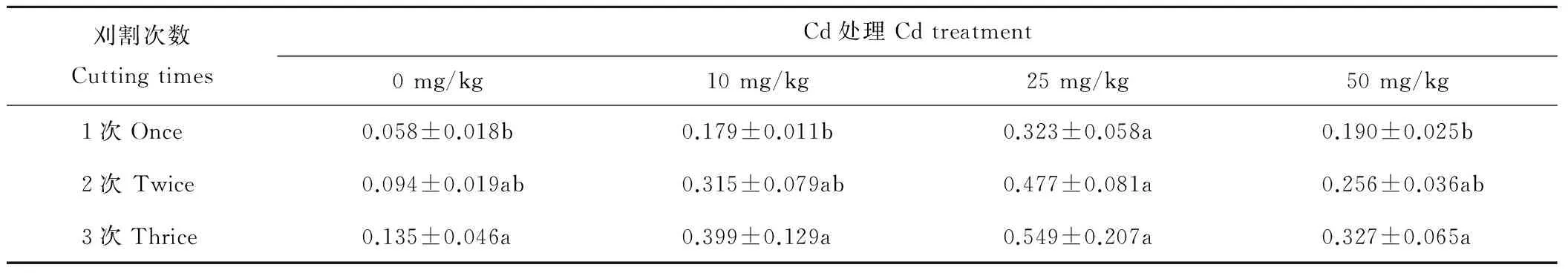
表2 刈割处理对紫花苜蓿地上部分Cd吸收速率的影响Table 2 Effects of different cutting treatments on Cd uptake rate in shoot of M. sativa under Cd stress μg/(plant·d)

表3 刈割处理对紫花苜蓿叶片相对电导率的影响Table 3 Effect of different cutting on relative electrical conductivity in leaves of M. sativa under Cd stress %
2.3.2 丙二醛(MDA)含量 表4显示相同Cd处理下,MDA含量变化趋势与相对电导率相同,即1次刈割最高,2次和3次刈割处理无显著差异(P>0.05),表明刈割频次增加会降低MDA含量。相同刈割条件下,MDA含量随Cd胁迫浓度的增加而递增,与不加Cd对照相比,50 mg/kg Cd浓度的MDA含量分别提高了76%,81%,97%。

表4 刈割处理对紫花苜蓿叶片MDA含量的影响Table 4 Effect of different harvesting on MDA contents in leaves of M. sativa under Cd stress μmol/g
2.3.3 脯氨酸含量 表5中,0,25 mg/kg Cd处理下2次和3次刈割的脯氨酸含量显著高于1次刈割(P<0.05)。10 mg/kg Cd时,3次刈割的脯氨酸含量显著高于1次刈割(P<0.05)。相同刈割处理下,加Cd处理的脯氨酸含量与不加Cd对照相比均增加,其含量随浓度的增加呈现先升高后降低的趋势,在25 mg/kg Cd浓度下脯氨酸含量达到最大。上述结果表明,刈割频次的增加提高了脯氨酸含量,提高了紫花苜蓿对Cd毒害的耐性。
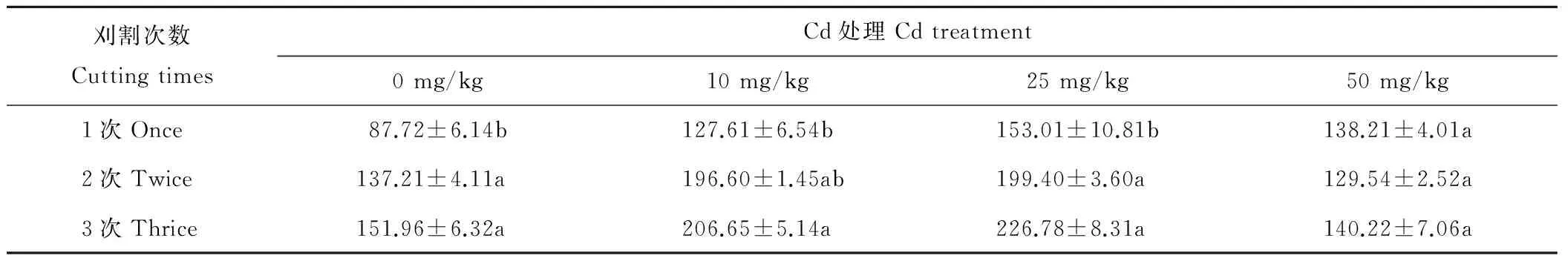
表5 刈割处理对紫花苜蓿叶片脯氨酸含量的影响Table 5 Effect of different harvesting on proline contents in leaves of M. sativa under Cd stress μg/g
3 讨论
刈割是草地利用及管理的主要措施之一,植物遭受刈割后通过再生长补偿去除的植物组织,同时表现出生物量增加,出现超补偿性生长[19]。本研究中,2次和3次刈割提高了紫花苜蓿地上部分的生长速率,这是由于刈割后植物地上部的损伤刺激植物体内同化物运转的最优化分配[20],叶绿素a和叶绿素b含量上升[21-22],光合速率提高,地上部分生长速率增加,促使地上部分的补偿生长[11,19]。多次刈割使超补偿性生长现象更加明显,表现出多次刈割对地上部分的生物量积累的促进作用。但刈割后同化物的优化分配使根系可溶性糖等含量下降,导致根系活力下降[23-24],抑制根系生长。本研究中,3次刈割下的根系生物量相对1次和2次刈割有明显下降,是由于刈割频次的增加或刈割间隔时间缩短使根系活力水平一直低下,从而抑制根部伸长生长及生物量累积[25-26]。添加Cd 10 mg/kg时,相对不加Cd情况下,根系生物量有一定程度的增加,这是由于低Cd胁迫刺激了植物根系小分子有机酸等分泌物的分泌[27],降低了根际pH值,提高了金属生物有效性和土壤微生物及土壤酶的活性[28],促进根系对Fe、Zn、Ca等营养元素的吸收[29],从而一定程度上保持了根系活力。而在添加Cd 25,50 mg/kg时,随刈割频次的增加根系生物量积累的下降程度有所减缓,是由于高浓度Cd胁迫下根系细胞失活,严重抑制根系活力,导致多次刈割对根系生物量积累的影响不明显。
有关研究发现,生物量大、再生能力强的重金属富集植物,可以通过刈割方式和增加收获次数来提高其生物量累积及植物修复效率[11,14-15,30]。本研究中, 2次和3次刈割显著提高了根系中Cd含量,而地上部分的Cd含量未有明显变化,这可能是由于刈割处理产生的超补偿性生长,促进根系大量吸收水分及无机盐,此过程中,Cd元素与K、Mg、Ca等的吸收竞争[31],刺激了根系对Cd的大量吸收。同时本研究中,Cd胁迫加强及刈割导致的同化物的再分配作用,抑制了根系的生长,但由于根系Cd含量的显著性增加,刈割次数增加,根系中Cd的积累量仍处于上升趋势。而地上部分由于再生长,可以使残茬中的重金属迁移到再生部位[11],本研究发现,紫花苜蓿地上部分再生长对Cd的吸收产生的“相对稀释效应”,使地上部分Cd含量无明显变化,但随着多次刈割处理使地上生物量的累积增加,Cd积累量也显著性增加。同时本研究中,紫花苜蓿地上部对Cd的平均吸收速率与生长速率随刈割次数的增加而升高,进一步证明了刈割促进了紫花苜蓿对土壤中Cd的吸收。
Cd毒害下,细胞膜受损,会引起膜脂过氧化反应,MDA含量升高,膜内物质外渗,外渗液电解质含量增加[31-33]。同时脯氨酸作为逆境胁迫下植物细胞中重要的渗透调节物质,防止膜破损时产生的渗透伤害,清除自由基,维持细胞膜的稳定性[34]。本研究中发现,10,25 mg/kg Cd处理下,刈割频次的增加使得叶片中MDA含量及相对电导率明显减少,脯氨酸含量增加,而50 mg/kg Cd时,MDA含量及相对电导率没有显著变化(P>0.05),脯氨酸没有明显增加,说明了高浓度下的Cd胁迫细胞膜受损严重,膜脂过氧化反应加剧,膜内物质大量外渗,活性氧含量增加,抗氧化酶活性遭受毒害加剧。说明了刈割处理一定程度上可以缓解Cd对紫花苜蓿的毒害作用。但高浓度Cd胁迫下刈割处理对紫花苜蓿遭受的Cd毒害作用没有积极影响。关于刈割措施缓解紫花苜蓿Cd毒害的生理变化(如抗氧化酶的变化),以及细胞超微结构的变化情况有待深入研究。
4 结论
适当增加刈割频次提高了紫花苜蓿地上部分生长速率,促进了地上生物量和重金属Cd的积累,虽然抑制了根系的生长,但根系Cd含量有明显提高,根系Cd积累量增加,从而提高紫花苜蓿对土壤中重金属Cd的修复效率。刈割频次增加能降低相对电导率,MDA含量,增加脯氨酸含量,一定程度上保持了紫花苜蓿细胞膜的稳定性。其中,两次刈割处理有利于紫花苜蓿的生物量累积及Cd的吸收,缓解Cd毒害作用。因此,刈割对提高紫花苜蓿Cd污染土壤修复效率有明显的积极作用。关于刈割措施对Cd毒害下紫花苜蓿的其他生理变化,如根系分泌物分泌,抗氧化酶活性,超微结构的变化等,需要进一步研究,来深入探索刈割措施对紫花苜蓿修复重金属土壤的积极作用。
References:
[1] Jiang K Y, Shao X X, Wu M. Research progress in sources identification of soil heavy metal pollution. Guangdong Trace Elements Science, 2007, 14(4): 1-6. 蒋科毅, 邵学新, 吴明. 土壤重金属污染来源及其解析研究进展. 广东微量元素科学, 2007, 14(4): 1-6.
[2] Zhang X Y, Xu Y N, Niu M L. Summary of sources and status of soil heavy metal pollution in China. Resources Economization & Environment Protection, 2013, (2): 55. 张晓云, 许延娜, 牛明雷. 我国重金属污染来源及污染现状概述. 资源节约与环保, 2013, (2): 55.
[3] Ran L, Li H H. Progress in the research of present situation of soil cadmium pollution and its hazards. Journal of Chongqing University of Arts and Sciences: Natural Science Edition, 2011, 30(4): 69-73. 冉烈, 李会合. 土壤镉污染现状及危害研究进展. 重庆文理学院学报: 自然科学版, 2011, 30(4): 69-73.
[4] Du L N, Yu R Z, Wang H Y,etal. Pollution and toxicity of cadmium: a review of recent studies. Journal of Environment and Health, 2013, 30(2): 167-174. 杜丽娜, 余若祯, 王海燕, 等. 重金属镉污染及其毒性研究进展. 环境与健康杂志, 2013, 30(2): 167-174.
[5] Xu S L, Xing C H, Fang Y. The effect of cadmium stress on growth and Cd content of alfalfa. Guangdong Trace Elements Science, 2008, 15(3): 23-26. 徐苏凌, 邢承华, 方勇. 镉胁迫对紫花苜蓿生长及植株镉含量的影响. 广东微量元素科学, 2008, 15(3): 23-26.
[6] Fan R, Feng Y J, Hao G X,etal. Study on growth and utilization of alfalfa grown in Cd-rich substrate. Pratacultural Science, 2009, 26(10): 67-72. 樊瑞, 冯永军, 郝桂喜, 等. 富镉基质中紫花苜蓿的生长与利用研究. 草业科学, 2009, 26(10): 67-72.
[7] Li X M, Song G L. Cadmium uptake and root morphological changes inMedicagosativaunder cadmium stress. Acta Prataculturae Sinica, 2016, 25(2): 178-186. 李希铭, 宋桂龙. 镉胁迫对紫花苜蓿镉吸收特征及根系形态影响. 草业学报, 2016, 25(2): 178-186.
[8] Sherifi E, Bytyqi A, Lluga-Rizani K. The concentration of Pb and Cd toMedicagosativaL. along Lipjan-Prizren highway and their influence on biomass. Journal of Engineering & Applied Sciences, 2009, 4(1): 60-63.
[9] Wang X, Jia Y F. Heavy metals accumulation and phytoremediation of alfalfa in contaminated soil. Chinese Journal of Soil Science, 2009, 40(4): 932-935. 王新, 贾永锋. 紫花苜蓿对土壤重金属富集及污染修复的潜力. 土壤通报, 2009, 40(4): 932-935.
[10] Peralta-Videa J R, Gardea-Torresdey J L, Gomez E,etal. Effect of mixed cadmium, copper, nickel and zinc at different pHs upon alfalfa growth and heavy metal uptake. Environmental Pollution, 2002, 119(3): 291-301.
[11] Li W X, Chen T B, Liu Y R. Effects of harvesting on As accumulation and removal efficiency of As by Chinese brake (PterisvittataL.). Acta Ecologica Sinica, 2005, 25(3): 538-542. 李文学, 陈同斌, 刘颖茹. 刈割对蜈蚣草的砷吸收和植物修复效率的影响. 生态学报, 2005, 25(3): 538-542.
[12] Pei X, Guo Z, Li J Y,etal. Effects of cutting on regeneration and Cd-accumulation bySolanumnigrumL. Journal of Shanghai Jiaotong University: Agricultural Science, 2007, 25(2): 125-129. 裴昕, 郭智, 李建勇, 等. 刈割对龙葵生长和富集镉的影响及其机理. 上海交通大学学报: 农业科学版, 2007, 25(2): 125-129.
[13] Wójcik M, Vangronsveld J, Tukiendorf A. Cadmium tolerance inThlaspicaerulescens: I. Growth parameters, metal accumulation and phytochelatin synthesis in response to cadmium. Environmental and Experimental Botany, 2005, 53(2): 151-161.
[14] Gonzaga M I S, Santos J A G, Ma L Q. Phytoextraction by arsenic hyperaccumulatorPterisvittataL. from six arsenic-contaminated soils: Repeated harvests and arsenic redistribution. Environmental Pollution, 2008, 154(2): 212-218.
[15] Fu D F, Wen L. The phytoremediation of ryegrass on multiple heavy metal soils by two reinforced methods. China Environmental Science, 2008, 28(9): 786-790. 傅大放, 温丽. 两种强化措施辅助黑麦草修复重金属污染土壤. 中国环境科学, 2008, 28(9): 786-790.
[16] Chen J X. Experimental Instruction of Plant Physiology[M]. Guangzhou: South China University of Technology Press, 2002: 64-65. 陈建勋. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2002: 64-65.
[17] Li M, Wang G X. Effect of drought stress on activities of cell defense enzymes and lipid peroxidation inGlycyrrhizauralensisseedlings. Acta Ecologica Sinica, 2002, 22(4): 503-507. 李明, 王根轩. 干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响. 生态学报, 2002, 22(4): 503-507.
[18] Sun N X. Physiological Response of CuttingMedicagosativato Cadmium Stress and Accumulation Property[D]. Beijing: Beijing Forestry University, 2015. 孙宁骁. 刈割对紫花苜蓿(Medicagosativa)镉富集特性及耐性生理影响研究[D]. 北京: 北京林业大学, 2015.
[19] Belsky A J, Carson W P, Jensen C L,etal. Overcompensation by plants: Herbivore optimization or red herring. Evolutionary Ecology, 1993, 7(1): 109-121.
[20] Li Y Q, Sheng C F. Plant overcompensation responses. Plant Physiology Communications, 1996, (6): 457-464. 李跃强, 盛承发. 植物的超越补偿反应. 植物生理学通讯, 1996, (6): 457-464.
[21] Dai H J, Xie Y Z, Hu Y L. Effects of different mowing intensities on growth and net photosynthesis and soluble sugar content ofMedicagosativaLinn. Plant Physiology Communications, 2009, 45(11): 1061-1064. 代红军, 谢应忠, 胡艳莉. 不同刈割程度对紫花苜蓿生长、净光合速率和可溶性糖含量的影响. 植物生理学通讯, 2009, 45(11): 1061-1064.
[22] Jin W B, Zhang F B. Response of quality and growth characteristics ofMedicagosativafor the different intensity of cutting. Northern Horticulture, 2014, (21): 72-77. 金文斌, 张凡兵. 紫花苜蓿生长特性及品质对不同刈割强度的响应. 北方园艺, 2014, (21): 72-77.
[23] Wang W, Jia Y S, Zhou T R,etal. The influence of mowing measures on the soluble sugar content in alfalfa root and green rate. Feed Industry, 2015, 36(11): 31-34. 王伟, 贾玉山, 周天荣, 等. 刈割措施对紫花苜蓿根系内可溶性糖含量及返青率的影响. 饲料工业, 2015, 36(11): 31-34.
[24] Schönbach P, Wan H, Gierus M,etal. Grassland responses to grazing: effects of grazing intensity and management system in an Inner Mongolian steppe ecosystem. Plant & Soil, 2011, 340(1/2): 103-115.
[25] Wang Y R, Guo Z G, Liu H X. Effect of cutting on root growth in lucerne. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(2): 215-220. 王彦荣, 郭正刚, 刘慧霞. 刈割对紫花苜蓿根系生长影响的初步分析. 西北植物学报, 2004, 24(2): 215-220.
[26] Zhang Z X, Sun X T, Chen X Y. Cutting frequency effect on root system and aboverground part biomass ofLespedezebicolor. Pratacultural Science, 2005, 22(5): 25-28. 张志翔, 孙显涛, 陈晓阳. 不同刈割频度下二色胡枝子根系及地上生物量的研究. 草业科学, 2005, 22(5): 25-28.
[27] Qin L, Li Y, Zu Y Q,etal. Effects of Cd contamination on the root exudates ofSonchusasperL. Hill. Ecology and Environmental Sciences, 2012, 21(3): 540-544. 秦丽, 李元, 祖艳群, 等. 镉胁迫对续断菊SonchusasperL.Hill.根系分泌物的影响. 生态环境学报, 2012, 21(3): 540-544.
[28] Wu H, Huang J F. Effect of biological nature of organic acid exudation from plant root. Modern Agricultural Science and Technology, 2008, (20): 323-324. 吴昊, 黄建凤. 植物根系分泌的有机酸及其作用. 现代农业科技, 2008, (20): 323-324.
[29] Xu W H, Huang H, Wang A H,etal. Advance in studies on activation of heavy metal by root exudates and mechanism. Ecology and Environment, 2006, 15(1): 184-189. 徐卫红, 黄河, 王爱华, 等. 根系分泌物对土壤重金属活化及其机理研究进展. 生态环境, 2006, 15(1): 184-189.
[30] Teng C Q, Li N, Wu L H. Effects of harvestingSedumplumbizincicolaon its zinc and cadmium uptake in a mixed heavy metal contaminated soil. Acta Pedologica Sinica, 2009, 46(4): 725-728. 滕淳茜, 李娜, 吴龙华. 收获方式对污染土壤上伴矿景天锌镉吸收性的影响. 土壤学报, 2009, 46(4): 725-728.
[31] Najeeb U, Jilani G, Ali S,etal. Insights into cadmium induced physiological and ultra-structural disorders inJuncuseffususL. and its remediation through exogenous citric acid. Journal of Hazardous Materials, 2011, 186(1): 565-574.
[32] Han D H, Meng H M, Wang J,etal. Energy based analysis of developmental situation and countermeasures for sustainable development of agricultural eco-economic systems of Gansu. Agricultural Research in the Arid Areas, 2007, 25(5): 151-154. 韩多红, 孟红梅, 王进, 等. 镉对紫花苜蓿种子萌发等生理特性的影响. 干旱地区农业研究, 2007, 25(5): 151-154.
[33] Jin X, Yang X, Islam E,etal. Effects of cadmium on ultrastructure and antioxidative defense system in hyperaccumulator and non-hyperaccumulator ecotypes ofSedumalfrediiHance. Journal of Hazardous Materials, 2008, 156(1/3): 387-397.
[34] Chen Y P, Qu M M, Su X N,etal. Effect of exogenous nitric oxide on active oxygen metabolism and cadmium accumulation in alfalfa seedlings under cadmium stress. Journal of Agro-Environment Science, 2015, 34(12): 2261-2271. 陈银萍, 蘧苗苗, 苏向楠, 等. 外源一氧化氮对镉胁迫下紫花苜蓿幼苗活性氧代谢和镉积累的影响. 农业环境科学学报, 2015, 34(12): 2261-2271.
Effects of cutting frequency on cadmium uptake and physiological responses ofMedicagosativaunder cadmium stress
LI Na1, SUN Ning-Xiao1, SONG Gui-Long1*, PUYANG Xue-Hua2, ZHOU Shu-Qiong2, ZHAO Ke-Qi2, JIANG Kai2
1.InstituteofTurfgrassScience,BeijingForestryUniversity,Beijing100083,China; 2.ShenzhenTechandEcology&EnvironmentCo.,Ltd,Shenzhen518040,China
Alfalfa (Medicagosativa) is a promising plant species for phytoremediation in soils polluted by heavy metals. This species has been reported to have a high growth rate and great potential for cadmium (Cd) accumulation. Alfalfa plants must be cut several times to reduce soil Cd concentrations to acceptable levels. Therefore, the aim of this study was to evaluate the effects of one, two, and three cuttings on the growth, Cd content, and physiological characteristics of alfalfa plants grown in Cd-contaminated soil. Alfalfa plants were grown in soil containing no Cd (control) and Cd at three concentrations (10, 25, 50 mg/kg) and cut once, twice, or three times. A higher number of cutting events promoted the growth rate and biomass accumulation in the shoot. The highest average shoot growth rate was 61.6 mg/(plant·d) in the three-cuttings treatment, but root growth was significantly lower in this treatment (P<0.05) than in the other treatments and the control. Over the whole growth cycle, cutting twice or three times improved the Cd uptake rate in the root and Cd accumulation in the shoot, thus increasing Cd enrichment in alfalfa plants. The highest Cd accumulation was 75.98 μg/plant in the 25 mg/kg Cd treatment with two cuttings. The relative electrical conductivity and malondialdehyde (MDA) contents were lower in the two-cuttings and three-cuttings treatments than in the single cutting treatment, but the proline contents were higher, which improved the tolerance of alfalfa to Cd toxicity under Cd stress. We concluded that in soil containing Cd at ≤ 25 mg/kg, two cuttings can significantly improve the repair efficiency of alfalfa plants growing in Cd-polluted soil.
Medicagosativa; harvesting; Cd uptake; phytoremediation; physiological changes
10.11686/cyxb2016419
http://cyxb.lzu.edu.cn
2016-11-07;改回日期:2016-12-29
中央高校基本科研业务费专项资金(YX2015-10)和深圳市铁汉生态环境股份有限公司(THRD008)资助。
李娜(1990-),女,河北保定人,在读硕士。E-mail: li08pieer@163.com*通信作者Corresponding author. E-mail: syihan@163.com
李娜, 孙宁骁, 宋桂龙, 濮阳雪华, 周述琼, 赵克奇, 蒋凯. 刈割次数对紫花苜蓿镉吸收影响及生理响应. 草业学报, 2017, 26(5): 109-117.
LI Na, SUN Ning-Xiao, SONG Gui-Long, PUYANG Xue-Hua, ZHOU Shu-Qiong, ZHAO Ke-Qi, JIANG Kai. Effects of cutting frequency on cadmium uptake and physiological responses ofMedicagosativaunder cadmium stress. Acta Prataculturae Sinica, 2017, 26(5): 109-117.
