DNA甲基化抑制因子5-AzaDc对犬卵母细胞体外培养核成熟的影响
2017-05-22李啸晨康锦丹朱海瑛尹熙俊
李 所,李啸晨,康锦丹,朱海瑛,郭 庆,郑 鑫*,尹熙俊*
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.延边大学动物科学系,吉林延吉133002)
DNA甲基化抑制因子5-AzaDc对犬卵母细胞体外培养核成熟的影响
李 所1,李啸晨2,康锦丹2,朱海瑛2,郭 庆2,郑 鑫1*,尹熙俊2*
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.延边大学动物科学系,吉林延吉133002)
本实验旨在研究DNA甲基化酶抑制剂5-氮-2-脱氧胞苷(5-AzaDc)对犬卵母细胞体外成熟的影响。研究比较添加不同浓度5-AzaDc(1、2 µ mol/L)处理不同时间(1、2、48、72 h)观察的犬卵母细胞成熟情况,并通过DNA甲基化的免疫荧光染色,观察5-AzaDc对DNA甲基化在犬卵母细胞中的分布情况及趋势变化。结果表明:添加2 µmol/L的5-AzaDc处理48 h,所有卵母细胞均脱离GV期,并且与对照组相比显著提高进入GVBD-MⅡ期的比率(28.3% vs.87.1%);免疫荧光染色结果显示,成熟卵母细胞的DNA甲基化染色位点主要集中在细胞核内,并未在细胞质中出现,DNA甲基化程度显著降低,并使染色质凝集。综上所述,添加2 µmol/L的5-AzaDc处理48 h可以通过抑制DNA甲基化水平提高犬卵母细胞体外成熟率,短时间的抑制DNA甲基化水平对犬卵母细胞的减数分裂恢复有积极促进作用。
犬卵母细胞;体外成熟;5-氮-2-脱氧胞苷;DNA甲基化抑制
随着宠物犬、功能犬越来越受到大众关注,世界各国的研究人员对犬的体细胞克隆及繁殖的研究越来越多。随着2005年首头“斯纳皮”克隆犬的诞生[1],2015年10月,中国科学院广州生物医药与健康研究院赖良学研究员研究团队同样利用体内成熟的犬卵母细胞成功建立了全球首例基因敲除犬模型[2]。目前,犬的体细胞克隆、体外胚胎生产等热门技术由于受到犬卵母细胞体外成熟率低而被约束。除外部环境外,卵母细胞的成熟同时也受到内部调控,如DNA甲基化也能控制卵母细胞的成熟,但有关犬体内DNA甲基化的研究甚少。目前,已证明DNA甲基化转移酶(DNA Methyhransferases,Dnmts)成员Dnmt1主要维持基因组的甲基化水平[3],并且Dnmt1与卵母细胞MII期染色质有关并影响附植前的早期胚胎,Dnmt3的转录与表达有利于生长期的卵母细胞发育[4]。因此,判断DNA甲基化能与卵母细胞的成熟有关。5-氮-2-脱氧胞苷(5-Asa-2'-Deoxyeytidine,5-AzaDc)是经典的DNA甲基化酶抑制剂。然而5-AzaDc极少出现在卵母细胞成熟的研究中,尤其是对犬类卵母细胞体外成熟的影响至今未见报道。经预实验已证明5-AzaDc对犬卵母细胞成熟有一定效果[5], 本研究将进一步探究5-AzaDc对犬卵母细胞体外成熟的最优作用浓度、作用时间及其机制。
1 材料与方法
1.1 卵巢、卵母细胞的收集 本实验犬卵母细胞主要是从延吉市肉犬屠宰场收集卵巢获取,母犬经处死宰杀后,将立即剖腹取出的双侧卵巢放入加有1%青-链霉素的生理盐水保温瓶中,温度维持在25~30℃,于1~2 h送回实验室。收集到的犬卵巢分为黄体前期(刚排完卵)、发情期(小卵泡)、黄体期中期、休情期、发情期(大卵泡)、黄体后期6个时期(图1A)。犬是季节性单次发情动物,处于发情期的卵巢数目少之又少。本实验为了保证结果稳定,选取休情期与黄体后期卵巢进行后续实验。选取的犬卵巢用37.5℃生理盐水清洗至少3次,洗去犬卵巢表面的多余血脂和油脂。随后将犬卵巢置于含有0.1%聚乙烯乙醇(PVA)的TALP-HEPES缓冲液的平皿内,在37.5℃的恒温板上用灭菌的手术刀片采用横纵结合切割法快速划开卵巢表面皮质层,释放卵子。选取直径大于或等于110μm、细胞质分布均匀、颜色较深、具有2层及2层以上卵丘细胞紧密包裹的卵丘卵母细胞复合体(COCs),用于本实验的体外成熟培养(图1B、C)。
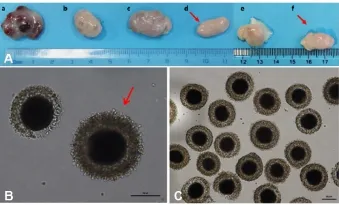
图1 不同发情周期犬卵巢及可用于体外培养的卵母细胞
1.2 犬卵母细胞的体外成熟培养 挑选出的高质量COCs,在含有0.1% PVA的TALP-HEPES缓冲液中至少洗3~4遍,采用基础成熟培养基TCM-199,添加25 mmol/L HEPES、10% FBS、10 ng/mL EGF、1 mg/mL L-半胱氨酸,另外增加1% 青-链霉素以防止污染。体外培养每100μL微滴培养液中放入15枚犬COCs,随机分成9组,置于38.5℃、最大饱和湿度、5% CO2浓度的二氧化碳培养箱内。通过预实验,确定在5-AzaDc浓度为1、2μmol/L 2个浓度下处理1、2、48、72 h后换液至无5-AzaDc的培养液中,直至72 h停止培养并观察卵母细胞成熟情况。
1.3 犬卵母细胞核成熟判定 用小孔玻璃管轻轻吹吸已剥离掉卵母细胞外的卵丘细胞以获得裸卵(DO),观察是否排出第一极体。D-PBS洗去脱掉的卵丘细胞后,将DO放进4%多聚甲醛中室温固定至少15 min。在载玻片四角滴上少量凡士林,将DO放到载玻片中央滴有少量甘油处,一个载玻片5~10个DO为1组,用20μg/mL Hoescht33342染色后5 min,以盖玻片覆于其上,在显微镜下观察,从中间轻轻下压再沿四周轻轻压以防卵母细胞破裂,直到DO胞质充满卵腔为止。用荧光显微镜观察鉴定每个犬卵母细胞的核成熟阶段。按照前人[6]报道核成熟阶段判定标准,如图2所示。

图2 犬卵母细胞体外成熟培养后经Hoechst 33342染色检测不同核成熟期
1.4 DNA甲基化的免疫荧光染色 经免疫荧光染色观察卵母细胞DNA甲基化程度。收集经5-AzaDc处理组体外成熟培养卵母细胞及空白对照组成熟犬卵母细胞,用含有0.1%PVA的PBS至少清洗3遍。4%多聚甲醛固定液室温固定40 min,含1% TritonX-100的PBS室温通透l.5 h,通透后的卵母细胞在PBS+2%BSA封闭液中室温封闭l h,后用PBS+2%BSA溶液稀释好的一抗(抗5-甲基胞嘧啶)孵育(l:50),锡纸包裹避光于4℃过夜,PBS+2%BSA至少清洗4遍,用FITC标记二抗羊抗鼠 IgG(l:100)37℃避光染色1.5 h。细胞核用20μg/mL Hoechst 33342 染色5 min,含有0.1%PVA的PBS至少清洗3遍后共聚焦荧光显微镜下进行检测。每个实验重复至少3次,每次每组实验中至少20枚卵子,每次重复使用相同的曝光度及相关参数以排除干扰。
1.5 统计分析 所有数据均采用IBM-SPSS23.0系统分析。对处理之间的差异进行分析,使用一般线性模型单因素方差分析,并进行数据转换转x`=sin-1√x以服从统计假设。方差分析后多重比较采用邓肯式。分类变量组(对照、1、2μmol/L浓度)和时间(1、2、48、72 h),因变量GV、GVBD、MI、MII、UDNM 及GVBD-MII,数据表达采用百分数形式(%)。免疫荧光强度分析采用Image J系统分析。显著性标准为P<0.05。
2 结果与分析
2.1 不同5-AzaDc培养浓度与不同培养时间对犬卵母细胞体外成熟的影响 排除死亡卵子后对不同核成熟时期卵母细胞进行统计。由表1可见,2μmol/L5-AzaDc处理犬卵母细胞48、72 h后,所有卵母细胞均脱离GV期,即GV期卵母细胞比率为0,但不同浓度、其他时间处理组与对照组GV期比率无显著性差异(P>0.05)。统计GVBD-MII期,在1μmol/L 72 h和2μmol/L 48、72 h(75.0%、87.1%、68.0%)处理下成熟率显著高于1μmol/L 1 h和对照组(28.3%、32.4%,P<0.05),其他处理组虽高于对照组,但相比差异无统计学意义。综上实验结果显示,2μmol/L的5-AzaDc条件下处理48 h为最优处理组。
2.2 5-AzaDc处理对甲基化分布及水平的影响 如图3所示,成熟的犬卵母细胞的DNA甲基化染色位点主要集中在细胞核内,并未在细胞质内出现,经5-AzaDc处理后,DNA甲基化程度明显降低,5-AzaDc处理后DNA甲基化受到抑制。对免疫染色结果进行荧光强度灰度值分析。图4结果显示,5-AzaDc处理后DNA甲基化水平极显著低于未处理组(P<0.01)。同一细胞期染色发现,5-AzaDc引起染色质的凝集,浓缩的染色质团上出现了完全的去甲基化。实验确定经5-AzaDc处理后,犬卵母细胞在体外成熟发育过程中的DNA甲基化水平变化趋势。

图3 犬卵母细胞抗5-甲基胞嘧啶抗体免疫荧光染色

图4 免疫荧光染色荧光强度比较
3 讨 论
DNA甲基化通过在Dnmts催化下,将甲基转移到胞嘧啶的5位碳原子上,对基因组稳定和基因表达模式起着非常关键的作用,并且在组织特异性基因表达、正常胚胎发育、X染色体失活和基因印迹等方面中起着至关重要的作用[7]。Vogel等[8]确定了Dnmt主要分布于细胞核内,只有少许出现于细胞质中。Lees 等[9]提出Dnmts是在细胞质中合成与储存,并逐渐转移到细胞核中执行其酶的功能,当不再被需要时重新退回到细胞质中。也有研究表明,Dnmts与染色体相互关联,并作用于染色体外表面,而不是内部[10],并且正常染色体凝集需要5'甲基胞嘧啶核苷作为先决条件。本研究也同样证实了5-甲基胞嘧啶存在于犬卵母细胞的细胞核内。

表1 不同浓度5-AzaDc处理不同时间对犬卵母细胞体外成熟的影响
随着对于DNA甲基化的深入研究,人们还发现了一些可以抑制DNA甲基化酶的药物,应用最普遍的是5-AzaDc和5-氮杂胞苷(5-AzaC)2种药物[11]。但由于5-AzaC不仅能渗入到DNA抑制DNA的合成同时还能渗入RNA中抑制RNA与蛋白质的合成,故目前多应用5-AzaDc。最近针对许多物种的研究发现,通过对供体细胞重构胚处理5-AzaDc和5-AzaC,可以部分消除重编程标记,显著提高克隆胚胎的发育能力[12]。在牛方面的研究也证明,对供体细胞和早期克隆胚胎处理5-AzaDc和TSA 可以显著提高克隆牛胚胎的体内、体外发育潜能[13]。另有报道表明,5-AzaDc处理使小鼠胚胎细胞的分化状态改变并抑制Dnmt的活性;细胞接触5-AzaDc引起复制时间改变,抑制基因的活化,并引起异染色质的去凝集[14]。 本研究对5-AzaDc处理组和对照组分别进行抗5mc抗体免疫荧光染色,结果显示成熟的犬卵母细胞经5-AzaDc处理后,DNA甲基化程度明显降低,5-AzaDc处理后DNA甲基化受到抑制。
对供体细胞和克隆胚胎均用低浓度5-AzaDc(20 nmol/L,72 h)进行处理可以显著提高克隆胚胎的囊胚率[7]。 Enright等[15]对供体成纤维细胞进行5-AzaDc处理后发现0.08~0.31μmol/L的高剂量5-AzaDc降低了重构胚的囊胚发育比率;进一步研究发现,少于0.1μmol/L的5-AzaDc反而会提高重构胚的融合率,并且不影响后期囊胚发育的情况。本研究预实验表明,低浓度(10、100 nmol/L)的5-AzaDc处理2、48 h均不能增加卵母细胞进入GVBD-MⅡ期的比率,而较高浓度(l、2μmol/L)的5-AzaDc处理2、48 h均能使卵母细胞进入MI-MⅡ期的比率增加。而本研究的进一步研究表明,更高浓度(3μmol/L)的5-AzaDc使卵母细胞死亡数显著增加(数据未显示)。相似研究表示,5-AzaDc对细胞具有一定的毒性作用,在培养液中添加这种试剂可以诱发细胞中的细胞形态变化、细胞凋亡等,因此高浓度5-AzaDc引起细胞毒性及凋亡[12]也与本研究结果相似,但是针对作用细胞种类的不同,对于5-AzaDc引起凋亡的浓度也有所不同。因此,本研究选取浓度为l、2 μmol/L,处理时间经预处理分别选择1、2、48、72 h。
Zhao等[14]研究表明,5-AzaC促进体外培养的小鼠卵母细胞成熟与其染色体结构的改变有关,与本研究结果相似。在卵母细胞中,在卵母细胞生长期DNA甲基化出现全面的增加,并在GV期达到最高水平。Lodde 等[16]通过对5-甲基胞嘧啶的免疫荧光染色发现染色质的初次凝集伴随着DNA甲基化水平的轻微升高。大部分关于犬卵母细胞体外成熟的研究均表明,犬卵母细胞体外成熟培养后,卵母细胞仍大部分处于GV期,无法达到GVBD。本实验室做了很多关于犬卵母细胞体外成熟培养的研究,尝试采用不同培养温度[17]、不同培养方法均未能显著提高犬卵母细胞到达GVBD-MII期的比率 。本次研究结果显示,经2μmol/L浓度的5-AzaDc处理犬卵母细胞48、72 h后,所有卵母细胞均脱离GV期;GVBD-M II期在1μmol/L浓度下处理72 h、2μmol/L浓度下处理48 h(75.0%、87.1%)下犬卵母细胞成熟率高于1μmol/L浓度下处理1 h组和对照组,存在显著差异。但根据实验结果显示,虽然1μmol/L浓度下处理72 h效果也好,但由于死亡数较多,因此不适宜作为培养犬卵母细胞的最优条件。
4 结 论
本研究结果显示,2μmol/L的5-AzaDc条件下处理48 h为最优处理组。免疫荧光染色观察DNA甲基化在卵母细胞中的分布情况及趋势显示,成熟的犬卵母细胞的DNA甲基化染色位点主要集中在细胞核内,经5-AzaDc处理后,DNA甲基化程度明显降低,表明5-AzaDc处理后DNA甲基化受到抑制。短时间的5-AzaDc处理增加犬卵母细胞成熟率的原因可能是5-AzaDc使DNA甲基化受到抑制,使染色体去凝集,促使GVBD的发生,短时间的5-AzaDc处理后,将卵母细胞释放到无5-AzaDc的基础培养液中,使卵母细胞发生重新甲基化,使染色体凝集,进而使犬卵母细胞进入MI-MⅡ期。说明通过短时间的抑制DNA甲基化水平对犬卵母细胞的减数分裂恢复有积极促进作用。
参考文献:
[1]Lee B C, Kim M K, Jang G,et al. Dogs cloned from adult somatic cells[J]. Nature, 2005, 436: 641.
[2]Zou Q, Wang X, Liu Y ,et al. Generation of gene-target dogs using CRISPR/Cas9 system[J]. J Mol Cell Biol, 2015, 7(6): 580-583.
[3]Howell C Y, Bestor T H, Ding F,et al. Genomic imprinting disrupted by a maternal effect mutation in the Dnmt1 gene[J]. Cell, 2001, 104: 829-38.
[4]Hata K, Okano M, Lei H,et al. Dnmt3L cooperates with the Dnmt3 family of de novo DNA methyltransferases to establish maternal imprints in mice[J]. Development, 2002, 129: 1983-1993.
[5]Li S, Yin Xi Jun, Liang S,et al. The effect of 5-Aza-2´-deoxyctidine on nuclear maturation of canine oocytes in vitro[C]. Guilin China: The 8th Annual Conference of the Asian Reproductive biotechnology Society, 2011.
[6]Rodrigues B A, Rodrigues J L. Influence of reproductive status on in vitro oocytes maturation in dogs[J]. Theriogenology, 2003, 60: 59-66.
[7]丁向彬. 牛体细胞核移植胚胎表观遗传修饰研究[D]. 杨凌: 西北农林科技大学, 2008.
[8]Vogel M C, Papadopoulos T, Müller-Hermelink H K,et al. Intracellular distribution of DNA methyltransferase during the cell cyele[J]. FEBS Lett, 1988, 236: 9-13.
[9]Lees-Murdock D J, Shovlin T C, Gardiner T,et al. DNA methyltransferase expression in the mouse germ line during periods of de novo methylation[J]. Dev Dyn, 2005, 232: 992-1002.
[10]Zhang L, Lu D Y, Ma W Y,et al. Age-related changes in the localization of DNA methyltransferases during meiotic maturation in mouse oocytes[J]. Fertil Steril, 2011, 95(4): 1531-1534.
[11]Egger G, Liang G N, Jones P A. Epigenetics in human disease and prospeets for Epigenetic therapy[J]. Nature, 2004, 429:457- 463.
[12]张亚妮, 王颖洁, 左其生, 等. 5-Azadc 和TSA对鸡Nanog基因启动活性及ESC多能性维持的影响[J]. 畜牧兽医学报, 2015, 46 (12): 2176-2184.
[13]Wanga S, Xiong X R, An Z X,et al. Production of cloned calves by combination treatment of both donor cells and early cloned embryos with 5-aza-2'-deoxycytidine and trichostatin A[J]. Theriogenology, 2011,75: 819-825.
[14]Zhao F Y, Shao C P, Li Y,et al. 5-Azacytidine induces early stage apoptosis and promotes in vitro maturation by changing chromosomal construction in murine oocytes[J]. Reprod Toxicol, 2013, 37: 56-61.
[15]Enright B P, Kubota C, Yang X,et al. Epigenetic characteristics and development of embryos cloned from donor cells treated by trichostatin A or 5-aza-2'-deoxycytidine[J]. Biol Reprod, 2003, 69: 896-901.
[16]Lodde V, Modina S C, Franciosi F,et al. Localization of DNA methyltransferase-1 during oocyte differentiation, in vitro maturation and early embryonic development in cow[J]. Eur J Histochem, 2009, 53(4): 199-207.
[17]李所, 康锦丹, 金君学, 等. 不同温度对犬卵母细胞体外卵丘扩散及核成熟的影响[J]. 中国畜牧杂志, 2014, 50(3): 35-38.
Effect of DNA Methyltransferase Inhibitor 5-AzaDc on Nuclear Maturation of Canine Oocytes in vitro
LI Suo1, LI Xiao-Cheng2, KANG Jin-dan2, ZHU Hai-Ying2, GUO Qing2, ZHENG Xin1*, YIN Xi-Jun2*
(1.College of Animal Science and Technology, Jilin Agricultural University, Jilin Changchun 130118, China; 2.Department of Animal Science, Yanbian University, Jilin Yanji 133002, China)
Researches showed that DNA methylation was very important for the maturation of oocytes, however, the effect of DNA methylation on canine oocytes maturationin vitrohas not been examined. The objective of this study was to evaluate the effect of DNA methyltransferase inhibitor 5-AzaDc on nuclear maturation of canine oocytesin vitro. We compared thein vitronuclear maturation of canine oocytes treated with various concentrations (1, 2 µmol/ L) of 5-AzaDc for different durations (1, 2, 48 or 72 h). Immunodetection of 5-AzaDc treatment was conducted on the distribution and trend of DNA methylation in canine oocytes. the results indicated that the treatment of 2 µmol/L 5-AzaDc for 48 h reduced the proportion of canine oocytes that blocked in GV stage, and significantly increased the percentage of canine oocytes that reached GVBD-MIIin vitro. Immunofluorescence staining of anti-5-methylcytosine showed that the localization of DNA methylation during canine oocyte centralized in nuclear area, but not in cytoplasm, and the treatment with 5-AzaDc significant decreased the DNA methylation level. In conclusion, 2 µmol/L 5-AzaDc supplementation during IVM for 48 h improved the maturation of canine oocytes by inhibiting the DNA methylation levels of oocytes, and the inhibition of DNA methylation levels for a short time active effect on meiotic resumption of canine oocytes.
Canine oocyte;in vitromaturation; 5-AzaDc; DNA methyltransferase
S829.3
A
10.19556/j.0258-7033.2017-05-050
2016-11-24;
2016-12-29
吉林农业大学科研启动基金(201602);吉林农业大学博士后流动站(166992);中国博士后科学基金第60批面上资助( 2016M601393)
李所(1988-),女,博士,讲师,主要研究方向动物遗传育种与繁殖,E-mail: wonderful8899@ 163.com
* 通讯作者:尹熙俊,男,教授,博士生导师,E-mail: yinxj33 @msn.com;郑鑫,女,教授,博士生导师,E-mail: zhengxin jilin@126.com
