烟草花叶病毒辽宁分离物Northern杂交检测体系的建立
2017-05-19李艳丽安梦楠王冠中吴元华
李艳丽 安梦楠 王冠中 吴元华
(沈阳农业大学植物保护学院,沈阳 110161)
烟草花叶病毒辽宁分离物Northern杂交检测体系的建立
李艳丽 安梦楠 王冠中 吴元华
(沈阳农业大学植物保护学院,沈阳 110161)
为了建立烟草花叶病毒辽宁分离物(TMV-LN)的高特异性、高灵敏度的分子杂交检测体系,从粗提纯的TMV-LN粒子中提取RNA,设计特异性引物通过RT-PCR扩增TMV-LN的CP和3'端非翻译区域,将片段连至pUC119载体获得重组质粒pUCTMV-PP,体外转录获得地高辛(DIG)标记的TMV-LN正义链RNA杂交检测探针,同时构建DNA检测探针作为对照。采用点印迹(Dot-blot)杂交和Northern杂交对比RNA探针和DNA探针对TMV-LN的检测特异性和灵敏性。检测结果表明,RNA探针和DNA探针在点印记杂交和Northern杂交中均表现出良好的检测特异性,RNA探针在检测灵敏度方面要略好于DNA探针,且点印迹杂交体系在病毒定性方面较为快捷,Northern杂交体系在病毒基因组RNA的定量方面具有明显优势。
烟草花叶病毒辽宁分离物;RNA探针;DNA探针;点印迹杂交;Northern杂交
烟草花叶病毒(Tobacco mosaic virus,TMV)世界各地均有分布,可侵染茄科、葫芦科、十字花科等300余种植物并引起严重危害,TMV的早期检测对于病害的控制十分重要。TMV是人类最早发现的植物正义单链RNA病毒,全基因组大小约为6.4 kb,编码至少4种蛋白质,分别为由基因组RNA编码的126 kD、183 kD复制相关蛋白质,以及由亚基因组RNA编码的30 kD运动相关蛋白(MP)和17.5 kD外壳蛋白(CP)[1,2]。
TMV的检测手段主要包括酶联免疫吸附测定(ELISA)、反转录PCR(RT-PCR)以及分子杂交等技术[3,4]。Northern杂交可分别检测病毒基因组RNA(gRNA)、亚基因组RNA(sgRNA)以及defective interfering(DI)RNA以及其他病毒由来的RNA片段的积累量和完整度[5-8]。
在植物病毒的检测方面,Northern杂交相比ELISA在特异性方面要高很多,在对病毒进行相对定量方面更为准确,在检测中Northern杂交所使用的探针构建比ELISA所需检测抗体的制备要方便;Northern 杂交相比RT-PCR技术,可检测出序列同源性很高(>90%)但归为不同株系的病毒,相比之下,RT-PCR法检测病毒对扩增引物的配对准确性要求极高,对于恰好在设计扩增引物序列中发生碱基突变的病毒可能无法检测,且容易扩增出非病毒由来条带,影响对试验结果的判断。因此Northern杂交在病毒的特异性检测方面相比ELISA和RT-PCR具有优势[9,10]。特异性探针的制备对于病毒Northern杂交检测具有决定性的作用,随着科技的进步以及人们对健康的重视,在探针制备方面地高辛(DIG)已经逐步代替了同位素,且研究表明,DIG标记RNA探针与32P标记的放射性探针在马铃薯纺锤块茎类病毒的检测灵敏度方面无明显差别,RNA探针相比DNA探针在检测灵敏度方面要高出2-30倍[11,12],同时,RNA探针可分别检测正义链和负义链的积累量,DNA探针由于是双链结构,可同时检测出病毒正、负义链RNA,由于长度相同无法分别研究正、负义链RNA的积累。因此,采用RNA探针的Northern杂交更适合于对病毒复制过程的分子研究[13]。
本研究构建出TMV-LN的RNA检测探针和DNA检测探针,建立TMV-LN的点印记杂交和Northern杂交检测体系,旨在为TMV早期检测、防治及深入的复制机理的研究提供可靠的研究方法。
1 材料与方法
1.1 材料
1.1.1 主要实验材料 TMV-LN毒源由沈阳农业大学烟草研究所提供;M-MuLV First Strand cDNA Synthesis Kit反转录试剂盒购自上海生工生物技术有限公司;PrimeSTAR®GXL DNA Polymerase、载体pUC119、内切酶KpnⅠ和PstⅠ均购自Takara Bio Inc.(大连宝生物工程有限公司);Trizon Reagent购自康为世纪生物科技有限公司;Dig Northern Start Kit、Dig High Primer DNA Labeling and Detection Starter Kit II购自德国罗氏生物试剂有限公司;尼龙膜为美国GE公司产品;CDP-Star Reagent为美国NEB公司产品;其他均为国产或进口分析纯。
1.1.2 引物设计 从GenBank获取TMV基因组全长序列(GenBank ID:NC_001367),设计特异性引物并由生工生物工程(上海)股份有限公司(以下简称上海生工)合成(表1)。
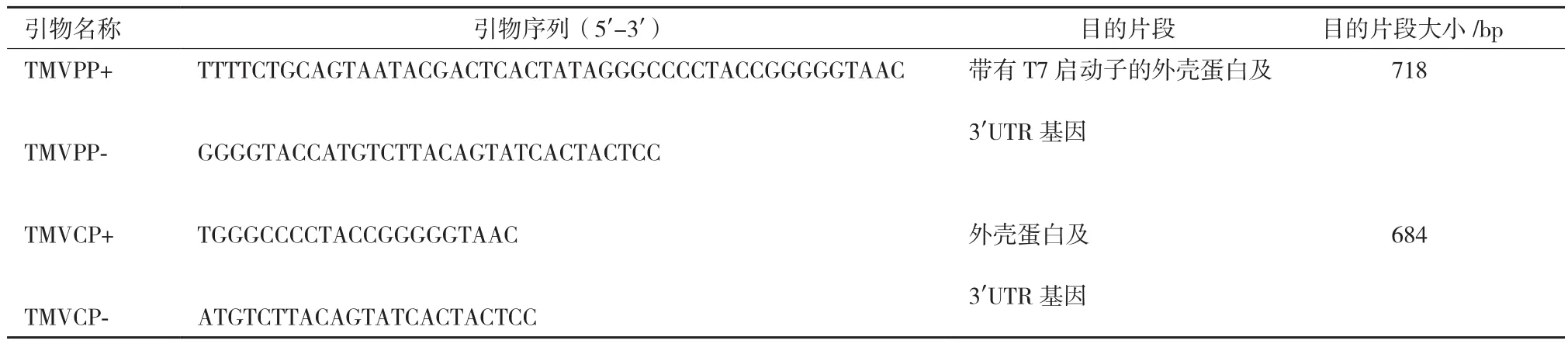
表1 扩增目的片段所需引物列表
1.2 方法
1.2.1 TMV-LN病毒粒子以及核酸RNA的提取 根据Gooding等[14]及Chapman[15]的方法,将20 g TMV-LN感病烟草叶片(品种为云烟87)加入30 mL PBS缓冲液充分研磨,每10 mL滤液加入0.8 mL正丁醇,数次颠倒室温培育15 min;于12℃10 000× g离心30 min,加入PEG6000至终浓度为4%,颠倒混匀后于冰上放置15 min;4℃,10 000× g离心15 min后保留沉淀,用8 mL 10 mmol/L磷酸缓冲液使之重新悬浮,加入1.7 mL 5mol/L NaCl和2.42 mL 20% PEG后混匀,冰上保存15 min;4℃10 000× g离心15 min,弃上清,用1 mL 10 mmol/L磷酸缓冲液使沉淀悬浮,得到病毒粗提液。
取上述病毒粗提液,加入等体积的苯酚∶氯仿∶异戊醇(25∶24∶1),剧烈震荡后4℃,16 200× g离心5 min,取上层水相至新离心管,重复上述操作后取出水相进行乙醇沉淀,干燥后用无RNase 水溶解。
1.2.2 TMV-LN RNA检测探针的制备 按照M-MuLV First Strand cDNA Synthesis Kit说明书方法可得到cDNA,通过特异性引物TMVPP+和TMVPP-进行PCR反应,反应为25 μL体系:5×PrimeSTAR GXL Buffer 5 μL;dNTP Mixture 2 μL;TMVPP+、TMVPP-(2.5 mmol/L)各2 μL;模板cDNA 1 μL;DNA polymerase 0.5 μL;超纯水补足至25 μL。反应条件:94℃预变性2 min;98℃变性10 s,55℃退火15 s,68℃延伸4 min,循环30次。上述PCR产物经纯化后,与pUC119质粒载体同时进行Pst I和Kpn I双酶切,用DNA Ligation Kit Ver.2.1(TaKaRa)16℃连接4 h,热激法导入DH5α感受态细胞,培养后采用菌落PCR筛选阳性克隆,送至测序(上海生工公司)并确定表达载体pUCTMV-PP构建成功。以pUCTMVPP为模板通过TMVPP+和TMVPP-进行PCR扩增后,采用Dig Northern Start Kit(Roche)体外转录制备DIG标记的RNA探针,保存于-80℃。
1.2.3 TMV-LN DNA检测探针的制备 以pUCTMVPP为模板采用TMVCP+、TMVCP-扩增后的PCR产物经纯化后作为模板DNA,按Dig High Prime DNA Labeling and Detection Starter Kit II说明书制备DNA探针:1 μg模板DNA,用灭菌双蒸水补足体系至16 μL;沸水浴10 min以充分变性DNA,之后迅速插入冰水混合物中;取4 μL DIG-High Prime至变性DNA,混匀并离心;37℃孵育5 h按Dig High Prime DNA Labeling and Detection Starter Kit II(Roche)说明书;反应结束后,加入2 μL 0.2 mol/L EDTA(pH8.0)终止反应。用无菌双蒸水补足体系至100 μL,分装保存于-20℃。
1.2.4 点印迹杂交检测和Northern杂交检测 待测样品RNA为Trizon Reagent从感染TMV-LN的烟草、感染辣椒轻斑驳病毒(Pepper mild mottle virus,PMMoV)的辣椒及健康烟草中分别提取的TMV、PMMoV及阴性对照的RNA,采用虹吸法对样品进行Northern杂交[16]及Dot-blot[17]检测:将RNA固体样品用上样缓冲液溶解,65℃金属浴变性10 min,由2%的甲醛凝胶电泳分离后,甲醛凝胶中的RNA由虹吸法转移到尼龙膜上,室温过夜,取出尼龙膜于120℃干热箱中处理1 h后,按照Dig Northern Start Kit、Dig High Primer DNA Labeling and Detection Starter Kit II说明进行杂交和免疫反应,之后于膜上滴2-3滴CDP-Star Reagent使膜润湿,由Bio-Rad ChemiDoc XRS+化学发光成像系统(美国伯乐)曝光30 s观察结果。省略甲醛凝胶电泳与转膜步骤。
2 结果
2.1 TMV及其RNA的提纯
为了减少外源RNA对试验结果的影响,本研究将从提纯的TMV粒子中提取TMV-LN的核酸RNA。通过紫外分光光度计Nano drop1000测得TMV-LN病毒粒子浓度为22.42 mg/mL,A260nm和A280nm两个波长吸光度比值为1.21,本研究提取的TMV核酸RNA纯度符合要求。除去外壳蛋白,纯化RNA后通过TBE琼脂糖凝胶电泳后,一条长度约为6 400 bp的条带且清晰可见(图2),符合反转录要求。
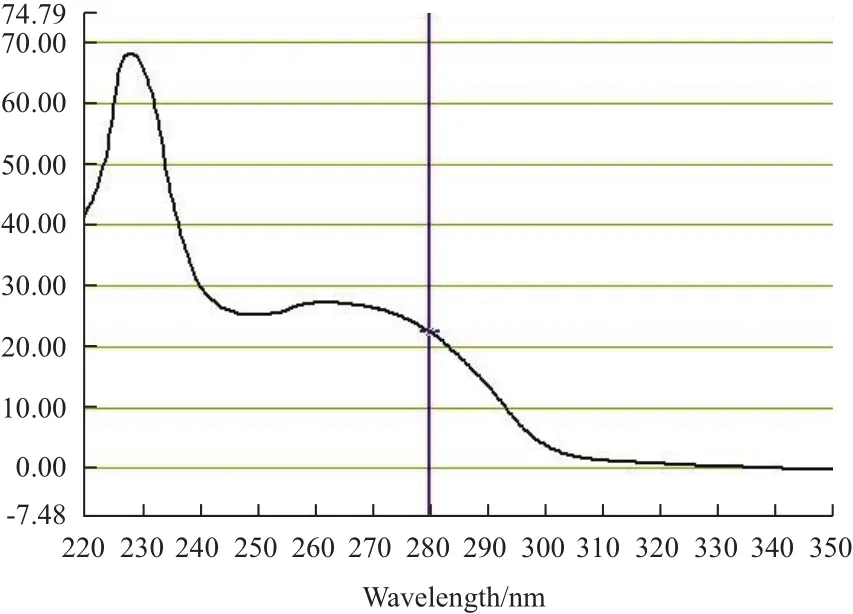
图1 提纯TMV的紫外吸收光谱
2.2 RNA及DNA探针的制备
将提取的TMV-LN核酸RNA进行反转录,以cDNA为模板采用TMVPP+和TMVPP-进行 PCR扩增,经TAE琼脂糖凝胶电泳后得到的结果清晰明亮且单一(图3),与718 bp的预期扩增长度一致。

图2 TMV RNA 电泳图

图3 PCR产物电泳图
将目的片段连接pUC119构建T7体外表达pUCTMV-PP,对质粒进行酶切结果(图4)表明,Pst I酶切后呈单一条带且长度与3 845 bp的预期长度相符,将测序结果与GenBank中TMV辽宁凤城分离物(GenBank:HE818420.1)序列相似度为98%。为了获取大量T7转录的DNA模板,提高RNA探针转录效率,本实验以pUCTMV-PP为模板使用引物TMVPP+、TMVPP-进行PCR扩增,条带清晰且单一,产物经纯化后进行RNA探针的转录。转录产物经TBE电泳可同时检测到模板DNA和转录产物两条条带(图5)。

图4 酶切后目标质粒电泳图

图5 RNA探针制备结果
在TMV-LN的DNA探针的构建方面,由于所得DNA探针长度与模板DNA相同,因此通过电泳凝胶电泳无法验出新和成的DNA链,本研究通过后续杂交试验检测判断DNA探针制备是否成功。
2.3 基于RNA探针的点印记杂交和Northern杂交检测
为了检测构建的RNA探针的检测特异性和灵敏性,本研究提取TMV-LN感病烟草叶片和同为烟草花叶病毒属的 PMMoV感病辣椒叶片总RNA,将上述待测样品做梯度稀释并分别进行点印记杂交和Northern杂交检测。核糖体RNA(rRNA)的TBE电泳结果作为对照。
点印迹杂交检测结果(图6-A)显示,TMV-LN感病样品所提取的RNA显阳性,PMMoV感病样品无检测信号,TMV-LN 感病样品稀释至1%后仍能检测到信号。Northern杂交检测结果(图7-A,泳道2)显示,TMV-LN 感病样品所提取的RNA显阳性,能同时检测到基因组RNA(gRNA)和亚基因组RNA(sgRNA)两条条带。在同样品稀释到1%后仍能微弱检测到gRNA的信号(图7-A,泳道4),且PMMoV感病样品无检测信号。综上结果,本实验构建的RNA探针具有良好的检测特异性和灵敏性。
2.4 基于DNA探针的点印记杂交和Northern杂交检测
本研究制备TMV-LN的DNA检测探针作为对照对比其与RNA探针在病毒检测特异性和敏感性方面是否存在差异,采用TMV-LN和 PMMoV的样品进行梯度稀释并分别进行基于DNA探针的点印记杂交和Northern杂交检测。
点印迹杂交检测结果(图6-B)显示,TMVLN 感病样品所提取的RNA显阳性,PMMoV感病样品无检测信号,TMV-LN 感病样品稀释至10%后能检测到信号,稀释至1%无法检测到阳性信号。Northern杂交检测结果(图7-B,泳道2)显示,DNA探针可同时检测到TMV-LN的gRNA和sgRNA的条带。检测灵敏度方面与点印记杂交结果基本相符。
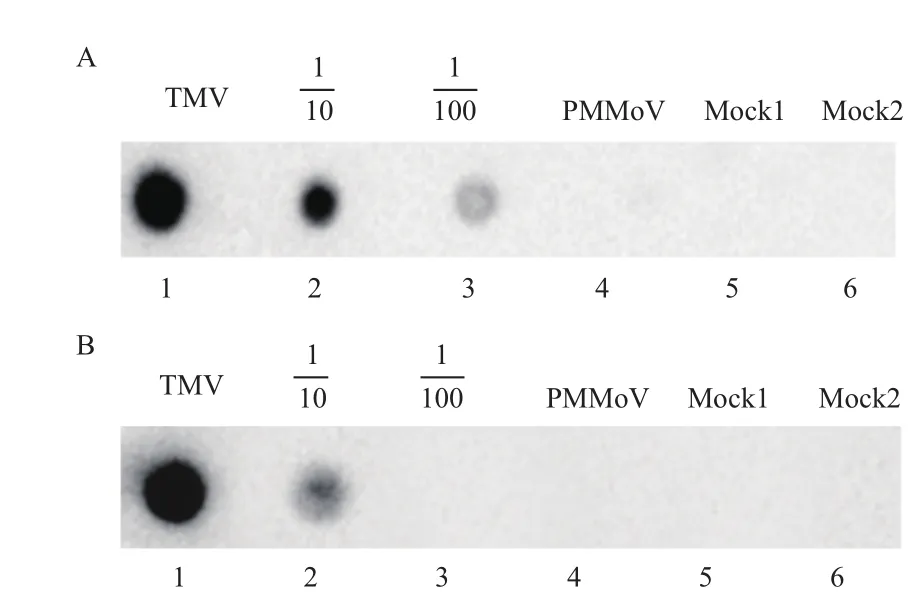
图6 RNA探针(A)和DNA探针(B)点印迹杂交检测结果
3 讨论
TMV寄主范围广泛,对农业生产造成持续的危害,TMV的精确分子检测对于病害的控制以及减少损失具有重要意义。分子杂交技术在植物病毒的检测和鉴定研究中发挥重要作用[3-6]。本研究所采用的Northern杂交检测体系灵敏度较高、特异性强,既可以定性分析,又可以定量分析,并可以获得片段大小及完整度等相关信息。
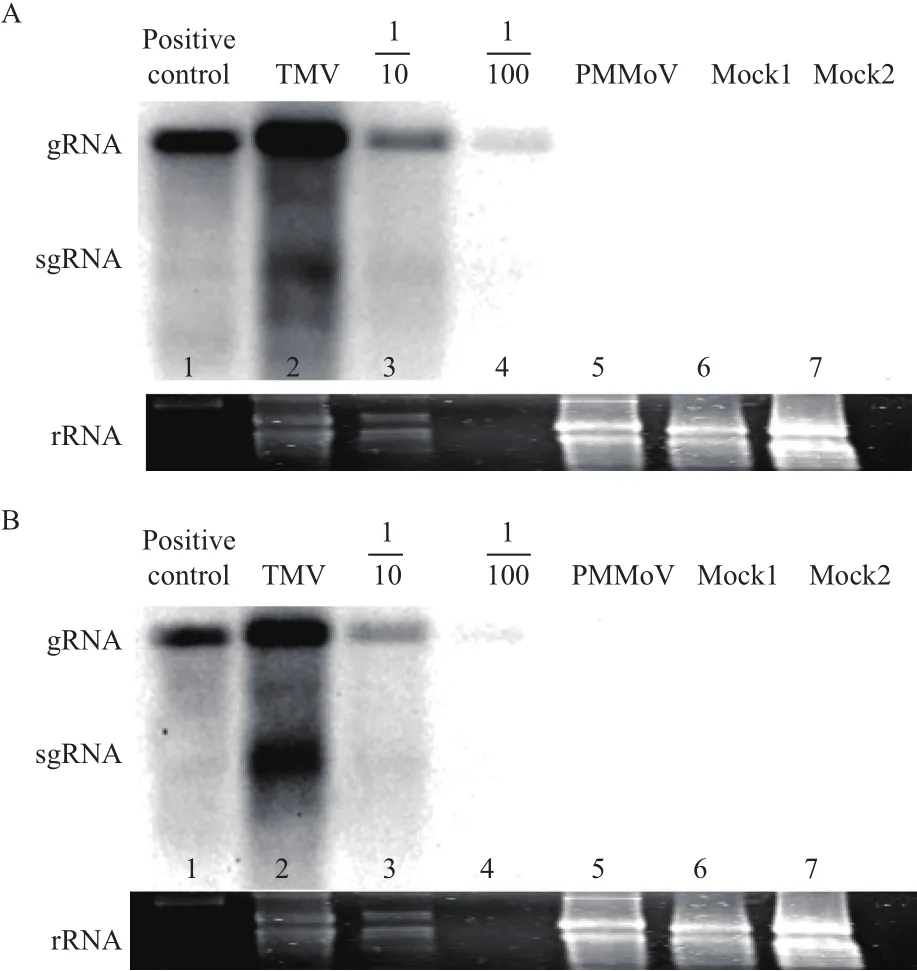
图7 RNA探针(A)和DNA探针(B)Northern杂交检测结果
本研究构建了非放射性DIG标记的TMV-LN正义链RNA探针以及DNA检测探针,采用点印记杂交和Northern杂交分别对TMV-LN感病样品进行了检测。结果表明,构建出的RNA探针和DNA探针都可以对感病烟叶中的TMV进行检测,根据PMMoV感病样品无阳性检测信号的结果,判断上述两种探针具备良好的检测特异性,且RNA探针灵敏度要明显高于DNA探针,其主要原因在于RNA和RNA的杂交结合强度比DNA和RNA杂交高[11]。此外,RNA探针可分别检测正义链和负义链的积累量[11],DNA探针由于是双链结构,可同时检测出病毒正、负义链RNA,由于长度相同无法分别研究正、负义链RNA的积累。因此,采用RNA探针的Northern杂交更适合于对病毒复制过程的分子研究[18]。对比点印记杂交和Northern杂交体系:两种杂交检测体系在检测TMV-LN的灵敏度方面没有明显差别,点印记杂交体系的优点在于可同时对大量病毒样品进行定性,且耗时较短,缺点在于对病毒核酸定量方面不够准确[19];Northern杂交检测体系通过凝胶电泳再转膜杂交,优点是可对病毒的gRNA以及sgRNA等进行分别定量检测,同时可判断核酸是否发生降解[3-5],缺点是整个检测过程耗时相对较长。
4 结论
本研究所建立的基于RNA探针和DNA探针的点印迹杂交和Northern杂交检测体系可以应用在TMV-LN较高灵敏度的定性以及定量检测,RNA探针的检测灵敏性要好于DNA探针。点印迹杂交检测体系为TMV-LN的快速、大量的检测提供了快捷方法;Northern杂交检测体系为TMV-LN分子致病机理,以及抗病毒药剂对病毒作用机制等详细的分子研究提供了有效、可靠的实验方法以及研究体系。
[1] Scholthof KB. Tobacco mosaic virus:a model system for plant biology[J]. Phytopathology, 2004, 42(42):13-34.
[2] Chujo T, Ishibashi K, Miyashita S, et al. Functions of the 5'-and 3'-untranslated regions of tobamovirus RNA[J]. Virus Research, 2015, 206:82-89.
[3] López MM, Llop P, Olmos A, et al. Are molecular tools solving the challenges posed by detection of plant pathogenic bacteria and viruses?[J]. Curr Issues Mol Biol, 2009, 11(1):13-46.
[4] Webster CG, Wylie SJ, Jones MGK. Diagnosis of plant viral pathogens[J]. Current Science, 2004, 86(12):1604-1607.
[5] 许清孝. 烟草花叶病毒的检测方法研究进展[J]. 现代农业科技, 2013(11):128-129.
[6] 刘崇, 高颖, 杨洪一. 辣椒轻斑驳病毒的分子杂交检测[J].湖南农业大学学报:自然科学版, 2015, 41(4):360-363.
[7] Iwakawa HO, Mizumoto H, Nagano H, et al. A viral noncoding RNA generated by cis-element-mediated protection against 5'-3' RNA decay represses both cap-independent and cap-dependent translation[J]. Journal of Virology, 2008, 82(20):10162-74.
[8] Panavas T, Nagy PD. Mechanism of stimulation of plus-strand synthesis by an RNA replication enhancer in a tombusvirus[J]. Journal of Virology, 2005, 79(15):9777-9785.
[9] 申煌煊, 李刚. 分子生物学实验方法与技巧[M]. 广州:中山大学出版社, 2010.
[10] Aboul-Ata AAE, Vitti A, Nuzzaci M, et al. Plant-based vaccines:Novel and low-cost possible route for Mediterranean innovative vaccination strategies[J]. Adv Virus Res, 2014, 89:1-37.
[11]Welnicki M, Hiruki C. Highly sensitive digoxigenin-labelled DNA probe for the detection of potato spindle tuber viroid[J]. Journal of Virological Methods, 1992, 39(1-2):91-99.
[12]Singh RP, Boucher A, Lakshman DK, et al. Multimeric nonradioactive cRNA probes improve detection of potato spindle tuber viroid(PSTVd)[J]. J Virol Methods, 1994, 49(2):221-33.
[13]李尉民. 南方菜豆花叶病毒(SBMV)两典型株系特异 cDNA和 RNA 探针的制备[J]. 植物病理学报, 1998, 28(3):243-248.
[14]Gooding Jr GV, Hebert TT. A simple technique for purification of Tobacco mosaic virus in large quantities[J]. Phytopathology, 1967, 57(11):1285-1285.
[15]Chapman SN. Construction of infectious clones for RNA viruses:TMV[J]. Methods Mol Biol, 2008, 451:477-490.
[16]Pall GS, Hamilton AJ. Improved Northern blot method for enhanced detection of small RNA[J]. Nature Protocols, 2008, 3(6):1077-84.
[17]Liu Y, Sun B, Wang X, et al. Three digoxigenin-labeled cDNA probes for specific detection of the natural population of Barley yellow dwarf viruses in China by dot-blot hybridization[J]. Journal of Virological Methods, 2007, 145(1):22-29.
[18]Minutillo SA, Mascia T, Gallitelli D. A DNA probe mix for the multiplex detection of Ten artichoke viruses[J]. European Journal of Plant Pathology, 2012, 134(3):459-465.
[19]杜国英, 王锡锋, 周广和. 地高辛标记的cDNA探针检测烟草花叶病毒、黄瓜花叶病毒及马铃薯Y病毒[J]. 植物病理学报, 2004, 34(1):75-79.
(责任编辑 李楠)
The Establishment of Northern Blot Hybridization Detection System for Tobacco Mosaic Virus Liaoning Isolate
LI Yan-li AN Meng-nan WANG Guan-zhong WU Yuan-hua
(College of Plant Protection,Shenyang Agricultural University,Shenyang 110161)
In order to establish a more sensitive and specific molecular hybridization detection system of Tobacco mosaic virus Liaoning isolate(TMV-LN),total viral RNA was extracted from purified TMV-LN viral particles and amplified by reverse-transcript PCR. The PCR products were ligated into pUC119 vector to construct pUCTMV-PP that express RNA detection probe using Digoxigenin(DIG)Northern Starter Kit. DNA probe was also constructed using DIG DNA hybridization kit. Dot-blot hybridization and Northern blot hybridization analysis were performed to study the specificity and sensitivity of the RNA probe and DNA probe constructed above. Both of the probes showed high specificity and sensitivity in TMV-LN detection through Dot-blot hybridization and Northern blot hybridization detection system. Comparison of two hybridization systems,Dot-blot hybridization system is suitable for virus qualitative detection,whereas,Northern blot hybridization has its advantage in relative quantification of viral genome RNA.
TMV Liaoning isolate;RNA probe;DNA probe;Dot-blot hybridization;Northern blot hybridization
10.13560/j.cnki.biotech.bull.1985.2017.04.017
2016-12-09
国家自然科学基金项目(31401710),国家烟草专卖局科技项目[110201601024(LS-04)]
李艳丽,女,硕士研究生,研究方向:植物病毒学;E-mail:duffin@163.com
安梦楠,男,博士,讲师,研究方向:分子植物病毒学,E-mail:anmengnan@syau.edu.cn吴元华,男,博士,博士生导师,研究方向:植物病毒学,E-mail:wuyh7799@163.com
