S. suis 2 中国强毒株烯醇化酶 Enolase 基因的分子克隆及蛋白生物功能研究
2017-05-19孙雯郑峰
孙雯郑峰
(1. 扬州科技学院,扬州 225000;2. 中国人民解放军南京军区军事医学研究所,南京 210002)
S. suis 2 中国强毒株烯醇化酶 Enolase 基因的分子克隆及蛋白生物功能研究
孙雯1郑峰2
(1. 扬州科技学院,扬州 225000;2. 中国人民解放军南京军区军事医学研究所,南京 210002)
对中国强毒株 S. suis 2 烯醇化酶 Enolase 进行克隆表达、定位分析、酶活性检测及免疫相关功能研究,探讨 Enolase在 S.suis 2 致病中的作用。基于 S. suis 2 05ZYH33 全基因组测序,对 Enolase 编码基因进行生物信息学分析。构建 pET32a∷eno 重组表达质粒,转化入 E. coli BL21 中诱导表达,利用 His-Beads 和 FPLC 纯化后获得 Enolase 重组蛋白。对纯化后的 Enolase 进行酶活性检测,鉴定其糖代谢功能。然后利用 FCM 分析 Enolase 在 S. suis 2 的定位情况,最后通过外周血单核细胞 MTT 实验检测 Enolase对 PBMCs 活性的影响。同源性分析发现 S. suis 2 eno 与多种细菌中 eno 高度同源。SignalP 和 TMHMM 分析发现 Enolase 没有信号肽也没有跨膜区。eno 分子克隆并测序显示长度为 1 308 bp。重组质粒经诱导表达并纯化后,获得 75 kD 的 Enolase 蛋白。纯化的重组 Enolase 有将 2-PEG 转化成 PEP 的能力。FCM 分析表明 Enolase 也存在于细菌表面。MTT 测试表明 Enolase 能够引发 PBMCs 活性的下降。Enolase 不仅在 S.suis 2 体内参与基础代谢活动,同时也存在于 S.suis 2 表面,可能通过破坏单核细胞参与感染过程。
猪链球菌2型(S. suis 2);烯醇化酶;酶活性;流式细胞术;外周血单核细胞
猪链球菌2型(S. suis 2)是猪链球菌35种血清型中致病性最强、分布最广的烈性人畜共患病原菌。近几十年,S. suis 2 已在欧洲、美洲、亚洲的几十个国家陆续引发了200多例散发的人群恶性感染事件[1]。尤其在2005年的中国四川省人群中暴发了规模巨大的 S. suis 2 疫情,大量患者出现了链球菌高侵袭、深部组织感染的罕见毒性休克综合征(STSS),病死率高达 62%-82%[2]。北京中科院通过流行病学调查、动物模型、多重 PCR 及基因生物信息学分析等方法,确认了 S. suis 2 是四川省猪链疫情暴发和 STSS 出现的原因[3]。
大量研究表明暴露在病原菌细胞壁外的蛋白不仅参与细菌的免疫防御机制,也涉及细菌侵染宿主过程中一系列环节,如黏附、侵袭、定植及穿梭等[4,5]。近年报道一些在细菌体内参与基础代谢的蛋白,大都缺乏信号肽序列和细胞壁锚定结构,但也能出现在细胞表面[6,7]。烯醇化酶(Enolase,ENO)似乎就是如此,在细菌细胞质中是一个参与糖代谢的金属酶,也能在许多病原菌胞壁外参与感染过程[10]。本研究在前期已完成 S. suis 2 05ZYH33(四川省资阳2005年疫区分离菌株)全基因组的测定,在此基础上发现了 CDS SSU1503 基因序列与多种细菌 Enolase 编码基因高度同源,故推断为Enolase 疑似编码序列(eno),进而本研究对 eno 基因进行序列信息分析和克隆表达,检测 eno 基因编码蛋白 Enolase 在菌内的酶活性和菌外的定位,并对蛋白引发的免疫抑制作用进行探究。
1 材料与方法
1.1 材料
本研究所用实验材料及其来源如表1所示。
1.2 方法
1.2.1 eno基因生物信息学分析 利用 BLAST(ExPASy提供)进行 Enolase 蛋白质序列相似度比对,在蛋白序列数据库中利用 PSIBLAST 程序搜索序列显著相似的 Enolase 同源序列。再利用 Clustal X 软件开展多重序列比对以及分子遗传分析软件生成 Enolase 的系统进化树。利用软件 SignalP 4.1 和TMHMM 2.0 分别预测 S. suis 2 05ZYH33 中 Enolase的信号肽及跨膜区结构。
1.2.2 Enolase 分子克隆 根据 S. suis 2 05ZYH33 Enolase 序列设计合成引物(DNAStar 软件设计,上海芃硕生物科技有限公司合成),进行 PCR 扩增。上游引物为 5'-GCGGATCC ATGTCAATTATTACTG-3'(前端带有 BamH I 切割位点);下游引物为 5'-GC CTCGA GTATGGATTTACCTGTTA G-3'(前端带有Xho I 切割位点)。PCR程序:95℃ 预变性 2 min;循环30次:94℃ 变性 40 s,55℃ 复性 35 s,72℃延伸 1 min;72℃ 延伸 7 min。PCR 产物经 1% 琼脂糖凝胶电泳和试剂盒回收回收后与 pMD-18T 载体连接,并转化进入感受态 E. coli DH5α。菌液 PCR 阳性者提取质粒进行酶切鉴定。用 BamH I 和 Xho I 分别对 pMD-18T∷eno 和 pET32a 进行双酶切,用 T4 DNA 连接酶连接酶切后的目的片段,构建成表达质粒 pET32a∷eno,再次转化进入感受态 E. coli DH5α,菌液 PCR 阳性者提取重组质粒,单酶切(BamH I)和双酶切(BamH I 和 Xho I)处理后,琼脂糖电泳后经凝胶成像仪鉴定阳性者由上海伯豪生物技术公司测序。

表1 实验材料
1.2.3 Enolase 表达和纯化 提取重组表达载体pET32a∷eno 转化进入感受态 E. coli BL21,IPTG(异丙基-β-D-半乳糖苷)诱导后,用无菌 PBS 重悬离心后菌体沉淀,进行超声裂解细菌,离心收集上清,经12% SDS-PAGE电泳、染色和脱色后,鉴定Enolase是否表达。大量培养重组菌 E. coli BL21(含pET32a∷eno)并诱导表达,超声破碎菌液离心取上清与 His 标签纯化树脂孵育过夜。次日将孵育物装进层析柱中,PBS 平衡后,用5 mmol/L 咪唑洗脱非特异性蛋白,用 100 mmol/L 咪唑洗脱 Enolase 目的蛋白。目的蛋白经快速蛋白液相层析(FPLC)法进一步得到纯化,再次用 SDS-PAGE 电泳分析。
1.2.4 Enolase 酶活性测定 酶催化体系为:重组Enolase(5 μg),2-PGE(2-磷酸甘油酸盐,以 0.25-12 mmol/L 的浓度逐渐增加),HEPES(100 mmol/L,pH 7.0),MgCl2(10 mmol/L),KCl(7.7 mmol/L)。每个浓度 37℃ 条件下反应 5 min,测定 OD240nm。以 2-PGE浓度为横坐标,以 OD 值为纵坐标,绘出米氏方程曲线,再根据 Lineweaver-Burk 双倒数法计算 Enolase的米氏常数 Km。
1.2.5 流式细胞术定位分析 将培养的 05ZYH33 菌液调整到 108CFU/mL,取 1 mL 菌液离心后用 0.01 mol/L PBS 洗沉淀3次,并重悬于 100 μL PBS 中,细菌总数约为108个。设实验组和对照组,实验组加入100倍稀释的大鼠抗 Enolase 蛋白多抗血清(对照组只加入大鼠阴性血清),4℃ 孵育 1 h,离心后用0.01 mol/L PBS 洗沉淀3次再重悬于 100 μL PBS 中,加入50倍稀释的 FITC-兔抗大鼠 IgG,4℃ 孵育 1 h,离心后用 PBS 洗涤沉淀4次并重悬,最后用 4% 多聚甲醛进行固定。用荧光激活细胞分选(FACS)技术检测。
1.2.6 外周血单核细胞 MTT 测试 通过密度梯度离心法从健康人的全血中分离出外周血单核细胞(PBMCs),洗涤后,用细胞培养液 RPMI 1640(添加抗生素和 10% 胎牛血清)将 PBMCs 浓度调整到105/ mL,并铺于96孔圆底组织培养板中(每孔 200 μL),细胞培养箱 37℃ 孵育,至细胞长满单层。设实验组和阴性对照组,实验组设3个浓度,每孔加入重组 Enolase 10 μg、5 μg和0.25 μg(100 μL,各10个复孔),阴性对照组只加入 RPMI 1640(100 μL,10个复孔),细胞培养箱 37℃ 孵育 72 h,实验组和对照组每孔分别加入 5 mg/mL噻唑蓝溶液(MTT),继续培养 4 h,酶标仪 570 nm 处测定 OD值(计算复孔平均值)。
2 结果
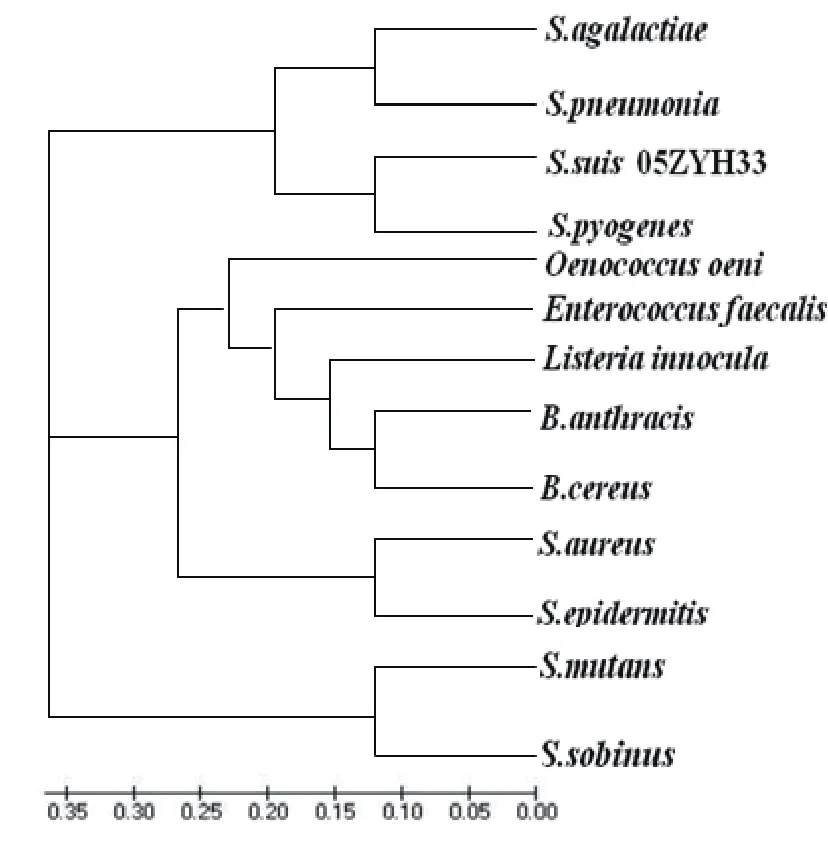
图1 S. suis 2 05ZYH33 Enolase蛋白进化树
2.1 eno基因生物信息学分析

图2 S. suis 05ZYH33 Enolase与其他相似序列的比对
BLAST 比对分析发现,S. suis 2 05ZYH33 CDSSSU1503基因编码序列与 S. pyogene、S. pneumoniae、S. sobrinu、S. agalactiae、S.mutans核酸序列相似性分别都达到 88% 以上,氨基酸序列则更加保守,相似性达到 91%-96% 之间,故将S.suis 2 05ZYH33中CDSSSU1503 基因序列推断为 Enolase 基因疑似序列。分子遗传软件生成 S. suis 2 05ZYH33 Enolase 蛋白进化树(图1,图2)。
2.2 Enolase信号肽和跨膜区预测
SignalP 4.1 和 TMHMM 2.0 分析发现 05ZYH33 Enolase 既没有信号肽序列(图3-A),也没有跨膜区结构(图3-B)。

图3 SignalP 4.1和TMHMM 2.0对Enolase信号肽(A)和跨膜区(B)的预测
2.3 eno基因分子克隆
重组载体 pMD18T∷eno 和 pET32a∷eno 经单酶切(BamH I)和双酶切(BamH I 和 Xho I)后,核酸凝胶电泳显示(图4) eno 疑似片段,生物公司测序后确定 eno 长 1 308 bp。
2.4 Enolase表达及纯化
重组菌 E. coli BL21(含 pET32a∷eno)诱导表达,进行 SDS-PAGE 电泳,与蛋白标记比对后显示在 75 kD 处有一条明显增多的蛋白条带(图5-A)。目的蛋白通过 Expasy 估算的分子量为54 kD,加上融合标签(Trx Tag+S Tag+His Tag)分子量约为21 kD,故认为融合蛋白的分子量与预测一致。利用 FPLC 技术进行蛋白纯化,每个收集管经电泳后显示出特异条带(图5-B,5-C)。

图4 质粒pMD-18T∷eno(A)和质粒pET32a∷eno(B)的酶切鉴定
2.5 Enolase酶活性测定
米氏方程曲线可以看出,在 Enolase 催化下,随着底物 2-PEG 的增加,产物磷酸烯醇丙酮酸盐(PEP)含量随之增加(图6-A),表明 Enolase 的确能够将2-PEG 转化为 PEP。双倒数作图法得出,横坐标轴截距为-1/Km(1.4308),纵坐标轴截距为1/Vmax(0.405 2)(图6-B)。由此算出,Vmax=1/0.405 2,Km=1/1.430 8(即 0.7 mmol/L)。
2.6 Enolase在S. suis 2的表面分布
流式细胞术采集图中,FACS 前向角(FCS)表示 S. suis 2 05ZYH33 体积大小,侧向角(SSC)表示 S. suis 2 05ZYH33 数量多少(图7-A)。大鼠阴性血清标记 FITC 峰图显示对照组荧光含量较低,为1.06%(图7-B),大鼠抗 Enolase 血清标记 FITC峰图显示实验组荧光含量较高,峰图明显右移,为4.33%(图7-C)。表明本室制备的鼠抗 Enolase 能够与 05ZYH33细菌表面的 Enolase 结合,验证了 S. suis 2 05ZYH33细菌表面确实存在 Enolase。
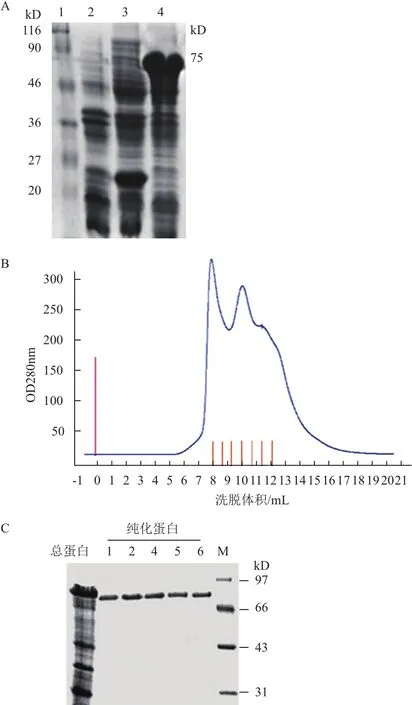
图5 Enolase蛋白的SDS-PAG电泳和FPLC鉴定
2.7 外周血单核细胞MTT测试
电子显微镜观察发现,不加 Enolase 的阴性对照组中 PBMCs 圆形、饱满、透明、贴壁生长(图8-A),而加 Enolase 孵育的实验组中 PBMCs 数量明显减少,脱落漂浮、透光性差(图8-B)。酶标仪 OD570nm结果显示,实验组 OD 值明显低于对照组(图8-C),P<0.05(实验组中Enolase不同浓度的OD值变化不大,未图示),暗示 Enolase 与 PBMCs 活性之间存在联系。

图6 纯化Enolase酶活测定
3 讨论
本研究通过 BLAST 蛋白序列相似度比对、Clustal 多重序列比对及分子遗传分析发现,S. suis 2 05ZYH33 CDS SSU1503基因序列及氨基酸序列与多种细菌中 Enolase 序列存在高同源性,故将S.suis 2 05ZYH33中 CDSSSU1503 基因序列推断为 Enolase基因疑似序列,同时暗示 Enolase 基因编码序列在进化中十分保守[8]。本研究对2005年四川疫区分离获得的强毒株 S. suis 2 05ZYH33 中 Enolase 编码基因进行分子克隆和蛋白表达,发现 Enolase 以可溶形式存在于重组菌中,经 His 标签亲和层析法和快速蛋白液相层析技术纯化后,获得了75 kD 的 Enolase重组蛋白,与预测相一致。酶催化实验显示纯化的重组 Enolase 具有酶活性,能将底物 2-PEG 转化为产物 PEP,说明 Enolase 在 S. suis 2 体内确实能参与基础糖分解代谢。研究资料显示,Enolase 同时也能催化糖生成逆向反应[9]。Enolase 有两个 Mg2+离子结合位点,当结合一个 Mg2+后能引起 Enolase 活性位点构型变化从而有利于结合第2个 Mg2+和底物[10,11]。生物信息学分析显示,S. suis 2 Enolase 既没有信号肽序列,也没有细胞膜锚定结构。然而,荧光激活细胞分选(FACS)技术检测结果却显示Enolase 确实在 S. suis 2 细胞壁表面存在。关于细胞质中的 Enolase 是如何穿过细胞膜在细胞壁表面存在的机制尚未明确,可能 Enolase 是通过非共价键结合了其他细菌表面蛋白。细菌吸附宿主细胞是侵染致病的第一步,推测 Enolase 确实可能参与了感染过程。

图7 荧光激活细胞分拣器对S. suis 2 Enolase的胞外定位检测
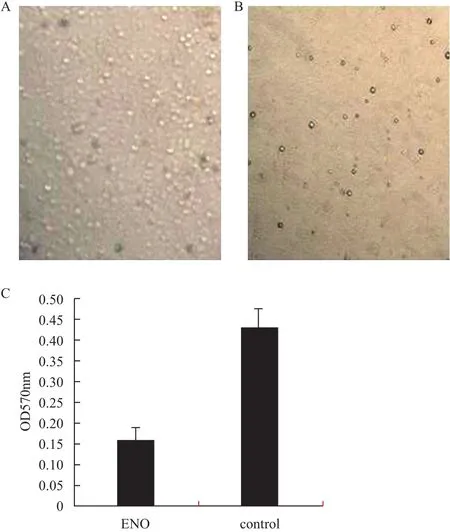
图8 Enolase引起PBMCs凋亡
在金黄色葡萄球菌、链球菌(A、C、G 群)、淋病奈瑟菌、沙门氏菌、幽门螺杆菌、流感嗜血杆菌及伯氏疏螺旋体等多种病原菌细胞壁表面都发现存在 Enolase,促进细菌穿越基底膜,参与感染过程[12-14]。研究发现,S. pyogenes 胞外的 Enolase 依靠 C 末端的赖氨酸残基结合血纤溶酶原,赖氨酸基因敲除株明显表现出侵袭细胞外基质屏障能力的减弱[15]。S. mutans 胞外的 Enolase 能结合宿主口腔中的唾液粘液素 MG2,有助于细菌定植于口腔组织,并进一步发生迁移[16]。近年来发现,在哺乳动物的神经组织、肌肉组织及肿瘤细胞和某些免疫细胞表面也存在 Enolase。当 S. suis 2 感染宿主时,宿主产生的抗细菌 Enolase 抗体也能够结合自身的 Enolase,从而引发交叉反应,导致很多自身免疫性疾病的发生[17]。如急性风湿性发热、系统性红斑狼疮、子宫内膜异位及免疫紊乱患者血清中都检测出升高Enolase 抗体[18]。
单核细胞具有吞噬、清除损伤或衰老细胞、产生抗体等作用,能够有效抵御或清除入侵的病原生物,是机体免疫防御系统的重要组成部分[19]。本研究发现外周血单核细胞在 Enolase作用下,出现数量减少、脱落漂浮、透光性差等现象,表明细胞受到了损伤或发生了凋亡。MTT 比色法,是检测细胞活性的常用技术,活细胞线粒体中的琥珀酸脱氢酶(SDH)能将 MTT 还原成蓝紫色结晶沉淀,死细胞则不能[20],因此 MTT 结晶量越大,则 OD 值越大,表明细胞活性越强。外周血单核细胞 MTT 测试显示 PBMCs 在 Enolase 作用下,OD 值明显下降,表明 PBMCs 活细胞数量的减少。前期溶血空斑试验发现 Enolase 能够引发小鼠体内免疫抑制状态出现[21],此结果与溶血空斑实验结果相符。推测细菌表面Enolase 可能通过直接或间接损伤单核细胞或诱发单核细胞凋亡,从而影响单核细胞的免疫防御机制。
4 结论
同源性分析发现 S. suis 2 05ZYH33 CDSSSU1503基因序列及氨基酸序列与多种细菌中 Enolase 序列高度同源,故推断此序列为S. suis 2 05ZYH33 Enolase基因疑似序列。SignalP 和 TMHMM 分析发现 Enolase没有信号肽也没有跨膜区。eno 分子克隆并测序显示长度为 1 308 bp,pET32a∷eno 重组表达质粒经诱导表达并纯化后,获得 75 kD 的 Enolase 蛋白。FCM定位分析显示 Enolase 也存在于细菌表面。MTT 试验检测表明 Enolase能够引发 PBMCs 活性的下降。
致谢:
本课题的实施得到了中国科学院微生物研究所高福实验室猪链球菌课题组的支持和帮助,在此表示衷心的感谢。
[1]Zhang YY, Ding DD, Liu ML, et al. Effect of the glycosyltransferases on the capsular polysaccharide synthesis of Streptococcus suis serotype 2[J]. Microbiological Research, 2016, 24(1):185-189.
[2]Tang JQ, Wang CJ, Feng YJ, et al. Streptococcal toxic shock syndrome caused by Streptococcus suis serotype 2[J]. PLoS Med, 2006, 3(5):151-155.
[3]Chen C, Tang JQ, Dong W, et al. A Glimpse of Streptococcal toxic shock syndrome from comparative genomics of S. suis 2 Chinese isolates[J]. PLoS ONE, 2007, 2(7):5298-5305.
[4]Zhang CP, Zhang ZQ, Li S. Antimicrobial resistance profile and genotypic characteristics of Streptococcus suis capsular type 2 isolated from clinical carrier sows and diseased pigs in China[J]. BioMed Research International, 2015, 20(22):3649-3657.
[5]Pian YY, Li XQ, Zheng YL, et al. Binding of human fibrinogen to MRP enhances Streptococcus suis survival in host blood in a αXβ2 integrin-dependent manner[J]. Scientific Reports, 2016, 6(4):26966-26969.
[6]JF Mariscotti, JJ Quereda, MG Pucciarelli. Contribution of sortase A to the regulation of Listeria monocytogenes LPXTG s[J]. International Microbiology, 2012, 15(1):43-51.
[7] Michon C, Langella P, Eijsink VGH, et al. Display of recombinant proteins at the surface of lactic acid bacteria:strategies and applications[J]. Microbial Cell Factories, 2016, 15(1):1-16.
[8] Wongsawan K, Gottschalk M, Tharavichitkul P, et al. Serotype- and virulence-associated gene profile of Streptococcus suis isolates from pig carcasses in Chiang Mai Province, Northern Thailand[J]. Journal of Veterinary Medical Science, 2014, 77(2):233-236.
[9]Wu CH, , Kuo YH, Hong RL, et al. α-Enolase-binding peptide enhances drug delivery efficiency and therapeutic efficacy against colorectal cancer[J]. Science Translational Medicine, 2015, 7(290):1250-1268.
[10]Zhong Z, Peng N, Ying Q, et al. An electrochemical immunosensor for simultaneous multiplexed detection of neuron-specific enolase and pro-gastrin-releasing peptide using liposomes as enhancer[J]. Electrochimica Acta, 2011, 56(16):5624-5629.
[11] Guillou C, Derambure C, Fréret M, et al. Prophylactic injection of recombinant alpha-Enolase reduces arthritis severity in the collagen-induced arthritis mice model[J]. Plos One, 2014, 10(8):4478-4488.
[12] Ebner P, Prax M, Nega M, et al. Excretion of cytoplasmic proteins(ECP)in Staphylococcus aureus[J]. Molecular Microbiology, 2015, 97(4):775-789.
[13]Wang J, Wang K, Chen D, et al. Cloning and characterization of surface-localized α-Enolase of Streptococcus iniae, an effective protective antigen in mice[J]. International Journal of Molecular Sciences, 2015, 16(7):14490-14510.
[14]M Ween, J Ahern, A Carroll, et al. A small volume technique to examine and compare alveolar macrophage phagocytosis of apoptotic cells and non typeable Haemophilus influenzae(NTHi)[J]. Journal of Immunological Methods, 2016, 429(11):7-14.
[15] Balhara V, Deshmukh SS, Kalman L, et al. The interaction of streptococcal enolase with canine plasminogen:the role of surfaces in complex formation[J]. PLoS One, 2014, 9(2):88395-88402.
[16] Mitsuhata C, Puteri MM, Ohara Y, et al. Possible involvement of enolase in fluoride resistance in Streptococcus mutans[J]. Pediatric Dental Journal, 2014, 24(1):12-16.
[17] Ge JP, Catt DM, Gregory RL, et al. Streptococcus mutans Surface α-Enolase Binds Salivary Mucin MG2 and human plasminogen[J]. Infection & Immunity, 2004, 72(11):6748-6752.
[18]Patricia AF, Pancholi V, Marcelo MN. Antibodies to streptococcal surface enolase react with human α-enolase:implications in poststreptococcal sequelae[J]. The Journal of Infectious Diseases, 2000, 182(1):1712-1721.
[19] G Ahangari, SE Koochak, LM Amirabad, et al. Investigation of 5-HT2A gene expression in PBMCs of patients with allergic asthma[J]. Nature, 2015, 14(1):529-532.
[20] Nazarpour R, Zabihi E, Alijanpour E, et al. Optimization of human peripheral blood mononuclear cells(PBMCs)cryopreservation[J]. International Journal of Molecular & Cellular, 2012, 1(2):88-93.
[21]孙雯. 猪链球菌2型的表面蛋白烯醇化酶在细菌黏附和引发免疫下调中的作用[J]. 微生物学免疫学进展, 2010, 38(2):28-31.
(责任编辑 狄艳红)
Molecular Cloning of Gene for Enolase in Highly Virulent Strains from Streptococcus suis serotype 2 and Its Protein Biological Function
SUN Wen1ZHENG Feng2
(1. Yangzhou College of Science and Technology,Yangzhou 225000;2. Institute of Military Medical Sciences,Nanjing Command,Chinese People’s Liberation Aarmy,Nanjing 210002)
To investigate the role of enolase in the pathogenesis of highly virulent strains from Streptococcus suis serotype 2,its molecular cloning,protein location analysis,enzymatic activity assay,and immune related function were studied. Based on the whole genome sequencing of S. suis 2 05ZYH33,bioinformatics of gene eno encoding enolase was analyzed. The recombinant expression plasmid pET30a∷eno was transformed into Escherichia coli BL21 competent cells,and the expression was induced. Recombinant protein enolase was obtained by the purification with His-Beads and FPLC. Then the enzyme activity of enolase was detected,and its basal metabolic function was identified. Further,FCM was used to analyze the localization of enolase in S. suis 2. Finally,the effect of enolase on the activity of peripheral blood monouclear cells(PBMCs)was detected by MTT test. Homology analysis showed a highly homologous of eno with that in many others. SignalP and TMHMM analysis revealed that enolase had neither signal peptide sequence nor transmembrane domain structure. Molecular cloning and sequencing illustrated that the eno fragment length was 1 308 bp. The 75 kD protein was acquired after the recombinant plasmid was induced to express and purification. Enzyme activity assay showed that the purified recombinant enolase had the ability to convert 2-PEG into PEP. FCM analysis demonstrated that enolase also existed on the surface of bacteria. The results of MTT test showed that enolase resulted in the decrease of PBMCs activity. In conclusion,enolase is not only involved in the activities of glucose metabolism in S. suis 2,but also exists on its surface,probably involving in the infection process by destroying the mononuclear cells.
Streptococcus suis serotype 2(S. suis 2);enolase;hemolytic activity;flow cytometry;peripheral blood monouclear cells
10.13560/j.cnki.biotech.bull.1985.2017.04.029
2016-09-22
国家自然科学基金青年科学基金项目(31300119)
孙雯,硕士研究生, 研究方向:流行病学;E-mail:wen-sun@163.com
郑峰,博士研究生,研究方向:流行病学;E-mail:zhengf82@gmail.com
