短波视蛋白在豚鼠频闪光诱导性近视和形觉剥夺近视眼模型中的表达差异
2017-05-18吉顺梅郑昌月李涛李炳周晓东
吉顺梅,郑昌月,李涛,李炳,周晓东
(复旦大学附属金山医院,上海 201508)
研究报告
短波视蛋白在豚鼠频闪光诱导性近视和形觉剥夺近视眼模型中的表达差异
吉顺梅,郑昌月,李涛,李炳,周晓东*
(复旦大学附属金山医院,上海 201508)
目的 观察豚鼠频闪光诱导性近视和形觉剥夺近视模型中短波视蛋白(S-opsin)表达差异,并初步探讨原因。方法 36只普通级2周龄豚鼠随机分成三组:频闪组(FLM组,n=13),形觉剥夺组(FDM组,n=12),对照组(n=11)。FLM组,饲养笼具安装有频闪仪(频率0.5 Hz),笼具内装有发光二极管;FDM组豚鼠右眼用半透明眼罩遮盖,并确保豚鼠眼睑能正常活动;对照组豚鼠不予特殊处理。在造模第1天(0周)和第6周测量豚鼠右眼屈光度、眼轴长度和角膜曲率半径,并通过免疫荧光法观察S-opsin表达。结果 第0周,FLM、FDM组与对照组屈光度、眼轴长度、角膜曲率半径差异均无显著性(P>0.05)。造模6周后,与对照组相比,FLM组、FDM组屈光度变化值、眼轴长度变化值差异均有显著性(P<0.05),而角膜曲率半径变化值差异无显著性(P=0.358),提示成功建立近视模型。FLM组与FDM组相比,屈光度变化值、眼轴长度变化值、角膜曲率半径变化值差异均无显著性(P>0.05)。免疫荧光结果显示:FLM组视蛋白灰度值>对照组视蛋白灰度值>FDM组视蛋白灰度值,任意两组进行比较,差异均有显著性(P<0.001)。结论 频闪光和形觉剥夺均能建立近视模型,频闪光诱导性近视模型中S-opsin产生增加,而形觉剥夺性近视模型中S-opsin产生减少,说明两种近视模型的发生机制可能不同。
近视;短波视蛋白;频闪光诱导;形觉剥夺;豚鼠
研究表明,近视的产生可源于过度的或不适当的光暴露,以及光污染环境[1],而频闪光是光污染环境的重要组成部分。目前研究表明频闪光能够诱导近视形成[2,3],并且近视程度与频闪光的频率有关[4]。频闪光,由于其强烈的明暗对比,可造成一种典型的光觉异常环境,从而影响视觉信息的形成和视觉感知[5],从而刺激豚鼠眼球增长,屈光度改变,引发视网膜电图α波潜伏期延长,视网膜结构改变;眼底也可看到裂纹状纹理[4]。有研究发现[6,7],形觉剥夺性近视和光学离焦性近视的豚鼠眼模型中,视蛋白表达都发生了一定的变化,表明视锥细胞可能参与了豚鼠实验性近视眼的形成,近视的形成可能由变化的视蛋白表达启动,然而目前尚未见实验研究视蛋白与频闪光诱导近视的关系。
本研究旨在通过观察与分析两种不同实验性近视模型中视网膜短波视蛋白(S-opsin)的分布与表达,探讨这两种模型的差异。
1 材料与方法
1.1 实验动物
普通级2周龄英国种短毛三色雄性豚鼠36只,屈光介质透明,排除眼部疾病及畸形。购自上海甲干生物科技有限公司【SCXK(沪)2015-0005】,体重为90~110 g,在上海市公共卫生临床中心中饲养【SYXK(沪)2015-0008】,室温保持在20~22℃,相对湿度维持在55%~65%,正常室内照明,光照周期12 h明∶12 h暗,光强度0~600 lx。按实验动物使用的3R原则给予人道主义关怀,自由摄食、进水,每日补充新鲜蔬菜和维生素C。
1.2 实验方法
1.2.1 形觉剥夺性近视和频闪光诱导性近视的模型建立
36只豚鼠随机分为①频闪组(flickering light-induced myopia,FLM组),n=13,参考邸悦等[3]的方法建立频闪光诱导性近视模型,饲养笼具安装有频闪仪(上海多毅科技有限公司,12 V方波脉冲电源,占空比50%,频率0.5 Hz)。在每个笼具顶上的四个角落均装有发光二极管(福州奥尔锐公司,LED灯,窄谱,峰值500 nm,色温2850 K)。光照条件:0~600 lx。②形觉剥夺组(form-deprived myopia, FDM组),n=12,右眼用半透明眼罩遮盖,并确保豚鼠眼睑能正常活动。每天检查两次。③对照组,n=11,豚鼠不予特殊处理,开放饲养。实验周期为6周。1.2.2 眼球生物测量
将造模第一天记为0周。在造模0周、第6周各测量一次,测量均采用单盲法。造模结束时减去造模前所测得测量值之差即为该眼生物参数变化量[8]。
(1)屈光度测定使用睫状肌麻痹剂复方托吡卡胺滴眼液(参天制药有限公司,中国)后进行带状光检影验光[9],散光以半量计入球镜,重复测量3次后取平均值作为该眼的屈光度值。
(2)眼轴长度的测定应用SUPER SW1000 眼科A 超测量仪,A 超频率为11 MHz。先行角膜表面麻醉,测量时探头对准角膜中心并垂直于角膜平面。每只眼重复测量10次取平均值,精确到0.01 mm。
(3)角膜曲率半径的测定为了校正曲率计(OM-4,Topcon,日本),于曲率计镜头前贴一个+8.0D镜片,读数乘以0.451即为实际角膜曲率半径[10]。计算水平和垂直向的平均值作为角膜曲率半径值,每只眼重复测量三次取平均值。
1.2.3 取材
6周实验干预后,采用腹腔内注射过量戊巴比妥钠(0.2 mg/mL)麻醉处死动物后,迅速取出右眼眼球,并固定。
1.2.4 免疫荧光染色
切片经脱蜡,复水,PBS洗涤3次,0.3%双氧水灭活,柠檬酸法进行抗原修复,牛血清封闭,一抗(1∶50兔来源抗S-opsin, Abcam,香港)4℃冰箱孵育过夜,二抗37℃孵育1 h(1∶200山羊抗兔),DAPI染色(1∶1000)后封片,激光共聚焦显微镜(Leica SP5,德国)观察、拍照。
1.3 统计学分析
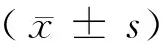
2 结果
2.1 频闪光诱导性近视眼模型的建立
实验造模0周,FLM组与对照组右眼的屈光度、眼轴长度、角膜曲率半径差异均无显著性(P=0.888,P=0.395,P=0.792);与对照组右眼相比,造模6周后,FLM组右眼屈光度、屈光度变化值、眼轴长度、眼轴长度变化值差异均有显著性(P<0.001),但角膜曲率半径、角膜曲率半径变化值差异无显著性(P=0.2,P=0.358)。(见表1,表2)。
2.2 形觉剥夺性近视眼模型建立
实验造模0周,FDM组与对照组右眼的屈光度、眼轴长度、角膜曲率半径差异均无显著性(P=0.888,P=0.395,P=0.792);与对照组右眼相比,造模6周后,FDM组豚鼠右眼屈光度、屈光度变化值、眼轴长度、眼轴长度变化值差异均有显著性(P<0.001,P<0.001,P=0.003,P=0.005),但角膜曲率半径、角膜曲率半径变化值差异无显著性(P=0.2,P=0.358)。(见表1,表2)。
2.3 FLM组与FDM组中豚鼠右眼生物参数比较
实验造模0周,FLM组与FDM组右眼的屈光度、眼轴长度、角膜曲率半径差异均无显著性(P=0.888,P=0.395,P=0.792)(见表1);造模6周后,FLM和FDM组屈光度、屈光度变化值、眼轴长度、眼轴长度变化值、角膜曲率半径、角膜曲率半径变化值差异均无显著性(P=1.000,P=1.000,P=0.972,P=0.42,P=0.2,P=0.358)。见表2。
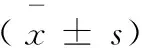
表1 造模0周,及6周后三组模型生物参数值Tab.1 Values of biological parameters of the three models at week 0 and week 6
注:表示与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.
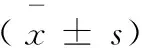
表2 造模6周后三组模型生物参数值变化值Tab.2 Changes of the biological parameter values after treatment for 6 weeks
注:表示与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.
2.4 免疫荧光
图1A显示视网膜各层S-opsin分布的免疫荧光图像,表达S-opsin的细胞的分布主要集中在光感受器细胞层(RC)。三组模型豚鼠中S-opsin平均绿色通道灰度值各不同,分别与对照组比较,FLM组、FDM组差异均有显著性(P<0.001),并且FLM组与FDM组之间比较差异也有显著性(P=0.001),灰度值大小排列为FLM组>对照组>FDM组。(见表3,图1B)。
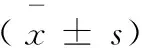
表3 实验6周后S-opsin的平均灰度值Tab.3 Mean gray levels of S-opsin after experiment for 6 weeks
注:表示与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.

注:A:S-opsin的激光共聚焦图片。绿色着染的为S-opsin,蓝色着染的为细胞核;RC:感光细胞层,OPL:外网状层,ONL:外核层,IPL:内网状层;INL:内核层;GCL:神经细胞节层;标尺:25μm。B:对激光共聚焦图片中视蛋白平均绿色通道灰度值进行半定量分析。表示与对照组相比,*P<0.05;数据以平均数±标准误表示。图1 S-opsin免疫荧光和蛋白质半定量分析Note. A: Images of S-opsin taken by confocal laser scanning microscopy. DAPI labeled cell nuclei (blue) co-labeled for S-opsin localization(red); RC:Retinal photoreceptor cells, OPL: Outer plexiform layer, ONL: Outer nuclear layer, IPL: Inner plexiform layer, GCL: Ganglion cell layer; Scale bar=25 μm. B: Semi-quantitative analysis of S-opsin content by mean gray values of green channel. Compared with the control group,* P<0.05. All the data are expressed in Fig.1 Immunofluorescence and semi-quantification analysis of S-opsin protein expression
3 讨论
我们研究发现,频闪光和形觉剥夺均能诱导出实验性近视,这与既往研究报道的结果一致[11,12]。在FLM组中S-opsin增加,而FDM组中S-opsin减少,提示这两种近视模型可能有着不同的发生机制。
视蛋白,主要由视觉细胞产生,参与视觉形成过程,是眼部感知光线的第一站。在哺乳类动物,视锥细胞视蛋白分为三类:长波长视蛋白(L-opsin,最大吸收光谱值λmax=560 nm)、中波长视蛋白(M-opsin,λmax=530 nm)、短波长视蛋白(S-opsin,λmax=420 nm)[13]。在视觉传导过程中,视蛋白参与视锥细胞视觉循环。视蛋白与视黄醛分离后,激活与其相连的G蛋白,经过胞内的磷酸化级联反应导致细胞膜上阳离子通道关闭,使细胞膜超极化,形成超极的感受器电位,将光信号放大并通过一系列电信号将信息传递至大脑[14]。由上可见,光线是视网膜感光细胞被刺激的前提条件。光线通过屈光系统,影响视蛋白表达,并经过一系列反应在视网膜上成像,所以光线条件对于视觉的形成很重要,并且会影响视觉的质量。目前,我们的眼睛越来越多地暴露于来自视频显示终端的发光二极管的光,且长期连续注视视频终端者较容易出现眼功能的改变,会出现视频终端综合征[15],而这些光中包含了很多的蓝光[16],蓝光为短波长光,所以本实验主要研究S-opsin。
视觉环境如光线强弱、光谱组成改变、颜色变化、物体空间性质的改变等多方面都可能成为影响近视发生发展的因素,而在动物实验中,视觉环境改变的可控性又为进一步具体研究提供了有利条件。本实验通过改变外界的光线条件影响豚鼠的屈光状态,以及视蛋白的变化。通过观察发现,FDM和FLM两个模型都诱导了豚鼠近视,但是视蛋白的含量却发生了不同的变化。我们认为原因如下:
一方面,有研究发现[17,18],出生后锥细胞具有可塑性,某些部位锥细胞可由于在发育过程中,一些事件作用于光感受器层,从而在无凋亡情况下密度发生改变,且不同类型间可相互转化,本实验中短波视蛋白的改变可能是在频闪光这种异常的光环境中豚鼠两种不同锥细胞之间相互转化的结果。形觉剥夺和频闪光诱导对视蛋白表达的影响提示光线或视网膜成像是锥细胞发育过程中较重要的一方面,两者都可干扰正常的视觉发育过程所需的锥细胞的转化比率,并且干扰产生的影响可能不同。
另一方面,我们认为可能是因为FDM和FLM组豚鼠接受不同的非正常光线。目前对FDM已有较多的研究,而目前对FLM的研究较少,FLM诱导近视的机制很少被阐述。研究发现,FDM诱导近视的成因有很多,包括:研究发现可能是由于实验眼活动减少[19],也可能是Wnt3/β-catenin信号通路激活,通过TGF-β1因子,减少I型胶原,从而使巩膜重塑,导致近视[20],另外,还有研究发现近视形成伴随DA水平下降[21],此外,NMDAR1/NO-cGMP通路激活[22]也可参与近视的形成。对于FDM组,我们认为由于与对照组相比,进入眼中的光线异常,对眼球的光刺激减少,所以由视觉细胞产生的视蛋白减少。对于FLM组,实验结果提示:可能是频闪光时间频率的因素,光照强度的亮-暗周期性变化影响了豚鼠视网膜中感光细胞内短波视蛋白的产生,从而改变了正常的正视化进程,并诱导了近视产生。频闪光照射条件下,光通量会周期性发生强弱改变,从而产生闪烁感。有研究认为[23],在这种频闪光照射环境下,视觉环境随光的闪烁出现明暗交替,视网膜上形成的物像在清晰与不清晰之间不断变化,眼球不能获得稳定的光照度及清晰成像,容易引起视疲劳,从而诱导近视发生或加速其发展。我们认为当物像不清晰时,视网膜发出信息通过某种机制进行调整,可能是通过视觉细胞产生更多短波视蛋白,力图得到持续、稳定、清晰的物像,在这调整过程中,眼球增大,发展为近视。本实验将实验动物置于亮1 s,暗1 s(频率为0.5 Hz)的特殊的频闪光光照环境中,如果将0.5 Hz这种频率的时间频率转化为空间频率,相当于频闪组豚鼠处在一个能诱导近视发生的低空间频率的视觉环境[24,25],这种视觉环境也可能影响短波视蛋白的产生。
本实验通过发现频闪光诱导性近视和形觉剥夺近视眼模型中视蛋白含量不同,得出两种近视模型的发生机制可能不同的结论。今后我们还将继续探索视蛋白变化伴随的影响。我们将通过更多研究进而探索视蛋白表达变化究竟是近视发生的原因,还是伴随改变,明确其在实验性近视眼发病机制中的作用,从而为近视防治提供更多的参考资料。
[1] Holker F, Wolter C, Perkin E K, et al. Light pollution as a biodiversity threat [J]. Trends Ecol Evolution, 2010, 25(12): 681-682.
[2] Crewther S G, Barutchu A, Murphy M J, et al. Low frequency temporal modulation of light promotes a myopic shift in refractive compensation to all spectacle lenses [J]. Exp Eye Res, 2006, 83(2): 322-328.
[3] Di Y, Liu R, Chu R Y, et al. Myopia induced by flickering light in guinea pigs: a detailed assessment on susceptibility of different frequencies [J]. Int J Ophthalmol, 2013, 6(2): 115-119.
[4] Di Y, Lu N, Li B, et al. Effects of chronic exposure to 0.5 Hz and 5 Hz flickering illumination on the eye growth of guinea pigs [J]. Curr Eye Res, 2013, 38(11): 1182-1190.
[5] 李炳, 邸悦, 李涛, 等. 频闪光诱导豚鼠近视与焦虑样行为变化的观察 [J]. 中国眼耳鼻喉科杂志, 2013,13(05): 289-292.
[6] 胡敏, 刘睿, 刘永松, 等. 豚鼠形觉剥夺和光学离焦性近视眼模型视蛋白表达变化研究 [J]. 中华眼科杂志,2012, 48(2): 148-152.
[7] 李瑾, 褚仁远, 瞿小妹, 等. 形觉剥夺对豚鼠锥视蛋白表达的影响研究 [J]. 中华眼科杂志,2007, 43(3): 266-270.
[8] Zhou X, Qu J, Xie R, et al. Normal development of refractive state and ocular dimensions in guinea pigs [J]. Vision Res, 2006, 46(18): 2815-2823.
[9] Durr N J, Dave S R, Lage E, et al. From unseen to seen: tackling the global burden of uncorrected refractive errors[J]. Annu Rev Biomed Eng, 2014,16:131-153.
[10] Howlett MH, Mcfadden SA. Form-deprivation myopia in the guinea pig (Caviaporcellus) [J]. Vision Res, 2006, 46(1-2): 267-283.
[11] Yu Y, Chen H, Tuo J, et al. Effects of flickering light on refraction and changes in eye axial length of C57BL/6 mice [J].Ophthalm Res, 2011, 46(2): 80-87.
[12] Wallman J, Turkel J, Trachtman J.Extreme myopia produced by modest change in early visual experience[J]. Science, 1978, 201(4362):1249-1251.
[13] Amann B, Hirmer S, Hauck S M, et al. True blue: S-opsin is widely expressed in different animal species [J]. J Animal Physiol Animal Nutr, 2014, 98(1): 32-42.
[14] Shichida Y, Imai H. Visual pigment: G-protein-coupled receptor for light signals [J]. Cell Mol Life Sci, 1998, 54(12): 1299-1315.
[15] Yoshihara A, Yamanaka K, Kawakami M. Effects of polyphenol on visual fatigue caused by VDT work[J]. Int J Occup Safety Ergon, 2009,15(3):339-343.
[16] Kuse Y, Ogawa K, Tsuruma K, et al. Damage of photoreceptor-derived cells in culture induced by light emitting diode-derived blue light[J]. Sci Rep, 2014,4:5223.
[17] Cornish EE, Xiao M, Yang Z, et al. The role of opsin expression and apoptosis in determination of cone types in human retina [J]. Exp Eye Res, 2004, 78(6): 1143-1154.
[18] 李瑾, 褚仁远, 赵云娥. 外源性全反视黄酸对出生后豚鼠锥细胞视蛋白表达和方向性的影响 [J]. 眼视光学杂志, 2008,10(4): 273-276.
[19] Wallman J, Gottlieb M D, Rajaram V, et al. Local retinal regions control local eye growth and myopia [J]. Science, 1987, 237(4810): 73-77.
[20] Li M, Yuan Y, Chen Q, et al. Expression of Wnt/beta-catenin signaling pathway and its regulatory role in type I collagen with TGF-beta1 in scleral fibroblasts from an experimentally induced myopia guinea pig model[J]. J Ophthalmol, 2016,2016:5126560.
[21] Mao J, Liu S, Fu C. Citicoline retards myopia progression following form deprivation in guinea pigs [J]. Exp Biol Med (Maywood, NJ), 2016, 241(11): 1258-1263.
[22] Wen D, Song W, Liu S, et al. Upregulated expression of N-methyl-D-aspartate receptor 1 and nitric oxide synthase during form-deprivation myopia in guinea pigs [J]. Int J Clin Exp Pathol, 2015, 8(4): 3819-3826.
[23] 王红, 庄康, 陶远, 等. 频闪光对发育期豚鼠近视的影响[J]. 环境与健康杂志, 2007,24(06):388-390.
[24] Schaeffel F. Myopia: the importance of seeing fine detail[J]. Curr Biol, 2006,16(7):R257-R259.
[25] Hess RF, Schmid KL, Dumoulin SO, et al. What image properties regulate eye growth?[J]. Curr Biol, 2006,16(7):687-691.
Changes of S-opsin expression in guinea pigs with flickering light-induced and form-deprived myopia
JI Shun-mei, ZHENG Chang-yue, LI Tao, LI Bing, ZHOU Xiao-dong*
(Jinshan Hospital, Fudan University, Shanghai 201508, China)
Objective To observe the changes of S-opsin expression in guinea pigs with flickering light-induced and form-deprived myopia, and to investigate the causes. Methods Thirty-six two-week-old healthy guinea pigs were randomly assigned to three groups: Flickering light-induced myopia group (FLM group,n=13), form-deprived myopia group (FDM group,n=12) and control group (n=11).For the FLM group, the cages were equipped with astroboscope (0.5 Hz), and LEDs were used as the light source. The right eyes of the guinea pigs in FDM group wore translucent goggles which did not interfere with the normal activity of their eyelids. No special treatment was given to the guinea pigs in the normal groups.All measurements were performed prior to and then after 6 weeks of treatment. The first measurement day was recorded as 0 week. Biological parameters, such as the refraction, axial length (AL) and corneal radius of curvature (CRC), were measured and fundus photography is performed before and after 6 weeks of the treatment. The expression of S-opsin was observed and analyzed by immunofluorescence technique and image analysis system. Results Before the treatment, no significant difference was found in three biometric measurements including refraction, AL and CRC between the groups at 0 week (P>0.05). After the treatment for 6 weeks, significant differences were found in changes of both the biometric measurements between the FLM and control groups, and between the FDM and control groups (P<0.05). However, no significant differences were found in the changes of CRC among the FLM, FDM and control groups(P=0.358), indicating that myopia models were established successfully. No significant differences were found in the changes of values of refraction, AL and CRC between the FLM and FDM groups (P>0.05). Expression of S-opsin differed in the FLM and FDM groups. For the mean gray values of green channel,compared with the control group respectively, significant differences were found in both the FLM and FDM group (P<0.001). The mean gray value of green channel of the FLM group was higher, however the mean gray value of green channel of the FDM group was lower. Conclusions Both guinea pig models of flickering light-induced and form-deprived myopia can be established successfully. S-opsin is increased in the flickering light-induced myopia model and decreased in the form-deprived myopia model, indicating that the mechanisms of formation of these two experimental myopia models may be different.
Myopia; S-opsin; Flickering light-induction; Form-deprivation; Guinea pigs
ZHOU Xiao-dong, E-mail: xdzhou2005@163.com
上海市自然科学基金(编号:17ZR1404200);上海市卫计委项目(编号:201640046)。
吉顺梅(1991-),女,在读硕士研究生,研究方向:眼视光学。E-mail:jishunmei22@126.com
周晓东,男,主任医师,硕士生导师, 研究方向:眼视光学。E-mail: xdzhou2005@163.com
Q95-33
A
1005-4847(2017) 02-0201-06
10.3969/j.issn.1005-4847.2017.02.016
2016-10-09
