高脂诱导五指山小型猪动脉粥样硬化模型的建立及Lp-PLA2的表达调控
2017-05-18汪晶潘永明徐孝平蔡月琴陈方明蔡兆伟陈民利
汪晶,潘永明,徐孝平,蔡月琴,陈方明,蔡兆伟,陈民利
(浙江中医药大学动物实验研究中心,杭州310053)
研究报告
高脂诱导五指山小型猪动脉粥样硬化模型的建立及Lp-PLA2的表达调控
汪晶,潘永明,徐孝平,蔡月琴,陈方明,蔡兆伟,陈民利*
(浙江中医药大学动物实验研究中心,杭州310053)
目的 高脂诱导建立五指山小型猪动脉粥样硬化(AS)模型,观察脂蛋白相关磷脂酶A2(Lp-PLA2)在AS模型血浆和斑块中的表达变化。方法 将10只五指山小型猪随机分为正常对照(Ctr)组4只饲喂普通饲料、AS模型(AS model)组6只饲喂高脂饲料,连续造模24周。造模24周时,空腹取前腔静脉血测定总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、甘油三酯(TG)、C-反应蛋白(CRP)、Lp-PLA2活性和成分的变化,并取主动脉进行油红O染色以及取腹主动脉血管行HE染色和IL-6免疫组化染色,观察血管脂质沉积和斑块病理以及IL-6蛋白表达变化。采用RT-PCR和Western Blot法观察腹主动脉组织中Lp-PLA2mRNA和蛋白的表达情况。结果 与正常对照组比,AS模型组体重、体质量指数(BMI)、TC、LDL-C、HDL-C、CRP、Lp-PLA2活性和成分均显著升高(P<0.05,P<0.01),同时主动脉脂质沉积明显(P<0.01)和AS斑块形成,腹主动脉组织中Lp-PLA2mRNA和蛋白表达以及IL-6蛋白表达均显著升高(P<0.05)。结论 长期高脂饮食24周能诱发五指山小型猪AS,且Lp-PLA2在参与血管炎症和AS斑块形成中发挥了关键作用。
五指山小型猪;动脉粥样硬化;脂蛋白相关磷脂酶A2;炎症
脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)是一种循环作用于动脉粥样硬化性心血管疾病具有活性的酶,能准确反映血管内的炎症,已成为动脉粥样硬化(atherosclerosis,AS)发展进程的动态监测指标[1],并发现循环中Lp-PLA2会增强血管炎症及AS[2];并在AS猪模型中发现抑制Lp-PLA2能降低冠状动脉的坏死核心区域和不稳定斑块病变的发展[3],同时在糖尿病/高脂血症猪模型中也发现在冠状动脉的炎症基因和通路中Lp-PLA2因子的作用更为重要[4],这些结果也反映了猪可能是研究Lp-PLA2与AS关系重要的模型动物。然而Lp-PLA2的表达与斑块稳定性、炎症、氧化应激及临床表现的关系均还有待于进一步阐述。
我国具有丰富的小型猪资源,如巴马小型猪、五指山小型猪、贵州香猪等,但这些小型猪在心血管疾病中的生理应用特点还尚不明确。近来有报道五指山小型猪对冠脉内皮损伤术耐受力较差,极易出现室颤[5];并用高胆固醇饮食诱导4~8个月时能出现早期的动脉病变;提示五指山小型猪可能对血管损伤和高脂饮食诱导的血管病变存在易感性[6]。为此,本研究采用高脂饮食诱导建立五指山小型猪AS模型,观察Lp-PLA2在五指山小型猪AS模型血浆和斑块中的表达变化,为五指山小型猪在心血管疾病中的应用提供实验依据。
1 材料与方法
1.1 实验动物
普通级五指山小型猪(WZSP)雄性10只,4月龄,体重为10~12 kg,由海南省农业科学院畜牧兽医研究所提供【SCXK(琼)2014-0006】;饲养于浙江中医药大学动物实验研究中心小型猪实验室【SYXK(浙)2013-0164】,环境温度:(22±1)℃,相对湿度:40%~65%,自由饮水,12 h/12 h明暗交替。
1.2 仪器与试剂
日立7020型全自动生化仪(日本日立公司)、Iq5 PCR仪(美国Bio-Rad公司)、Odyssey红外荧光扫描仪(美国Odyssey公司)、RM2245型石蜡切片机(美国徕卡公司)、80I相差显微镜(日本Nikon公司)。总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、甘油三酯(TG)试剂盒购自上海申能德赛诊断技术有限公司;猪C反应蛋白(CRP)、Lp-PLA2活性和成分试剂盒均购自杭州诚维生物科技有限公司;Lp-PLA2抗体购自美国Santa Cruz生物技术公司;IL-6抗体购自北京中杉金桥公司;逆转录试剂盒(PrimeScript RT reagent Kit)、荧光定量试剂盒(SYBR Premix Ex TaqTMII)、RNA Extraction kit(总RNA提取试剂盒),购自日本TaKaRa公司。
1.3 五指山小型猪AS模型的建立
五指山小型猪适应性饲养后,空腹行前腔静脉穿刺取肝素抗凝血,经测定肝肾功能、血脂和血常规等各项指标无异常后入选。将WZSP随机分成正常对照(Ctr)组4只饲喂基础饲料和AS模型(AS model)组6只饲喂高脂饲料(高脂饲料配方:1.5%胆固醇、15%油脂、10%蛋黄粉、73.5%基础饲料),每天按2.5%体重分两次等量饲喂,连续24周。
1.4 指标观察
1.4.1 血脂代谢、CRP、Lp-PLA2活性和成分测定
造模24周时,空腹取前腔静脉肝素抗凝血,分离血浆,在7020-全自动生化分析仪上测定血浆中TC、LDL-C、HDL-C和TG水平的变化;同时采用ELISA法测定血浆CRP、Lp-PLA2活性和成分变化。
1.4.2 RT-PCR法检测腹主动脉组织中Lp-PLA2mRNA的表达
取各组腹主动脉组织,用TRIzol试剂盒提取总mRNA及逆转录合成cDNA。选取GAPDH为内参照基因,以Primer 6.0软件设计猪Lp-PLA2mRNA引物(表1),采用RT-PCR扩增按照试剂盒(RNA PCR kit,TaKaRa)方法,根据Ct值,通过2-△△CT法计算各个基因的相对表达量。

表1 引物序列Tab.1 Sequences of primers used in the real-time RT-PCR assay
1.4.3 Western blot法检测腹主动脉组织中Lp-PLA2蛋白的表达
取腹主动脉组织100 mg,用蛋白提取试剂盒提取总蛋白,BCA法测定蛋白浓度。定量后取各样本50 μg用5%十二烷基硫酸钠-聚丙烯凝胶电泳,电泳结束后将胶转至PVDF膜,丽春红染色观察转移效果,确定蛋白分子量标准位置。5%脱脂奶粉+TBST封闭液封闭2 h;加入一抗(Lp-PLA2,1∶150稀释)4℃过夜。洗膜后加入辣根过氧化物酶标记的二抗,室温孵育1 h,TBST洗三次,结果用Odyssey红外荧光扫描仪上进行扫描,用Image J软件计算各条带的灰度值,并以GAPDH作为内参进行对照,以二者的比值代表Lp-PLA2蛋白的表达。
1.4.4 主动脉脂质沉积和血管病理组织学观察
造模24周后,小型猪经耳缘静脉注射3%戊巴比妥钠溶液(30 mg/kg)麻醉和开胸术行安乐死;测量体长(从鼻正中部到尾根部的距离),计算体质量BMI指数(体重/体长2)。取主动脉弓至腹主动脉髂部的主动脉经24 h甲醛固定后,油红O染色15 min,冲洗并拍照,用Image J软件分析脂质沉积。同时,取腹主动脉血管,行常规脱水、石蜡包埋后切成4 μm的薄片,行苏木素伊红(HE)染色,观察血管组织病变情况。
1.4.5 免疫组化法观察腹主动脉组织IL-6蛋白表达
取腹主动脉组织用冰冻切片切成7 μm的薄片,用3%过氧化氢溶液封闭10 min,消除内源性过氧化物酶活性,然后加入多抗稀释液(抗IL-6)4℃过夜孵育,PBS冲洗后滴加二抗孵育1 h。然后DAB显色,自动染色程序,复染,透明后封片。用倒置显微镜拍摄4张×400倍数的随机照片,并用NIS-Element S.F.2.30软件记录,所获取的照片用IPP 6.0软件分析其阳性表达光密度(IOD)。
1.5 统计学处理
2 结果
2.1 表型特征的变化
与正常对照组比,高脂诱导后五指山小型猪体重、BMI指数均明显升高(P<0.01),血浆TC、LDL-C和HDL-C水平均显著升高(P<0.05,P<0.01)(表2);油红O染色显示AS模型组主动脉弓至腹主动脉髂部的血管脂质沉积明显增加(P<0.01);HE染色亦显示,正常对照组血管内皮细胞完整,形态结构正常,内膜下未见泡沫细胞;AS模型组内膜增厚,平滑肌增生排列紊乱,内膜下可见泡沫细胞及炎症细胞浸润(图1)。
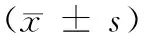
表2 高脂诱导五指山小型猪AS模型的表型特征Tab.2 Phenotypic characteristics of the WZSP minipig AS models fed with high fat/cholesterol atherogenic diet
注:与正常对照组相比,*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.
2.2 血浆CRP水平和Lp-PLA2活性和成分的变化
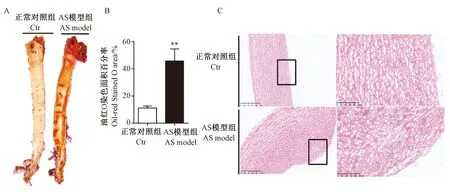
与正常对照组比,AS模型组血浆CRP水平明显升高(P<0.01),同时血浆Lp-PLA2活性和成分均显著升高(P<0.05,P<0.01);相关分析显示,血浆Lp-PLA2活性与CRP、LDL-C均明显相关(P<0.01)(图2)。
注:油红O染色分析主动脉脂质沉积(A)和油红O染色面积百分率(B),腹主动脉组织HE病理形态(C,左图×25,右图×100);与Ctr组比,** P<0.01。图1 高脂诱导后五指山小型猪的血管脂质沉积和病理形态学变化Note. Aortic lipid analysis using oil red O staining (A) and percent of oil red O stained area (B) and H&E-stained abdominal aorta (C, Left is ×25,and right is ×100). Compared with the control group, **P<0.01.Fig.1 Lipid deposition and pathological changes of blood vessels in the WZSP minipigs fed with high fat/cholesterol atherogenic diet
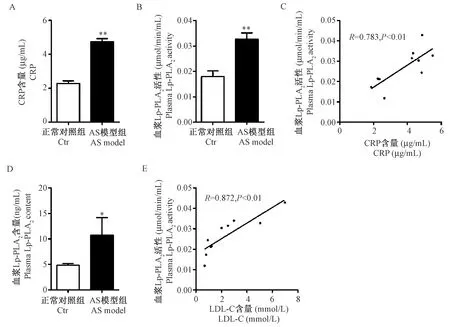
注:血浆CRP水平(A),Lp-PLA2活性(B)及其与CRP的相关性(C),Lp-PLA2成分(D),Lp-PLA2活性与LDL-C的相关性(E);与正常对照组相比,*P<0.05,**P<0.01。图2 高脂诱导后五指山小型猪血浆CRP水平和Lp-PLA2活性和成分的变化Note. Plasma CRP levels (A), Lp-PLA2 activity (B) and its association with CRP (C), Lp-PLA2 composition (D), and Lp-PLA2 activity correlated with LDL-C (E); Compared with the control group,*P<0.05,**P<0.01.Fig.2 Changes of plasma CRP level, Lp-PLA2 activity and composition in the pigs induced by high fat/cholesterol atherogenic diet
2.3 腹主动脉组织中Lp-PLA2mRNA和蛋白的表达
与正常对照组比,AS模型组腹主动脉组织中Lp-PLA2mRNA和蛋白的表达均显著升高(P<0.05)(图3)。
2.4 腹主动脉组织中IL-6蛋白的表达
与正常对照组比,AS模型组血管内膜IL-6蛋白阳性表达明显增强;并且AS模型组IOD值显著高于正常对照组(P<0.05);相关分析显示,IL-6蛋白与CRP和Lp-PLA2活性均明显相关(P<0.05,P<0.01)(图4)。

注:腹主动脉组织中Lp-PLA2 mRNA表达(A)和蛋白表达(B);与正常对照组相比,*P<0.05。图3 高脂诱导后五指山小型猪腹主动脉组织中Lp-PLA2mRNA和蛋白的表达Note.The expression of Lp-PLA2 mRNA (A) and protein (B) in abdominal aorta.Compared with the control group,*P<0.05.Fig.3 Expression of Lp-PLA2 mRNA and protein in the abdominal aortic tissue of WZSP Pigs induced by high fat/cholesterol atherogenic diet

注:免疫组化腹主动脉组织IL-6蛋白表达(A,左图为正常对照组,右图为AS模型组,×200)和定量分析IOD值(B);IL-6蛋白与CRP(C)和Lp-PLA2活性的相关性;与正常对照组相比,*P<0.05。图4 高脂诱导后五指山小型猪腹主动脉组织IL-6蛋白的表达Note.A. Aortic tissues, normal (left) and AS models (right). ×200. B. Quantitative analysis of IOD values. C. Correlation of IL-6 protein with CRP. D. Lp-PLA2 activity. Compared with the control group, *P<0.05.Fig.4 Expression of IL-6 protein in the abdominal aortic tissue of WZSP minipigs induced by high fat/cholesterol diet
3 讨论
尽管适合研究AS疾病的模型动物较多,但部分动物的生理特点与人类存在较大的差异,如大鼠有自发性抗AS形成和无胆囊的特点,对外源性胆固醇吸收率低,相对难以形成模型;兔无脂质沉积斑块,与人类AS病变有一定差异;故除灵长类动物外,猪可能是最接近人类的模式动物之一,其循环系统、脂蛋白代谢等生理结构方面与人类有许多共同之处,并且其斑块与人类成熟斑块具有高度相似性,同时猪过度紧张或兴奋等刺激会突发动脉硬化性心血管疾病,而且用高脂饮食诱导方法简单易行,符合人类AS渐进性慢性发展的特点。因此,本研究采用的五指山小型猪具有体重较小,便于实验操作和饲养,已被广泛用于心血管疾病研究[5,6]。
膳食因素是导致肥胖、高脂血症、AS重要的危险因素。在AS早期,各种危险因素的刺激使LDL渗透进入血管内膜,刺激巨噬细胞产生并释放炎症因子,上调黏附分子和趋化因子的表达,故血脂代谢和炎症反应在AS泡沫细胞形成过程中起着很重要的作用。LDL-C的升高也是AS的危险因素之一[7],在本研究也发现高脂诱导后五指山小型猪体重和体质量BMI指数均明显增加,LDL-C水平明显升高,同时伴有TG升高的趋势,表明高脂诱导能促发机体肥胖和血脂紊乱异常,而这些均是AS及其心血管疾病发生的重要独立危险因子[8];另外,组织病理学发现高脂诱导后主动脉脂质沉积明显,血管内膜增厚,出现明显的泡沫细胞和炎症反应,表明高脂诱导24周能成功建立五指山小型猪AS模型。
除血脂异常外,慢性炎症反应不仅是AS的基本特征,也是始动因子,在斑块破裂中起着重要的作用,并与生物活性脂质介质的形成有关,贯穿于AS的发生发展中,是疾病产生病变的关键因素之一。C反应蛋白已被证实在冠心病患者中明显增加,并与疾病的严重程度及其并发症相关,是AS的标志物之一[9]。CRP主要在肝脏中合成,并受炎症因子和IL-6控制[10]。研究发现,在肥胖儿童中CRP明显增加,且循环血液中1/3的IL-6来源于脂肪细胞,故IL-6可能是促发肥胖患者CRP升高的联系纽带之一[11,12]。同样,本研究亦表明高脂诱导后五指山小型猪CRP明显升高,同时腹主动脉组织中IL-6表达亦显著增加,而且CRP和IL-6两者密切相关,这也证实了炎症贯穿AS发生发展的进程,而IL-6可能通过增强炎症反应,降解斑块内的基质使斑块纤维帽变薄而使斑块破裂。
近来发现Lp-PLA2是一种由巨噬细胞及单核细胞分泌主要与低密度脂蛋白结合的酶,其水平与LDL呈正相关,是预测AS的危险标志物[13],受到相关炎性介质的调节,参与炎症反应,促进AS的发生发展[14]。在AS斑块中表达显著升高,尤其在易损斑块纤维帽的巨噬细胞中强表达,表明Lp-PLA2与心血管事件有着密切的联系,故Lp-PLA2水平的升高提示斑块形成和破裂的危险性很大[15]。另外,循环血液中Lp-PLA2的含量及活性的变化也与炎症密切相关,Lp-PLA2活性的增高不仅可作为AS相关的炎性生物标志物,也提示机体中脂质过氧化和氧化应激水平增高[16]。Lp-PLA2能通过裂解氧化低密度脂蛋白(ox-LDL)中的氧化磷脂生成溶血卵磷脂(LysoPC)和氧化游离脂肪酸等促炎性介质[17],使内皮功能发生异常,从而能刺激黏附因子和细胞因子的产生,介导炎性反应,导致单核细胞由管腔向内膜聚集浸润,并参与巨噬细胞的形成过程中,使巨噬细胞内的胆固醇大量堆积聚集,促进脂质沉积并形成泡沫细胞,最终出现脂质条纹和斑块,促进AS的发生与发展,甚至诱发血栓形成和心血管事件的发生[18,19]。动物实验表明,Lp-PLA2抑制剂darapladib能有效减少冠状动脉的斑块面积[3]。本研究也发现高脂诱导后五指山小型猪循环血液中Lp-PLA2活性和成分均明显升高;同时相关分析显示,Lp-PLA2活性与CRP和LDL-C明显正相关,表明循环血液中Lp-PLA2活性的变化可作为AS炎症、脂质代谢异常和心血管事件发生的标志物。此外,IL-6不仅影响CRP外,还可能与Lp-PLA2有关。有学者认为Lp-PLA2与IL-6可能共同参与AS的形成中[20],并发现Lp-PLA2抑制剂darapladib干预能影响IL-6水平,临床研究亦发现在肥胖妇女中Lp-PLA2的活性与ox-LDL和IL-6有显著的相关性[21],其机制可能与年龄及堆积的内脏脂肪,能通过LDL的氧化作用及氧化应激激活炎症和细胞因子的表达导致AS有关[22]。体外细胞实验也发现Ox-LDL促进IL-6的分泌和通过活化磷脂酰肌醇3激酶及p38丝裂原蛋白激酶途径刺激单核细胞中Lp-PLA2的表达[23]。同样,本研究也发现高脂诱导后五指山小型猪腹主动脉组织中Lp-PLA2mRNA和蛋白表达均明显上调,相关分析也显示与IL-6蛋白表达呈一致性,提示Lp-PLA2与IL-6存在一定的联系并共同促进AS炎症的级联反应,使斑块不稳定性增加。
综上所述,高脂诱导五指山小型猪24周能成功建立AS模型,表现出明显的血脂紊乱异常、炎症反应、血管脂质沉积明显和动脉粥样硬化;且Lp-PLA2在参与血管炎症和AS斑块形成中发挥了关键作用。因此,抑制炎症反应可能是干预AS形成的一个重要靶点。Lp-PLA2作为一种新的炎症反应标志物,是当前研究的热点,能独立预测AS的风险及评价斑块的稳定性,对于AS的预防和治疗具有潜在的临床价值[24]。但Lp-PLA2的应用前景还需要更多的临床研究进一步开拓和发展。
[1] Cerelli MJ, Grimm K, Duan X, et al. Evaluation of recombinant enzyme calibration to harmonize lipoprotein-associated phospholipase A2activity results between instruments [J].Clin Biochem, 2016, 49(6): 480-485.
[2] Toth PP, Mccullough PA, Wegner MS, et al. Lipoprotein-associated phospholipase A2: role in atherosclerosis and utility as a cardiovascular biomarker [J]. Expert Rev Cardiovasc Ther, 2010, 8(3): 425-438.
[3] Wilensky RL, Shi Y, Mohler ER 3rd, et al. Inhibition of lipoprotein-associated phospholipase A2 reduces complex coronary atherosclerotic plaque development [J]. Nat Med, 2008, 14(10):1059-1066.
[4] Fenning RS, Burgert ME, Hamamdzic D, et al. Atherosclerotic plaque inflammation varies between vascular sites and correlates with response to inhibition of lipoprotein-associated phospholipase A2 [J].J Am Heart Assoc, 2015, 4(2): e001477.
[5] 谢忠忱, 黄广勇, 尹明,等. 五指山小型猪冠状动脉球囊损伤术[J]. 中国比较医学杂志, 2006,18(9):559-559.
[6] 陈华, 谢忠忱, 黄广勇,等. 五指山小型猪动脉粥样硬化模型的建立[J]. 实验动物科学, 2007, 24(6):39-45.
[7] Ming YS, Feng HX, Shi CT, et al. Effect of atorvastatin on serum levels of total cholesterol and high-sensitivity C-reactive protein in high-risk patients with atrial fibrillation in Asia [J]. ClinTher, 2015, 37(8):1740-1750.
[8] Alexy T, Pais E, Wenby RB, et al. Abnormal blood rheology and chronic low grade inflammation:possible risk factors for accelerated atherosclerosis and coronary artery disease in Lewis negative subjects [J].Atherosclerosis, 2015, 239(1): 248-251.
[9] Backes JM, Howard PA, Moriarty PM. Role of C-reactive protein in cardiovascular disease [J].Ann Pharmacother,2004, 38(1): 110-118.
[10] Heinrich PC, Castell JV, Andus T. Interleukin-6 and the acute phase response [J].Biochem J, 1990, 265(3): 621-636.
[11] Cook DG, Mendall MA, Whincup PH, et al. C-reactive protein concentration in children: relationship to adiposity and other cardiovascular risk factors [J]. Atherosclerosis, 2000, 149(1):139-150.
[12] Yudkin JS, Kumari M, Humphries SE, et al. Inflammation, obesity, stress and coronary heart disease: is interleukin-6 the link?[J] Atherosclerosis, 2000,148(2): 209-214.
[13] Ait-Oufella H, Mallat Z, Tedgui A. Lp-PLA2 and sPLA2: cardiovascular biomarkers [J]. Med Sci (Paris), 2014, 30(5): 526-531.
[14] Garg PK, McClelland RL, Jenny NS, et al. Lipoprotein-associated phospholipase A2 and risk of incident cardiovascular disease in a multi-ethnic cohort: The multi ethnic study of atherosclerosis [J]. Atherosclerosis, 2015, 241(1): 176-182.
[15] Gilstrap LG, Wang TJ. Biomarkers and cardiovascular risk assessment for primary prevention: an update [J]. Clin Chem, 2012, 58(1):72-82.
[16] Kim JY, Hyun YJ, Jang Y, et al. Lipoprotein-associated phospholipase A2 activity is associated with coronary artery disease and markers of oxidative stress: a case-control study [J]. Am J ClinNutr, 2008, 88(3): 630-637.
[17] Tellis CC,Tselepis AD. Pathophysiological role and clinical significance of lipoprotein-associated phospholipase A2(Lp-PLA2) bound to LDL and HDL [J]. Curr Pharm Des, 2014, 20(40): 6256-6269.
[18] 郭旭, 华川, 李伟中, 等. 脂蛋白相关磷脂酶A2、缺血修饰蛋白在动脉硬化性脑梗死的应用价值[J]. 临床军医杂志, 2012, 40(10): 1102-1104.
[19] Lee JY,Byeon SK,Moon MH. Profiling of oxidized phospholipids in lipoproteins from patients with coronary artery disease by hollow fiber flow field-flow fractionation and nanoflow liquid chromatography-tandem mass spectrometry [J]. Anal Chem, 2015, 87(2): 1266-1273.
[20] 孙姬, 陈一竹, 郭玲玉, 等. 辅酶Q10对动脉粥样硬化大鼠血脂及炎症因子表达的影响[J].诊断学理论与实践, 2015,4: 357-362.
[21] Paik JK,Kim M,Kim M,et al. Circulating Lp-PLA2activity correlates with oxidative stress and cytokines in overweight/obese postmenopausal women not using hormone replacement therapy [J]. Age (Dordr), 2015, 37(2):32.
[22] Paik JK, Kim JY, Kim OY, et al. Circulating and PBMC Lp-PLA2 associate differently with oxidative stress and subclinical inflammation in nonobese women (menopausal status) [J]. PLoS One, 2012, 7(2): e29675.
[23] Wang WY,Li J,Yang D, et al. OxLDL stimulates lipoprotein-associated phospholipase A2 expression in THP-1 monocytes via PI3K and p38 MAPK pathways [J]. Cardiovasc Res, 2010, 85(4):845-852.
[24] Tyagi MG,Mathew SK. Lipoprotein associated phospholipase A2 enzyme: possible new roles and inhibition for therapeutic intervention [J]. Int J Res Med Sci, 2014, 2(3): 805-809.
Establishment of a Wuzhishan minipig model of atherosclerosis induced by high fat/cholesterol diet and regulation of Lp-PLA2expression
WANG Jing, PAN Yong-ming, XU Xiao-ping, CAI Yue-qin, CHEN Fang-ming, CAI Zhao-wei, CHEN Min-li*
(Laboratory Animal Research Center, Zhejiang Chinese Medical University, Hangzhou 310053, China)
Objective To establish a Wuzhishan minipig model of atherosclerosis (AS) induced by high fat/cholesterol diet, and observe the changes of expression of lipoprotein associated phospholipase A2(Lp-PLA2) in plasma and plaques.Methods 10 Wuzhishan minipigs were randomly divided into 2 groups: The normal control (Ctr,n=4) group was fed with normal diet, and AS model (n=6) group fed with high fat/cholesterol diet for 24 weeks. After the modeling for 24 weeks, the changes of total cholesterol (TC), low density lipoprotein (LDL-C), high density lipoprotein (HDL-C), triglyceride (TG), C-reactive protein (CRP), Lp-PLA2activity and composition were detected. The changes of vascular lipid deposition and plaques were assessed by pathology using oil red O staining and HE staining, respectively, and immunohistochemical staining for IL-6 protein expression. Moreover, the expression ofLp-PLA2mRNA determined by RT-PCR and protein by Western blot were observed in the abdominal aortic tissues. Results Compared with the control group, the body weight, body mass index (BMI), TC, LDL-C, HDL-C, CRP, Lp-PLA2activity and composition and aortic lipid deposition were significantly increased, and AS plaque formation was observed in the AS model group (P<0.05,P<0.01). The expression ofLp-PLA2mRNA and protein and IL-6 protein in abdominal aortic tissues were also significantly increased (P<0.05). Conclusions Long-term high fat/cholesterol diet feeding for 24 weeks can induce atherosclerosis in Wuzhishan minipigs, and Lp-PLA2 plays a key role in the vascular inflammation and plaque formation.
Wuzhishan minipig; Atherosclerosis; Lipoprotein associated phospholipase A2; Inflammation
CHEN Min-li, E-mail: cmli991@ aliyun.com
国家自然科学基金项目(31572346);浙江省自然科学基金项目(LY16C040001);浙江中医药大学比较医学创新团队(XTD201301)。
汪晶(1990-),女,硕士生,研究方向:实验动物与比较药理。E-mail: 1209076410@qq.com
陈民利(1963-),女,教授,研究方向为实验动物与比较医学。E-mail: cmli991@ aliyun.com
Q95-33
A
1005-4847(2017) 02-0194-07
10.3969/j.issn.1005-4847.2017.02.015
2016-10-18
