巴马小型猪85%肝切除术后急性肝功能衰竭模型的建立
2017-05-18桑剑锋马虎成施晓雷黄韬伊丹丹丁义涛
桑剑锋,马虎成,施晓雷,黄韬,伊丹丹,丁义涛*
(1. 南京大学医学院附属鼓楼医院肝胆外科,南京 210008;2. 南京医科大学,南京 211166)
研究报告
巴马小型猪85%肝切除术后急性肝功能衰竭模型的建立
桑剑锋1,马虎成1,施晓雷1,黄韬2,伊丹丹2,丁义涛1*
(1. 南京大学医学院附属鼓楼医院肝胆外科,南京 210008;2. 南京医科大学,南京 211166)
目的 探索不同比例肝切除体积对巴马小型猪急性肝功能衰竭的影响,为建立合适的小型猪大部分肝切除后急性肝功能衰竭模型提供合适的方法。方法 分别行75%、85%及95%肝切除,CT检查残留肝并记录存活情况,术前、术后 1、3、5 d和术后 1、2、3 周定期抽血检测肝功能,获取肝组织HE 染色,检查肝病理情况。结果 75%、85%及 95%肝切除小型猪平均存活时间为(19.0±5.6)d,(17.3±5.5)d,(1.3±1.5)d,不同肝切除比例的巴马小型猪病理学评分分别为(5.67±0.52)、(8.17±0.82)、(8.50±0.71)。随着肝切除比例增加,肝功能衰竭发病率升高。85%肝切除可引起谷丙转氨酶、谷草转氨酶、碱性磷酸酶、乳酸脱氢酶、总胆汁酸水平显著增高。结论 85%体积肝切除可造成典型的小型猪急性肝功能衰竭模型。
急性肝功能衰竭;肝大部切除术;动物模型;巴马小型猪
急性肝衰竭(acute liver failure, ALF)是一种以短期剧烈肝功能丧失以及大量肝细胞坏死为特点的临床重症,常常伴有肝性脑病且易引起多器官功能衰竭,即使采取重症监护,ALF的病死率仍然很高[1]。肝移植是目前治疗ALF唯一有效的方式,但却存在供体缺乏以及需要长期使用免疫抑制剂等问题。近年来,生物人工肝支持系统[2]和干细胞移植[3,4]等新方法被大量用于包括急性肝衰竭在内的各种终末期肝病的基础和临床研究,取得了令人瞩目的成果。但是,由于ALF病情复杂、影响因素多、缺乏对照等原因,对于生物人工肝或者干细胞移植治疗ALF的确切疗效往往难以判断。因此,建立理想的ALF动物模型,是进行ALF研究的基础。
目前建立ALF动物模型的方法主要包括外科手术、药物和基因敲除。但是这些方法还存在着一些问题,例如,传统的外科手术肝切除常出现动物术后出血死亡,肝切除量不精确;而结扎各肝叶Glisson系统的手术方法对实验人员手术技能以及手术设备要求较高;药物诱导是选择合适的药物,在保证有显著的ALF表现及较高死亡率的同时,尽可能减少肝外器官的损害,并且有一定的存活时间及可接受的实验费用。另外,目前ALF的动物模型多数为鼠、兔的模型,与临床患者临床表现、生理生化指标和病理改变差异较大。与啮齿类动物相比,小型猪的生理特征以及免疫系统与人类相似。本实验通过比较不同比例肝切除体积对小型猪肝功能衰竭的影响,为建立合适的小型猪大部分肝切除后ALF模型提供合适的方法。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级巴马小型猪,24只,雌雄不限,体重15 kg左右,由南京大学医学院附属鼓楼医院实验动物中心提供【SCXK(沪)2012-0013】。无菌手术在南京大学医学院附属鼓楼医院动物实验中心屏障动物设施进行【SYXK(苏)2014-0052】。试验全程所有的动物处理方法和实验操作步骤均严格遵守《南京大学动物保护和使用规定》。
1.1.2 实验材料
丙泊酚注射液(20 mL, 200 mg),西安力邦制药有限公司,批号:1209252;氟哌利多注射液(2 mL, 5 mg),上海旭东海普药业有限公司,批号:AE130101;盐酸利多卡因注射液(20 mL, 0.4 g),上海朝晖药业有限公司,批号:1203E02;硫酸阿托品注射液(1 mL, 0.5 mg),上海禾丰制药有限公司,批号:121203;盐酸氯胺酮注射液(2 mL, 0.1 g),上海朝晖药业有限公司,批号:120405。地西泮注射液(2 mL, 10 mg),天津金耀氨基酸有限公司,批号:1301041。
1.2 方法
1.2.1 猪大部分肝切除模型的建立
所有动物在25℃环境下适应3 d后建模。巴马小型猪麻醉采用氯胺酮(2支)、氟哌利多(2支)、阿托品(1支)颈部肌肉注射。手术过程中以丙泊酚(1支)、氯胺酮(2支)、地西泮(3支)、5 mL盐酸利多卡因溶于5%葡萄糖溶液静脉滴注维持。实验猪仰卧位,四肢固定于手术台上。安尔碘消毒术区皮肤。腹部正中切口,自剑突切开皮肤、白线及腹膜后入腹,切开长约10 cm。用手术纱布将肠管隔离,即可显露肝。术中观察猪肝分为左外侧叶、中叶、右外侧叶和尾状叶,中叶又分为左中叶和右中叶,尾状叶与右外侧叶相连,但有一不甚明显的小叶间裂从右外侧叶分裂出尾状叶。参照Higgins和Anderson方法[5]行猪肝切除术:(1)假手术组 (Sham)(n=6):仅作开腹处理;(2)75%肝切除组 (75% hepatectomy)(n=6):顺序切除实验猪肝左外侧叶、左中叶及右中叶的远端2/3;(3)85%肝切除组 (85% hepatectomy)(n=6):顺序切除实验猪肝左外侧叶及中叶;(4)95%肝切除组 (95%, hepatectomy)(n=6):顺序切除实验猪肝左外侧叶、中叶及右外侧叶,仅留尾状叶。结扎下腔静脉,按上述肝切除方法行不同比例的肝切除术。术后室温下饲养,予以自由进食和饮水。观察并记录存活情况。
1.2.2 术后观察指标

1.3 统计学处理
实验结果用均数±标准差表示。采用SPSS 19.0统计学软件进行数据处理,组间比较应用独立样本t检验,生存期比较采用Kaplan-Meir曲线,P<0.05为差异有统计学意义。
2 结果
2.1 术后一般情况及生存时间
75%肝切除实验猪术后苏醒快,无肝功能衰竭表现,进食和活动与正常猪没有区别。85%肝切除实验猪均出现肝功能衰竭的征象,表现为术后苏醒时间延长,精神萎靡,嗜睡,不喜动,对刺激反应弱,眼睛出现血性分泌物,大量腹水,尿色深黄。死亡实验猪尸检可见肝右外侧叶肿胀,腹腔有中等量腹水。95%肝切除实验猪术后即陷入肝昏迷状态,对刺激反应较弱,很快于1~3 d内死亡,尸检见尾状叶肿胀,腹腔少量积液。在实验猪死亡后尸体解剖时均未发现腹腔大出血或血管栓塞等并发症,证明实验猪死于肝功能衰竭。
所有存活的实验猪术后25 d处死,共2只,均为75%肝切除组。各组的生存时间分别为:75%肝切除组,(21.4±2.9)d;85%肝切除组,(17.3±3.6) d;95%肝切除组,(1.3±1.0) d,与前两组差异均具有显著性(P< 0.01)(图1)。
2.2 实验猪术前、术后影像学观察及切除比例测定
各组动物在手术切除前、手术切除后均行肝CT扫描以测定肝体积。各组动物肝CT扫描及重建结果见图2。经体积测定证实,各组手术切除范围分别为70%~80%、80%~90%和93%~97%,符合切除要求。
2.3 实验室检验
各组试验猪在术前、手术后第1天(D1)、手术后第3天(D3)、手术后第5天(D5)、手术后1周(W1)、手术后2周(W2)、手术后3周(W3)抽血静脉血行肝功能(ALT、AST、TBil、DBil、TBA、γ-GT、ALP、LDH、ALB)、血清氨及凝血功能(PT)检测。各项检查结果见图3。
与假手术组比较,75%切除术后1 d(P<0.05)、85%切除术后1 d(P<0.01)及3 d(P<0.05)谷丙转氨酶指标明显提高,差异具有显著性;75%切除术后1 d(P<0.05)、85%切除术后1 d(P<0.01)、95%切除术后1 d(P<0.01)谷草转氨酶指标显著性提高,差异有显著性,并持续保持高水平状态。碱性磷酸酶活性85%切除术后保持持续性升高,差异有显著性(P<0.01);乳酸脱氢酶活性85%及95%切除术后1 d活性明显增高,差异有显著性(P<0.05);γ-谷氨酰转移酶各组活性明显增高(P<0.05或P<0.01);总胆汁酸85%切除术后3、5 d明显升高,差异有显著性(P<0.05);直接胆红素85%切除术后3、5 d及1周明显升高,差异有显著性(P<0.05)。凝血酶原时间未见统计学差异。肝切除各组之间差异无显著性(P>0.05)。
2.4 组织学改变
所有存活的实验猪在术后3 d在超声引导下行肝穿刺取少量肝组织,术后3 d内死亡的实验猪行尸体取肝,行HE染色,病理图片见图4。肝切除各组HE染色切片显示肝窦明显扩张、空泡样变最早出现在汇管区周围肝细胞、可出现点状坏死和片状坏死。假手术组实验猪肝小叶结构清晰,肝细胞绕中央静脉放射状排列,肝小叶间由纤细的结缔组织分割。汇管区由小叶间动脉、小叶间静脉和小叶间胆管组成,胆管上皮细胞无变性、坏死,无增生(图4A-a)。75%肝切除组肝小叶结构紊乱,肝窦重度扩张、充血,出血(图4A-b)。85%肝切除组出血区肝细胞坏死、消失,肝小叶边缘残存少量肝细胞。肝组织坏死,仅见肝小叶结构轮廓(图4A-c)。95%肝切除切片中肝小叶轮廓可见,但细胞全部坏死, 汇管区纤维组织部分坏死,内有炎细胞浸润,部分炎细胞处于坏死状态(细胞核固缩或碎裂)(图4A-d)。

图1 各组巴马小型猪生存百分率Fig.1 Survival rates of the Bama miniature pigs with post-hepatectomy acute hepatic failure
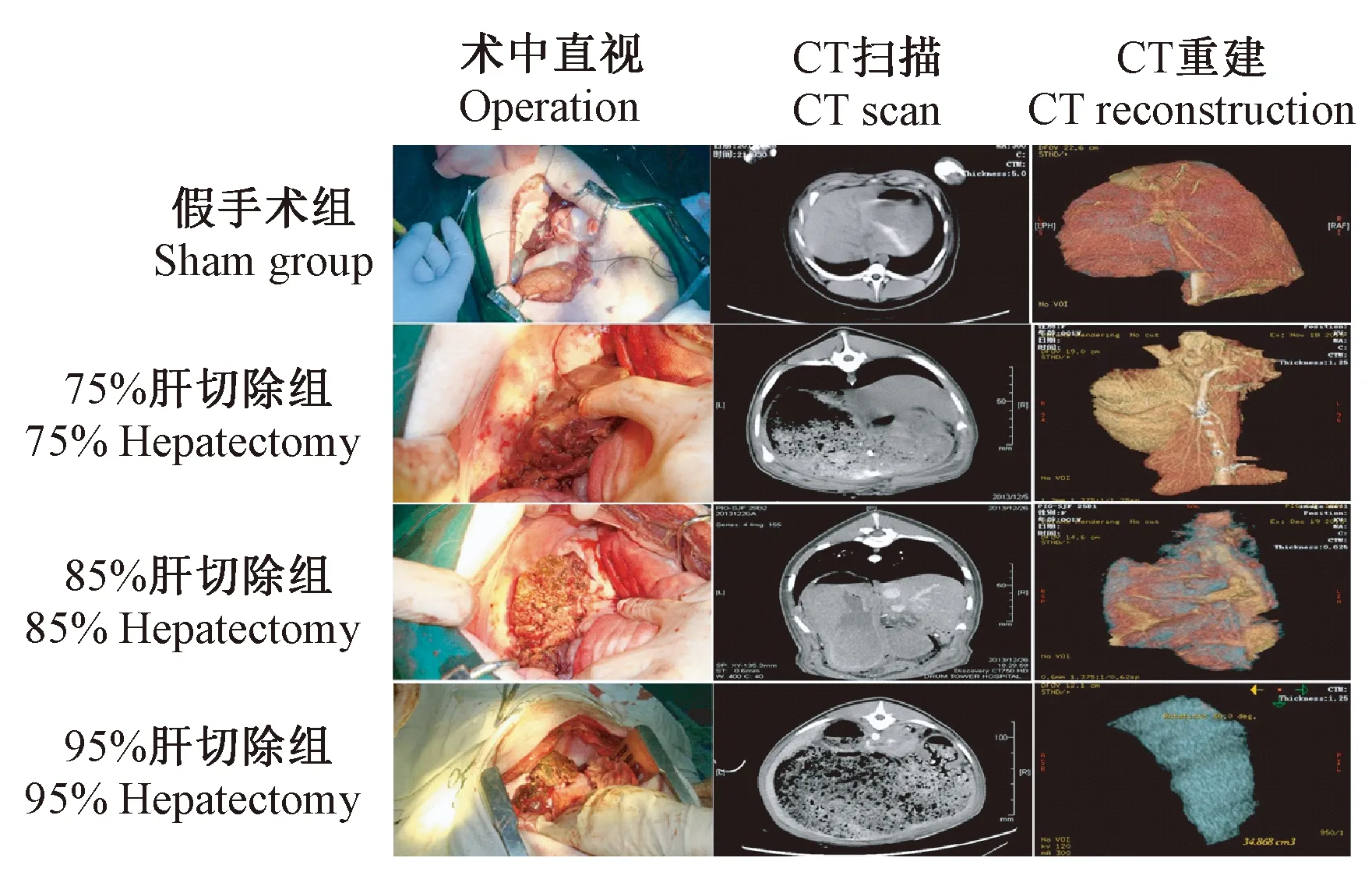
图2 不同体积肝切除肝CT扫描及重建结果Fig.2 CT scan and CT reconstruction of the Bama miniature pigs with post-hepatectomy acute hepatic failure
病理学评分结果如图4B,假手术组、75%肝切除组、85%肝切除组及95%肝切除组的病理学评分分别是(0.33±0.26)、(5.67±0.52)、(8.17±0.82)、(8.50±0.71)。各肝切除组与假手术组比较,差异有显著性(P<0.01);75%肝切除组病理学评分明显低于85%及95%肝切除组,差异有显著性(P<0.05); 85%肝切除组和95%肝切除组的评分接近,差异无显著性(P>0.05)。
3 讨论
理想的ALF模型应具有6个特征[6]:包括治疗后疾病肝衰竭可逆、可重复性、死于肝衰竭本身、合适的治疗窗、足够的动物大小及对实验人员危害小。符合上述标准的动物模型主要有两大类:即药物肝损伤和外科手术模型[7]。但是目前这些方法都各有其局限性。
采用药物诱导的方法中,D-氨基半乳糖诱导的大鼠ALF模型目前被实验人员广泛使用,但是该药稳定性一般,个体差异较大;同时较高的价格限制了其在大动物的应用[8]。抗Fas抗体Jo2也常被用作诱导ALF模型,但是须每周反复使用,剂量较难掌握,重复性较差[9]。四氯化碳是较早用于建立ALF动物模型的物质,使用方法较为简便,但主要的问题是肝外毒性作用较大,模型动物常出现高铁血红蛋白血症和急性呼吸窘迫综合征,往往导致动物死亡[10],另外,四氯化碳在被用作诱导ALF时存在可重复性低和物种间个体差异较大等缺陷[11]。
外科手术模型就是采用手术切除模型动物大部分的肝组织,让其肝功能短时间内失代偿,从而出现ALF症状。现有文献报道的肝大部分切除建立ALF模型的切除体积从70%~95%不等,越大的体积伴随着更高的死亡率。如Emond等[12]发现在70%肝大部切除术后,几乎100%的大鼠能够存活。而Panis等[13]发现在75%,85%和90%的肝切除后,术后4 d时存活率分别为100%,18%和0%,结果与我们的研究类似。另外,Madrahinov[14]报道了在肝切除90%和95%之后,大鼠1周时的存活率分别为100%和66%。
以上的实验大都集中在鼠类,而在巴马小型猪中,切除多少体积的肝诱导ALF目前并无统一认识。另外,传统的Higgins和Anderson介绍的直接套扎肝蒂并切除相应肝叶的方法虽然简单,但由于在做套扎时,为防止腔静脉狭窄,往往要远离肝蒂结扎,这样切除的肝量不精确。为了避免切除肝体积的误差而引起的实验偏倚,本研究采用术后CT重建计算残留肝体积的方法,保证每组小型猪手术后残余的肝体积符合实验要求的体积量。如果某一只小型猪的残留肝体积不符合其所在组的分组标准范围,可以选择放弃该次建模或者根据残留肝体积,将其分到另一符合标准范围的组,确保了实验的准确性和可重复性。
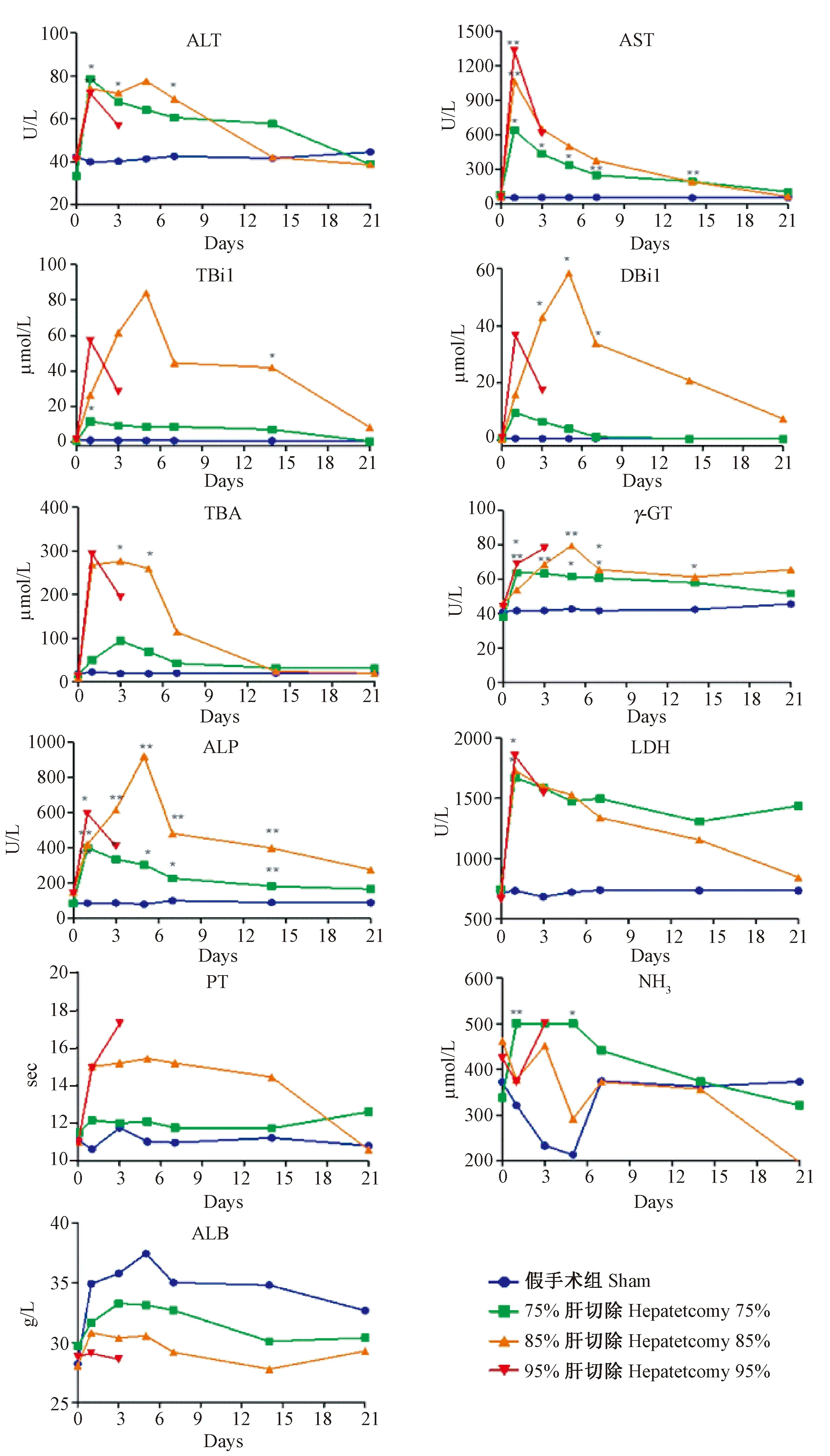
注:* P<0.05 vs 假手术组,** P<0.01 vs 假手术组。图3 各组小型猪血清生化、凝血和氨的表达水平Note. * P<0.05, ** P<0.01 vs sham-operated group.Fig.3 Serum biochemical, coagulation and ammonia parameters of the Bama miniature pigs with post-hepatectomy acute hepatic failure

注:A:各组HE染色。a:假手术组(术后3 d),组织结构正常。b:75%肝切除组(术后3 d),蓝星示一个肝小叶,基本正常。黑箭示小叶间纤细的纤维组织。c:85%肝切除组(术后3 d),黑星示肝小叶,肝细胞全部坏死,黑箭示汇管区,其内有变性、坏死的炎细胞浸润。d:95%肝切除组(术后1 d死亡时),黑星示胆汁湖,局部肝细胞坏死。蓝星是肝小叶中央部肝细胞索变窄、肝窦扩张。B:各组病理学评分结果。** P <0.01 vs假手术组;# P <0.05 vs 95%肝切除组及85%肝切除组。图4 各组肝组织HE染色和病理学评分Note. A: The liver tissues. a: A sham-operated pig, 3 days post hepatectomy. b: A pig at 3 days after 75% hepatectomy. The blue star indicates a small lobule, the black arrow indicates lobular fibrous tissue. c: A pig at 3 days after 85% hepatectomy. The black star shows a hepatic lobule filled with necrotic cells, the black arrow indicates portal area, where degenerative and necrotic inflammatory cells were observed. d: A pig died at one day after 95% hepatectomy. The black star indicates a bile lake containing necrotic hepatocytes. The blue star shows that hepatic cords in the hepatic lobule became narrow and hepatic sinus expanded. B: Pathological scores of liver tissues. **P<0.01, vs. the sham-operated group, #P<0.05, vs. 95% hepatorectomy group and 85% hepatorectomy group. Fig.4 Pathological scores of the Bama miniature pigs with post-hepatectomy acute hepatic failure(HE staining)
本研究结果表明,75%肝切除可以引起肝小叶结构紊乱,肝窦重度扩张、充血、出血,肝功能指标也出现异常,但肝功能衰竭的表现并不明显,由于实验猪具有较强的肝功能修复能力,动物总体生存时间也相对较长,不利于生存期的考察。而85%肝切除模型属于急性肝功能衰竭,手术实验猪均出现肝功能衰竭的征象,表现为术后苏醒时间延长、精神萎靡、嗜睡、对刺激反应弱和尿少色深黄等症状。尸体剖检未发现腹腔出血和血管血栓形成,但存在尾状叶肿胀和腹腔少量积液,证明实验猪死于门静脉高压引起的肝功能衰竭。死亡实验猪尸检可见肝右外侧叶肿胀、颜色变浅,腹腔有中等量腹水,这些均是出现门静脉高压的表现。存活实验猪的肝功能在术后第4天开始逐渐得到改善。随着肝切除量增加,实验猪生存率明显降低。95%肝切除组实验猪,死亡时间集中于术后l~3 d内。肝最大切除量是多少,在理论上还不明确。实验猪经历了85%肝切除后仍可存活的现象提示,并非是剩余的肝细胞数量不足引发的肝功能衰竭,而是由大部分肝切除后发生的病理生理变化导致肝有效肝细胞数量减少。
目前的研究表明有多种机制参与肝切除术后肝功能衰竭的发生。包括过度的炎性反应[13]、菌群易位[15]和Kupffer细胞激活[16]等。另外,急性门静脉高压可能也是术后肝功能衰竭的主要机制之一。大量肝实质细胞被切除后,门静脉血流动力学的异常变化现已成为研究者关注的焦点,而由此引发的的小肝综合征,使人们对门静脉高压所引起的肝损伤越来越重视[17-19]。因此,本实验所建立的大部分肝切除模型除了能够为ALF的基础研究提供大动物模型外,还完美地模拟了小肝综合征,为研究临床上大部分肝切除术导致的小肝综合征提供了可以借鉴的动物模型。
综合而言,85%肝切除模型出现的肝衰竭征象较75%肝切除更加典型,血清生化学指标及病理组织学检查均出现肝衰竭的明显特征性改变,符合临床肝衰竭的特征,95%肝切除由于手术操作的难度及较短的动物生存期,不具有实际应用价值。由于实验猪具有较强的肝功能修复能力,75%肝切除动物总体肝衰竭症状不典型,生存时间也相对较长,不利于生存期的考察。85%肝切除动物生存期介于75%肝切除和95%肝切除之间,亦比较适合考察不同治疗方案对动物生存期的影响。本研究显示85%肝切除模型可作为巴马小型猪肝功能衰竭模型建立的标准,正是这种模型具有的肝功能衰竭的高发病率、高死亡率以及一定的自愈率,使其成为合适的外科ALF模型,对建立巴马小型猪肝切除后ALF模型标准的统一具有重要意义。
[1] Petersen BE, Bowen WC, Patrene KD, et al. Bone marrow as a potential source of hepatic oval cells [J]. Science. 1999, 284: 1168-1170.
[2] Struecker B, Raschzok N, Sauer IM. Liver support strategies: cutting-edge technologies [J]. Nat Rev Gastroenterol Hepatol. 2014, 11(3): 166-76.
[3] Moore JK, Stutchfield BM, Forbes SJ. Systematic review: the effects of autologous stem cell therapy for patients with liver disease [J]. Aliment Pharmacol Ther. 2014, 39: 673-685.
[4] Salomone F, Barbagallo I, Puzzo L, et al. Efficacy of adipose tissue-mesenchymal stem cell transplantation in rats with acetaminophen liver injury [J]. Stem Cell Res. 2013, 11: 1037-1044.
[5] Higgins G, Anderson R. Experimental pathology of the liver [J]. Arch Pathol, 1931, 12(1): 186-202.
[6] Terblanche J, Hickman R. Animal models of fulminant hepatic failure [J]. Dig Dis Sci, 1991, 36(6): 770-774.
[7] Williams R. Classification, etiology, and consideration of outcome in acute liver failure [J]. Semin Liver Dis. 1996, 16(4): 343-348.
[8] 周越, 董英, 陆嘉伟,等. D-半乳糖诱导小鼠多囊卵巢综合征的动物模型研究 [J]. 中国实验动物学报, 2013, 21(5): 19-240.
[9] Vidal I, Blanchard N, Alexandre E, et al. Improved xenogenic hepatocyte implantation into nude mouse liver parenchyma with acute liver failure when followed by repeated anti-Fas antibody (Jo2) treatment [J]. Cell Transplant, 2008, 17(5): 507-524.
[10] Wang XD, Ar’Rajab A, Andersson R, et al. The influence of surgically induced acute liver failure on the intestine in the rat [J]. Scand J Gastroenterol, 1993, 28: 31.
[11] Rahman T M, Hodgson H J. Animal models of acute hepatic failure [J]. Int J Exp Pathol, 2000, 81(2): 145-157.
[12] Emond J, Capron-Laudereau M, Meriggi F, et al. Extent of hepatectomy in the rat: evaluation of basal conditions and effect of therapy [J]. Eur Surg Res 1989, 21: 251-259.
[13] Panis Y, McMullan DM, Emond JC. Progressive necrosis after hepatectomy and the pathophysiology of liver failure after massive resection [J]. Surgery 1997, 121: 142-149.
[14] Madrahimov N, Dirsch O, Broelsch C, et al. Marginal hepatectomy in the rat: from anatomy to surgery [J]. Ann Surg 2006; 244: 89-98.
[15] Wang XD, Soltesz V, Anderson R, et al. Bacterial translocation in acute liver failure induced by 90 per cent hepatectomy in the rat [J]. Br J Surg. 1993, 80(1): 66-71.
[16] Fujiwara K, Ogata I, Mochida S, et al. Activated Kupffer cells as a factor of massive hepatic necrosis after liver resection [J]. Hepatogastroenterology. 1990, 37(2): 194-197.
[17] Sugimoto H, Kaneko T, Hirota M, et al. Critical progressive small-graft injury caused by intrasinusoidal pressure elevation following living donor liver transplantation [J]. Transplant Proc. 2004, 36(9): 2750-2756.
[18] Ito T, Kiuchi T, Yamamoto H, et al. Changes in portal venous pressure in the early phase after living donor liver transplantation: pathogenesis and clinical implications [J]. Transplantation. 2003, 75(8):1313-1317.
[19] Sato Y, Kobayashi T, Nakatsuka H, et al. Splenic arterial ligation prevents liver injury after a major hepatectomy by a reduction of surplus portal hypertension in hepatocellular carcinoma patients with cirrhosis [J]. Hepatogastroenterology. 2001, 48(39): 831-83
Establishment of a porcine model of acute liver failure after 85% hepatectomy
SANG Jian-feng1, MA Hu-cheng1, SHI Xiao-lei1, HUANG Tao2, YI Dan-dan2, DING Yi-tao1*
(1. Department of Hepatobiliary Surgery, Drum Tower Hospital Affiliated to Nanjing University Medical School, Nanjing 210008, China; 2. Nanjing Medical University, Nanjing 211166)
Objective To establish a porcine model of liver failure after different percent hepatectomy. Methods The porcine models of liver failure 75%, 85%, 95% hepatectomy were developed and the living conditions and survival time were recorded. The blood samples of pre-surgery, post-hepatectomy d1, d3, d5 and post-hepatectomy 1 week, 2 weeks, and 3 weeks were collected for hepatic function analysis. Histological examination of liver tissues was performed using HE staining. Liver injury histology was interpreted and scored in the terminal samples. Results The average survival time of pigs with post-hepatectomy liver failure after 75%, 85%, 95% hepatectomy was 19.0±5.6 days, 17.3±5.5 days, 1.3±1.5 days, respectively. Their pathological scores were 5.67±0.52, 8.17±0.82 and 8.50±0.71, respectively. With the increase of percent hepatic resection, the incidence of hepatic failure was increasing. ALT, AST, ALP, LDH and TBA were dramatically increased in the pigs after 85% hepatectomy. Conclusions The pig model of acute liver failure by 85% hepatectomy is successfully established, which can cause typical acute liver failure in Bama miniature pigs.
Acute liver failure; Hepatectomy; Animal model; Bama miniature pigs.
DING Yi-tao, E-mail: kwh2003@263.net
国家自然科学基金(编号:81500478)。
桑剑锋(1971-),男,博士,副主任医师,专业:普通外科。E-mail: drsangjianfeng@163.com
丁义涛 (1950-),男,教授,博士生导师, 研究方向:肝脏外科。E-mail: yitao_ding@163.com
Q95-33
A
1005-4847(2017) 02-0174-07
10.3969/j.issn.1005-4847.2017.02.011
2016-08-21
