人参皂苷 Rg1对创伤后应激障碍大鼠行为学变化和海马神经元自噬的影响*
2017-05-18吴仲敏程正文倪桂莲邵爱民
吴仲敏, 程正文, 倪桂莲, 邵爱民, 崔 融△
(1台州学院医学院解剖学教研室,浙江 台州 318000; 2临海市第一人民医院神经内科, 浙江 临海 317000)
人参皂苷 Rg1对创伤后应激障碍大鼠行为学变化和海马神经元自噬的影响*
吴仲敏1, 2, 程正文2, 倪桂莲2, 邵爱民2, 崔 融2△
(1台州学院医学院解剖学教研室,浙江 台州 318000;2临海市第一人民医院神经内科, 浙江 临海 317000)
目的: 研究人参皂苷 Rg1 对创伤后应激障碍(PTSD)大鼠行为学变化和海马神经元自噬的影响。方法: 将SD大鼠随机分为5组:对照组;模型组;人参皂苷Rg1低、高剂量(20和40 mg/kg)组;阳性药(氟西汀)组。采用连续单一应激和足底电击相结合方法制备 PTSD 模型,人参皂苷 Rg1 低、高剂量组和阳性药组分别连续灌胃给药 21 d,对照组及模型组每日等体积生理盐水灌胃。造模前后各组大鼠分别作旷场试验和僵立行为测定,Nissl染色法观察海马神经元形态结构变化,免疫荧光双标记法观察海马 beclin 1和LC3 阳性神经元,Western blot法检测海马 beclin 1、LC3-Ⅰ、LC3-Ⅱ 蛋白水平以及 LC3-Ⅱ/LC3-Ⅰ比率。结果: 与对照组相比,模型组大鼠在旷场箱内活动次数减少,木僵率提高,海马神经元排列疏松,出现空泡样结构,伴有不同程度的细胞固缩,beclin 1和LC3 阳性神经元明显增多,beclin 1 蛋白水平增高,LC3-Ⅱ/LC3-Ⅰ比率增大。人参皂苷 Rg1 低、高剂量组大鼠在旷场箱内活动次数增加,木僵率下降,海马神经元空泡样结构减少,细胞数量增多,beclin 1和LC3 阳性神经元减少,beclin 1 蛋白水平下降,LC3-Ⅱ/LC3-Ⅰ比率减少。其中,人参皂苷Rg1高剂量组较Rg1低剂量组上述改变更为明显。结论: PTSD 模型大鼠存在明显的海马神经元自噬增强和行为学异常表现。人参皂苷 Rg1 对 PTSD 症状有明显改善作用,其机制可能与抑制海马神经元异常自噬活动有关。
创伤后应激障碍; 人参皂苷 Rg1; 海马; 自噬
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指由突发性、威胁性或灾难性生活事件导致长期持续存在的精神障碍[1]。其临床表现以再度体验创伤为特征,并伴有情绪的易激惹和回避行为[2]。近年来,随着严重自然灾害、重大传染病流行和突发事件的不断发生,PTSD 呈明显上升趋势[3],对其发病机制的研究已成为目前的研究热点之一。已有的研究认为,PTSD 的发生与海马神经元萎缩、凋亡、异常自噬以及突触萎缩等改变相关联[4-5],其中5-羟色胺(5-hydroxytryptamine,5-HT)系统在PTSD海马的病理变化中扮演重要角色,5-HT系统功能低下被认为是PTSD的主要病因[6-7],但其确切的发病机制尚不明了。人参皂苷 Rg1(ginsenoside Rg1)是人参的主要活性成分,具有神经保护和神经营养作用[8],能促进神经发生,提高免疫功能[9],但其对PTSD是否有干预作用,目前尚未见文献报道。本研究通过连续单一应激(single prolonged stress)和足底电击(foot stock)相结合的方法制备 PTSD 大鼠模型[10],观察人参皂苷 Rg1对PTSD大鼠行为学变化和海马神经元自噬的影响,探讨人参皂苷 Rg1对PTSD大鼠的干预作用及机制。
材 料 和 方 法
1 实验仪器、药物及试剂
行为学自动观察分析系统:采用Noldus行为学研究设备,含计算机、摄像监控及Observer、EthoVision等分析软件。人参皂苷 Rg1 由上海同田生物技术有限公司提供;盐酸氟西汀分散片,每片含盐酸氟西汀相当于氟西汀 20 mg,由Lilly生产;兔抗beclin 1 抗体和兔抗LC3抗体均购自Abcam;放射免疫沉淀实验(radioimmunoprecipitation assay,RIPA)裂解液和二喹啉甲酸(bicinchonic acid,BCA)蛋白质定量试剂盒均购自上海碧云天生物技术有限公司。
2 实验动物及分组
清洁级健康成年雄性 SD 大鼠,体重(200±20)g,由浙江大学实验动物中心提供,动物合格证编号为SYXK-2012-0178;适应性饲养 7 d后,进行旷场实验,剔除水平和垂直活动总分低于10的大鼠。而后采用完全随机设计,将旷场实验合格的大鼠50只,随机分成 5 组,即对照组、模型组、阳性药(氟西汀)组和人参皂苷 Rg1 低、高剂量组,每组 10 只。
3 实验方法
3.1 PTSD 模型的建立及干预方法 大鼠适应性单笼饲养 7 d后,除对照组外,其余大鼠均采用连续单一应激和足底电击相结合方法制备PTSD模型:先给予单一连续应激(禁锢 2 h,强迫游泳 20 min,乙醚麻醉至昏迷),30 min后大鼠置于电击箱(40 cm×30 cm×25 cm)适应196 s后给予 15 个循环周期(电流0.8 mA,持续 10 s,间歇 10 s)的足底电击。对照组大鼠放入相同的电击箱10 min,不给予足底电击。电击结束后把动物放回鼠笼静养。饲养条件为:22~25 ℃,昼夜节律,自由饮水摄食。实验期间每天9:00予阳性药组大鼠灌服氟西汀,氟西汀的用药剂量为10 mg/kg;人参皂苷低、高剂量组大鼠分别灌服人参皂苷 Rg1 20和40 mg/kg[11-12],均溶于生理盐水中;对照组及模型组每日等体积生理盐水灌胃。各组灌胃容积均为5 mL/kg,连续给药 21 d后测试实验效应。
3.2 旷场实验检测大鼠焦虑水平 连续给药 21 d后分别取各组大鼠进行旷场实验,实验在安静环境下进行,采用特制的旷场箱(100 cm × 100 cm × 40 cm),由浙江大学实验动物中心提供,箱体为立方形,内侧壁及底面为灰色,用黑线划分为 25 格,每格形制均为 20 cm × 20 cm。沿侧壁的格称为外周格(16 个周边正方形),其余为中央格(9 个中心正方形)。正中格正上方安置摄像头。将动物放入箱内底面正中格内,同时用自动观察分析系统摄像,观察大鼠在5 min内穿越格数(4爪均进入方格才记数,为水平运动得分)和后肢直立次数(2 前爪腾空或攀附墙壁,为垂直运动得分)。每只大鼠仅进行1次测定。每一次测定完毕后彻底清洁方箱内壁及底面再进行下一只观察,以免上次动物余留的信息(如动物的大、小便和气味)影响下次测试结果。
3.3 僵立行为测试大鼠恐惧表达 旷场实验结束后对各组大鼠进行僵立行为测试,将大鼠置于原造模电击箱中,测 4 min 内的僵立行为,每 10 s测1次,表现为僵立行为时为阳性,所得阳性次数之和占总次数的百分比为木僵率。僵立行为是一种普遍见于啮齿类动物的防御行为,表现为刻板式的蹲伏姿势,可以有一定程度的摇摆,大鼠外观除呼吸运动以外其余的肌肉运动均消失,是大鼠恐惧表达的一种行为方式。
3.4 Nissl染色法观察海马神经元形态结构 行为学测试完毕后,随机抽取各组大鼠5 只,经腹腔注射戊巴比妥钠(50 mg/kg)深麻醉,经升主动脉灌注4%多聚甲醛(0.1 mol/L PB,pH 7.4)内固定,固定后取出脑块,再固定 2 h,Leica 恒冷箱冰冻切片机连续切片,切片梯度乙醇降至水,0.1% 焦油紫染色 5~10 min,梯度乙醇脱水,二甲苯透明,中性树脂封片,光镜下观察海马神经元形态结构改变。
3.5 免疫荧光双标记法检测海马组织beclin 1 和 LC3 阳性神经元 分别取各组大鼠固定后的脑块,连续冰冻切片,片厚20 μm ,隔2取1,分为3套切片,依次裱贴于经明胶处理的载玻片上,切片入 PBS 液洗涤 3 遍,80%甲醇(含0.03%过氧化氢)溶液处理30 min,然后滴加抗体稀释液4 ℃冰箱内过夜。其中第1套切片进行 NeuN 和 beclin 1 双标记染色,首先切片入兔抗 beclin 1 (1∶1 000)抗体中孵育48 h;再在生物素化的羊抗兔 IgG(1∶200, Vector)中孵育 24 h;然后在avidin结合的 FITC(1∶200, Vector)中孵育 6 h,经 PBS 液洗涤 3 遍后,再次将切片置于鼠抗 NeuN(1∶1 000,Abcam)抗体中孵育48 h;用生物素化的羊抗鼠 IgG(1∶200, Vector)孵育 24 h;在avidin结合的 Texas-red(1∶200, Vector)中孵育 6 h。以上步骤均在 4 ℃ 避光条件下进行, 经 PBS 甘油(1∶1)封片。第2套切片用于 NeuN 和 LC3双标记染色,染色步骤同上。第3套切片作为阴性对照(用 PBS 液替代 I 抗,其余实验步骤不变)。
在激光共聚焦显微镜下分别观察红色 Texas-red 标记(细胞核)的 NeuN 阳性神经元中绿色 FITC 标记(细胞浆)的 beclin 1和LC3。阳性细胞记数:随机抽取每个海马组织双标记阳性的 4 张切片,200 倍视野下用显微镜目镜测微尺(上海光学仪器厂)计数单位面积内(mm2)beclin 1和 LC3 阳性细胞数量的平均值。
3.6 Western blot法检测海马组织beclin 1 和 LC3蛋白水平 行为学测试完毕后,另取各组大鼠5只,经腹腔注射戊巴比妥钠(60 mg/kg)深麻醉,大鼠断头速取新鲜海马组织,分别称量各组海马组织 100 mg,按比例加入RIPA 裂解液,冰浴充分研磨,离心取上清为海马组织总蛋白,参照 BCA 蛋白浓度测定试剂盒测定蛋白浓度,按30 μg 蛋白量上样,应用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,湿法转膜,5% 脱脂牛奶室温封闭2 h,加入目标蛋白 I 抗(1∶1 000)或β-actin I 抗(1∶500),4 ℃ 反应过夜。次日洗膜,加入辣根过氧化物酶标记的 II 抗(1∶1 000, Vector),室温孵育 1 h,洗膜后加 ECL 显色剂,胶片曝光显影,采用ImageJ 软件分析 Beclin 1 和LC3 蛋白表达情况。
4 统计学处理
全部资料用SPSS 19.0软件进行统计分析。各组数据以均数±标准差(mean±SD)表示,两组间比较采用t检验, 多组间比较采用单因素方差分析,进一步两两比较采用 LSD 检验,以P<0.05 为差异有统计学意义。
结 果
1 行为学实验指标改变明显
1.1 人参皂苷 Rg1作用后PTSD大鼠旷场箱内垂直和水平运动得分增加 如表1所示,给予不同的干预因素21 d 后,5组间垂直运动(直立次数)和水平运动均有显著差异(P<0.01)。其中模型组大鼠在垂直运动、水平运动方面均明显低于对照组(P<0.01);与模型组相比,人参皂苷 Rg1 低、高剂量组大鼠垂直运动和水平运动得分均显著增加(P<0.05),氟西汀组的垂直运动和水平运动得分也显著高于模型组(P<0.01)。
1.2 人参皂苷 Rg1作用后PTSD大鼠木僵率降低 5组间僵立行为百分率均有显著差异(P<0.01)。其中与对照组比较,模型组大鼠木僵率明显提高(P<0.01);与模型组相比,人参皂苷 Rg1 低、高剂量组大鼠木僵率显著降低(P<0.05),氟西汀组的木僵率也显著低于模型组(P<0.01),见表 1。
表1 各组大鼠旷场行为和僵立行为测试结果比较
Table 1.Comparison of the locomotor activity in open-field test and the stiff rate in stiff behavior test among groups (mean±SD.n=10)
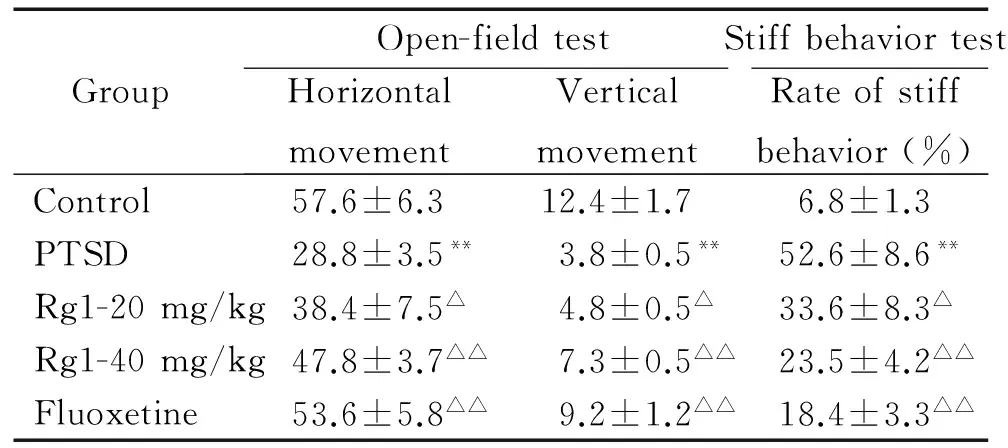
GroupOpen-fieldtestStiffbehaviortestHorizontalmovementVerticalmovementRateofstiffbehavior(%)Control57.6±6.312.4±1.76.8±1.3PTSD28.8±3.5**3.8±0.5**52.6±8.6**Rg1-20mg/kg38.4±7.5△4.8±0.5△33.6±8.3△Rg1-40mg/kg47.8±3.7△△7.3±0.5△△23.5±4.2△△Fluoxetine53.6±5.8△△9.2±1.2△△18.4±3.3△△
**P<0.01vscontrol group;△P<0.05,△△P<0.01vsPTSD group.
2 人参皂苷 Rg1作用后PTSD海马神经元形态结构趋于完整
如图1所示,对照组海马神经元排列整齐,细胞形态结构完整,模型组海马神经元排列疏松,出现空泡样结构,伴有不同程度的细胞固缩;人参皂苷 Rg1 组较之模型组海马神经元排列趋向整齐,细胞结构日趋完整,空泡样结构不断减少,细胞数量也有所增加,尤以高剂量组改变明显;氟西汀组海马神经元的数量、排列和细胞结构与人参皂苷 Rg1 高剂量组相似。

Figure 1.The distribution of hippocampal neurons in rats (Nissl staining).Scale bar=50 μm.
图1 Nissl染色观察大鼠海马神经元的形态与分布
3 人参皂苷 Rg1作用后PTSD海马beclin 1 和 LC3 阳性神经元减少
激光共聚焦显微镜下观察海马荧光双标记阳性神经元,经统计学检验,5组间beclin 1和LC3 阳性神经元均有显著差异,模型组显著高于对照组(P<0.01),人参皂苷 Rg1 高剂量组和氟西汀组的beclin 1 和 LC3 阳性神经元明显少于模型组(P<0.01),略高于对照组,但无显著差异,见图2、表2。

Figure 2.Distribution of beclin 1 and LC3 positive neurons in hippocampus of the rats (immunofluorescence labeling). Scale bar=50 μm.
图2 免疫荧光标记大鼠海马beclin 1和LC3阳性神经元的形态与分布
表2 各组大鼠海马beclin 1标记阳性和LC3标记阳性神经元的数量
Table 2.Numbers of beclin 1-positive neurons and LC3-positive neurons in rat hippocampus (mm-2. Mean±SD.n=5)

GroupBeclin1-positiveneuronsLC3-positiveneuronsControl4.5±1.15.8±1.3PTSD45.6±7.2**57.6±10.1**Rg1-20mg/kg32.4±4.5△33.6±5.3△Rg1-40mg/kg21.8±3.7△△23.5±4.2△△Fluoxetine11.2±2.2△△11.4±3.3△△
**P<0.01vscontrol group;△P<0.05 ,△△P<0.01vsPTSD group.
4 人参皂苷 Rg1作用后PTSD海马神经元自噬水平减低
海马组织Western blot结果见图3、表3,经统计学检验,5组间beclin 1 和LC3-Ⅱ/LC3-Ⅰ比值均有显著差异。模型组beclin 1 蛋白水平和 LC3-Ⅱ/LC3-Ⅰ比值均明显高于对照组(P<0.01), 人参皂苷 Rg1 高剂量组的 beclin 1 蛋白水平和 LC3-Ⅱ/LC3-Ⅰ比值均明显低于模型组(P<0.01),略高于对照组;人参皂苷Rg1高剂量组的beclin 1蛋白水平和 LC3-Ⅱ/LC3-Ⅰ比值均低于低剂量组(P<0.05)。
讨 论
PTSD的临床表现主要为对创伤事件的病理性重现、对创伤相关线索回避、持续性高唤醒,以及对创伤经历的选择性遗忘和情感麻木等。本研究采用连续单一应激和足底电击相结合方法制备 PTSD 大鼠模型,通过旷场行为检测和僵立次数变化来验证模型制备效果,实验结果表明连续单一应激+足底电击应激能较好地诱发大鼠多种 PTSD 样精神和行为异常表现,显示本模型为研究 PTSD 发病机制及药理机制的较理想的动物模型。
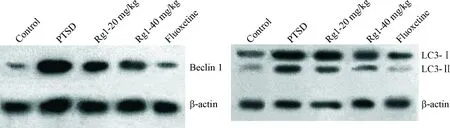
Figure 3.The changes of beclin 1 and LC3-Ⅰ/LC3-Ⅱ protein levels in the hippocampus of the rats determined by Western blot.
图3 Western blot检测大鼠海马beclin 1和LC3-Ⅰ/LC3-Ⅱ蛋白水平的变化
表3 各组大鼠海马beclin 1蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ蛋白表达水平比值的定量结果
Table 3.Protein quantification of beclin 1 and the expression ratio of LC3-Ⅱ to LC3-Ⅰin rat hippocampus (Mean±SD.n=5)

GroupBeclin1LC3-Ⅱ/LC3-ⅠControl1142.5±655.10.218±0.013PTSD2545.6±877.2**0.676±0.021**RG1-20mg/kg1832.4±754.5△0.433±0.023△RG1-40mg/kg1311.8±683.7△△0.265±0.018△△Fluoxetine1278.2±852.5△△0.211±0.015△△
**P<0.01vscontrol group;△P<0.05,△△P<0.01vsPTSD group.
人参皂苷 Rg1是人参的标志性成分,对老年痴呆、脑缺血、帕金森病等神经退行性疾病有一定改善作用,它还能够增加神经发生和突触可塑性,具有重要的神经保护作用[13],而人参皂苷 Rg1 是否具有抗PTSD作用未见报道。本研究通过连续单一应激+足底电击应激刺激制备PTSD大鼠模型,依据王巧云等[11]和李彦东等[12]的灌胃剂量与方法,观察人参皂苷 Rg1抗PTSD的活性,并探讨人参皂苷 Rg1抗PTSD的机制。旷场实验和僵立行为测试结果发现,人参皂苷 Rg1 组大鼠的穿格次数和直立次数显著增加,僵立次数明显减少,说明人参皂苷 Rg1可以改善大鼠的PTSD 样行为,对PTSD具有明显调节作用。 PTSD的海马组织存在明显萎缩、体积缩小现象[14-15],海马作为中枢边缘系统的主要结构,与情绪、记忆以及应激联系密切,海马损伤会导致海马相关的空间记忆、应激、情感控制和对新奇事物的反应处理等过程的缺陷[16]。本研究发现 PTSD 模型大鼠海马神经元排列疏松,出现空泡样结构,伴有不同程度的细胞固缩;人参皂苷 Rg1 低、高剂量组海马神经元数量均有不同程度增加,空泡样结构明显减少;阳性药氟西汀组海马神经元在数量、排列和结构方面的变化均与人参皂苷 Rg1 高剂量组相似。这说明人参皂苷 Rg1和氟西汀均具有促进海马神经元增殖和减缓PTSD海马病理进程的作用。
有研究报道PTSD大鼠的海马神经元存在过度自噬[17],因此过度自噬可能是海马体积缩小的重要原因。临床上推荐的抗PTSD一线药物氟西汀是典型的选择性5-HT再摄取抑制剂,新近的研究认为其作用机制与抑制海马神经元过度自噬,改善海马神经元突触重塑性有关[18]。Beclin 1是调控自噬的关键因子,也是自噬体的标志分子之一[19];LC3则是自噬的关键蛋白,分为Ⅰ型和Ⅱ型,采用蛋白印迹法测定LC3-Ⅱ/LC3-Ⅰ比值是一种评价自噬活性简单易行的办法[20],本研究首先采用免疫荧光双标记法标记各组大鼠海马beclin 1和LC3阳性神经元,在激光共聚焦显微镜下观察beclin 1和LC3阳性神经元,并采用蛋白印迹法检测beclin 1 蛋白水平和 LC3-Ⅱ/LC3-Ⅰ比值,结果显示PTSD大鼠beclin 1、LC3 阳性神经元明显增多,海马beclin 1 蛋白水平显著增高,LC3-Ⅱ/LC3-Ⅰ比值明显增大,提示自噬参与了 PTSD的病理进程。实验同时发现,人参皂苷 Rg1 低、高剂量组和氟西汀组大鼠海马beclin 1和LC3 阳性神经元均不断减少,beclin 1 蛋白水平和 LC3-Ⅱ/LC3-Ⅰ比值均有不同程度下降,其中,人参皂苷 Rg1 高剂量组较之 Rg1 低剂量组上述改变更为明显。由此,可以认为人参皂苷 Rg1是通过减缓PTSD大鼠海马神经元的异常自噬活动而产生良好的抗PTSD作用,这为临床用药开拓了广阔前景。
综上所述,本研究通过成功复制PTSD大鼠模型,探讨人参皂苷 Rg1对PTSD大鼠行为学和海马神经元自噬的影响,实验结果表明人参皂苷 Rg1与阳性药氟西汀均具有调节大鼠PTSD样行为作用,且二者的抗PTSD作用机制均与其抑制PTSD大鼠海马神经元异常自噬以及促进海马神经元增殖作用有关。据此认为,人参皂苷 Rg1对PTSD具有一定的治疗作用,至于何等剂量的人参皂苷 Rg1作用最为理想以及人参皂苷 Rg1抗PTSD作用的确切机制有待进一步研究。
[1] Andero R, Ressler KJ. Fear extinction and BDNF: translating animal models of PTSD to the clinic[J]. Genes Brain Behav, 2012, 11(5):503-512.
[2] 王庆松, 王正国, 朱佩芳. PTSD样情感行为异常大鼠海马 ATP酶活性与Ca2+/CaM改变[J]. 中国病理生理杂志, 2002, 18(9):1046-1049.
[3] 董强利, 叶兰仙, 张玉堂. 创伤后应激障碍的影响因素及心理危机干预[J]. 精神医学杂志, 2012, 25(1):72-74.
[4] Kitayama V, Vaccarino M, Kutner P, et al. Magnetic resonance imaging (MRI) measurement of hippocampal volume in posttraumatic stress disorder: a meta-analysis[J]. J Affect Disord, 2005, 88(1):79-86.
[5] Castilla-Ortega E, Hoyo-Becerra C, Pedraza C, et al. Aggravation of chronic stress effects on hippocampal neurogenesis and spatial memory in LPA1receptor knockout mice[J]. PLoS One, 2011, 6(9): e25522.
[6] Hoskins M, Pearce J, Bethell A, et al. Pharmacotherapy for post-traumatic stress disorder: systematic review and meta-analysis[J]. Br J Psychiatry, 2015, 206(2):93-100.
[7] Jans LA, Riedel WJ, Markus CR, et al. Serotonergic vulnerability and depression: assumptions, experimental evidence and implications[J]. Mol Psychiatry, 2007, 12(6): 522-543.
[8] 吴 露, 黄小平, 邓常清, 等. 人参皂苷Rg1对小鼠脑缺血再灌注后脑组织损伤及Nrf2/HO-1途径的影响[J]. 中国病理生理杂志, 2013, 29(11):2066-2071.
[9] Jiang B, Xiong Z, Yang J, et al. Antidepressant-like effects of ginsenoside Rg1 are due to activation of the BDNF signalling pathway and neurogenesis in the hippocampus[J]. Br J Pharmacol, 2012,166(6):1872-1887.
[10]Wang W, Liu Y, Zheng H, et al. A modified single prolonged stress model for post-traumatic stress disorder[J]. Neurosci Lett, 2008, 441(2):237-241.
[11]王巧云, 吴峰阶. 人参皂苷Rg1 对局灶性脑缺血再灌注大鼠脑组织NOS活性和蛋白表达的影响[J]. 中国病理生理杂志, 2011, 27(12):2328-2332.
[12]李彦东, 李 沫, 苏亚楠. 人参皂苷 Rg1 对阿尔茨海默病大鼠海马细胞周期依赖性蛋白激酶和p-tau 的影响[J]. 中国老年学杂志, 2014, 34(23):6732-6734.
[13]逯 丹, 舒晓明, 张婵娟, 等. 人参皂苷 Rg1 抑制叔丁基过氧化氢诱导的原代大鼠皮层神经元损伤[J]. 中国病理生理杂志, 2014, 30(3): 479-485.
[14]Golub Y, Kaltwasser SF, Mauch CP, et al. Reduced hippocampus volume in the mouse model of posttraumatic stress disorder[J]. J Psychiatr Res, 2011, 45(5): 650-659.
[15] Schmahl C, Berne K, Krause A, et al. Hippocampus and amygdala volumes in patients with borderline personality disorder with or without posttraumatic stress disorder[J]. J Psychiatry Neurosci, 2009, 34(4):289-295.
[16] Wu ZM, Zheng CH, Zhu ZH, et al. SiRNA-mediated serotonin transporter knockdown in the dorsal raphe nucleus rescues single prolonged stress-induced hippocampal autophagy in rats[J]. J Neurol Sci, 2016, 360:133-140.
[17] 隋竹欣, 刘 昊, 王海涛, 等. 创伤后应激障碍大鼠海马、杏仁核神经元自噬和凋亡改变[J]. 西安交通大学学报:医学版, 2014, 35(1):136-138.
[18] 沈忠飞, 王志坚, 潘巍巍, 等. 氟西汀调控CUMS抑郁大鼠海马突触重塑[J]. 中国病理生理杂志, 2016, 32(9):1642-1647.
[19]Pattingre S, Espert L, Biard-Piechaczyk M, et al. Regulation of macroautophagy by mTOR and Beclin-1 complexes[J]. Biochimie, 2008, 90(2):313-323.
[20]Scherz-Shouval R, Shvets E, Elazar Z. Oxidation as a post-translational modification that regulates autophagy[J]. Autophagy, 2007, 3(4):371-373.
(责任编辑: 林白霜, 罗 森)
Effect of ginsenoside Rg1 on behavioral changes and autophagy of hip-pocampal neurons of rats with post-traumatic stress disorder
WU Zhong-min1,2, CHENG Zheng-wen2, NI Gui-lian2, SHAO Ai-min2, CUI Rong2
(1DepartmentofAnatomy,TaizhouUniversitySchoolofMedicine,Taizhou318000,China;2DepartmentofNeurology,FirstPeople’sHospitalofLinhaiCity,Linhai317000,China.E-mail:Cuirong1949@163.com)
AIM: To investigate the effects of ginsenoside Rg1 on the behavioral changes and the autophagy of hippocampal neurons of the rats with post-traumatic stress disorder (PTSD). METHODS: The Sprague-Dawley rats were randomly divided into 5 groups: control group, model group, fluoxetine group, low-dose ginsenoside Rg1 group and high-dose of ginsenoside Rg1 group. The combination of single prolonged stress and foot stock was performed to induce PTSD-like animal model. The rats in fluoxetine group was administered with fluoxetine by gavage at dose of 10 mg/kg for 21 d, while the rats in low and high doses of ginsenoside Rg1 groups were administered with ginsenoside Rg1 by gavage at doses of 20 mg/kg and 40 mg/kg for 21 d, respectively. The rats in control group and model group were both given saline by gavage for 21 d. The open-field test and stiff behavior test were used to examine the behavioral changes of the rats. The morphological structure and numerical changes of the hippocampal neurons were observed by Nissl-staining method. We adopted immunofluorescence labeling to observe the beclin 1 and LC3 positive hippocampal neurons and the levels of beclin 1 and LC3-Ⅱ/LC3-Ⅰratio in rat hippocampus. RESULTS: Compared with control group, decreased vertical movement time and horizontal movement time in open-field test and increased rate of stiff behavior in the stiff behavior test were observed in model group. Hippocampal neurons in model group were loosely arranged with vacuole-like structures and different degrees of cell shrinkage in contrast with control group. More beclin 1 and LC3 positive cells were identified, and higher protein levels of beclin 1 and ratio of LC3-Ⅱ/LC3-Ⅰ in model group were found as compared with control group. However, increase in movement in open-field test and decrease in stiff behavior were detected in the rats treated with low- and high-dose ginsenoside Rg1 as compared with the model rats. Meanwhile, vacuole structures, the numbers of beclin 1 and LC3 positive neurons, the protein expression of beclin 1 and LC3, and the total cell numbers were increased. Higher dose of ginsenoside Rg1 had more profound effects on these observed results. CONCLUSION: Ginsenoside Rg1 alleviates the abnormal behaviors in the PTSD rats, which might be related to the inhibition of abnormal autophagy of hippocampal neurons.
Post-traumatic stress disorder; Ginsenoside Rg1; Hippocampus; Autophagy
1000- 4718(2017)05- 0896- 06
2016- 12- 26
2017- 03- 02
浙江省公益性应用研究计划(实验动物)项目(No. 2014C37026; No. 2017C37124)
R925; R363
A
10.3969/j.issn.1000- 4718.2017.05.021
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0576-85170001; E-mail: Cuirong1949@163.com
