阿托伐他汀对急性ST段抬高型心肌梗死患者外周血内皮祖细胞表面标志物表达的影响*
2017-05-18陈祖平陈见红银剑斌储成顶
刘 洁, 陈祖平, 陈见红, 银剑斌∆, 储成顶
(1 柳州市人民医院心血管内科,广西 柳州 545006; 2安徽医科大学公共卫生学院,安徽 合肥 230032)
阿托伐他汀对急性ST段抬高型心肌梗死患者外周血内皮祖细胞表面标志物表达的影响*
刘 洁1, 陈祖平1, 陈见红1, 银剑斌1∆, 储成顶2
(1柳州市人民医院心血管内科,广西 柳州 545006;2安徽医科大学公共卫生学院,安徽 合肥 230032)
目的: 比较不同剂量的阿托伐他汀对急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者中内皮祖细胞(endothelial progenitor cells,EPCs)功能变化的影响。方法: 选择确诊为STEMI的患者共40例,根据服用阿托伐他汀钙片的剂量不同,随机分为20 mg组及40 mg组。采用流式细胞术,在不同时点 (服药前及服药后第5、10、15、20、30、60、90、120天)对STEMI患者的循环EPCs进行识别及量化分析,检测EPCs表面标志物CXC趋化因子受体(CXCR)4、血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、沉默信息调节因子1(SIRT1)的表达。结果: 第5天40 mg组细胞增殖力及CXCR4、VEGF、bFGF的表达高于20 mg组(P<0.05);第10~120天 20 mg组细胞增殖力及CXCR4、VEGF、bFGF的表达高于40 mg组(P<0.05)。SIRT1 在第30天前2组的表达差异无统计学显著性;在第30天后出现明显变化,第60天达高峰,随后呈下降趋势,各时点均可见20 mg组大于40 mg组(P<0.05)。结论: 在STEMI急性期,40 mg阿托伐他汀提升机体修复功能优于20 mg。然而,长期低浓度的他汀治疗在改善血管内膜功能和促进血管新生作用方面优于高剂量。
ST段抬高型心肌梗死; 内皮祖细胞; 阿托伐他汀; CXC趋化因子受体4; 血管内皮生长因子; 碱性成纤维细胞生长因子; 沉默信息调节因子1
缺血性心血管疾病是全球死亡的首要原因,造成了严重的健康负担。血管内皮功能障碍是动脉粥样硬化(atherosclerosis,AS)的共同病理基础。冠心病患者常常合并内皮祖细胞(endothelial progenitor cells,EPCs)减少及功能下降[1]。EPCs在生理或病理因素刺激下,EPCs参与损伤血管的修复,维持血管内皮的完整性,生成新的血管,为缺血性心脏病的治疗提供了新思路[2]。
他汀类药物是3-羟基-3-甲基戊二酰辅酶A(3-hydroxyl-3-methylglutaryl coenzyme A,HMG CoA)还原酶抑制剂,通过竞争性抑制内源性胆固醇合成限速酶HMG CoA还原酶,使胆固醇的合成减少,清除增加,从而显著降低血清总胆固醇(total cholesterol,TC)及低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)浓度,维持血管内膜的完整性,降低心血管疾病的发病率和死亡率[3]。近年来他汀类药物的多效性效应被人们广泛熟识。特别是他汀类药物能改善或(和)恢复血管内皮功能,降低氧化应激和血管炎症,具有抗血栓形成和免疫调节活性,并最终提高粥样斑块的稳定性,因此被广泛用于血脂异常和AS的治疗中。动物实验及体外药物实验发现他汀类药物通过上调EPCs动员和分化,促进动物缺血组织的新生血管生成[4],然而并没有最终阐明是如何促血管生成的[5];也有人发现他汀类药物在低浓度时可促血管生成,而更高的浓度可降低血管生成[6],且观察他汀类药物治疗效果相对持续时间较短(通常为4周或更短),而长期临床他汀治疗的观察结果都不得而知[7]。
CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)是一种表达于EPCs表面抗原,具有7次穿膜结构,可以归巢到血管损伤部位。血管内皮生长因子(vascular endothelial growth factor,VEGF),是超强的促血管生长因子,直接刺激血管内皮细胞增殖,促进血管内膜增生,形成管腔样结构,诱导血管新生。碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)是成纤维细胞生长因子(fibroblast growth factor,FGF)的异构体,在AS中起主要作用,具有强烈的血管生成作用,可以修复损害的内皮细胞,促进平滑肌细胞的增殖,新血管的形成。沉默信息调节因子1(silent information regulator 1, SIRT1)与细胞增殖、分化、衰老、凋亡和代谢密切相关,是重要的机体“长寿”因子,可以通过下调肌细胞标志基因表达来抑制成肌细胞分化,起到延缓细胞衰老的作用。
基于以上原因,本研究的目的是,采取人体临床药物实验的手段,在不同的时点,以细胞的增殖、归巢、内皮的修复和血管的新生及细胞凋亡5个方面来观察和评估ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者在服用阿托伐他汀后循环EPCs的生物学变化情况,比较2组不同剂量的阿托伐他汀对改善缺血性心脏病的疗效,为长期使用他汀类药物治疗缺血性心脏病提供临床试验依据。
材 料 和 方 法
1 研究对象
研究对象为2013年12月~2014年5月柳州市人民医院心血管内科收治的STEMI患者,确诊后按就诊顺序,依序选用随机序列数(由中国丁香园医学网站统计论坛提供),随机等分为2组(阿托伐他汀钙片20 mg和40 mg组),每组20例。其中20 mg组,女性3例,男性17例;40 mg组,女性1例,男性19例。
纳入标准:依据《2012年欧洲心脏学会ST段抬高的急性心肌梗死管理指南》[8],确诊为STEMI。从未使用过他汀类药物的人群。排除标准:(1)转氨酶升高超出正常值3倍者;(2)出现肌酸磷酸激酶升高并伴有肌炎者;(3)孕产妇。
本研究经柳州市人民医院医学伦理委员会批准,所有受试者均被告知研究的目的,并签署知情同意书,遵照《世界医学协会赫尔辛基宣言》精神,严格进行该项研究。
2 药物
所服用阿托伐他汀钙为中国辉瑞制药有限公司生产(商品名:立普妥)。临床实践中常用剂量为10~80 mg/d(最大剂量)。本研究为20及40 mg/d。
3 研究方法
3.1 基线采集 分别记录每位患者的一般情况、心电图、冠脉造影及介入治疗。
3.2 血样采集 服药前从前臂静脉采集3 mL外周血,提取单个核细胞(peripheral blood mononuclear cells,PBMCs),进行细胞培养。分别在药物干预的第5、15、30、60、90和120天抽取外周血3 mL,进行细胞分离、培养、染色、识别, 采用流式细胞仪测定细胞表面标志物进行循环EPCs的定量分析(CD45-/CD133+/CD34+、CD45-/CD34+/KDR+)和细胞表面标志物(CXCR4、VEGFR、bFGF和SIRT1)的检测。
3.3 细胞染色与鉴定 采用梯度离心法获得PBMCs。根据细胞培养步骤,接种于培养板中,置于孵箱中培养,待典型的内皮细胞克隆出现,取贴壁细胞,先后加入DiI标记的乙酰化低密度脂蛋白(DiI-labeled acetylated low-density lipoprotein, acLDL-DiI)和FITC标记的荆豆凝集素I(FITC-labeledUlexeuropaeusagglutinin I,UEA-I-FITC)染色,然后加入荧光标记的CD34单克隆抗体,孵育,PBS冲洗,去除CD45+细胞、血小板和碎屑等物,在激光扫描共聚焦显微镜鉴定。双染色阳性细胞为正在分化的EPCs。经测定,经鉴定,95%以上的贴壁细胞为EPCs。
3.4 EPCs的识别 依据国际血液病治疗及移植工程协会(International Society of Hematotherapy and Graft Engineering,ISHAGE)推荐的标准化方案[9], 取贴壁细胞,按试剂盒说明,加入试剂,进行荧光活化细胞分类检测技术分析,排除CD45+细胞,CD45-/CDl33+/CD34+为分化较早期的EPCs(分泌型EPCs);CD45-/CD34+/KDR+为分化较晚期的EPCs(功能型EPCs)。
3.5 EPCs的量化分析 采用双抗体夹心酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA),严格按照试剂盒说明书操作。依次在酶标板中分别加入100 μL的稀释样本溶液及标准品溶液,水浴、洗涤后避光反应,以全自动酶标仪在490 nm波长处测吸光值(A值),依次检测CXCR4、VEGF、bFGF和SIRT1,描绘标准曲线计算样本含量。本实验由同一位训练有素的检验人员完成,将人为的实验误差降至最低。
4 统计学分析
使用SPSS 20.0 软件进行数据分析。计数资料以比率描述,组间比较采用卡方检验或精确概率检验;多时点观测计量资料以均数±标准差(mean±SD)描述,均经正态性检验及球型性校正,行重复测量方差分析。两组间比较为LSD-t检验,两两时间比较为差值t检验(按Bonferroni校正法调整检验水准为0.01)。其余数据以P<0.05为差异有统计学意义。
结 果
1 基线比较
该项研究的患者均为初次接受他汀类药物治疗,并曾接受冠状动脉造影;平均年龄(64.26±11.12)岁,约90%为男性;在冠脉血管病变程度、植入支架数、罪犯血管病变长度及平均管径狭窄程度等方面无显著差异,见表1;各时点血脂的比较发现,TC、高密度脂蛋白胆固醇(high-density lipoporotein cholesterol, HDL-C)和LDL-C均无明显差异,见表2。
表1 2组患者冠脉病变程度的比较
Table 1.The comparison of coronary artery lesion degree between the 2 groups [n(%).n=20]

Vascularlesionandstent20mggroup40mggroupComparison2PLesionsin1vessel1(5)4(20)Lesionsin2vessels10(50)7(35)2.3290.312Lesionsin3vessels9(45)9(45)Leftmainlesions2(10)1(5)0.0001.000Leftanteriordescendingcoro-nary arterylesions19(95)19(95)0.0001.000Circumflexcoronaryarteryle-sions13(65)10(50)0.9210.337Rightcoronaryarterylesions15(75)17(85)0.1560.693Diffuselesions19(95)16(80)0.9140.339Thromboticlesions3(15)5(25)0.1560.693Calcificationlesions3(15)5(25)0.1560.693Culpritvessel Leftmaincoronaryartery1(5)1(5)0.5910.898 Circumflexcoronaryartery2(10)1(5) Leftanteriordescendingco-ro- naryartery11(55)13(65) Rightcoronaryartery6(30)5(25)
Yates modified2test and exact probability test were used.
表2 2组血脂变化的比较
Table 2.The changes of blood lipids between the 2 groups (mmol/L.Mean±SD.n=20)
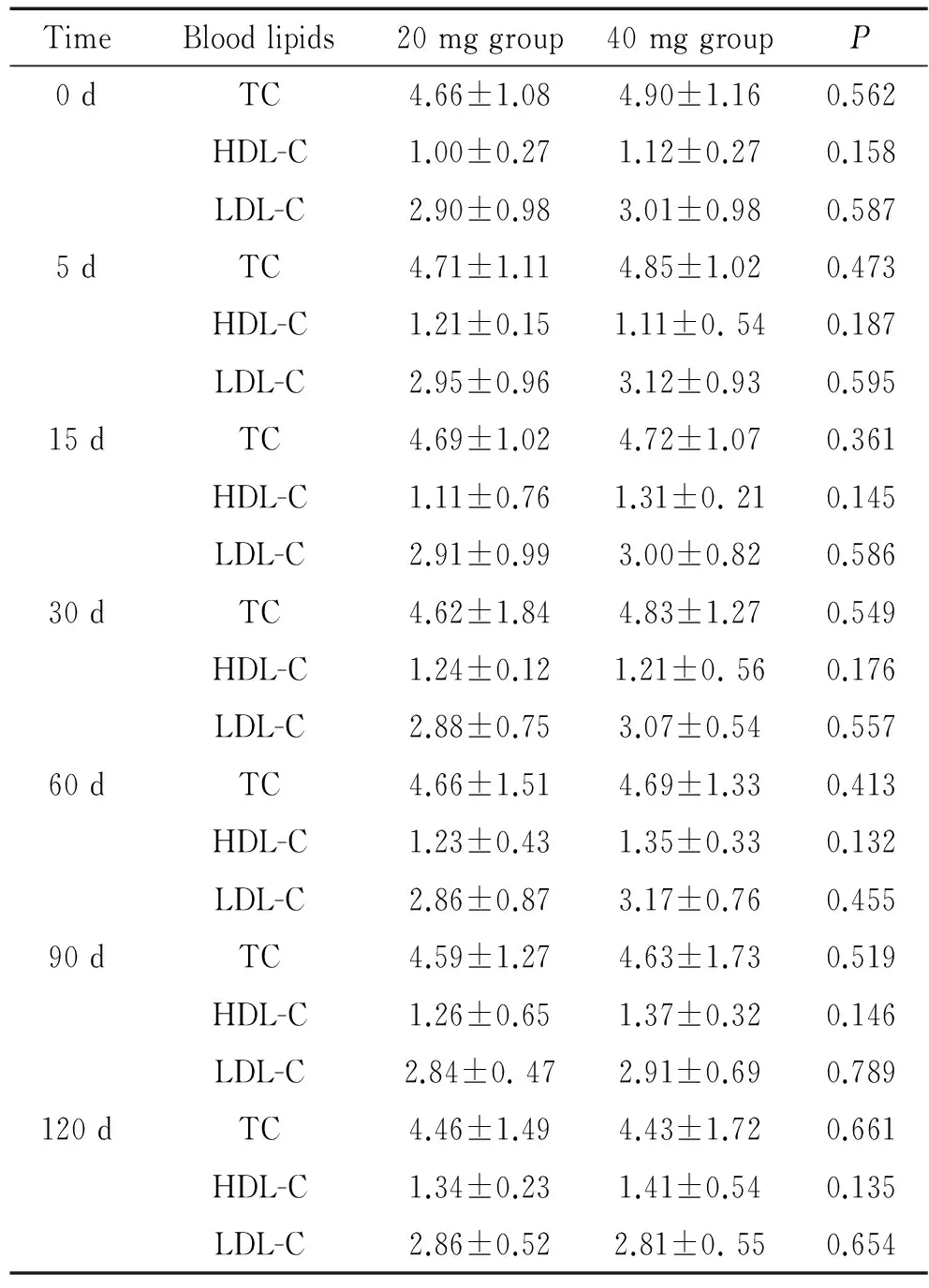
TimeBloodlipids20mggroup40mggroupP0dTC4.66±1.084.90±1.160.562HDL-C1.00±0.271.12±0.270.158LDL-C2.90±0.983.01±0.980.5875dTC4.71±1.114.85±1.020.473HDL-C1.21±0.151.11±0.540.187LDL-C2.95±0.963.12±0.930.59515dTC4.69±1.024.72±1.070.361HDL-C1.11±0.761.31±0.210.145LDL-C2.91±0.993.00±0.820.58630dTC4.62±1.844.83±1.270.549HDL-C1.24±0.121.21±0.560.176LDL-C2.88±0.753.07±0.540.55760dTC4.66±1.514.69±1.330.413HDL-C1.23±0.431.35±0.330.132LDL-C2.86±0.873.17±0.760.45590dTC4.59±1.274.63±1.730.519HDL-C1.26±0.651.37±0.320.146LDL-C2.84±0.472.91±0.690.789120dTC4.46±1.494.43±1.720.661HDL-C1.34±0.231.41±0.540.135LDL-C2.86±0.522.81±0.550.654
2 EPCs的形态鉴定
细胞培养约7天左右,可以出现周围为放射状分布的梭形细胞,而中心为圆形细胞的早期集落;21天后可观察到晚期集落,细胞放射状向外生长,表现为纺锤形或多角形,呈贴壁状态。红色细胞为AcLDL-DiI染色阳性;绿色细胞为FITC-UEA-I染色阳性;双重染色呈黄色。经检验95%以上的贴壁细胞为双重染色阳性细胞,见图1。

Figure 1.The morphological characteristics of EPCs observed under inverted microscope (A) and the fluorescence staining results of the EPCs (B). Magnification:×200.
图1 倒置显微镜观察EPCs形态学特征和EPCs的荧光染色结果
3 EPCs表面标志物的检测
如图2所示,EPCs在实验区间中呈波浪形增殖趋势,在第5天时达到第 1 个增长小高峰,无论是CD45-/CD133+/CD34+细胞还是CD45-/CD34+/KDR+细胞,40 mg组均高于20 mg组,且CD45-/CD34+/KDR+的增长明显高于CD45-/CD133+/CD34+。这考虑为急性病变及PCI治疗直接刺激机体,激活外周血EPCs,使EPCs迅速“成熟”,形成功能型EPCs,产生自体保护作用。而其后EPCs有个短暂的回落,在第15、30、60、90和120天无论是分泌型还是功能型EPCs的增长,20 mg组大都明显高于40 mg组。
第15天前2个实验组SIRT1的表达几乎处于基线水平,第15天后SIRT1的表达开始增加,第60天时SIRT1的增长率最快,无论是CD45-/CD133+/CD34+细胞还是CD45-/CD34+/KDR+细胞,20 mg组明显高于40 mg组(P<0.05)。
在对CXCR4、bFGF和VEGF的检测中我们同样发现它们的浓度呈曲线分布,且在第5天时无论CD45-/CD133+/CD34+细胞还是CD45-/CD34+/KDR+细胞, 40 mg组的CXCR4、bFGF和VEGF浓度明显高于20 mg组;此后,随着时间的推移,在第15天时开始出现20 mg组高于40 mg组。不同的细胞表面标志物浓度增长高峰不同,随着药物干预时间的延长,表面标志物浓度有下降趋势。与药物干预前比较,第120天时无论CD45-/CD133+/CD34+细胞还是CD45-/CD34+/KDR+细胞各表面标志物浓度都有不同程度的增高;但是40 mg组的CD45-/CD34+/KDR+在第120天时有所下降,也就是说40 mg组阿托伐他汀在第120天时已经失去了促进功能型EPCs增殖的功能。
讨 论
EPCs来源于骨髓,参与受损组织的修复。在组织急性缺血时可自发“招募”骨髓和循环血中的EPCs进入缺血区,对受损的血管内膜的修复,血管新生,促进新生血管的再内皮化,延缓血管内皮的衰老,从而改善血液循环和减轻动脉粥样硬化的进展[2]。相当多的证据表明,EPCs的数量减少,可预测未来的心血管事件。因此,如何增加EPCs的数量、增强EPCs的生物学效应在缺血性心脏病中存在广泛、深远的治疗意义。大量的动物实验研究表明,EPCs促血管新生和抗动脉粥样硬化的作用与细胞替代修复和定向分化有关。这些包括营养支持和增强的内源性修复过程。内皮祖细胞是异质性的,可分为早期或晚期内皮祖细胞。在体外培养系统中,4~7 d内出现早期内皮祖细胞,在2~3周后发展为晚期内皮祖细胞。据推测,早期EPCs可能主要是提供营养支持,而晚期EPCs表达多种内皮标志物,分化为成熟的内皮细胞,促进血管的修复[10]。随着细胞的分化和成熟,EPCs开始表达特定的内皮细胞标志,这使得它们能够从其它的各种干细胞和骨髓细胞中被区分开来,将不同的表面标志物组合起来可以区分不同分化阶段的EPCs。临床上,他汀类药物被广泛用于治疗血脂异常及相关的动脉血管异常中。事实上,来自在体外和体内的众多试验数据表明,不论胆固醇浓度,他汀类药物具有多效性的行为已经超出其降脂作用,在缺血性心脏病和外周疾病患者中显示出良好的治疗效果[11]。有动物实验及体外研究报告,连续的他汀类药物治疗可导致EPCs的逆变与减少[13],长期的他汀类药物治疗可能无法充分、连续刺激EPCs,导致“脱敏”效应(即他汀类药物的时间依赖性及浓度依赖性学说)。低浓度他汀类药物可促进内皮细胞迁移和血管生成。与此相反,高浓度阻碍血管发生和诱导内皮细胞凋亡[10-11]。然而,以往众多的动物及体外研究主要集中在短期他汀类药物对外源性细胞因子诱导的急性病理性血管功能障碍的影响;他汀类药物到底是促进血管生成,还是抗血管生成的,具体使用多长时间,如何增强EPCs的生物学效应,并没有详细地阐明。因此,在本研究中,我们观察了早、晚期EPCs的增殖、归巢、衰老及内膜修复、新生血管的情况,以期较为全面地反映EPCs在阿托伐他汀药物干预下的生物学变化。
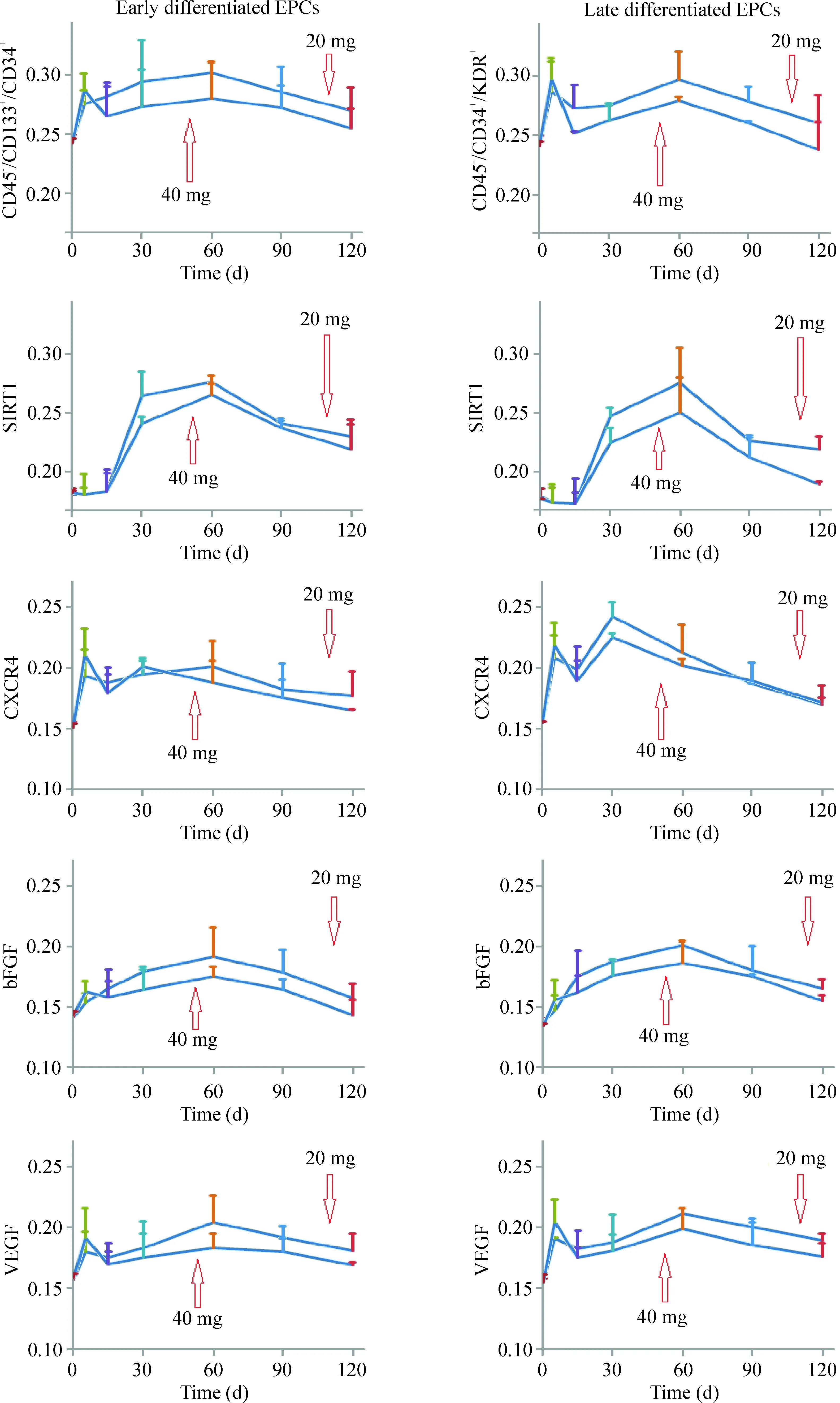
Figure 2.The expression of the surface markers in early (CD45-/CD133+/CD34+) and late (CD45-/CD34+/KDR+) differentiated EPCs compared between the 2 groups. Mean±SD.n=20.
图2 2组分化早期与晚期EPCs表面标志物表达的比较
在本研究中,我们发现,在血管急性损伤及支架置入术后,EPCs的快速增强以增加外周循环中晚期分化的EPCs为主,迁移、归巢的EPCs增加,内皮的修复功能也随之增强。这可能与机体应激[12]和自体防护功能有关,与Eisen等[2]的研究结果相吻合。在急性期40 mg组EPCs功能明显优于20 mg组,而随着阿托伐他汀药物的继续干预,我们发现无论是分泌型EPCs还是功能型EPCs, 20 mg组要高于40 mg组。也就是高剂量的阿托伐他汀可以有效地招募机体储存的EPCs使其迅速成熟,形成功能型EPCs,对机体起到防护及早期修复功能。而10 d以后20 mg组无论在促进细胞的增殖方面还是细胞的迁移、归巢、内皮的修复和新生血管等功能方面,20 mg组要明显优于40 mg组。也就是说阿托伐他汀增强了EPCs对缺血组织的反应,促使EPCs的增殖,延缓EPCs的凋亡,诱导循环EPCs的共同表达归巢受体CXCR4的数量显著增加,提高EPCs动员和招募至缺血部位,从而增强内皮的修复功能和加速新生血管的生成。从实验结果发现在急性损伤及机体应激情况下40 mg组能有效地提高机体的自我修复功能;但5~10 d甚至更长的时间后20 mg组EPCs的细胞生物学改变优于40 mg组,从而更进一步印证长期低浓度的他汀促进血管新生作用更优于高剂量组。
[1] 贺甫威, 叶红华, 费晓红, 等.经皮冠状动脉介入术前他汀再负荷对围术期循环内皮祖细胞及炎症因子的影响[J]. 中国病理生理杂志, 2014, 30(10):1772-1777.
[2] Eisen A, Leshem-Lev D, Yavin H, et al. Effect of high dose statin pretreatment on endothelial progenitor cells after percutaneous coronary intervention (HIPOCRATES study)[J]. Cardiovasc Drugs Ther, 2015, 29(2):129-135.
[3] Zhou J, Cheng M, Liao YH, et al. Rosuvastatin enhances angiogenesis via eNOS-dependent mobilization of endothelial progenitor cells[J]. PLoS One, 2013, 8(5):e63126.
[4] Shav D, Gotlieb R, Zaretsky U, et al. Wall shear stress effects on endothelial-endothelial and endothelial-smooth muscle cell intreractions in tissue engineered models of the vascular wall[J]. PLoS One, 2014, 9(2):e88304.
[5] Banerjee S, Abu Fadel M, Sarode R, et al. Plaque regression and progenitor cell mobilization with intensive lipid elimination regimen (PREMIER) trial design[J]. J Clin Apher, 2014, 29(2):97-106.
[6] Dworacka M, Krzyzagorska E, Wesolowska A, et al. Statins in low doses reduce VEGF and bFGF serum levels in patients with type 2 diabetes mellitus[J].Pharmacology, 2014, 93(1-2):32-38.
[7] Lin LY, Huang CC, Chen JS, et al. Effects of pitavastatin versus atorvastatin on the peripheral endothelial progenitor cells and vascular endothelial growth factor in high-risk patients: a pilot prospective, double-blind, randomized stu-dy[J]. Cardiovasc Diabetol, 2014, 13:111.
[8] Steg PG, James SK, Atar D, et al. ESC guidelines for the management of acute myocardial infarction in patients pre-senting with ST-segment elevation[J]. Eur Heart J, 2012, 33(20):2569-2619.
[9] António N, Fernandes R, Soares A, et al. Reduced levels of circulating endothelial progenitor cells in acute myocardial infarction patients with diabetes or pre-diabetes:accompanying the glycemic continuum[J]. Cardiovasc Diabetol, 2014, 13:101.
[10]Margaritis M, Channon KM, Antoniades C, et al. Statins as regulators of redox state in the vascular endothelium: beyond lipid lowering[J]. Antioxid Redox Signal, 2014, 20(8):1198-1215.
[11]Lee PS, Poh KK. Endothelial progenitor cells in cardiovascular diseases[J]. World J Stem Cells, 2014, 6(3):355-366.
[12]Hibbert B, Simard T, Ramirez FD, et al. The effect of statins on circulating endothelial progenitor cells in humans: a systematic review[J]. J Cardiovasc Pharmacol, 2013, 62(5):491-496.
(责任编辑: 陈妙玲, 罗 森)
Effect of atorvastatin on expression of peripheral blood EPC surface mar-kers in patients with acute ST-segment elevation myocardial infarction
LIU Jie1, CHEN Zhu-ping1, CHEN Jian-hong1, YIN Jian-bin1, CHU Cheng-ding2
(1VasculocardiologyDepartment,LiuzhouPeople’sHospital,Liuzhou545006,China;2AnhuiMedicalUniversitySchoolofPublicHealth,Hefei230032,China.E-mail: 705714556@qq.com)
AIM: To compare the effects of atorvastatin at different doses on the function of endothelial proge-nitor cells (EPCs) in the patients with ST-segment elevation myocardial infarction (STEMI). METHODS: The patients of STEMI (n=40) were chosen. According to treatment with different doses of atorvastatin calcium tablet, they were randomly divided into a group of 20 mg and a group of 40 mg (20 cases in each group). The EPCs isolated from the patients were identified and quantitatively analyzed at different time points (before the treatment and on days 5, 10, 15, 20, 30, 60, 90 and 120 after the treatment) by flow cytometry. The surface markers of the EPCs, CXC chemokine receptor 4 (CXCR4), vascular endothelial growth factor (VEGF), basic fibroblast growth factor (bFGF) and silent information regulator 1 (SIRT1), were also detected. RESULTS: On the 5th day, the group of 40 mg demonstrated stronger cell proliferation capability and higher expression levels of CXCR4, VEGF and bFGF than the group of 20 mg (P<0.05). From the 10th day to 120th day, the group of 20 mg revealed stronger cell proliferation capability and higher expression levels of CXCR4, VEGF and bFGF than the group of 40 mg (P<0.05). Within 30 d, the expression of SIRT1 showed no significant diffe-rence between the 2 groups, yet it witnessed a marked change after that and peaked on the 60th day with a drop afterwards. At each time point, the SIRT1 expression level in the group 20 mg was observed higher than that in the group of 40 mg (P<0.05). CONCLUSION: In the acute phase, the repair function of the body treated with atorvastatin at dose of 40 mg is better than that with 20 mg. However, in a long term the low concentration of statin therapy works better in improving the vascular intima and promoting the angiogenesis than high concentration.
ST-segment elevation myocardial infarction; Endothelial progenitor cells; Atorvastatin; CXC chemokine receptor 4; Vascular endothelial growth factor; Basic fibroblast growth factor; Silent information regulator 1
1000- 4718(2017)05- 0851- 06
2016- 07- 28
2017- 03- 23
广西壮族自治区卫计委科研基金资助项目(No. Z2014546)
R542.2+2; R363
A
10.3969/j.issn.1000- 4718.2017.05.014
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13978001489; E-mail: 705714556@qq.com
