生酮饮食添加治疗婴儿痉挛的临床疗效观察
2017-05-18宋婷婷黄绍平王雪莹姜永生
宋婷婷,黄绍平,杨 琳,王雪莹,姜永生,刘 宇,李 丹
(西安交通大学第二附属医院小儿内科,陕西 西安 710004)
[临床研究]
生酮饮食添加治疗婴儿痉挛的临床疗效观察
宋婷婷,黄绍平,杨 琳,王雪莹,姜永生,刘 宇,李 丹
(西安交通大学第二附属医院小儿内科,陕西 西安 710004)
目的 观察生酮饮食(KD)添加治疗婴儿痉挛(IS)的临床疗效、不良反应及可能影响KD疗效的因素,为临床上应用添加KD治疗IS提供有效参考依据。方法 筛选2011年12月至2015年10月在西安交通大学第二附属医院添加KD治疗的36例确诊为婴儿痉挛患儿的临床资料,比较KD疗效在各预测因素组内的差异,评估KD后的发作控制率、KD保留率及不良反应。结果 KD维持治疗1、3、6个月的保留率分别为91.7%、88.9%和80.6%。在6个月时KD控制婴儿痉挛的有效率为66.7%。因发作控制不佳甚至增加而中止KD者占57.1%。KD前使用抗癫痫药物(AEDs)的种类越少,添加KD的有效率越高(χ2=8.309,P=0.013<0.05)。结论 KD作为对IS的添加治疗有效和安全;KD保留率主要的影响因素是疗效;KD治疗前的用药种类对其疗效可能有一定的预测价值。
生酮饮食;婴儿痉挛;有效率;保留率;不良反应
生酮饮食(ketogenic diet,KD)是一种模拟禁食状态下代谢过程的高脂、低碳水化合物、适量蛋白和其他营养素的饮食方案。在KD过程中机体所需80%的能量供应来自脂肪,另外20%的能量由蛋白质及碳水化合物供应;同时还应添加维生素、叶酸、钙离子等多种无糖的机体生长发育及生理活动所必需的物质。1921年,最早由Wilder首次将KD成功地应用于癫痫的治疗[1]。目前全世界已有40多个国家在癫痫治疗领域开展了KD,KD已成为治疗包括婴儿痉挛(infantile spasms,IS)在内的儿童难治性癫痫的重要方法之一[2]。IS的三大主征:点头发作、进行性智力减退、脑电图呈现高度失律(hypsarrhythmia)。IS属于癫痫性脑病,对药物的反应较差。KD是除药物外重要的无创治疗方法,对于IS患儿疗效国内报道较少,本文主要目的在于评价KD作为添加治疗IS的疗效、依从性及安全性等,为KD在IS临床治疗领域的进一步推广提供一定的参考,现报道如下。
1资料与方法
1.1一般资料
研究对象为2011年12月至2015年10月在西安交通大学第二附属医院进行KD治疗的36例确诊为IS患儿,并且通过医院伦理委员会逐一审查批准。
病例入选标准符合2013年国际抗癫痫联盟(ILAE)对IS的诊断标准[3]:①发病年龄早(多发于1岁以下);②发作形式特殊(典型临床表现为突然而短暂地颈、躯干、四肢屈曲或伸直痉挛运动,常成串出现,可不对称);③脑电图(EEG)呈特征性改变(发作间期呈高峰失律);④常伴有精神运动发育停滞或进行性倒退[4]。
入组标准:①按ILAE诊断标准诊断为IS的患儿;②既往未接受过KD治疗;③经正规治疗,使用2种或2种以上抗癫痫药物(AEDs)而癫痫发作未得到有效控制;④家属同意接受患儿KD治疗,并签署书面知情同意书;⑤随访6个月以上。
排除标准(排除KD治疗相关禁忌症):①患有干扰葡萄糖及脂肪代谢的代谢性疾病;②严重的肝脏疾病;③线粒体疾病(如线粒体酶缺乏等);④呕吐、发热和器官急性损伤;⑤各种可能引发严重不良反应的疾病;⑥免疫缺陷。
1.2研究方法
本临床研究方法为自身对照的前瞻性研究。记录纳入对象KD治疗前的癫痫临床发作、药物治疗及KD治疗后的不良反应等情况,分析添加KD对IS治疗的临床疗效及安全性。
1.2.1生酮饮食的配制方法
使用专门的KD配餐软件,按照Johns Hopkins改良方案设计配餐[5]。
1.2.2生酮饮食治疗流程
每个入组患儿一般住院1周左右,KD治疗前首先完善包括身高、体重、血尿粪常规、血生化、血尿代谢筛查、左腕关节正侧位片、脑电图、微量元素、腹部及泌尿系B超、心电图、头颅影像学及抗癫痫药物的血药浓度等相关检查。如以上结果有异常,经相关治疗复查好转后再开始KD治疗。首先禁食(一般少于24小时),禁食期间可少量多次饮水,并对血糖、血酮水平进行监测。当血酮稳定在2.0mmol/L左右时停止禁食,开始给予生酮奶并逐渐加至全量。对于部分年龄小,身体状况欠佳的患儿则逐渐引入KD,KD治疗过程中需密切监测患儿血糖、血酮及尿酮情况,并定期复查血生化、微量元素、腹部及泌尿系B超。如血糖<2.8mmol/L可给予口服含橙汁或5%的葡萄糖10~20mL,1小时后复测血糖,必要时重复使用。
1.3随访指标
①记录KD开始前3个月患儿癫痫发作的形式及平均频率作为每月发作的基数。随访记录KD治疗后各时间点的癫痫发作形式及频率,记录KD治疗后第1、3、6个月的发作频率及形式,与治疗前情况进行比较,确定疗效等级;②统计KD治疗的保留率,保留率的计算方法为各个时间点仍坚持KD的人数占总病例数的百分比;③对KD治疗的不良反应进行监测;④记录患儿终止KD的时间并分析原因。
1.4生酮饮食疗效评价标准
KD疗效评价参照Engel分级[6],Ⅰ级:无影响功能的癫痫发作,即痉挛发作终止,高峰节律紊乱消失,脑电图完全恢复正常;Ⅱ级:治疗后癫痫发作减少≥90%同时<100%,即痉挛发作较前明显减少,脑电中高峰节律紊乱显著改善;Ⅲ级:治疗后癫痫发作≥50%同时<90%,即痉挛发作较前有所减少,脑电中高峰节律紊乱有所改善;Ⅳ级:治疗后癫痫发作减少<50%或发作增加,脑电中高峰节律紊乱无改善甚至加重。治疗后痉挛发作达到Ⅰ、Ⅱ、Ⅲ级疗效者为有效,Ⅳ级为无效。
1.5统计学方法

2结果
2.1生酮饮食的保留率、疗效及终止生酮饮食治疗的原因
本资料36例患儿中,KD维持治疗1、3、6个月的保留率分别为91.7%、88.9%和80.6%。在1个月内起效者20例,在3个月内起效者23例,在6个月内起效者24例。在6个月内癫痫发作完全控制者占19.4%(7/36),达Ⅱ级、Ⅲ级疗效者分别占27.8%(10/36)、19.4%(7/36),总有效率66.7%。因发作控制不佳甚至增加而中止KD者占57.1%(4/7),家长依从性差者占14.3%(1/7),合并严重感染者占14.3%(1/7),不能耐受严重饥饿者占14.3%(1/7),见表1。
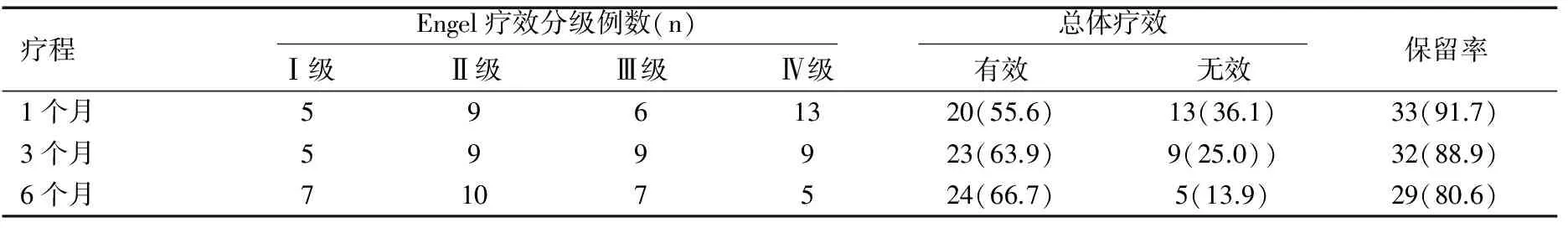
表1 KD各时间点的疗效及保留率[n(%)]
2.2影响生酮饮食疗效的预测因素
随访6个月后,保留依从性较强患者29例。其中男性24例,添加KD治疗有效者21例;女性5例,添加KD治疗有效者3例。按首次发作时年龄分组:≤12个月的患者22例,其中19例有效;13~36个月的患者7例,其中5例有效。开始添加KD治疗时平均年龄(27.8±5.2)个月,年龄≤12个月开始添加KD治疗者9例,6例有效;13~36个月的患者14例,13例有效;37~72个月的6例,有效者5例。接受随访的29例添加KD治疗患儿的病程跨度在2~62个月,平均病程为(19.6±2.1)个月。病程≤12个月者15例,8例有效;病程13~36个月者9例,8例有效;病程≥37个月者5例,4例有效,见表2。
病因系隐源性者22例,19例治疗有效;病因系症状性者7例(其中结节性硬化2例,脑发育不良2例,脑室周围白质软化、巨脑回畸形及双侧顶叶钙化灶各1例),5例治疗有效。添加KD治疗前使用3~10种AEDs,平均4种AEDs。使用3种者21例,20例有效;使用4种以上者8例,4例有效;使用5种及5种以上者6例,其中1例有效。有11例患儿曾接受过免疫治疗,其中有效者8例;未接受过免疫治疗者18例,治疗有效者16例,见表2。
在首次发作年龄、开始添加KD治疗年龄、性别、病程、病因及是否接受免疫治疗在不同组别内KD疗效的比较差异均无统计学意义(均P>0.05),说明首次发作年龄、开始添加KD治疗年龄、性别、病程、病因及是否接受免疫治疗对KD添加治疗IS的疗效无影响;KD疗效在添加KD治疗前使用AEDs的种类各组间比较差异有统计学意义(P<0.05),使用AEDs的种类越少,KD的有效率越高,见表2。
表2 各种预测因素对KD疗效的影响[n(%)]
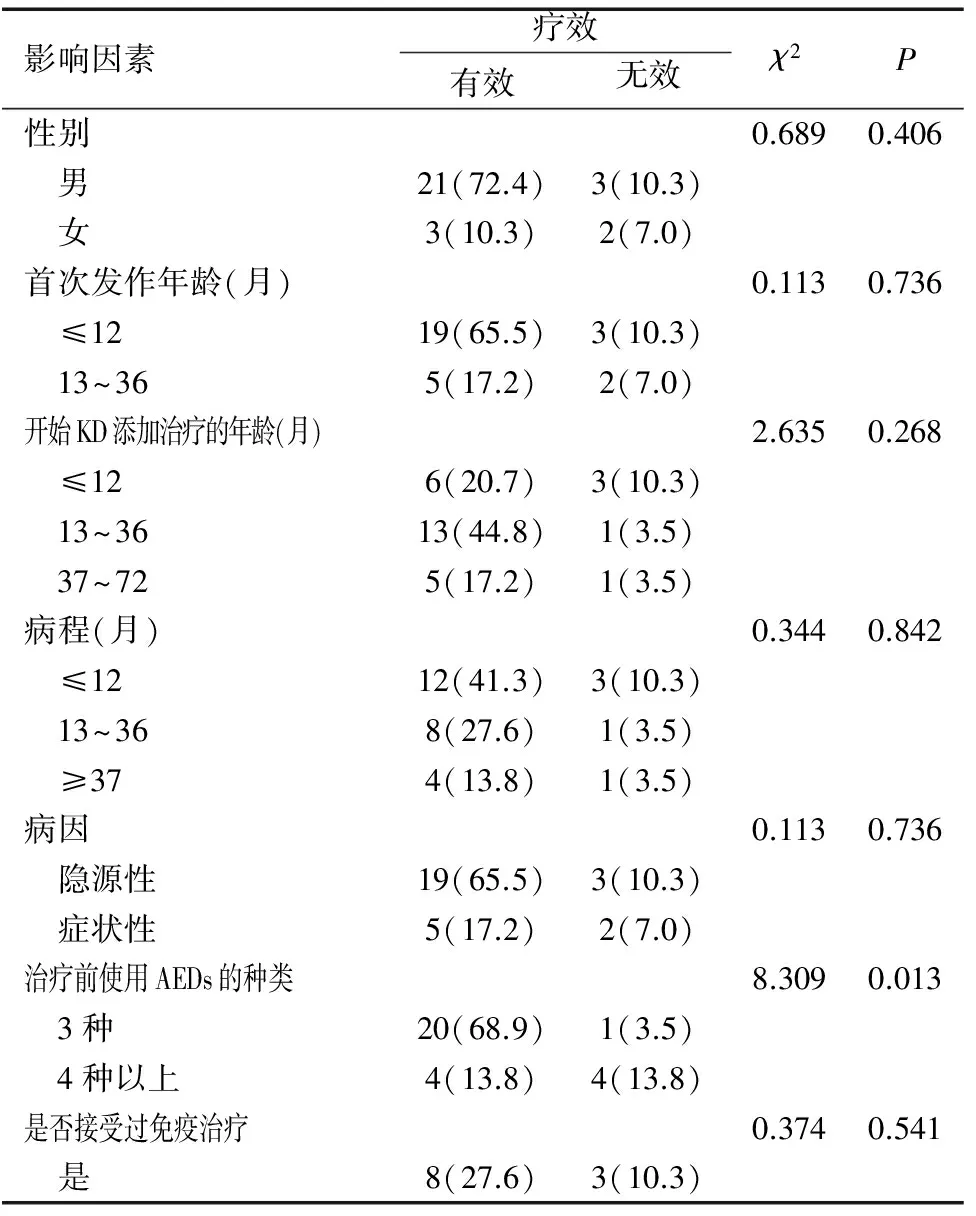
Table 2 Influence of various predictive factors on efficacy of KD[n(%)]
2.3不良反应情况
患儿在KD启动期及维持期出现的不良反应多为一过性或可治疗的消化道症状和代谢紊乱,包括睡眠增多、乏力、恶心呕吐、易激惹、腹泻、便秘、饥饿感、感染、高甘油三酯、高胆固醇、低血糖及肝功能异常等。本资料中10例患儿未出现明显不良反应,4例患儿因不良反应严重而终止治疗,其中1例严重拒食,1例频繁呕吐,2例合并严重感染,见表3。
表3 IS患儿添加KD治疗的不良反应(n)
Table 3 Adverse reactions of IS infants with KD therapy(n)

不良反应启动期(人次)维持期(人次)睡眠增多192乏力111恶心呕吐132腹泻103便秘84易激惹51感染31高甘油三脂42高胆固醇31低血糖31肝功能异常10
3讨论
3.1生酮饮食可以有效治疗婴儿痉挛
IS与大田原综合征、Lennox-Gastaut综合征同属于年龄依赖性癫痫性脑病,其发病平均年龄是6个月,发病率约为0.31‰,是婴儿期起病的难治性癫痫[7]。IS的患儿正处于大脑发育的关键时期,频繁的发作会导致癫痫性脑病的发生,使患儿出现精神运动发育倒退现象。因此,控制IS患儿的发作十分重要。目前,国内外对IS的一线治疗用药为促肾上腺皮质激素(ACTH)或强的松。但是美国神经学学院和儿童神经病学学会的报告认为ACTH可能对IS仅有短期疗效,长期治疗存在明显副作用,且没有足够证据用以推荐治疗的最佳剂量和持续时间[8]。近年来,国内外大量回顾性研究显示KD对难治性癫痫具有一定疗效。
目前大量的临床研究证实KD具有抗惊厥作用,其作用机制尚不十分清楚[9-10]。有研究发现γ-氨基丁酸A型受体功能的转化可能是癫痫发病机制的重要环节之一,KD可能通过修饰阳离子-氯离子协同转运体进而调节GABAa受体的兴奋性来控制癫痫发作[11]。2008年美国一项回顾性病例对照研究显示KD治疗IS安全、有效,KD治疗可终止2/3患儿的痉挛发作,其痉挛复发率和治疗不良反应均低于ACTH[12]。已有研究提出添加KD治疗后有超过50%的患儿痉挛发作得到缓解,6个月发作控制在64%,1~2年后发作控制达77%[13]。本研究中36例IS患儿添加KD治疗观察6个月,癫痫发作完全控制者占19.4%,达Ⅱ级、Ⅲ级疗效者分别为27.8%、19.4%,总体有效率达66.7%,证实国内KD治疗IS稍高于国外报道的疗效,提示KD可作为IS治疗的新方法。有研究证实小婴儿可耐受KD治疗,经过3个月的坚持治疗,部分IS患儿可完全治愈[14]。
3.2影响生酮饮食保留率的因素
国外研究发现不经过禁食,由正常饮食逐渐过渡为KD的治疗方案较经典KD方案更易使患儿及其家长接受,更易于KD治疗的开展[1,15]。本课题组另一项研究显示:选用经典KD疗法,1、3、6个月的保留率分别为50.0%、52.8%、47.2%[16]。本研究中部分年龄小、营养状况欠佳的患儿并不是通过禁食,而是逐渐缓慢引入KD,KD维持治疗1、3和6个月的保留率分别是91.7%、88.95和80.6%,提示通过非经典的KD疗法,可减少患儿出现严重饥饿、低血糖等现象的发生,从而增加KD治疗的依从性。
3.3影响生酮饮食临床疗效的因素
影响KD临床疗效的因素可能包括:病因、癫痫发作分型、脑电图特点、既往治疗经历等多个方面。Lee等[17]认为隐源性癫痫患儿对KD治疗的反应较好,且发病年龄越大反应越好。Walker等[18]及Than等[19]研究表明,患儿性别、起病年龄、KD治疗开始年龄、病因、体质量指数、KD治疗前应用AEDs的种类及KD饮食参数与临床疗效均无明显关系,而不同癫痫发作分型及脑电图特点在KD疗效上有一定差异。有研究指出KD治疗对Doose综合征、Dravet综合征、IS、Landau-Kleffner综合征均有一定疗效,除复杂局灶性发作对KD的反应较差外,其他发作形式均反应良好,特别是痉挛发作[19-22]。本研究结果显示,IS患儿性别、首次发作年龄、开始治疗的年龄、病因、病程及是否使用免疫治疗均对KD添加治疗的疗效无明显影响;KD前使用AEDs种类越少的成功率越高,其原因可能是IS患儿使用AEDs种类越多,常提示治疗难度越大,预后越差,进而对KD的反应可能也会越差。
3.4生酮饮食治疗的不良反应
KD治疗的不良反应在启动期及维持期不尽相同。启动期不良反应主要包括短期的脱水、代谢异常(低血糖、高脂血症、高胆固醇血症、低蛋白血症、高尿酸血症、电解质紊乱及代谢性酸中毒)、血尿、烦躁、嗜睡、感染倾向、溶血性贫血、急性胰腺炎等;维持期的不良反应主要是进行性的骨量减少、血脂异常、皮肤干燥、头发稀疏、心肌病及缺铁性贫血等[23-24]。本研究36例患儿中有26例患儿在整个KD期间出现了程度不一的不良反应,启动期不良反应主要为嗜睡、恶心、呕吐及乏力,维持期不良反应主要是便秘、腹泻;但是,随着疗程的延长,患儿对生酮食物的不良反应大多逐渐减少、减轻或消失,仅有4例患儿因不良反应而中止KD治疗。由于KD引发的不良反应在一定时间内会对患儿的健康造成影响,从而在一定程度上造成依从性低。因此,在KD治疗的整个过程中都需要加强对患儿不良反应的监测,通过不断改良KD的饮食方案以降低不良反应的发生,保障KD顺利进行。
本研究证实KD作为IS的添加治疗,其有效率较高。KD治疗保留率的影响与KD的疗效、家长的依从性及不良反应等有关。KD治疗过程中出现的不良反应一般轻微且多逐渐消退。因此,KD可作为AEDs药物治疗IS疗效不佳时的有效添加治疗方案。但是,KD治疗的具体方案、长期不良反应、群体依从性等方面仍需大样本病例、多中心医疗机构和前瞻性研究设计进一步观察和探讨。
[1]Kim J A, Yoon J R, Lee E J,etal.Efficacy of the classic ketogenic and the modified Atkins diets in refractory childhood epilepsy[J].Epilepsia,2016,57(1):51-58.
[2]Ito S, Oguni H.Ketogenic diet for intractable childhood epilepsy; as an early option as well as a last resort[J].Brain Nerve,2011,63(4):393-400.
[3]Nelson G R.Management of infantile spasms[J].Transl Pediatr,2015,4(4):260-270.
[4]Lux A L.Latest American and European updates on infantile spasms[J].Curr Neurol Neurosci Rep,2013,13(3):334.
[5]Winesett S P,Bessone S K,Kossoff E H.The ketogenic diet in pharmacoresistant childhood epilepsy[J].Expert Rev Neurother,2015,15(6):621-628.
[6]Groleau V,Schall J I,Stallings V A,etal.Long-term impact of the ketogenic diet on growth and resting energy expenditure in children with intractable epilepsy[J].Dev Med Child Neurol,2014,56(9):898-904.
[7]Hrachovy R A,Frost J D Jr.Infantile spasms[J].Handb Clin Neurol,2013,111:611-618.
[8]Mytinger J R, Weber A, Heyer G L.The response to ACTH is determined early in the treatment of infantile spasms[J].Epileptic Disord,2015,17(1): 52-57.
[9]Ashrafi M R, Hosseini S A, Zamani G R,etal.The efficacy of the ketogenic diet in infants and young children with refractory epilepsies using a formula-based powder[J].Acta Neurol Belg,2016,[Epub ahead of print].
[10]Kawamura M J, Ruskin D N, Masino S A.Metabolic therapy for temporal lobe epilepsy in a dish: investigating mechanisms of ketogenic diet using electrophysiological recordings in hippocampal slices[J].Front Mol Neurosci,2016,9:112.
[11]Rossetti A O,Milligan T A,Vulliemoz S,etal.A randomized trial for the treatment of refractory status epilepticus[J].Neurocrit Care,2011,14(1):4-10.
[12]Kossoff E H, Hedderick E F, Turner Z,etal.A case-control evaluation of the ketogenic diet versus ACTH for new-onset infantile spasms[J].Epilepsia,2008,49(9):1504-1509.
[13]Hong A M, Turner Z, Hamdy R F,etal.Infantile spasms treated with the ketogenic diet:prospective single-center experience in 104 consecutive infants[J].Epilepsia,2010,51(8):1403-1407.
[14]Pires M E,Ilea A,Bourel E,etal.Ketogenic diet for infantile spasms refractory to first-line treatments:an open prospective study[J].Epilepsy Res,2013,105(1-2):189-194.
[15]Kossoff E H,Hartman A L.Ketogenic diets:new advances for metabolism-based therapies[J].Curr Opin Neurol,2012,25(2):173-178.
[16]李丹,杨琳,黄绍平,等.生酮饮食添加治疗难治性癫痫长期有效率、保留率分析及不良反应监测[J].中华实用儿科临床杂志,2014,29(22):1737-1741.
[17]Lee J,Lee J H,Yu H J,etal.Prognostic factors of infantile spasms:role of treatment options including a ketogenic diet[J].Brain Dev,2013,35(8):821-826.
[18]Walker I,Said R R.Predictors of ketogenic diet efficacy in children based on the electroencephalogram(EEG)[J].J Child Neurol,2015,30(10):1270-1274.
[19]Than K D, Kossoff E H, Rubenstein J E,etal.Can you predict an immediate, complete, and sustained response to the ketogenic diet?[J].Epilepsia,2005,46(4):580-582.
[20]Nangia S,Caraballo R H,Kang H C,etal.Is the ketogenic diet effective in specific epilepsy syndromes?[J].Epilepsy Res,2012,100(3):252-257.
[21]Wirrell E C.Treatment of Dravet syndrome[J].Can J Neurol Sci,2016,43(Suppl 3):S13-S18.
[22]Vehmeijer F O, van der Louw E J, Arts W F,etal.Can we predict efficacy of the ketogenic diet in children with refractory epilepsy?[J].Eur J Paediatr Neurol,2015,19(6):701-705.
[23]Lima P A,Sampaio L P,Damasceno N R.Neurobiochemical mechanisms of a ketogenic diet in refractory epilepsy[J].Clinics (Sao Paulo),2014,69(10):699-705.
[24]Halevy A,Peleg-weiss L,Cohen R,etal.An update on the ketogenic diet, 2012[J].Rambam Maimonides Med J,2012,3(1):e0005.
[专业责任编辑: 周戬平]
Clinical efficiency of Ketogenic diet on infantile spasm
SONG Ting-ting, HUANG Shao-ping, YANG Lin, WANG Xue-ying, JIANG Yong-sheng, LIU Yu,LI Dan
(DepartmentofPediatrics,SecondAffiliatedHospitalofXi’anJiaotongUniversity,ShaanxiXi’an710004,China)
Objective To provide effective reference for clinical application of ketogenic diet (KD) in the treatment of infantile spasm (IS) by observing the curative effect and adverse reactions of KD as well as the factors that may affect the curative effect of KD. Methods Clinical data of 36 cases of IS accepting KD treatment in the Second Affiliated Hospital of Xi’an Jiaotong University from December 2011 to October 2015 were screened to compare the difference in KD effect among forecast factor groups and to evaluate the curative effect, retention rate and adverse reactions of KD. Results The retention rates of KD were 91.7%, 88.9% and 80.6%, respectively after treatment for 1 month, 3 months and 6 months. The effective rate of KD for IS was 66.7%. Because of poor control and even increasing seizures, cases terminating KD accounted for 57.1%. The less types of AEDs administration before KD, the higher the efficiency of adding KD (χ2=8.309,P=0.013<0.05). Conclusion KD is efficient and safe as additional therapy for patients with IS. The efficacy of KD has a certain impact on retention rate of KD treatment. The types of antiepileptic drugs maybe predict the efficiency of KD.
ketogenie diet (KD);infantile spasms (IS);effective rate;retention rate;adverse reactions
2016-08-05
2012年西安交通大学第二附属医院科研基金青年资助项目[YJ(QN)201213]
宋婷婷(1987-),女,住院医生,硕士研究生,主要从事小儿神经系统疾病的研究。
李 丹,副主任医师。
10.3969/j.issn.1673-5293.2017.02.021
R725
A
1673-5293(2017)02-0163-04
