酸碱预处理后酶解提升丹参药渣中丹参酮类成分的提取效率研究
2017-05-17戴新新沈飞宿树兰张森郭盛江曙
戴新新+沈飞+宿树兰+张森+郭盛+江曙+钱大玮+段金廒
[摘要]通过酸碱预处理丹参药渣,并利用纤维素酶降解,比较不同处理方法对丹参酮类成分提取效率的影响,以期为丹参药渣中丹参酮类成分的开发利用提供科学依据。结果表明,未经酸碱预处理的丹参药渣中,当酶c浓度为6U·mL-1,酶解4.5d时可使大部分纤维素降解,所得葡萄糖质量分数最高为59.74mg·g-1。对不同预处理方法评价,发现碱预处理.纤维素酶c降解后的效果最佳,葡萄糖质量分数达119.50 mg·g-1,相同浓度纤维素酶c酶解的酸预处理药渣次之。丹参酮的提取量经酶液降解后,与常规非酶法处理相比,丹参酮ⅡA提取量提高了82.54%,质量分数达2.451 mg·g-1;丹参酮Ⅰ提取量提高了81.82%,质量分数达2.373mg·g-1;隐丹参酮提取量提高了64.4%,质量分数达1.080mg·g-1;二氢丹参酮Ⅰ提取量提高了61.3%,质量分数达0.6012mg·g-1。通过酸碱预处理与纤维素酶降解相结合的方法可有效提高丹参药渣中丹参酮类成分的提取效率,该方法具有可操作性和实用性,有利于提升丹参药渣中丹参酮类资源性化学物质的利用效率。
[关键词]丹参药渣;丹参酮;酸碱预处理;酶解
丹参为唇形科鼠尾草属植物丹参Salvia miltior-rhiza Bge的干燥根和根茎,主产于山东、河北、安徽、河南等地,始载于《神农本草经》,具有活血祛瘀、通经止痛、清心除烦、凉血消痈功效。用于瘀血闭阻所致的胸痹及中风、冠心病、心绞痛、心肌梗塞等症的治疗。丹参酮(tanshinone)是丹参中脂溶性松香烷型二萜类化合物,具有广泛的药理作用和临床应用价值,受到医药学家的高度关注。目前,丹参类注射液制备生产过程主要采用水提醇沉工艺,致使脂溶性的丹参酮类成分残留于药渣中,未得到充分利用导致丹参资源性化学物质的浪费和资源利用效率低,同时造成环境污染。
此外,丹参药渣中富含纤维素类、半纤维素类以及木质素类成分,如能将纤维类物质转化降解成为糖类物质,既可提升丹参药渣中丹参酮类成分的提取效率,又可将其进行生物转化开发动物饲料、肥料等,对于实现丹参资源的多途径、多层次综合利用具有重大的现实意义和应用价值。细胞壁是阻碍代谢产物溶出的主要因素,因此,采用纤维素酶对细胞壁进行降解,可在平衡生产成本和提取效果的基础上,确定一套温和、环保、节能的丹参酮提取工艺。
本文在前期研究基础上,采用纤维素酶降解的方法对丹红注射液生产过程中产生的丹参药渣进行预处理后,提取丹参酮类成分,以期提升丹参酮类成分的提取效率,从而为丹参药渣的资源化利用提供科学依据。
1材料
美国Waters 2695高效液相色谱系统,Waters2998 PDA检测器,Waters 2424型ELSD检测器(Waters公司),Empower数据管理系统,FW80型高速万能粉碎机(天津),DHG-9023A型电热恒温鼓风干燥箱(上海),TDL-80-2B型离心机(上海),KH-500型超声波清洗仪器(昆山),ML204/02、MS-205电子天平(上海),IS-RDV1型恒温振荡器(美国精骐),Perkin Elmer酶标仪(Enspire公司)。
甲醇、甲酸、柠檬酸、柠檬酸钠、乙酸、乙酸钠、氢氧化钠、3,5.二硝基水杨酸、酒石酸钾钠、亚硫酸钠、苯酚、羟甲基纤维素钠、硫酸均为分析纯,乙腈(美国TEDIA公司)为色谱纯试剂。葡萄糖(中国食品药品检定研究院)、二氢丹参酮I(南京春秋生物工程有限公司,批号20140516)、丹参酮I(中国食品药品检定研究院,批号110867-200406)、隐丹参酮(中国食品药品检定研究院,批号110852300806)、丹参酮ⅡA(中國食品药品检定研究院,批号110766-200619),纤维素酶分别为自制酶液(纤维素酶A)和国产纤维素酶(纤维素酶B)以及购自SIG-MA公司的纤维素酶(纤维素酶C)。水为实验室自制超纯水。丹参药材与丹参固体废弃物在2016年3月收集于菏泽步长制药有限公司,经南京中医药大学段金廒教授鉴定为丹红注射液生产过程中产生的丹参固体废弃物。
2方法
2.1纤维素酶活力的测定
2.1.1试剂的配制3,5-二硝基水杨酸(DNS)显色剂的配制:10g氢氧化钠,10g3,5.二硝基水杨酸,200g酒石酸钾钠,0.5g亚硫酸钠,2g苯酚,纯水定容至1000mL,避光保存,1周后可用。
试剂配制:0.5%羧甲基纤维素钠水溶液(CMC),0.1mol·L-1pH4.5的乙酸.乙酸钠缓冲液,1.05 g·L-1的葡萄糖溶液,0.1mol·L-1pH4.8的柠檬酸.柠檬酸钠缓冲液。
酶液的配制:分别准确称取纤维素酶A,B,C各2g,精确至0.0001g,加入50mL的柠檬酸盐缓冲液,从中取出1mL再定容至100mL,(以保证稀释后的纤维素酶活力应在0.04~0.08 U·mL-1)待测。
2.1.2酶活力葡萄糖标准曲线的绘制
分别吸取0,0.2,0.4,0.6,0.8,1.0 mL的葡萄糖于6支试管中,用超纯水稀释至1mL,加DNS显色剂3mL,摇匀后沸水浴中煮沸10Min,冷却,定容至10mL,充分混匀。在520nm波长下各管溶液的吸光度并记录结果。以葡萄糖质量浓度(g·L-1)为横坐标,以对应的吸光度为纵坐标,绘制出葡萄糖标准曲线。
2.1.3纤维素酶活力测定
取2.1.1项下酶液各1mL,分别加入0.5%CMC 3mL,在50℃水浴中酶解30min,沸水浴10min使酶失活,得到酶解液,冷却后加入3mL显色液,沸水浴10min,冷却加水定容至10mL,在550nm处测定吸光度。纤维素酶单位的定义:在50℃,pH 7.0的条件下,每30min分解羧甲基纤维素钠释放1mg葡萄糖所需要的酶量为1个酶活力单位U。纤维素酶活力的计算公式见文献。
2.1.4空白对照的测定
取1mL酶液,沸水浴5min,冷却后加入0.5%CMC 3mL,与样品同时放入50℃水浴30min。其他操作同2.1.3项下进行。
2.2酶解纤维素产生葡萄糖的测定方法
2.2.1丹参药渣预处理将水提取后的丹参药渣在60℃温度下烘干,取干燥药渣打粉,过20目筛,备用。
2.2.2丹参药渣酸、碱预处理方法
采用4%硫酸与丹参药渣10:1(mL·g-1)混合,搅拌均匀后,90℃水浴1.5 h;采用10%氢氧化钠溶液与丹参药渣6:1(mL·g-1)混合,搅拌均匀后,90℃水浴1.5h。将酸、碱预处理后的丹参药渣用蒸馏水洗涤至中性,然后在60℃下烘干,研磨至均匀的颗粒大小,备用。
2.2.3样品的配制将纤维素酶溶解于柠檬酸.柠檬酸钠缓冲液中,药渣与乙酸.乙酸钠缓冲溶液混合,根据相应条件加入不同量的酶液,置于50℃,180 r·min-1的恒温摇床内进行酶解,定时取样测定。
2.2.4酶浓度的影响加入一定量的酶液,将反应体系中底物酶的浓度配制成1.25,2.5,3.75,5,7.25 U·mL-1。反应一定时间后,取出加入3mLDNS,沸水浴5min,终止反应,然后放入冷水中,在8000 r·min-1下离心10min,取上清液,过0.22μm的滤膜,测定葡萄糖的含量。
2.2.5酶解反應时间的影响加入一定量的酶液,反应时间分别为36,60,84,108,132,156 h取出加入3 mL DNS,沸水浴5min,终止反应,然后放入冷水中,在8 000 r·min-1下离心10min,取上清液,过0.22μm的滤膜,测定葡萄糖的含量。
2.2.6葡萄糖测定的色谱条件检测器:EISD,色谱柱:XBridge Amide(4.6mmx150mm,3.5μm),柱温30℃,流速0.8mL·min-1,进样量10μL,以乙腈(A)-0.1%甲酸水(B)80:20为流动相,等度洗脱,增益10,喷雾器加热,动力60%,漂移管温度80℃,气体压力40 psi(1 psi=6.89 kPa)。
2.3丹参酮类化学成分分析方法
2.3.1对照品溶液的制备分别精密称取二氢月参酮Ⅰ、丹参酮Ⅰ、隐丹参酮、丹参酮ⅡA对照品适量,用甲醇配成质量浓度分别为0.024 8,0.152,0.209,0.126 g·L-1的对照品储备液。
2.3.2样品的配制取经过纤维素酶降解后的药渣和未经过降解的药渣,精密加入甲醇溶液30mL,精密称定,浸泡16h后在30℃,100kHz下超声30min,称量补足失重,过滤,滤液在8000r·min-1。下离心10min,取上清液,过0.22μm的滤膜,进样。
2.3.3色谱条件色谱柱BDS HYPERSIL C18(4.6mmX250 mm,5μm),柱温30℃,流速1mL·min-1,进样量10μL,以乙腈(A)-0.1%甲酸水(B)为流动相,梯度洗脱(0~8min,15%A;8~9min,15%~28%A;9~20min,28%A;20~22min,28%~54%A;22~28min,54%A;37~38min,54%~60%A;38~43min,60%~68%A;43~48min,68%~70%A;48~52min,70%~15%A),色谱图见图1。
2.3.4线性范围的考察取适量二氢丹参酮I、丹参酮I、隐丹参酮、丹参酮ⅡA对照品,分别进样1,2,5,10,20μL;按2.3.3色谱条件进样记录峰面积积分值。以峰面积积分值y为纵坐标,进样浓度x为横坐标,得二氢丹参酮I、丹参酮I、隐丹参酮、丹参酮ⅡA的回归方程。
2.3.5重复性试验按照上述方法制备6份样品溶液,按上述色谱条件测定二氢丹参酮I、丹参酮I、隐丹参酮、丹参酮Ⅱ。的RSD。
2.3.6 精密度试验精密吸取对照品贮备液10ixL,连续进样6次,测定二氢丹参酮I、丹参酮I、隐丹参酮、丹参酮ⅡA色谱峰峰面积,计算得RSD。
2.3.7稳定性试验取同一批对照品溶液,每隔4h测定1次,测定6次,最终得到二氢丹参酮I、丹参酮I、隐丹参酮、丹参酮ⅡA的RSD。
2.3.8回收率试验
精密称定已知质量分数的样品3份,加入适量对照品,混匀,按照2.3.3项方法处理,测定有效成分的含量,计算加样回收率。
2.4样品分析测定
精密吸取样品溶液10μL,注入高效液相色谱仪,计算样品中二氢丹参酮I、丹参酮I、隐丹参酮、丹参酮ⅡA的含量。
3结果与分析
3.1纤维素酶活力的测定
3.1.1酶活力葡萄糖标准曲线的绘制
以光密度为纵坐标,葡萄糖质量浓度(g·L-1)为横坐标,得到葡萄糖标曲为Y=1.7224X-0.000 3,R2=0.9940,线性范围210~1050μg。
3.1.2样品酶活力测定通过检测与计算,纤维素酶A的酶活力为1.03 U·mg-1,纤维素酶B为1.35U·mL-1,纤维素酶C的酶活力为50.02U·mL-1。
3.2纤维素降解后葡萄糖含量测定
3.2.1葡萄糖标准曲线的绘制
以HPLC-ELSD方法检测到的峰面积取对数后为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线,对应的回归方程为Y=0.451 8X+5.910 9,R2=0.990 1。线性范围1.05~21.00μg。此标准曲线线性关系良好,可用于葡萄糖的测定,色谱图见图2。
3.2.2酶的影响
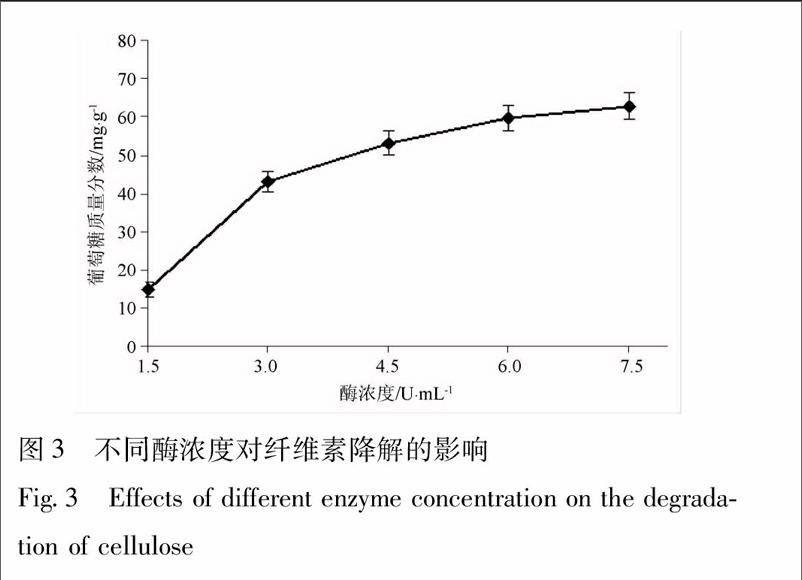
通过不同酶浓度对丹参药渣进行酶解处理,所用酶为纤维素酶C,当底物酶浓度升高时,葡萄糖的含量也随着升高,酶在1.5~3U·mL-1时降解得到葡萄糖为14.91~43.19 mg·g-1。当酶为4.5 U·mL-1时,葡萄糖的含量趋于平稳,当酶为6 U·mL-1时,葡萄糖为59.74mg·g-1,由此可知,最适宜酶底物为6 U·mL-1,见图3。
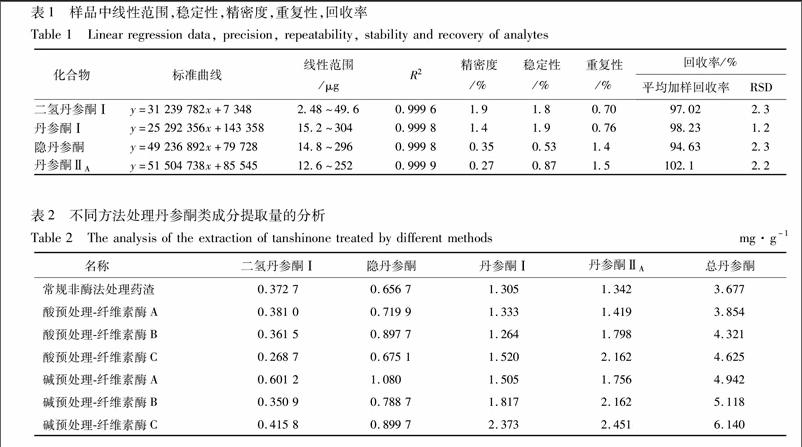
3.2.3酶解时间对纤维素降解率和葡萄糖浓度的影响纤维素酶C与底物的作用时间过长或过短都不能准确反映样品的酶活力大小。酶解时间对纤维素降解的影响见图4,酶浓度为6U·mL-1,酶解1.5d可使大部分纤维素降解,所得葡萄糖质量分数为59.74mg·g-1。酶解4.5~5.5 d时葡萄糖为74.60~79.60 mg·g-1,且趋于稳定,因此,可选择4.5d为最佳酶解反应时间。
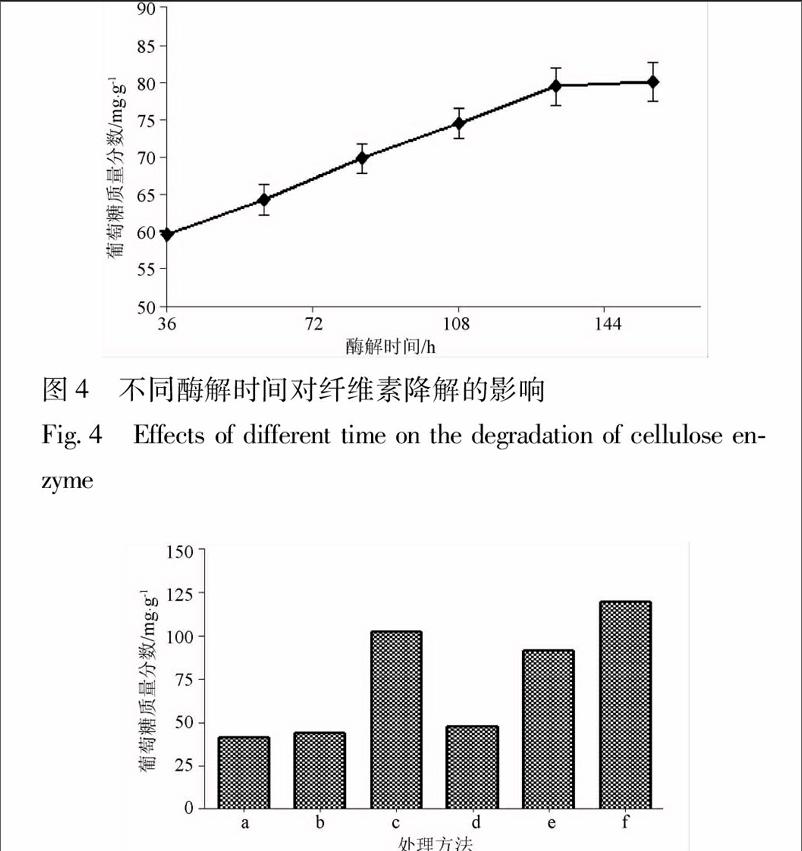
3.2.4不同酶液处理对纤维素降解的影响将纤维素酶A,B,C分别加入到酸预处理和碱预处理的丹参药渣中,降解后葡萄糖的含量见图5,由图5可知,碱预处理.纤维素酶C降解后的效果最佳,葡萄糖质量分数达119.50mg·g-1,相同浓度纤维素酶C酶解的酸预处理药渣次之。
3.3方法学考察结果
利用HPLC-PDA方法建立了二氢丹参酮I、丹参酮I、隐丹参酮、丹参酮Ⅱ4个化合物含量测定的标准曲线,并进行了稳定性、重复性、及精密度等方法学考察。其所测定的结果见表1,所测化合物的方法学考察其RSD均小于2%,回收率在94.63%~102.1%,RSD小于2.3%。以上结果表明本实验可以用于样品中这4个丹参酮成分的检测。
3.4不同预处理对丹参酮类成分的提取量的影响
与常规非酶法处理药渣相比,丹参酮的提取量在通过酶液降解后,丹参酮Ⅱ。提取量提高可达82.54%,质量分数达2.451mg·g-1;丹参酮I提取量提高可达81.82%,质量分数达2.373mg·g-1;隐丹参酮提取量提高可达64.4%,质量分数达1.080mg·g-1;二氢丹参酮I提取量提高可达61.3%,质量分数达0.601 2 mg·g-1,见表2。通过比较不同处理方式总丹参酮提取效率可见,通过碱预处理.纤维素酶C降解后所得总丹参酮提取效率最高,酸预处理中纤维素酶C降解效果较佳,这与3.2.3项下纤维素酶降解纤维素的结果相一致。4讨论
现代研究表明,丹参酮类成分具有抗氧化、心脑血管药理作用、抗菌消炎作用以及肝保护等多种生物活性,尤其在抗肿瘤方面尤为突出,临床上广泛用于治疗心脑血管疾病、感染性疾病以及糖尿病等的治疗。由于丹参相关的制剂的使用量逐年增加,丹参酮和高纯度丹参酮的需求量每年大幅增加。但技术力量较为薄弱,工艺较为陈旧,产品质量不稳定,生产成本高,经济效益低,环境污染严重等诸多因素,造成丹参资源的极大浪费。
目前,丹参酮类的提取方法主要有非离子表面活性剂辅助提取、超临界CO2,萃取法、超顺磁性吸附剂提取、超声提取法、微波提取法、超高压辅助提取等。上述提取方法均可不同程度的提高丹参酮的提取率,但酶解法可加速有效成分的释放,还可将提取物中的杂质分解去除,也可促进某些极性低的脂溶成分转化为易溶于水的糖苷类成分而利于提取,在中药行业中的应用前景广阔。
本实验分析和比较了DNS法测定3种纤维素酶活力(自制酶液、国产纤维素酶以及SIGMA纤维素酶),结果显示,SIGMA纤维素酶酶活力最佳;在前期研究的基础上,对常规性的影响酶解反应因素,酶浓度和酶解反应时间等因素进行了单因素考察,确定了酶解的最适条件。并在此条件下,利用纤维素酶酶解丹参药渣后提取丹参酮类成分,此方法操作简便,适应性强。因此,提高丹参酮类成分的提取效率,可考虑将酶提取法与其他方法联用,例如采用酸碱预处理后酶解或酶法提取后再用超声提取,可大大提升丹参酮类成分的提取效率,獲得纯度较高的提取物,且可减少提取过程中热不稳定成分的损失。
