基于THP-1细胞的皮肤致敏体外检测方法
2017-05-17程树军谈伟君
陈 彧,喻 欢,秦 瑶,程树军,谈伟君
(1. 广东出入境检验检疫局技术中心,广东 广州 510623;2. 广东药科大学,广东 广州;3. 广州市华代生物科技有限公司,广东 广州 510623)
技术方法
基于THP-1细胞的皮肤致敏体外检测方法
陈 彧1,2,喻 欢1,3,秦 瑶3,程树军1,谈伟君2
(1. 广东出入境检验检疫局技术中心,广东 广州 510623;2. 广东药科大学,广东 广州;3. 广州市华代生物科技有限公司,广东 广州 510623)
目的 建立基于人细胞系的替代皮肤致敏动物实验的体外检测方法(h-CLAT),并对化学品、日用化学产品和化妆品植物原料进行皮肤致敏性检测。方法 体外培养人急性单核细胞白血病细胞(THP-1),不同浓度受试物与细胞共孵育24 h,通过流式细胞仪检测细胞表面标志物CD86和CD54活化的差异,并对11种已知皮肤致敏化学物质和9种未知样品进行皮肤致敏性预测。同时对未知样品进行豚鼠局部封闭涂皮法验证。结果 使用h-CLAT方法准确区分了11种参考物质的皮肤致敏性,9种受试样品中,7种样品被判断为阴性皮肤致敏物质,2种植物提取物被确认为皮肤致敏疑似物质。9种样品的预测结果与动物实验一致。结论 h-CLAT体外检测方法可以代替部分动物测试,用于可溶性皮肤致敏物质的预测。
皮肤致敏;THP-1细胞;h-CLAT;替代方法;接触性过敏性皮类;致敏化学物;化妆品终产品
接触性过敏性皮炎是一种由外源物质引发的皮肤IV型过敏反应,皮肤致敏试验是化学品分类标识的要求,也是化妆品、日用化学品、医疗器械等皮肤接触产品毒性评价的重要内容。传统动物实验使用豚鼠最大化法或Buehler法测试,优化后的小鼠局部淋巴结实验(LLNA)以淋巴结T细胞增生定量测定代替皮肤临床症状观察,提高了动物福利标准[1,2]。在化妆品非动物测试法规的影响和有害结局通路(AOP)测试概念的指导下,许多体外皮肤致敏筛查实验逐步得到开发和被法规认可。近1年来,列入世界经济合作和发展组织( OECD)测试指南TG442的皮肤致敏替代方法包括直接多肽结合试验(DPRA)、KeratinosenTM法和人细胞活化实验(h-CLAT)[3-5]。本研究通过建立h-CLAT方法,并将其应用于市售商品的皮肤致敏性检测和评价,为下一步建立替代方法的组合策略提供数据支持。
1 材料和方法
1.1 材料
1.1.1 细胞来源和培养方法:人急性单核细胞白血病细胞(THP-1)由安利(上海)研发中心馈赠(ATCC号:TIB-202)。采用含25 mmol/L HEPES、0.05 mmol/L β-巯基乙醇、10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基,于5% CO2,37℃细胞培养箱内常规培养。
1.1.2 细胞培养和检测试剂:RPMI1640培养基、胎牛血清、β-巯基乙醇(Gibco)、链霉素、青霉素、4-羟乙基哌嗪乙磺酸、二甲基亚砜(DMSO)和牛血清白蛋白(BSA)均购自Sigma公司;校准珠、球蛋白阻断剂、7-氨基放线菌素-D(7AAD)、FITC标记的小鼠单克隆CD86抗体、PE标记的小鼠单克隆CD54抗体、FITC标记的小鼠IgG1、PE标记的小鼠IgG1均购自BD公司。
1.1.3 实验动物及饲养:健康豚鼠190只,雌雄各半,清洁级,实验动物开始时体重(381±24)g,由广东省医学实验动物中心提供,生产许可证:SCXK(粤)2013-0002。动物实验在广东检验检疫技术中心进行,使用许可证为 SYXK(粤)2013-0086。
1.1.4 参考物质和测试样品:十二烷基磺酸钠(SLS)(CAS:151-21-3)、乳酸(CAS:50-21-5)、肉桂醇(CAS:104-54-1)、丁香酚(CAS:97-53-0)、柠檬醛(CAS:5392-40-5)、肉桂醛(CAS:104-55-2)、苯乙醛(CAS:122-78-1)、没食子酸丙酯(CAS:121-79-9)、马来酸酐(CAS:108-31-6)、苯醌(CAS:106-51-4)、二硝基氯苯(CAS:97-00-7)均购自Sigma公司;待测样品:松茸提取物、微乳卸妆液、当归提取物、黄芩提取物、人参果提取物、积雪草提取物、金缕梅提取物、马齿笕提取物和绿茶提取物由广州市华代生物科技有限公司体外实验室馈赠,根据受试物的特性选择生理盐水或DMSO作为受试物溶剂。
1.1.5 主要仪器:全波长酶标仪(Thermo Scientific 公司)、流式细胞仪(FACS Canto II,美国BD公司)、二氧化碳培养箱(德国Memmert公司)、高速离心机(Sigma公司)和自动细胞计数仪(广州商特仪器有限公司)。
1.2 方法
1.2.1 细胞培养和表面标志稳定性检测:复苏THP-1细胞转入25 cm2培养瓶中培养,显微镜下观察细胞状态,当细胞密度接近1×106个/mL时进行传代,每2~3 d常规换液传代1次,建议复苏后的THP-1细胞使用期限为2个月或不超过30代,同时每次实验以4~4.5 μg/mL DNCB和2 500~3 000 μg/mL乳酸进行表面标志稳定性检测。
1.2.2 化合物细胞毒性测定:吸取500 μL浓度为2×106个/mL的细胞悬液至24孔细胞培养板中,每孔添加500 μL受试物,每组受试物3个平行。每种受试物按照2倍稀释系数测试8个浓度,加有不同浓度受试物的培养板置于培养箱中孵育24 h。暴露结束后从24孔细胞培养板收集细胞分别移入1 mL EP管中,离心(250 r/min,5 min,4℃)收集细胞,用FACS缓冲液(PBS + 0.1%的BSA)清洗后再次离心收集细胞。每支EP管中添加100 μL染料(20 μL 7AAD + 80 μL FACS缓冲液),常温、暗室下当染色10 min。用FACS缓冲液清洗2次和使用500 μL FACS缓冲液重悬细胞后移入5 mL流式管中。一次流式进样约需10 000个细胞,计算IC50(使50%细胞活性抑制的受试物浓度)和CV75(使75%细胞存活受试物浓度)。
1.2.3 化合物暴露和细胞表面标志物测定:THP-1细胞如上述进行24孔铺板,CV75的浓度作为最高试验浓度,然后以1.2~1.8为系数稀释5个浓度。每次实验需要设置3组对照,分别为培养基对照、DMSO对照和DNCB阳性对照。添加相应浓度的受试物与细胞置于培养箱中共同孵育24 h。随后按照上述步骤离心收集细胞,将离心获得的细胞进行蛋白阻断。将上述细胞平均分配至4支1 mL的EP管中,每管中大约含有3×105个细胞。CD86(FITC-CD86抗体)和CD54(PE-CD54抗体),对应的同型对照FITC-IgG1和PE-IgG1,以及活率测试所用的7AAD分别根据推荐测试浓度进行配制,可根据实验具体情况对抗体进行梯度稀释,每支EP管添加50 μL含有抗体的FACS缓冲液,2-8℃环境和暗室条件下染色30 min,随后使用FACS缓冲液清洗2次,再用500 μL FACS缓冲液重悬细胞并移入5 mL流式管,使用流式细胞仪检测蛋白标志物。
1.2.4 豚鼠局部封闭涂皮法试验:具体实验操作参照2015版《化妆品安全技术规范》的皮肤变态反应试验。
1.2.5 结果分析:流式细胞检测得到相对荧光强度(relative fluorescence index, RFI),并计算有效作用浓度(effective concentration, EC),FITC-CD86使用EC150(当CD86的RFI达到150时受试物的最低有效浓度);PE-CD54使用EC200(当CD54的RFI达到200时受试物的最低有效浓度)。
计算EC150和EC200需分两种情况:
首先,当阳性值出现时,从最低浓度开始计算,满足阳性标准的第一个浓度设置为A浓度,随后根据下述原则选择下一个浓度为B浓度:第二个浓度的RFI值比第一个浓度的RFI值至少高10%,否则用第三个浓度的RFI值,直到符合大于10%的标准。

(2) 如果测试所得A浓度和B浓度的RFI值均大于150或200,那么公式为:

1.2.6 预测模型:每组化学物质至少重复两次实验。在细胞活率大于50%前提下,如果RFICD86≥150和/或RFICD54≥200,则该物质可判断为皮肤致敏阳性物;否则判断为阴性物质。另外,细胞在受试物各浓度作用下皆无细胞毒性情况下,都不满足上述的阳性结果判断,则可判断为皮肤致敏阴性物质。
2 结果
2.1 细胞培养
2.1.1 THP-1细胞培养情况:THP-1细胞培养如图1,细胞密度适中,部分呈现集中生长,形态一致,无过多碎片或折光差异较大的细胞集团,无特殊突起和触角,无贴壁舒展情况出现。经测试所用细胞平均倍增时间为37.89±3.93 h,在正常生长THP-1细胞倍增时间43 h±12 h的范围内。在细胞特性方面保证了实验的稳定可比性。
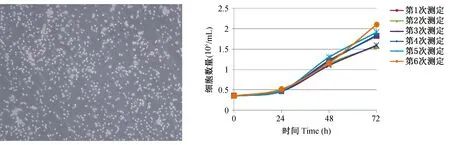
(左图:第5代细胞,40×;右图:细胞倍增曲线)图1 THP-1细胞培养及质控(Left: The fifth generation of cells, 40×; Right: Cell multiplication curves)Fig.1 THP-1 cell culture and quality control

受试物SamplesIC50(μg/mL)CV75(μg/mL)非致敏物(Non-sensitizer)十二烷基磺酸钠(SLS)80.13±3.4862.32±5.37乳酸(Lactate)3778.35±180.842901±150.17弱致敏物(Weaksensitizer)肉桂醇(Cinnamicalcohol)495.8±12.51358.8±14.61丁香酚(Eugenol)406.2±13.94305.9±14.18中等致敏物(Mildsensitizer)柠檬醛(Citral)44.24±2.8126.2±2.47肉桂醛(Cinnamaldehyde)26.5±4.8320.4±3.84苯乙醛(Phenylacetaldehyde)41.7±4.5120.2±5.18强致敏物(Strongsensitizer)没食子酸丙酯(Propylgallate)366.8±21.84124.25±10.51马来酸酐(Maleicanhydride)947.47±38.14651.24±30.81极强致敏物(Extremesensitizer)苯醌(Benzoquinone)8.3±1.59 5.7±1.56二硝基氯苯(DNCB)9.32±0.315.75±0.15样品(Unknownsamples)微乳卸妆液(mg/mL)(Microemulsionmakeupremover)3.31±0.45 1.3±1.07松茸提取物(mg/mL)(Tricholomamat-sutakeextract)554.2±20.07235.71±14.42当归提取物(vol.%)(Angelicaextract)38.16±7.4730.21±6.41黄芩提取物(vol.%)(ScutellariabaicalensisGeorgiextract)8.43±1.257.05±1.13人参果提取物(vol.%)(Ginsengfruitex-tract)24.31±4.5719.84±5.71积雪草提取物(vol.%)(Centellaasiaticaextract)87.18±15.7364.78±9.44金缕梅提取物(vol.%)(Witchhazelex-tract)250.77±36.81190.44±47.18马齿笕提取物(vol.%)(Purslaneherbex-tract)97.44±24.7880.87±22.41绿茶提取物(vol.%)(Greenteaextract)127.21±19.44110.34±19.87
2.2 受试物细胞毒性检测
11种化学品和样品的细胞毒性结果见表1。
2.3 CD54和CD86表达检测
2.3.1 标准物质的特征性指标结果:根据细胞毒性结果分别对11种标准物质暴露THP-1细胞后的表面标志物CD54和CD86的变化进行检测,结果如图2。细胞活率大于50%时,随着受试物浓度增加,细胞活率整体呈现递减趋势,不同化合物的CD54和CD86两条RFI曲线呈现不同规律。两个致敏阴性物质SLS和乳酸的RFI远远低于两条参考值标线。两种被LLNA划分为弱致敏性的丁香酚和肉桂醇,CD86和CD54两个值在某个浓度情况下都超过了临界值,没食子酸丙酯和马来酸酐这两种强致敏物并非两个指标都超过规定阈值。
2.3.2 阳性参考物质的最低有效作用浓度:表2显示9种皮肤致敏阳性参照物质引起THP-1细胞CD86和CD54表达时的最低有效作用浓度,表明化合物在该浓度下,可引起THP-1细胞表面标志物表达的显著性增加,并超出预测模型设定的EC150(CD86)和EC200(CD54)阈值。
2.3.3 未知样品检测:几种水溶性样品的细胞活性测试结果见表1,根据细胞毒性结果分别检测其暴露细胞后特征标志物的表达情况。结果如图3,微乳卸妆液、松茸提、人参果、积雪草、金缕梅、马齿笕和绿茶等7种提取物对应的CD86和CD54的RFI值没有超过限定阈值。当归提取物引起THP-1细胞的CD86(EC150=23.54±7.84%)和CD54(EC200=15.37±4.61%)两个指标的RFI都超过了限定阈值,黄芩提取物只引起THP-1细胞CD54(EC200=2.66±0.74%)的RFI高于阈值。根据判断标准,当归和黄芩提取物可能具有皮肤致敏性。在豚鼠局部封闭涂皮法试验(BT测试)中,采用0.2%(W/V)2,4-二硝基氯苯作为阳性参照物,生理盐水作为阴性参照物;受试物为9种植物提取物。在致敏后1 h和24 h,各组动物皮肤均未见明显红斑和水肿等过敏反应;激发给药后24 h,各组均未出现明显的皮肤过敏反应;激发给药后48 h,阳性对照组2只动物(2/10例)出现轻微红斑,1只动物(1/10例)出现中度红斑、轻度水肿,3只动物(3/10例)出现轻度红斑、轻度水肿;当归提取物组1只动物(1/20)出现轻微红斑,1只动物(1/20)出现中度水肿;黄芩提取物组2只动物(1/20)出现轻微红斑和轻度水肿;其它受试的植物提取物相应组别为阴性。
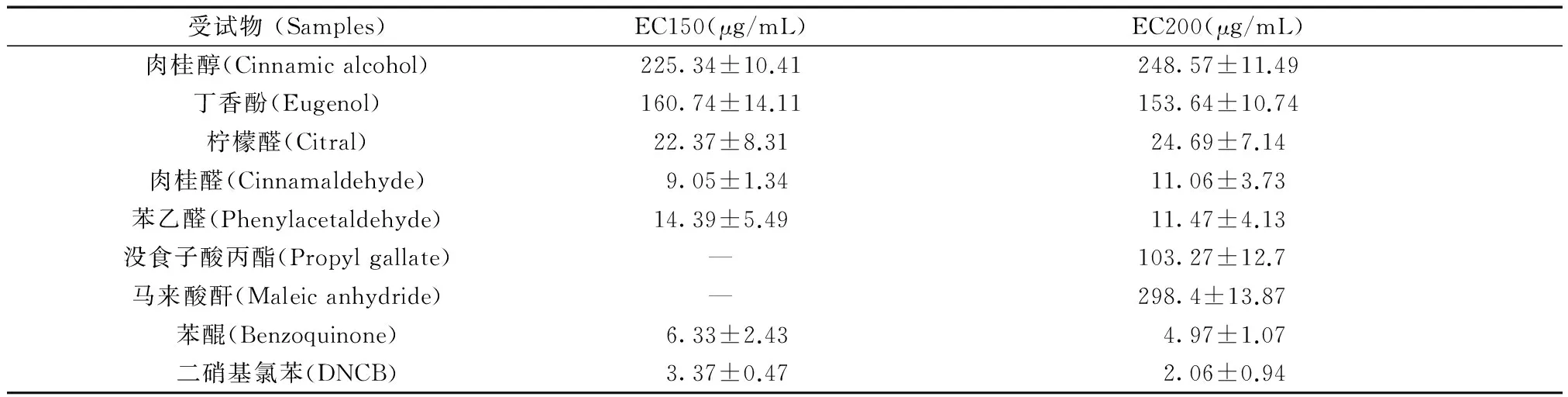
表2 阳性物质引起细胞标志物表达的有效浓度



图2 11种标准物质的检测结果Fig.2 Results of sensitization tested from 11 standard materials
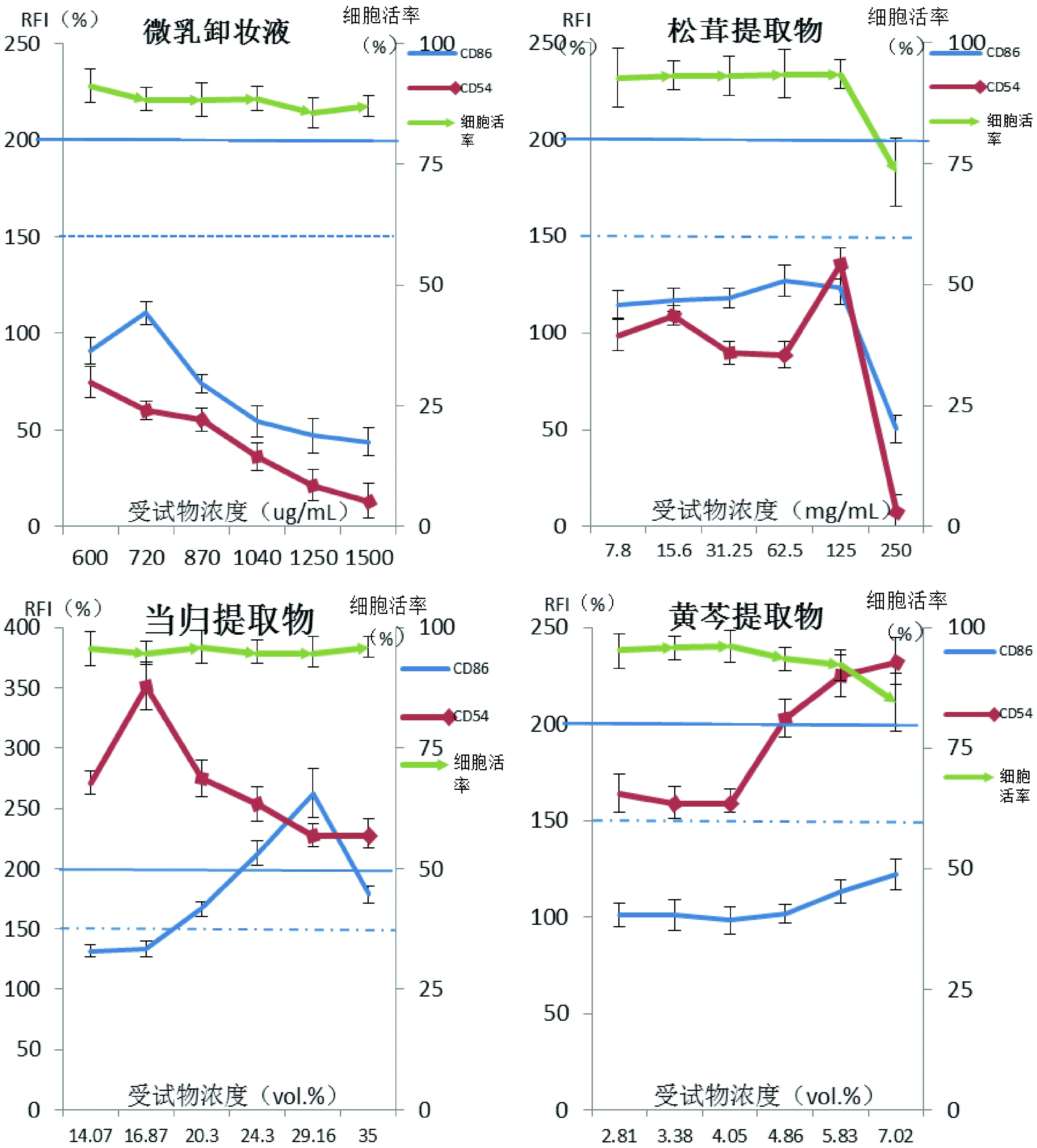
图3 4种样品细胞标志表达测定结果Fig.3 Results of sensitization from 4 samples
3 讨论
外源化合物引起的皮肤致敏是多细胞共同参与的复杂过程,其中朗格汉斯细胞起着承上启下的作用。从皮肤原代分离朗格汉斯细胞或从外周血分离树突状细胞都非常困难,且供体稳定性和重复性较差。THP-1细胞是一种来源于急性单核细胞性白血病患者的细胞系,具有类似于皮肤树突状细胞的标志。研究表明是体外细胞水平筛查致敏物质的理想模型[6-7]。
由于THP-1细胞容易在培养过程中转化成其他树突状细胞,其稳定性对于致敏物筛查非常关键,本研究采用DNCB和乳酸常规检测细胞表面标志物CD86和CD54,对细胞定期进行质控,减少因为细胞问题影响结果的稳定[8]。
本研究选择OECD指南442E方法研究中推荐的11种皮肤致敏标准物质,建立了基于THP-1细胞的皮肤致敏筛查方法[9],并将2种非致敏物质和9种致敏物质正确地区分开来。h-CLAT方法以CD86和CD54的表达变化为判定指标,研究表明,多数致敏物质可同时引起两种分子表达的变化,有一些化合物只引起其中一种标志物变化。本研究同样证实,2种强致敏物马来酸酐和没食子酸丙酯,只引起了CD54表达的增加,而CD86的表达未达到阳性阈值。CD86为共刺激分子,CD54为细胞粘附分子,在诱发机制上存在差异,不同类型的致敏化合物可能诱导不同机制的细胞分子表达差异。如果只以CD54的分子表达差异为判定依据(如利用U937细胞建立的U-SENS方法),则部分致敏物质的特征可能会预测不到。
h-CLAT方法虽然能计算出受试物的最低有效作用浓度EC150(CD86)和EC200(CD54),但尚不能以此作为评判受试物质皮肤致敏潜力的依据,还需要其它数据支持,如正辛醇-水分配系数、巯基反应性、组织代谢过程模拟等。尤其是当测试物为混合物时,还应包括各个组份的成份、比例和溶剂等信息[10]。
本研究对未知致敏特性样品的细胞活化检测结果与动物实验结果一致,均显示当归提取物和黄芩提取物被认为存在可疑致敏成分。当归提取物主要活性成分为阿魏酸、藁本内脂、正丁烯酰内脂和烟酸等[11]。黄芩提取物的主要成份为黄芩苷,属于黄酮类化合物,本身具有抗炎和抗过敏的作用,据报道黄芩苷可能存在人群皮肤致敏性[12]。h-CLAT经过验证对于已知的单一化学物质的皮肤致敏预测性达到80%以上,当联合多种其他皮肤致敏检测方法后,相应的预测能力更加稳健[13]。同样地,针对复杂的化合物和植物提取物,相应的体外皮肤致敏检测方法需要进一步探索。本研究中9种植物提取物经过h-CLAT的检测,发现了两种受试物的致敏性,在植物提取物成分复杂和各个组分含量不明确的基础上,仍然通过该方法检测出皮肤致敏性,很大程度上可以认为该物质存在皮肤致敏能力,而相反的,出现阴性结果的物质仍然需要进一步验证皮肤致敏性[14]。
本方法建立的原理是基于AOP皮肤致敏的关键细胞事件,还有针对该通路其它组件的替代方法,如针对分子启始事件的直接多肽反应试验(DPRA)、针对角质细胞关键事件的ARE - Nrf2荧光素酶检测方法(KeratinoSens)同样已被OECD认可为指南方法,其他与AOP相关的替代方法还有U-SENS、Lusens 等处于验证过程中。这些方法的开发在一定程度上替代了动物实验,但实现最终替代动物实验的目标,还应采用整合测试评估策略(IATA),合并减少体外方法的数量、确定不同方法的权重,以及建立判定决策树。
[1] 程树军, 焦红. 实验动物替代方法原理与应用 [M]. 北京:科学出版社, 2010: 285-304.
[2] Zurlo J, Hutchinson E. The state of animal welfare in the context of refinement [J]. ALTEX, 2014, 31(1): 4-10.
[3] OECD. The adverse outcome pathway for skin sensitisation initiated by covalent binding to proteins. Part 2: Use of the AOP to develop chemical categories and integrated assessment and testing approaches. Series on testing and assessment No. 168. Paris, 2012. ENV/JM/MONO(2012)/PART2.
[4] Van Meer PJ, Graham ML, Schuurman HJ. The safety, efficacy and regulatory triangle in drug development: Impact for animal models and the use of animals [J]. Eur J Pharmacol, 2015, 759: 3-13.
[5] Patlewicz G, Kuseva C, Kesova A, et al. Towards AOP application—implementation of an integrated approach to testing and assessment (IATA) into a pipeline tool for skin sensitization [J]. Regul Toxicol Pharmacol, 2014, 69(3): 529-545.
[6] Takenouchi O, Miyazawa M, Saito K, et al. Predictive performance of the human cell line activation test (h-CLAT) for lipophilic chemicals with high octanol-water partition coefficients [J]. J Toxicol Sci, 2013, 38(4): 599-609.
[7] Casati S, Aeby P, Basketter DA, et al. Dendritic cells as a tool for the predictive identification of skin sensitisation hazard [J]. Altern Lab Anim, 2005, 33(1): 47-62.
[8] Nukada Y, Ashikaga T, Miyazawa M, et al. Prediction of skin sensitization potency of chemicals by human Cell Line Activation Test (h-CLAT) and an attempt at classifying skin sensitization potency [J]. Toxicol in Vitro, 2012, 26(7): 1150-1160.
[9] Nukada Y, Ito Y, Miyazawa M. The relationship between CD86 and CD54 protein expression and cytotoxicity following stimulation with contact allergen in THP-1 cells [J]. J Toxicol Sci. 2011, 36(3): 313-324.
[10] Tsujita-Inoue K, Atobe T, Hirota M, et al. In silico risk assessment for skin sensitization using artificial neural network analysis [J], J Toxicol Sci, 2015,40(2): 193-209.
[11] 高向东,吴梧桐.当归及其成分阿魏酸对小鼠免疫功能的影响 [J]. 中国生化药物杂志, 1994, 15(2): 107-110.
[12] 曾姣丽, 贺福元, 唐昱, 等. 双黄连注射剂中黄芩苷致敏原性的研究 [J]. 中国实验方剂学杂志,2012, 18(1): 102-106.
[13] Tsujita-Inoue KT, Hirota M, Ashikaga T, et al. Skin sensitization risk assessment model using artificial neural network analysis of data from multiple in vitro assays [J]. Toxicol in Vitro, 2014, 28(4): 626-639.
[14] Jaworska J, Harol A, Kern PS, et al. Integrating non-animal test information into an adaptive testing strategy -skin sensitization proof of concept case [J]. ALTEX,2011, 28(3): 211-225.
An in vitro skin sensitization test based on THP-1 cell line
CHEN Yu1,2,YU Huan1,3,QIN Yao3,CHENG Shu-jun1,TAN Wei-jun
Objective To establish an in vitro skin sensitization test, human cell line activation test ( h-CLAT), based on THP-1 cell line (a human acute monocytic leukemia cell line), and to assess the sensitizing potency of plant raw materials of chemical and cosmetic products by this in vitro skin sensitization test. Method THP-1 cells were cultured in vitro and exposed to 11 reference skin sensitization chemicals and 9 samples, by monitoring the cell viability, cell surface marker CD54 /CD86 and relative fluorescence intensity of cells surface after the cells was exposures to the substances, and to discover whether there is a positive reaction. At the same time, Buehler test was used to validate the results of samples tested by h-CLAT. Results 11 reference chemicals were distinguished correctly by h-CLAT. Among the 9 samples tested, 7 samples were recognized as negative sensitizer and 2 plant extracted substances were identified as suspicious skin sensitizer. The qualitative classification of the 9 samples by h-CLAT test was consistent with the results obtained by animal test. Conclusions The h-CLAT-in vitro test can be used to replace some animal tests for the prediction of soluble skin sensitizing substances.
Skin sensitization; THP-1 cell Line; Human cell line activation test, h-CLAT; Alternative methods; Contact dermatitis; Sensitizing chemicals; Cosmetic products
广东省科技计划项目(2015A030402005)。
陈彧(1989-):男,硕士研究生,研究方向:皮肤致敏替代方法研究与验证, 邮箱: cy94776@163.com。
程树军(1971-):男,研究员,从事替代方法研发和标准化,邮箱:chengsj@126.com。
R-33
A
1671-7856(2017) 04-0094-09
10.3969.j.issn.1671-7856. 2017.04.016
2016-07-31
