慢病毒介导稳定敲低Smurf1细胞株的构建及对细胞迁移的影响
2017-05-17韦荣飞李梦媛朱瑞敏杨星九
韦荣飞,郭 静,李梦媛,朱瑞敏,杨星九,高 苒
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
研究报告
慢病毒介导稳定敲低Smurf1细胞株的构建及对细胞迁移的影响
韦荣飞,郭 静,李梦媛,朱瑞敏,杨星九,高 苒
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
目的 构建慢病毒介导稳定敲低Smurf1的HeLa和A549细胞株并检测敲低Smurf1细胞迁移的影响。方法 将包装好的Smurf1敲低慢病毒感染HeLa和A549细胞,7 d后进行嘌呤霉素抗性筛选阳性细胞,Western blot和qPCR检测敲低效果,并进行Transwell检测Smurf1敲低对细胞迁移的影响。结果 利用干扰慢病毒系统成功构建稳定敲低Smurf1的HeLa和A549细胞株,稳定敲低Smurf1抑制细胞的迁移速率。结论 敲低Smurf1抑制细胞迁移。
Smurf1;慢病毒;RNA干扰;细胞迁移
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是真核细胞内蛋白质降解的主要途径,其参与众多的生物学过程,在器官的代谢平衡调控过程中发挥重要的作用。泛素-蛋白酶体途径是泛素在泛素激活酶(ubiquitin-activing enzyme,E1)[1]、泛素结合酶(ubiquitin-conjugating enzyme,E2)[2]和泛素连接酶(ubiquitin ligase,E3)[3]的酶促级联反应中对蛋白质进行标记并使其被蛋白酶体所识别、最终完成降解的过程。泛素-蛋白酶体途径的异常与多种疾病密切相关,包括恶性肿瘤、神经退行性疾病及自身免疫性疾病等[4,5]。目前已有超过600个E3被发现,这些E3主要分为RING(really interesting new gene)锌指结构域类和HECT(homologous to E6AP C-terminus)结构域类[3,6,7]。Smurf1(SMAD ubiquitylation regulatory factor-1)是HECT类泛素连接酶Nedd4家族的重要成员[8,9]。Smurf1在TGF-beta信号通路的调控中至关重要,其主要通过靶向泛素化降解TGF-beta信号通路中的多个蛋白来发挥其生物学功能,包括Smad1、Smad2、Smad3、Smad5等[10-12]。前期研究报道揭示,Smurf1在众多生物学过程中发挥重要的功能,包括调控骨稳态[13,14]、肺动脉高压[15,16]_ENREF_5、神经元轴突生长[17,18]、细胞极性[19,20]及肿瘤的发展[21]等。近期,Xiaoning Li等揭示Smurf1通过靶向降解DAB2IP蛋白调控细胞的迁移,DU145和MCF7细胞中敲低Smurf1后,细胞迁移明显受到抑制[22]。为了深入研究Smurf1在细胞迁移及小鼠肿瘤转移模型中的重要功能,本研究制备干扰慢病毒介导的Smurf1稳定敲低的HeLa和A549细胞株,为进一步研究Smurf1在肿瘤转移调控中的功能奠定基础。
1 材料和方法
1.1 材料
1.1.1 干扰慢病毒和细胞系:Smurf1干扰慢病毒为本实验室设计的siRNA序列(表1)提供给上海吉凯基因公司合成包装;HeLa和A549细胞系为本实验室所冻存。

表1 Smurf1 siRNA干扰序列
1.1.2 主要试剂:胎牛血清、DMEM、胰酶购自美国Gibco公司;puromycin、结晶紫、RIPA裂解液购自美国Sigma公司;Trizol试剂、反转录试剂盒、蛋白marker及发光底物购自Thermo公司;Transwell实验相关试剂购自BD公司;Polybrene购自美国Santa Cruz公司;Smurf1抗体购自Abcam公司;GAPDH抗体购自北京中杉金桥生物技术有限公司。
1.1.3 qPCR所用引物序列:qPCR所使用的引物见表2。
1.2 方法
1.2.1 慢病毒感染HeLa和A549细胞系:HeLa和A549细胞以每孔8×104的细胞量接种于6孔板中,18 h后,每孔加入6×105的病毒量,且每孔添加终浓度为10 μg/mL的Polybrene,8 h后更换新鲜DMEM (10% FBS,1%双抗)培养基。感染3~6 d后观察绿色荧光强度,并添加嘌呤霉素进行阳性细胞筛选2~3 d,随后富集阳性细胞并扩大培养,通过qPCR和Western blot检测Smurf1的mRNA和蛋白水平,确定Smurf1干扰慢病毒的敲低效率,得到Smurf1稳定敲低细胞株。
1.2.2 qPCR检测:收集Smurf1稳定敲低的HeLa和A549细胞株,利用Trizol法提取RNA,根据Thermo公司反转录试剂盒合成cDNA,qPCR检测Smurf1的mRNA水平,反应条件如下:95℃,1 min;95℃,15 s,60℃,30 s,40个循环;95℃,15 s,60℃,1 min,95℃,15 s。
1.2.3 Western blot检测:收获稳定细胞株,RIPA细胞裂解液冰上裂解10 min,加入等体积的2× loading buffer,沸水煮15 min,得到蛋白样品。将制备好的蛋白样品进行SDS-PAGE凝胶电泳;100 mA恒流,3 h,将蛋白从凝胶中转移至PVDF膜上;TBST溶液配制的5%脱脂奶粉室温封闭45 min;Smurf1抗体(1∶1000稀释)和GAPDH抗体(1∶5000稀释)4℃孵育过夜;TBST溶液洗3次,每次10 min;二抗室温孵育1 h;TBST溶液洗3次,每次10 min;ECL显色系统显影检测目的蛋白。
1.2.4 Transwell检测细胞转移:在Transwell专用24孔板里(下室)加入500 μL含10%血清的完全培养基(下层培养液);细胞计数后,将一定量的细胞用200 μL的无血清培养基(上层培养液)重悬,加入Transwell小室(上室)中;24 h后,吸弃上层培养基,并用棉签轻轻擦拭除去上层细胞,剪下小室底膜置于载玻片上(底面朝上放置),PBS洗1次,甲醇国定,0.1%的结晶紫染色,观察,拍照。
2 结果
2.1 稳定干扰细胞株的建立
将携带Smurf1特异性干扰序列的慢病毒颗粒和对照病毒颗粒感染HeLa和A549细胞,感染6天后,镜下观察几乎80%的细胞可见绿色荧光,说明慢病毒颗粒已成功感染细胞(图1)。随后,利用嘌呤霉素筛选阳性细胞,富集细胞继续培养,得到稳定干扰细胞株。

注:上图(上部分)为对照、shSmurf1 1#和2#慢病毒颗粒感染HeLa细胞3天和6天后细胞的绿色荧光强度观察结果;下图(下部分)为对照、shSmurf1 1#和2#慢病毒颗粒感染A549细胞3天和6天后细胞的绿色荧光强度观察结果。图1 干扰慢病毒颗粒感染HeLa和A549细胞Fig.1 Green fluorescence micrographs of HeLa (A) and A549 cells (B) at 3 and 6 days after lentivirus infection for Smurf1 silencing.
2.2 qPCR鉴定干扰效果
将上述6种感染病毒颗粒的细胞分别提取总RNA后,qPCR检测Smurf1的mRNA水平。结果如图2所示,Smurf1的两条特异性干扰序列均能有效下调Smurf1的mRNA水平,约下调90%。

注:上图分别为对照、shSmurf1 1#和2#稳定干扰HeLa (A)和A549 (B)细胞株中,Smurf1 mRNA水平的qPCR检测结果。图2 qPCR检测细胞株中Smurf1的mRNA水平Fig.2 The mRNA level in the HeLa (A) and A549 cells (B) of control and with stably shSmurf1 1# and 2# silencing by lentivirus infection, detected by qPCR.
2.3 Western blot鉴定干扰效果
同样,收集上述6种感染病毒颗粒的细胞,提取细胞总蛋白,Western blot检测Smurf1的蛋白水平。结果如图3所示,Smurf1的两条特异性干扰序列均能有效下调Smurf1的蛋白水平。

注:上图分别为对照、shSmurf1 1#和2#稳定干扰HeLa(A)和A549(B)细胞株中,Smurf1蛋白水平的Western blot检测。图3 Western blot检测细胞株中Smurf1的mRNA水平Fig.3 The mRNA level of Smurf1 in the HeLa (A) and A549 cells (B) stably lentivirus-infected for Smurf1 silencing, detected by Western blot.
2.4 干扰慢病毒稳定敲低Smurf1抑制细胞的迁移
通过Transwell检测Smurf1敲低后对细胞迁移的影响。结果如图4所示,与对照组相比,干扰慢病毒稳定敲低HeLa细胞中的Smurf1后,穿过基底膜的细胞明显减少(图4A),统计结果显示,敲低Smurf1明显降低细胞的迁移速率(图4B)。
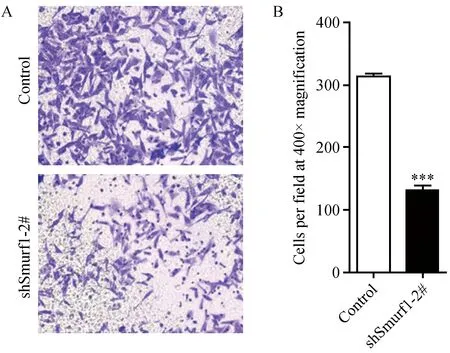
注:上图为Transwell检测对照、shSmurf1 2#稳定干扰HeLa细胞迁移,400×显微镜拍照(A)和统计学分析结果(B)。图4 Transwell检测敲低Smurf1对细胞迁移的影响Fig.4 Knockdown of Smurf1 leads to defective migration, detected by Transwell assay. A. Pictures were taken from a representative field, 400×; B. Cell number counted from five random fields.
2.5 Smurf1已知底物蛋白水平的验证
通过Western blot,检测干扰慢病毒稳定敲低HeLa细胞中Smurf1已知底物Smad1、Smad5和细胞迁移相关蛋白DAB2IP的蛋白水平。结果如图5所示,Smurf1敲低后,Smad1/5和DAB2IP的蛋白水平均明显上调,该结果与前期相关报道一致,说明通过干扰慢病毒已有效敲低HeLa细胞中的Smurf1。
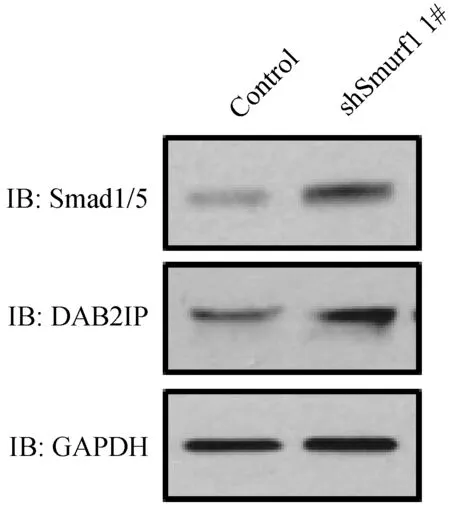
注:上图为Western blot检测对照、shSmurf1 1#稳定干扰HeLa细胞中Smurf1已知底物的蛋白水平。图5 Smurf1已知底物Smad1、Smad5和DAB2IP的蛋白水平检测Fig.5 Western blot detection of protein levels of the known substrates of Smurf1 in HeLa cells stably transfected with virus for Smurf1 silencing. The protein levels of Smad1, Smad5 and DAB2IP are up-regulated in the HeLa cells transfected with shSmurf1 1# lentivirus.
3 讨论
泛素-蛋白酶体途径参与众多的生物学过程,其异常导致多种疾病的发生,包括神经退行性疾病、恶性肿瘤及骨质疏松等。在泛素-蛋白酶体系统中最重要的酶为泛素连接酶,它决定底物的特异性,也是蛋白质降解研究领域的热点。目前,关于泛素连接酶E3与肿瘤的关系,已有较多研究发现很多RING类E3为肿瘤抑制因子或致癌因子。Nedd4家族与肿瘤的关联研究,相关报道较少,已知报道揭示了该家族中与Smurf1同源性高达80%的成员Smurf2,与肿瘤发生发展关系密切,证明了Smurf2是一个肿瘤抑制因子,并阐释具体作用机制[23]。关于Nedd4家族成员与肿瘤的关系,研究揭示,40%的前列腺癌和乳腺癌中均能检测到WWP1 mRNA和蛋白水平的上调[24,25];Nedd4在前列腺癌和膀胱癌中高表达;Smurf2在食管癌中高表达,Smurf1在胰腺癌中有mRNA水平的扩增[26]。前期部分研究提示Smurf1能够促进肿瘤的发生发展,然而,其具体的作用机制尚不明确。关于Smurf1在调控肿瘤细胞迁移过程的生物学功能有待深入研究。
在研究肿瘤的发生发展及肿瘤细胞迁移的过程中,基因沉默是常规的研究手段。目前,关于基因沉默的方法有多种,包括传统意义上的RNA干扰、带有短发夹RNA (short hairpain RNA,shRNA)的质粒或病毒载体介导的RNA干扰等方法。慢病毒载体感染能够同时感染分裂期和非分裂期的细胞,能够长期表达外源基因,稳定性好,且较安全[27]。本研究针对人源Smurf1设计了2条干扰序列,采用的慢病毒载体可以同时表达GFP和Puro抗性,病毒感染HeLa和A549细胞,经荧光显微镜观察可见GFP表达,且经嘌呤霉素筛选得到阳性细胞,qPCR和Western blot检测揭示Smurf1 mRNA和蛋白水平的明显下调,说明我们已经成功构建干扰慢病毒介导的Smurf1稳定敲低的HeLa和A549细胞株。同时,我们揭示了Smurf1的敲低明显抑制细胞迁移的速率,提示Smurf1在肿瘤细胞迁移过程中的重要功能。通过检测Smurf1已知底物Smad1/5和细胞迁移相关蛋白DAB2IP的蛋白水平,发现shSmurf1 1#稳定干扰的HeLa细胞中,Smad1/5和DAB2IP的蛋白水平均明显上调,进一步证实我们已成功构建干扰慢病毒介导的Smurf1稳定敲低的HeLa细胞株。
目前,关于Smurf1调控细胞迁移的作用机制有待进一步深入研究,或者其降解底物有待进一步挖掘,建立干扰慢病毒介导的Smurf1稳定敲低的HeLa和A549细胞株,能够为进一步的基础研究和临床应用奠定基础。
[1] Schulman BA, Harper JW. Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signalling pathways [J]. Nature Rev Mol cell Biol, 2009, 10(5): 319-331.
[2] Ye Y, Rape M. Building ubiquitin chains: E2 enzymes at work [J]. Nature Rev Mol cell Biol, 2009, 10(11): 755-764.
[3] Deshaies RJ, Joazeiro CA. RING domain E3 ubiquitin ligases [J]. Annu Rev Biochem, 2009, 78: 399-434.
[4] Reinstein E, Ciechanover A. Narrative review: protein degradation and human diseases: the ubiquitin connection [J]. Ann Intern Med, 2006, 145(9): 676-684.
[5] Dahlmann B. Role of proteasomes in disease [J]. BMC Biochem, 2007, 8(Suppl 1): S3.
[6] Hatakeyama S, Nakayama KI. U-box proteins as a new family of ubiquitin ligases [J]. Biochem Biophys Res Commun, 2003, 302(4): 635-645.
[7] Rotin D, Kumar S. Physiological functions of the HECT family of ubiquitin ligases [J]. Nature Rev. Mol Cell Biol, 2009, 10(6): 398-409.
[8] Cao Y, Zhang L. A Smurf1 tale: function and regulation of an ubiquitin ligase in multiple cellular networks [J]. Cell Mol Life Sci, 2013, 70(13): 2305-2317.
[9] Cao Y, Zhang L. Pharmaceutical perspectives of HECT-type ubiquitin ligase Smurf1 [J]. Curr Pharm Des, 2013, 19(18): 3226-3233.
[10] Cao Y, Wang C, Zhang X, et al. Selective small molecule compounds increase BMP-2 responsiveness by inhibiting Smurf1-mediated Smad1/5 degradation [J]. Sci Rep, 2014, 4: 4965.
[11] Sangadala S, Metpally RP, Reddy BV. Molecular interaction between Smurf1 WW2 domain and PPXY motifs of Smad1, Smad5, and Smad6—modeling and analysis [J]. J Biomol Struct Dyn, 2007, 25(1): 11-23.
[12] Alexandrova EM, Thomsen GH. Smurf1 regulates neural patterning and folding in Xenopus embryos by antagonizing the BMP/Smad1 pathway [J]. Dev Biol, 2006, 299(2): 398-410.
[13] Yamashita M, Ying SX, Zhang GM, et al. Ubiquitin ligase Smurf1 controls osteoblast activity and bone homeostasis by targeting MEKK2 for degradation [J]. Cell, 2005, 121(1): 101-113.
[14] Zhang Y, Wang C, Cao Y, et al. Selective compounds enhance osteoblastic activity by targeting HECT domain of ubiquitin ligase Smurf1 [J]. Oncotarget, 2016. DOI: 10.18632/oncotarget.10648. [Epub ahead of print]
[15] Murakami K, Mathew R, Huang J, et al. Smurf1 ubiquitin ligase causes downregulation of BMP receptors and is induced in monocrotaline and hypoxia models of pulmonary arterial hypertension [J]. Exp Biol Med (Maywood), 2010, 235(7): 805-813.
[16] Rothman AM, Arnold ND, Pickworth JA, et al. MicroRNA-140-5p and SMURF1 regulate pulmonary arterial hypertension [J]. J Clin Invest, 2016, 126(7): 2495-2508.
[17] Kannan M, Lee SJ, Schwedhelm-Domeyer N, et al. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth [J]. Development, 2012, 139(19): 3600-3612.
[18] Cheng PL, Lu H, Shelly M, et al. Phosphorylation of E3 ligase Smurf1 switches its substrate preference in support of axon development [J]. Neuron, 2011, 69(2): 231-243.
[19] Ozdamar B, Bose R, Barrios-Rodiles M, et al. Regulation of the polarity protein Par6 by TGFbeta receptors controls epithelial cell plasticity [J]. Science, 2005, 307(5715): 1603-1609.
[20] Lee MG, Jeong SI, Ko KP, et al. RASSF1A directly antagonizes RhoA activity through the assembly of a Smurf1-mediated destruction complex to suppress tumorigenesis [J]. Cancer Res, 2016, 76(7): 1847-1859.
[21] Xie P, Zhang M, He S, et al. The covalent modifier Nedd8 is critical for the activation of Smurf1 ubiquitin ligase in tumorigenesis [J]. Nat Commun, 2014, 5: 3733.
[22] Li X, Dai X, Wan L, et al. Smurf1 regulation of DAB2IP controls cell proliferation and migration [J]. Oncotarget, 2016. 7(18):26057-26069
[23] Blank M, Tang Y, Yamashita M, et al. A tumor suppressor function of Smurf2 associated with controlling chromatin landscape and genome stability through RNF20 [J]. Nature Med, 2012, 18(2): 227-234.
[24] Chen C, Sun X, Guo P, et al. Ubiquitin E3 ligase WWP1 as an oncogenic factor in human prostate cancer [J]. Oncogene, 2007, 26(16): 2386-2394.
[25] Chen C, Zhou Z, Ross JS, et al. The amplified WWP1 gene is a potential molecular target in breast cancer [J]. Int J Cancer, 2007, 121(1): 80-87.
[26] Zhu H, Kavsak P, Abdollah S, et al. A SMAD ubiquitin ligase targets the BMP pathway and affects embryonic pattern formation [J]. Nature, 1999, 400(6745): 687-693.
[27] Whitehead KA, Langer R, Anderson DG. Knocking down barriers: advances in siRNA delivery [J]. Nat Rev Drug Discov, 2009, 8(2): 129-138.
Establishment of two human tumor cell lines with lentivirus-mediated stably Smurf1 silencing and their effect on cell migration
WEI Rong-fei, GUO Jing, LI Meng-yuan, ZHU Rui-min, YANG Xing-jiu, GAO Ran
(Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences &Comparative Medical Center, Peking Union Medical College, Beijing 100021,China)
Objective To establish lentiviral expression vectors for Smurf1 silencing and assess the effects of Smurf1 silencing on cell migration. Methods HeLa and A549 cells were infected with lentiviral expression vectors for Smurf1 silencing respectively. After 7 days, the stable cell lines with Smurf1 silencing were obtained after puromycin-resistance screening, enrichment and expansion. The intracellular gene and protein levels of Smurf1 were detected by qPCR and western blot. Transwell assay was used to assess the effect of Smurf1 silencing on cell migration. Results The stable cell lines with Smurf1 silencing are constructed successfully. Silencing of Smurf1 down-regulated cell migration rate detected by Transwell assay. Conclusion Smurf1 promotes cell migration.
Smurf1; lentivirus; RNA interference; Cell migration
协和青年基金资助,中央高校基本科研业务费专项资金资助(3332016077),中国医学科学院医学实验动物研究所基本科研业务费专项资助(2016ZX310033)。
韦荣飞(1990-),女,助理研究员,研究方向:免疫与肿瘤。E-mail: weirongfei2010@163.com。
高苒(1980-),女,副研究员,研究方向:肿瘤学、免疫学。E-mail: gaoran26@Hotmail.com。
R-33
A
1671-7856(2017) 04-0046-06
10.3969.j.issn.1671-7856. 2017.04.008
2016-11-26
