MBP-mCTCF融合蛋白原核表达载体的构建及表达
2017-05-16尚丽平李武峰
尚丽平,李武峰
(山西农业大学生命科学学院,山西太谷030801)
MBP-mCTCF融合蛋白原核表达载体的构建及表达
尚丽平,李武峰
(山西农业大学生命科学学院,山西太谷030801)
为了构建鼠的CTCF与麦芽糖结合蛋白(MBP)融合蛋白的原核表达载体,并进行原核诱导表达及鉴定,以pMXs-3Flag-mCTCF为模板,PCR扩增得到mCTCF序列,目的基因片段EcoR I,Sal I双酶切后连接到同样双酶切的pMal-C2G载体上,测序鉴定。将测序正确的质粒转化到E.coli BL21中,用IPTG诱导融合蛋白的表达,用SDS-PAGE分离检测蛋白表达效果。经菌液PCR、测序鉴定、双酶切鉴定证明,得到的重组质粒pMal-C2G-mCTCF构建成功,且成功诱导出了MBP-mCTCF融合蛋白,最佳诱导条件为:10×10-4mol/LIPTG浓度在37℃诱导6 h。
CTCF;质粒构建;原核诱导表达
CCCTC-结合因子(CTCF)是一种在生物体内广泛表达并在进化上高度保守的蛋白,鼠的CTCF全长736个氨基酸,包括N-末端(氨基端)、C-末端(羧基端)和锌指结构域(CTCF-ZFs)[1]。其中,CTCF-ZFs有312个氨基酸,形成11个连续的锌指,小鼠和人的CTCF-ZFs 100%同源[1]。CTCF通过其11个锌指与基因组DNA的相互作用而在细胞中发挥多种生物学功能,包括基因的转录激活或者抑制、基因印记、染色质绝缘、X染色体失活、染色质高级结构调控等[2]。为了更为直接地研究CTCF蛋白与DNA的结合机制,体外通过原核诱导表达是常用的研究方法,选择最适的诱导表达条件对于CTCF的诱导表达和进一步功能研究至关重要。
本研究构建了鼠的MBP-mCTCF融合蛋白表达质粒,并优化了原核诱导表达的条件,旨在诱导得到MBP-mCTCF融合蛋白以及最佳的蛋白诱导表达条件。
1 材料和方法
1.1 材料
E.coli BL21购自天根生物公司、E.coli DH5α、pMal-C2G质粒、pMXs-3Flag-mCTCF质粒由中国科学院广州生物医药与健康研究院姚红杰实验室制备和保存;Fermentas快速内切酶EcoR I[3],Sal I购自Thermo公司;Solution 1购自Takara公司,异丙基-β-D-硫代半乳糖苷(Isopropyl β-D-1-thiogalactopyranoside,IPTG)购自Thermo公司。
1.2 方法
1.2.1 目的基因扩增以pMXs-3Flag-mCTCF质粒为模板,分别用进入EcoR I和Sal I酶切位点的mCTCF正反向引物扩增鼠的CTCF片段。primermCTCF-正向引物序列为:5′-CCGGAATTCCTCGA GATGGCCTTTGTGACCA-3′,primer-mCTCF-反向引物序列为:5′-ACGCGTCGACTCAGCCATCTGGGC CAGCACAATTATC-3′。PCR反应体系为20μL:模板pMXs-3Flag-mCTCF(40ng/μL)1μL;正向引物(1×10-5mol/L)0.3 μL;反向引物(1×10-5mol/L)0.3 μL;KOD plus 0.5 μL;10×KOD Buffer 2 μL;MgSO40.4 μL;H2O15.5 μL。扩增程序为:98℃预变性2 min;98℃30 s,58℃30 s,68℃10 min,扩增30个循环;68℃延伸10 min[4-6]。扩增产物进行1%琼脂糖凝胶电泳检测。
1.2.2 表达质粒的构建用EcoR I,Sal I双酶切PCR产物,割胶回收后连接到同样用EcoR I,Sal I,双酶切的pMal-C2G空载体上[7-8],重组质粒转化到感受态E.coli DH5α中,挑取单克隆进行菌液PCR,选择条带正确的克隆测序鉴定,确保编码蛋白的区域没有突变或缺失。提取质粒EcoR I,Sal I,双酶切鉴定,构建成功的质粒转化到感受态E.coli BL21中,用于后续蛋白诱导表达。
1.2.3 目的蛋白的诱导表达及条件优化原核诱导表达的方法参考文献[9-10]进行:挑取单克隆置于5 mL加Amp的LB培养基中,37℃,220 r/min培养过夜,菌种以1∶500接种到新鲜培养基中,37℃,220 r/min培养到OD260/OD280为0.6~0.8时,加入适当浓度的IPTG和ZnSO4继续培养6 h[11-12]。首先,使用3个传统的诱导温度(16,28,37℃)和3个IPTG浓度(1×10-4mol/L,5×10-4mol/L和10×10-4mol/L)初步确定诱导温度;随后细化IPTG的浓度(1×10-4,2×10-4,3×10-4,4×10-4,5×10-4,6×10-4,7×10-4,8×10-4,9×10-4,10×10-4,11×10-4,12×10-4mol/L),确定最佳诱导条件。
1.2.4 融合蛋白检测用12%的SDS-PAGE分离蛋白后,用考马斯亮蓝染色,观察蛋白表达情况。
2 结果与分析
2.1 目的片段扩增
以pMXs-3Flag-mCTCF质粒为模板PCR扩增的鼠的CTCF片段,经1%琼脂糖凝胶电泳后,得到的条带与预期大小相符,mCTCF的长度为2 211 bp(图1)。
2.2 重组质粒鉴定
质粒重组后,转化、涂板培养过夜后,挑取克隆进行菌液PCR,结果如图2所示。5,6,7,8,10号克隆在2 000 bp附近有一条带,选择这几个克隆测序,测序正确后提取质粒,双酶切鉴定,结果与预期相符(图3)。



2.3 融合蛋白诱导表达
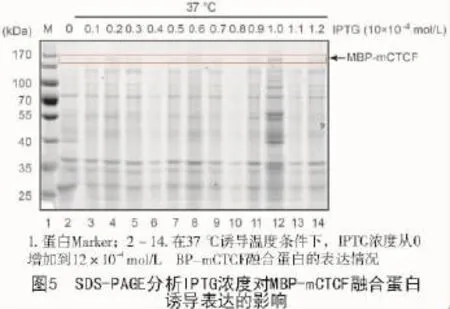
将含表达质粒的E.coli BL21经IPTG诱导表达后,用SDS-PAGE分析诱导前后的蛋白表达情况,蛋白分子量小于170 kDa时,出现明显的差异性诱导表达的融合蛋白条带(图4,5)。首先对诱导温度和IPTG诱导浓度进行初步优化,确定了最适的诱导温度为37℃(图4)。
随后对IPTG浓度进行优化,IPTG的浓度从1×10-4mol/L增加到12×10-4mol/L,SDS-PAGE分离后,考马斯亮蓝染色的结果显示,最佳的IPTG浓度为10×10-4mol/L(图5)。因此,最终确定融合蛋白MBP-mCTCF最适诱导表达条件为:10×10-4mol/L IPTG浓度在37℃诱导6 h。

3 讨论与结论
CTCF作为一个多功能的转录因子,主要通过与基因组DNA的结合作用而行使功能。CTCF在基因组上的结合位点研究是从鸡的c-Myc基因开始[13-14],随后的研究中又发现了一系列的CTCF结合序列,这些序列的长度从十几个碱基到几十个碱基不等[1]。随着高通量测序技术的快速发展,人们关于CTCF结合位点的认识更为清晰。KIM等[15]通过ChIP-seq,ChIP-ChIP等方法研究得出,过去由体外试验得到的CTCF结合位点基本都含有同一段19~21个碱基的核心序列,这段核心序列被定义为M1(CTCF结合Motif1)。在M1和下游约5~6个碱基的位置发现了一个新的CTCF结合的序列,这段区域的核心序列为9~11个碱基,把这个核心序列定义为M2(CTCF结合Motif 2)[16-17]。CTCF与DNA的结合并非需要11个锌指全部参与,而是通过几个锌指与DNA作用而发挥功能[9]。研究发现,包含M1的CTCF结合序列主要结合CTCF的4~8号锌指,而包含M2的CTCF结合序列主要结合CTCF的7~ 11号锌指[9,18-19]。
CTCF作为一个转录因子,在调控基因表达中发挥重要功能,CTCF可以通过锌指与DNA的结合调控许多癌基因的表达。也有报道发现,在许多癌细胞中,CTCF与其靶位点结合异常,包括白血病、宫颈癌和Wilms′肿瘤[20]。因此,推测CTCF结合异常,比如结合位点突变、锌指氨基酸突变都可能与肿瘤等疾病的发生相关[21,22]。在本研究中,通过原核诱导表达得到了MBP-mCTCF融合蛋白,再进行纯化,获得足量的蛋白后,可进行PULL-DOWN,EMSA等试验,进一步研究CTCF与DNA结合的机制。
总之,本研究成功构建了鼠的CTCF的原核表达质粒pMal-C2G-mCTCF,优化了原核诱导表达的条件,并对原核诱导表达的目的蛋白进行了鉴定,为下一步CTCF蛋白的功能研究奠定了基础。
[1]OHLSSON R,RENKAWITZ R,LOBANENKOV V.CTCF is a uniquely versatile transcription regulator linked to epigenetics and disease[J].Trends in Genetics,2001,17(9):520.
[2]PHILLIPS J E,CORCES V G.CTCF:master weaver of the genome [J].Cell,2009,137(7):1194-1211.
[3]余美华,张姝芳,倪晓敏,等.MCL-1原核表达载体构建及重组蛋白表达[J].安徽农业科学,2013,41(18):7742-7744.
[4]王晓梅,张钟文,杨楠.辣椒疫霉病无毒基因RXLR128001克隆与蛋白表达纯化[J].山东农业大学学报(自然科学版),2016,47(1):25-29.
[5]张微,孙红,裴丹,等.小麦自噬相关基因ATG4和ATG8的原核表达及蛋白纯化[J].天津农业科学,2014,20(5):19-22.
[6]朱莉,刘刚,ZHULI,等.小鼠生精相关基因pQE/Dnajb13重组载体的构建和蛋白表达[J].南方医科大学学报,2013(12):1757-1760.
[7]胡乔木,王凯琳,陈松林.半滑舌鳎Dmrt1蛋白表达、纯化及功能[J].中国水产科学,2013(6):1132-1138.
[8]秦艳红,乔奇,张德胜,等.甘薯褪绿矮化病毒外壳蛋白基因的克隆及在大肠杆菌中的表达[J].河南农业科学,2013,42(6):85-87.
[9]RENDA M,BAGLIVO I,BURGESSBEUSSE B,et al.Critical DNA bindinginteractions ofthe insulator protein CTCF:a small number of zinc fingers mediate strong binding,and a single finger-DNA interaction controls binding at imprinted loci[J].Journal of Biological Chemistry,2007,282(46):33336-33345.
[10]YAO H,BRICK K,EVRARD Y,et al.Mediation of CTCF transcriptional insulation by DEAD-box RNA-binding protein p68 and steroid receptor RNAactivator SRA[J].Genes&Development,2010,24(22):2543-2555.
[11]肖莹,刘君,刘晓颖,等.栽培小麦Brock中转录因子基因WRKY的克隆与表达分析[J].天津农业科学,2015,21(2):1-4.
[12]刘永晖,张改平,乔松林,等.猪繁殖与呼吸综合征病毒nsp7蛋白的表达与纯化[J].河南农业科学,2012,41(5):141-144.
[13]LOBANENKOV V V,NICOLAS R H,ADLER V V,et al.A novel sequence-specific DNA binding protein which interacts with three regularly spaced direct repeats of the CCCTC-motif in the 5′-flanking sequence of the chicken c-myc gene[J].Oncogene,1990,5(12):1743-1753.
[14]KLENOVA E M,NICOLAS R H,PATERSON H F,et al.CTCF,a conserved nuclear factor required for optimal transcriptional activityof the chicken c-myc gene,is an 11-Zn-finger protein differentiallyexpressed in multiple forms[J].Molecular&Cellular Biology,1993,13(12):7612-7624.
[15]KIM T H,ABDULLAEV Z K,SMITH A D,et al.Analysis of the vertebrate insulator protein CTCF binding sites in the human genome[J].Cell,2007,128(6):1231-1245.
[16]NAKAHASHI H,KWON K R,RESCH W,et al.A genome-wide
map of CTCF multivalency redefines the CTCF code[J].Cell Reports,2013,3(5):1678-1689.
[17]SCHMIDT D,SCHWALIE P C,WILSON M D,et al.Waves of retrotransposon expansion remodel genome organization and CTCF bindingin multiple mammalian lineages[J].Cell,2012,148(1/2):335-348.
[18]XIAO T,WONGTRAKOONGATE P,TRAINOR C,et al.CTCF recruits centromeric protein CENP-E to the pericentromeric/centromeric regions of chromosomes through unusual CTCF-binding sites[J].Cell Reports,2011,12(10):1704.
[19]GHIRLANDO R,FELSENFELD G.CTCF:making the right connections[J].Genes&Development,2016,30(8):881.
[20]刘芳,张冲,王寅彪,等.猪伪狂犬病毒gD蛋白抗原表位的克隆及表达[J].河南农业科学,2016,45(4):122-125.
[21]NETWORK C G A,KANDOTH C,SCHULTZ N,et al.Integrated genomic characterization of endometrial carcinoma[J].Nature,2013,497:67.
[22]FIORENTINO F P,GIORDANO A.The tumor suppressor role of CTCF[J].Journal ofcellular physiology,2012,227(2):479-492.
Construction of Prokaryotic Expression Vector and Expression of MBP-mCTCF Fusion Protein
SHANGLiping,LI Wufeng
(College ofLife Science,Shanxi Agricultural University,Taigu 030801,China)
To construct the prokaryotic expression vector of pMal-C2G-mCTCF and induce the expression of fusion protein,DNA fragments encoding the mouse CTCF were generated by PCR using the plasmid pMXs-3Flag-mCTCF as a template,PCR products were digested with the restriction enzyme EcoR I and Sal I and cloned into pMal-C2G expression vector.The plasmids were sequenced to confirm that there were no point mutations in the coding sequences.The constructed plasmids were transformed into E.coli BL21 to induce the expression ofMBP-mCTCF fusion protein.The fusion protein was analyzed by SDS-PAGE and Coomassie blue staining.The prokaryotic expression plasmids pMal-C2G-mCTCF were successfullyconstructed,which were testified bybacterial PCR,gene sequence and double restriction enzyme digestion analysis.We alsogot the suitable conditions for inducingfusion protein expression.The optimized induction condition was 37℃with 10×10-4mol/LIPTGfor 6 hours toinduce higher amount ofMBP-mCTCF fusion protein.
CTCF;construction ofvectors;prokaryotic expression
10.3969/j.issn.1002-2481.2017.05.01
Q51
:A
:1002-2481(2017)05-0677-04
2017-03-06
尚丽平(1990-),女,山西神池人,在读硕士,研究方向:动物遗传育种。李武峰为通信作者。
