膝关节表面软骨与游离体表面软骨FT-IR光谱成像的对比研究
2017-05-16范家强苑举辉郝云甲周密陈伟王爱国
范家强,苑举辉,郝云甲,周密,陈伟,王爱国*
(1.江苏省徐州市中心医院,江苏 徐州 221009;2.吉林大学中日联谊医院,吉林 长春 130033;3.吉林大学物理学院,吉林 长春 130033)
实验研究
膝关节表面软骨与游离体表面软骨FT-IR光谱成像的对比研究
范家强1,苑举辉2,郝云甲1,周密3,陈伟2,王爱国1*
(1.江苏省徐州市中心医院,江苏 徐州 221009;2.吉林大学中日联谊医院,吉林 长春 130033;3.吉林大学物理学院,吉林 长春 130033)
目的 研究游离体表面软骨与关节软骨的差异,为修复关节软骨缺损提供借鉴。方法 以膝关节表面软骨及关节内游离体表面软骨为研究对象,通过FT-IR光谱成像的分析方法及主成分分析法,从分子水平辨别同处于一个关节腔微环境中两种软骨的差别。结果 两种软骨中作为填充物的蛋白多糖,没有明显的变化,二阶导数波数位置中1 514 cm-1所代表的胶原N-H弯曲振动(实验组为1 516 cm-1,对照组为1 514 cm-1)与1 574 cm-1所代表的酰胺Ⅱ(实验组为1 575 cm-1,对照组为1 573 cm-1)表现出蓝移。主成分散点图显示关节表面软骨主要分布于第一象限,游离体表面软骨主要分布于三四象限。结论 游离体表面软骨基质成分尤其是胶原已发生变化,具有一定的缺陷性。
关节;软骨;傅里叶转换红外;游离体;主成分分析
关节软骨于胚胎期伴随着骨关节的出现而发生,研究表明[1]诸多的调节因子参与了关节软骨生长,关节软骨细胞成熟之后转而成为功能性细胞,分泌胶原等关节软骨的细胞外基质。游离体的产生与很多因素有关[2]:创伤致关节软骨撕脱进入关节腔内,炎性因子的分泌和失衡等。曾报道[3]膝关节软骨游离体在关节腔生理环境中随着时间的延长而呈现进行性软骨结构性破坏、生理活性下降。有学者研究[4]发现游离体内的软骨细胞体积增大,排列紊乱,基质减少,出现正常软骨细胞不表达的Ⅰ型和Ⅲ型胶原mRNA。Arokoski研究[5]发现游离体软骨细胞周围基质降解使软骨陷窝的容积增大,其中的软骨细胞失去了基质的保护和制约,受到了异常力学和细胞因子的影响。
对关节表面软骨与游离体表面软骨通过FT-IR红外光谱成像进行对比研究,并应用相对广泛的二阶导数和主成分分析法(PCA)分析两者的异同点,能够从分子水平更深入地了解软骨的差异和变化。
1 实验部分
1.1 实验器材 甲醛(天津永晟精细化工有限公司);无水乙醇,二甲苯,浓盐酸(北京化工厂);载玻片(Labserv Fisher Scientific,8106W-4);苏木精-伊红Y染色剂(北京赛驰生物科技有限公司);溴化钾(上海谱振生物科技有限公司);X线成像仪(德国西门子公司);包埋机(湖北泰维科技实业有限公司TB-718L);切片机(上海倍曼生物科技有限公司);染色机(德国MICROM公司HMS740);恒温水浴箱(德国leica HI1210);光学显微镜(OLYMPUS BX41TF);高温烘箱(上海博讯实业有限公司);封装机(德国MICROM公司CTM6);FT-IR红外光谱成像仪器(ominic nicolet 360,USA)。
1.2 实验过程
1.2.1 取材 膝关节表面软骨及关节内游离体(吉林大学中日联谊医院骨关节外科术中收集,标本取材符合医学伦理学要求,并由吉林大学中日联谊医院医学伦理委员会审议批准):关节表面软骨(对照组,n=10)及游离体(实验组,n=10)来自于临床诊断为OA的患者。其中男性4例,女性6例;年龄60~75岁,平均64.1岁。术中提取对照组及实验组标本:作为对照组的关节表面软骨取材区位于股骨内外髁表面,游离体取材区为其表面软骨,所有软骨样本均取自表层软骨下1 mm的中浅层。同时将术中提取到的同源实验标本部分制备病理切片,来确定样本的统一标准性。
1.2.2 样品制备 取病理切片同源的游离体及关节软骨的薄片,厚度约1 mm的中浅层软骨,脱蜡,去离子水充分冲洗,干燥,将实验组与对照组的软骨标本与KBr粉末按一定比例(约1︰20)混合后,置于玛瑙研钵中充分研磨,压片机压制透明薄片(压片机压力约P=16 kPa)。
1.2.3 红外吸收谱线的采集 红外光谱成像仪实验区域经二氧化碳干燥,采取的样本类型窗口为KBr,调整分辨率为4 cm-1,扫描次数为32次,取平均值,波段范围400~4 000 cm-1,预先扫描背景,去除水蒸气与CO2的干扰,将压制好的透明薄片样本置于红外光谱系统中采集光谱。利用onimic 7.0软件(ominic nicolet,USA)对光谱进行收集及保存,对红外吸收谱线进行自动基线校准及平滑。二阶导数谱图采用Savizky-Golay算法(7点平滑)。

2 结 果
2.1 组织切片结果 正常关节表面软骨,可见软骨分布具有明显分层,基质由浅至深逐渐减少,软骨细胞由浅至深逐渐增多,而游离体表面的软骨基质染色均一化,无软骨陷凹存在,软骨细胞呈簇型结节样聚集现象而未有层次出现,伴细胞外基质染色异常(见图2)。

图1 关节表面软骨(a)和游离体表面软骨(b)的吸收光谱 图2 正常表面软骨(左)及游离体表面软骨(右)对比(HE染色,10*10)
2.2 游离体表面软骨中蛋白多糖结果 软骨成分方面的研究[7]表明,水分最为丰富,占总重的70%,经过干燥等光谱测试前处理的软骨样本,主要含有胶原和蛋白多糖,其比值为1/4~2/3,而胶原主要是Ⅱ型胶原为主。蛋白多糖[8](984~1 140 cm-1)和Amide I(1 585~1 720 cm-1)含量[9]的比值(Carb/Amide I)可间接反映胶原蛋白多糖的比值关系[10]。吸收光谱谱线下面积经修正表示,对照组为(0.335±0.100),实验组为(0.410±0.200),P=0.480,两者未表现出统计学意义(见图3)。二阶导数的对比中,对照组红外光谱中的甲基CH3-的对称振动位置在(1 387±5)cm-1,实验组的位置在(1 385±5)cm-1,P=0.779。SO3-的对称拉伸振动的波数位置对照组在(1 068±3)cm-1,实验组在(1 067±5)cm-1,P=0.911,两者结果差异无统计学意义。
2.3 游离体表面软骨中胶原结果 对照组和实验组在1 202 cm-1,1 336 cm-1,1 448 cm-1,1 640 cm-1等波数位置均未表现出统计学差异。代表胶原主链结构肽键中C-N键拉伸和C-N键折叠的酰氨Ⅱ波数位置1 574 cm-1,实验组相对于对照组发生明显蓝移,对照组为(1 573±0)cm-1,实验组为(1 575±2)cm-1,P=0.015,两者之间存在明显的统计学差异。代表胶原分子中N-H键弯曲振动波数位置1 514 cm-1,实验组相对于对照组发生明显蓝移,对照组为(1 514±2)cm-1,实验组为(1 516±1)cm-1,P<0.01,两组存在显著的统计学差异(详见图3~4)。
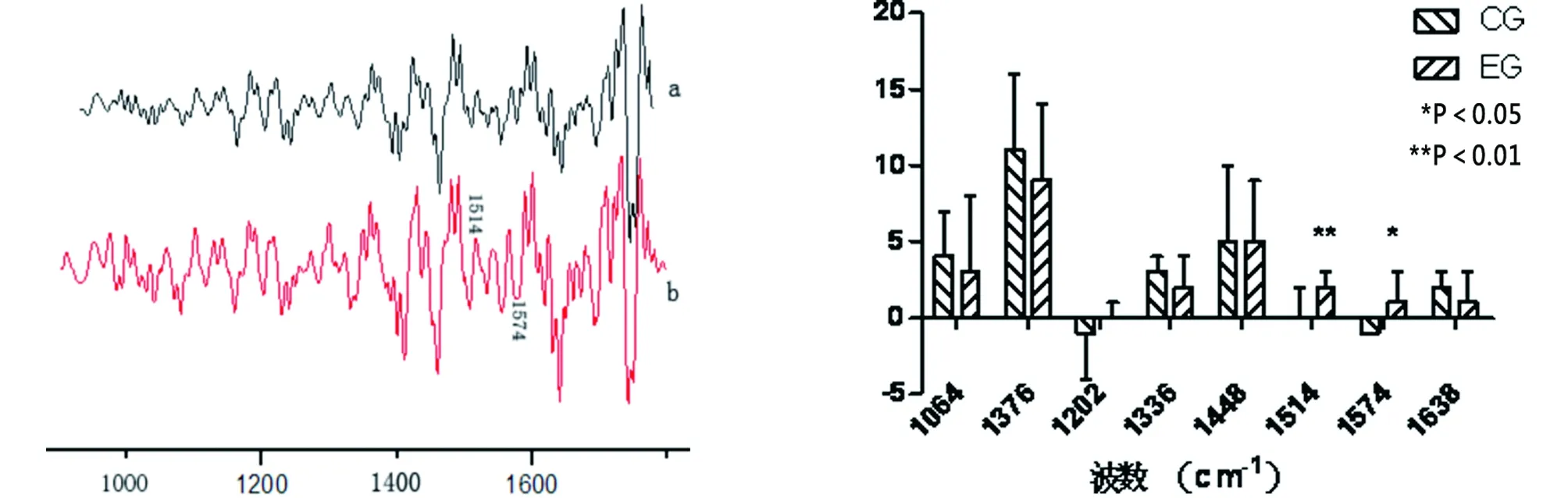
图3 关节表面软骨(a)和游离体表面软骨(b)的平均二阶导数谱线图 图4 对照组(CG)和实验组(EG)二阶导数中不同波数位置的统计值
2.4 主成分分析法结果分析 主成分分析的结果显示前两个的主成分特征值及积累可信度PC_1合计值为33.19,积累值为85.10%,PC_2的合计值为4.618,积累可信度96.94%。通过两个主成分值即可说明所有样本的信息,以PC_1为横坐标,PC_2为纵坐标,对20个样本的主成分得分值点进行作图,得到图5所示散点图。
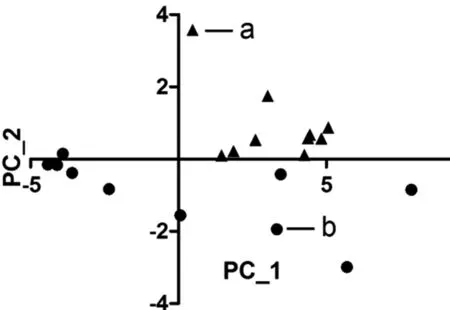
图5 样本的主要成分得分值坐标图(a为对照组,b 为实验组)
3 讨 论
通过对两者的病理结果分析,可说明这些关节内游离体与关节表面软骨的退变存在必然的相关性。Yorgancigi研究[17]表明关节腔内游离体的数量呈现由多到少,外形呈现由光滑到粗糙的变化趋势。游离体的表面均可见软骨包裹,丧失正常软骨的平整光滑特性。这说明在同一关节腔内,除在关节表面存在软骨外,关节内其他部位仍可存在软骨组织。游离体表面的软骨基质染色均一化,未出现正常软骨随深度而出现变少的迹象,无软骨陷凹存在,软骨细胞呈簇型结节样聚集现象,细胞外基质增生异常(见图1)。由此可见,来源同一机体内在同一关节腔内生长、相同空间微环境情况下,软骨发育是不完全相同的。而这种差别在细胞形态上很难区分,主要表现在细胞分布、细胞排列等方面。这种差异考虑与以下几方面有关:不同部位软骨营养供应来源不同[18],不同部位的软骨细胞表型改变,外伤致软骨所受压力负荷的不均衡。并有研究[19]发现,通过免疫组织化学方法处理样本后,关节表面软骨与游离体表面软骨在胶原表达方面存在较大差异。
以上结果得出,蛋白多糖作为关节软骨的填充物未出现变化。一方面,两者同处于关节腔同一个微环境下,因骨关节炎造成软骨残存不全,细胞外基质裸露,游离体表面软骨与关节软骨中的蛋白多糖发生相互交换填充;另一方面,组成游离体表面软骨的软骨细胞表型发生变化,但合成和分泌PGs的能力未发生明显变化,致使两者的成分未见差别。
另外关节软骨中的胶原是一种同源的三聚体结构,即3条α多肽链相互螺旋状排列做成的蛋白结构,每条α链都是由Gly-X-Y这种序列多次重复排列组成的(Gly为甘氨酸,X为脯氨酸,Y为4-羟脯氨酸)。胶原α链的骨架结构Gly-X-Y组成为C-C-N的重复序列,这种序列在组成α链的各个氨基酸分子内,或者酰胺之中。而X和Y中C-C-N的连接因为形成了杂环样结构而导致波数严重背离观测波数位置,因此特定波数所代表的化学基团的振动信息可以代表胶原主链的信息,具体可见表1。
表1 关节软骨的红外光谱峰值所代表的基团振动(cm-1)

1720~1585(1640) AmideI(C=Ostretch)1064C=OstretchingofthecarbohydrateresiduesinPGs/SO3⁃symmetricstretchingofGAGs[11⁃12]1376CH3⁃symmetricbendingofGAGs[10]1202AmideⅢvibrationwithCH2waggingvibration[13]1336CH2⁃sidechainvibrationofcollagen[10]1448CH3⁃asymmetricbending[14]1409COO⁃stretchingofaminosidechains[10]1574AmideⅡ,C⁃NstretchingandN⁃Hbendingvibration[15]1514AmideⅡ,N⁃Hbendingvibration[16]
游离体表面软骨的胶原分子排列不同于关节表面软骨,实验组酰胺Ⅱ的波数位置出现明显蓝移,表明其胶原分子的稳定性更高,而这种异常分泌的稳定性更高的软骨胶原基质需要更高的能量来裂解。同处于裂解酶类及炎性因子作用环境中关节表面软骨的胶原分子因稳定性较差则首先发生裂解,这样的变化带来的是反馈调节还可以使同在关节腔内的正常软骨更加容易产生裂解退变,加重了骨关节炎的进展,并无法维持正常软骨的功能。
通过对红外谱线吸收值进行主成分分析之后,在主成分散点图上可得同时含有PC_1和PC_2两种主成分的第一象限中只有对照组的样本存在,绝大部分实验组都位于横坐标轴以下的三四象限,这说明关节表面软骨的主要成分是正常的,游离体表面软骨却表现出各种不同成分的缺失,无论是PC_1还是PC_2。对照组和实验组的表层软骨表现出成分的不同,结合之前的研究结果,作为填充物的蛋白多糖未出现变化,而作为软骨骨架的胶原方面出现了变化,具体部位为构成胶原骨架的主链结构异常,致使游离体表面软骨不能等同于关节表面软骨应用于临床软骨的移植等方面。
胶原主链结构上的这种差异体现在细胞表达的胶原类型上,就会出现胶原表型转变或形成螺旋更加偏离非正常结构;体现在组织结构上,出现异常的软骨排列和分布,这种变化带来的反馈调节使同在关节腔内的正常软骨更加容易产生裂解退变,表现出更多的不稳定性和抗挤压能力差,加重了骨关节炎的进展,并无法维持正常软骨的功能。导致这种情况发生的原因我们认为有以下几个方面:a)血供的影响,游离体作为独立的个体与关节软骨不同,无法从软骨下骨获得血液带来的营养物质,致使其合成代谢出现变异[20-21];b)关节腔内,或者滑膜分泌的某些炎性因子[22],包括转化生长因子-β、胰岛素样生长因子、表皮细胞生长因子、成纤维细胞生长因子、前列腺素E2等激活炎症通路,诱导关节滑膜的炎性增生致使关节病变;c)基质金属蛋白酶[23]及其拮抗因子基质金属蛋白酶抑制剂等[24]作用于表面软骨的细胞外基质,使胶原骨架裂解破坏。
综上所述,关节表面软骨与游离体表面的软骨细胞,除在细胞的分布及细胞基质都有一定差距外,更重要的是通过红外光谱二阶导数方法分析游离体表面软骨的胶原组成在胶原分子的主链之中C-N键稳定性差。游离体表面软骨中胶原的主链结构存在不稳定性。说明游离表面软骨的形成与关节软骨虽然同在一个关节腔内,但是他们的生理环境却不相同,表现在两者的软骨基质成分,尤其是胶原存在差异性,同时也表明游离体的生成与骨关节炎有密切的相关性。
[1]Li Y,Cai H,Fang W,et al.Fibroblast growth factor 2 involved in the pathogenesis of synovial chondromatosis of temporomandibular joint[J].J Oral Pathol Med,2014,43(5):388-394.
[2]Wright JK,Cawston TE,Hazleman BL.Transforming growth factor beta stimulates the production of the tissue inhibitor of metalloproteinases (TIMP) by human synovial and skin fibroblasts[J].Biochim Biophys Acta,1991,1094(2):207-210.
[3]Wright JK,Cawston TE,Hazleman BL.Transforming growth factor beta stimulates the production of the tissue inhibitor of metalloproteinases (TIMP) by human synovial and skin fibroblasts[J].Biochim Biophys Acta,1991,1094(2):207-210.
[4]裴明,曲绵域,于长隆,等.骨关节炎关节软骨及游离体中胶原Ⅰ、Ⅱ、Ⅲ型的表达[J].中华风湿病学杂志,2000,4(2):85-88.
[5]Arokoski JP,Jurvelin JS,Väätäinen U,et al.Normal and pathological adaptations of articular cartilage to joint loading[J].Scand J Med Sci Sports,2000,10(4):186-198.
[6]Rieppo L,Rieppo J,Jurvelin JS,et al Fourier transform infrared spectroscopic imaging and multivariate regression for prediction of proteoglycan content of articular cartilage[J].PloS One,2012,7(2):1-8.
[7]Mosher TJ,Liu Y,Torok CM.Functional cartilage MRI T2 mapping:evaluating the effect of age and training on knee cartilage response to running[J].Osteoarthritis Cartilage,2010,18(3):358-364.
[8]Boskey A,Pleshko CN.FT-IR imaging of native and tissue-engineered bone and cartilage[J].Biomaterials,2007,28(15):2465-2478.
[9]Camacho NP,West P,Torzilli PA,et al.FTIR microscopic imaging of collagen and proteoglycan in bovine cartilage[J].Biopolymers,2001,62(1):1-8.
[10]Kim M,Bi X,Horton WE,et al.Fourier transform infrared imaging spectroscopic analysis of tissue engineered cartilage:histologic and biochemical correlations[J].J Biomed Opt,2005,10(3):031105.
[11]Jackson M,Choo LP,Watson PH,et al.Beware of connective tissue proteins:assignment and implications of collagen absorptions in infrared spectra of human tissues[J].Biochim Biophys Acta,1995,1270(1):1-6.
[12]Servaty R,Schiller J,Binder H,et al.Hydration of polymeric components of cartilage-an infrared spectroscopic study on hyaluronic acid and chondroitin sulfate[J].Int J Biol Macromol,2001,8(2):121-127.
[13]Kim M,Foo LF,Uggen C,et al.Evaluation of early osteochondral defect repair in a rabbit model utilizing fourier transform-infrared imaging spectroscopy,magnetic resonance imaging,and quantitative T2 mapping[J].Tissue Eng Part C Methods,2010,16(3):355-364.
[14]Kohler A,Bertrand D,Martens H,et al.Multivariate image analysis of a set of FTIR microspectroscopy images of aged bovine muscle tissue combining image and design information[J].Anal Bioanal Chem,2007,389(4):1143-1153.
[15]Kim M,Foo LF,Uggen C,et al.Evaluation of early osteochondral defect repair in a rabbit model utilizing fourier transform-infrared imaging spectroscopy,magnetic resonance imaging,and quantitative T2 mapping[J].Tissue Eng Part C Methods,2010,16(3):355-364.
[16]Hanifi A,McCarthy H,Roberts S,et al.Fourier transform infrared imaging and infrared fiber optic probe spectroscopy identify collagen type in connective tissues[J].PLoS ONE,2013,8(5):e64822.
[17]Yorgancigi H,Karahan N,Baydar ML.Multiple loose bodies in the joints:from snowstorm to hailstones[J].J Arthroscopy,2004,20(8):113-116.
[18]Pascual-Garrido C,Tanoira I,Muscolo DL,et al.Viability of loose body fragments in osteochondritis dissecans of the knee.A series of cases[J].Int Orthop,2010,34(6),827-831.
[19]Saotome K,Tamai K,Osada D,et al.Histologic classification of loose bodies in osteoarthrosis[J].J Orthop Sci,2006,11(6):607-613.
[20]Touten Y,Adachi N,Deie M,et al.Histologic evaluation of osteochondral loose bodies and repaired tissues after fixation[J].Arthroscopy,2007,23(2):188-196.
[21]Giannini S,Buda R,Grigol B,et al.The detached osteochondral fragment as a source of cells for autologous chondrocyte implantation (ACI) in the ankle joint[J].Osteoarthritis Cartilage,2005,13(7):601-607.
[22]Swingler TE,Wheeler G,Carmont V,et al.The expression and function of micro RNAs in chondrogenesis and osteoarthritis[J].Arthritis Rheum,2012,(64)6:1909-1919.
[23]Nagase H,Visse R,Murphy G.Structure and function of matrix metalloproteinases and TIMPs[J].Cardiovasc Res,2006,69(3):562-573.
[24]Visse R,Nagase H.Matrix metalloproteinases and tissue inhibitors of metalloproteinases:structure,function,and biochemistry[J].Cir Res,2003,92(8):827-839.
The Comparative Research of Knees’ Articular Surface Cartilage and Loose Body’s Surface Cartilage Using Fourier Transform Infrared Spectroscopic Imaging
Fan Jiaqiang1,Yuan Juhui2,Hao yunjia1,et al
(1.Department of Orthopedics,Central Hospital of Xuzhou,Xuzhou 221009,China;2.China-Japan Fellowship Hospital,Changchun 130033,China)
Objective To study the difference between articular surface cartilage and loose body’s surface cartilage.Methods The knees’ articular surface cartilage and loose body’s surface cartilage were collected research objects,using Fourier Transform Infrared Spectroscopic Imaging and Principle Component Analysis to explore the different of the two samples.Results There was no different in the total PGs content of the two samples calculated by an indirection method.N-H bending vibration wavenumber of collagen in the second derivative peaks (in articular surface cartilage is 1 514 cm-1,in the loose body is 1 516 cm-1) and N-H bending vibration and C-N stretching vibration wavenumber of Amide Ⅱ in the second derivative peaks (in articular cartilage is 1 573 cm-1,in the loose body is 1 575 cm-1) showing up an obvious blue shift.PCA shows that the articular surface cartilage was mainly distributed in the first quadrant,and the loose body was mainly distributed in the three or four quadrant.Conclusion The component of loose body surface cartilage,especially collagen has some deficient compared with articular surface cartilage.
articular;cartilage;fourier transform infrared spectroscopic;loose body;principle component analysis
1008-5572(2017)04-0328-05
吉林省自然科学基金资助项目(201215056);*本文通讯作者:王爱国
R322.7+2
B
2016-08-15
范家强(1988-),男,医师,江苏省徐州市中心医院,221009。
范家强,苑举辉,郝云甲,等.膝关节表面软骨与游离体表面软骨FT-IR光谱成像的对比研究[J].实用骨科杂志,2017,23(4):328-332.
