小球藻无菌培养体系的建立及培养条件的优化
2017-05-16武振晋周广航赵奎王亚君季春丽薛金爱李润植
武振晋,周广航,赵奎,王亚君,季春丽, 薛金爱, 李润植
(山西农业大学 分子农业与生物能源研究所,山西 太谷 030801)
小球藻无菌培养体系的建立及培养条件的优化
武振晋,周广航,赵奎,王亚君,季春丽, 薛金爱, 李润植*
(山西农业大学 分子农业与生物能源研究所,山西 太谷 030801)
[目的]埃氏小球藻(ErichsenChlorella)富含油脂、具有高效光合固碳能力,是生产生物柴油的优质藻种。杂菌污染和培养条件是制约小球藻生物量和油脂产量以及规模化培养生产的重要因素。为有效防除杂菌污染,优化埃氏小球藻培养条件,[方法]本试验选用5种普通抗生素即头孢霉素(Cefo)、氨苄霉素(Amp)、羧苄霉素(Car)、硫酸新霉素(Nw)和利福平霉素(Rif),检测其不同剂量和组合对埃氏小球藻除菌效果及生长的影响。分析初始接种量、藻液pH、培养温度和盐浓度等因子对埃氏小球藻生长的影响。[结果]综合评定各项指标,建立埃氏小球藻无菌培养体系和优化的培养条件。[结论]抗生素组合为Rif+Cefo(30 mL·L-1+100 mL·L-1);最适培养条件为:接种的初始OD值0.2,pH范围8.5~9.5,培养温度(25±0.5) ℃,盐浓度<0.01 mol·L-1。
埃氏小球藻; 抗生素; 无菌培养体系; 培养条件优化
小球藻是可以大规模养殖的为数不多的藻种之一,易于培养,生长繁殖快,含有丰富的蛋白质、多糖、维生素、类胡萝卜素、DHA、EPA等营养物质[1]。小球藻大规模培养过程中常伴有杂菌污染,并且培养条件的不同对其生长发育和代谢产物的合成积累影响较大。因此,杂菌防除和培养条件的优化是小球藻规模化培养的两个非常重要环节。
小球藻细胞壁极易吸附细菌,细菌与小球藻形成共生体系,不易除去[2]。从小球藻的生长曲线上来看,带菌体系并没有显著影响小球藻的生长,但是小球藻的稳定期时间却明显减少,无菌的小球藻稳定期时间是有菌小球藻的4倍左右。稳定期是小球藻积累代谢产物的主要时期,如油脂积累就主要在这个时期。高油脂含量是制取生物柴油的前提,所以建立无菌培养体系延长小球藻的稳定期,对增加小球藻的油脂积累或其它高附加值天然产物含量非常重要。
在小球藻培养过程中,培养条件的不同严重影响小球藻的生长以及油脂的积累,例如,在不同盐浓度、光照强度、pH等条件下,小球藻生长速率有显著差异。藻液中营养元素含量的不同则导致小球藻细胞体内油脂积累不同。因此,优化培养条件可提高小球藻规模化培养效率,获得最佳目标化合物产量[3]。
本试验选取5种常用抗生素,研究其不同剂量和组合对埃氏小球藻固体和液体培养体系的除菌效果和对小球藻生长等的影响。着重分析了小球藻液体培养中接种浓度、温度、pH和盐浓度对埃氏小球藻生物量及生长的影响。通过综合各种参数和评定, 建立了埃氏小球藻无菌培养体系和优化的培养条件。为该种优质小球藻规模化培养和开发利用提供了技术和科学参考。
1 材料和方法
1.1 材料
藻种:本试验所用的埃氏小球藻(ErichsenChlorella)株系SXND-12由山西农业大学分子农业与生物能源研究所从山西省境内分离、鉴定获得。
抗生素:氨苄霉素(Amp)、羧苄霉素(Car)购自广州博衍生物科技有限公司。头孢霉素(Cefo)购自郑州豫新制药公司。利福平霉素(Rif)、硫酸新霉素(Nw)购自Invitrogen公司。所有抗生素均是粉末,母液的配制参照钱文倩的方法[4],并用0.22 μm滤膜过滤除菌。
培养基:BG11液体和固体培养基按照表1配制,用1 mol·L-1的盐酸和氢氧化钠将液体培养基的pH调至6.5左右,高压灭菌20 min,温度为121 ℃。灭菌前固体培养基中添加1.2%的琼脂。试验中按照要求分别加入抗生素。
2216E固体培养基[5]成分见表2:调节pH到7.4~7.8。
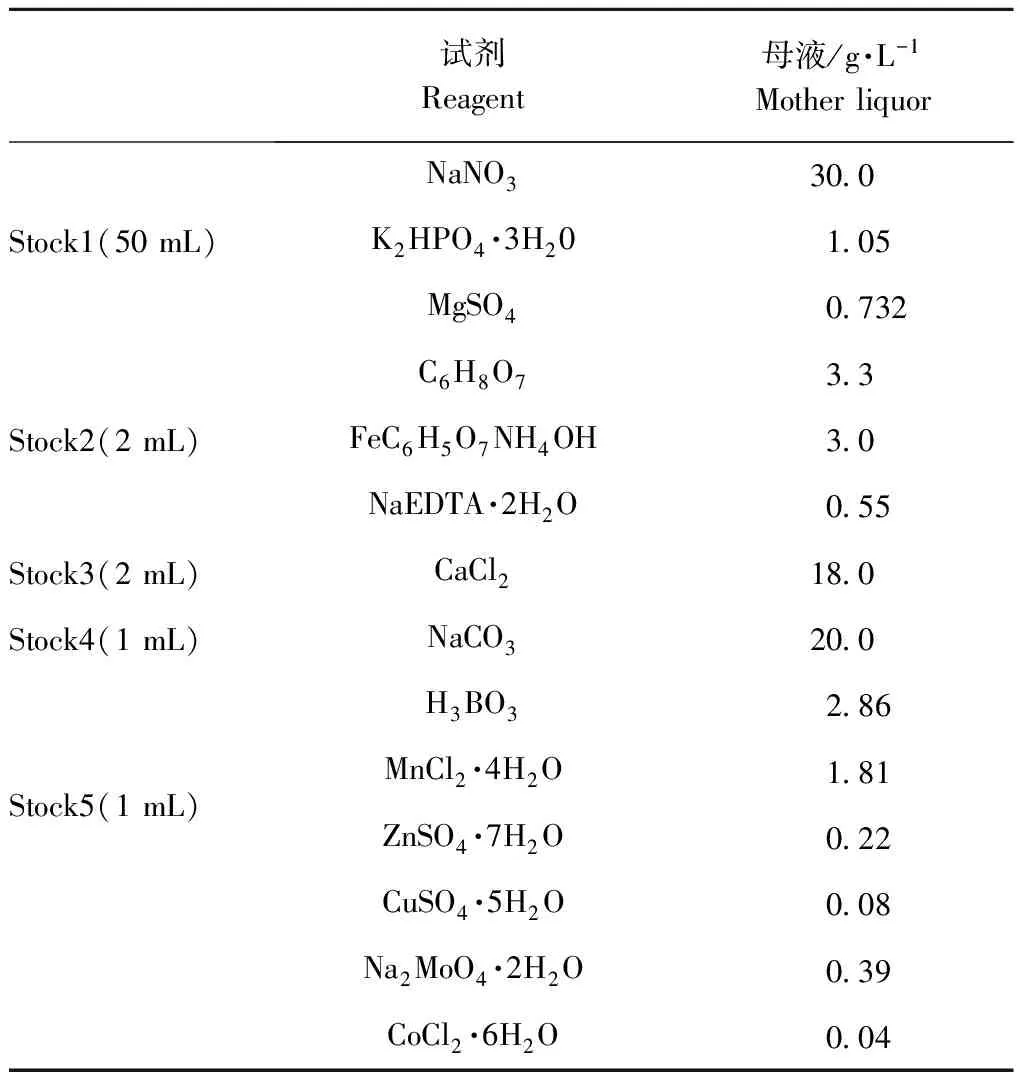
表1 BG11培养基(母液)配方

表2 2216E培养基配方
1.2 方法
1.2.1 培养方法
接种物的制备:在平板上挑取体积较大,生长状态良好的埃氏小球藻藻落,利用接种针将其接种于含有一定量新鲜培养液的三角烧瓶中,一周后转接到体积为250 mL三角烧瓶进行扩大培养,生长至指数期离心,转速为6 000 r·min-1,时间 5 min,倒掉上清液,无菌水洗涤2~3次,用一定量新鲜的灭菌的培养液悬浮,用于接种。
液体培养:将悬浮液转接到含有一定量培养液的100 mL的三角烧瓶中,利用纱布将瓶口包裹若干层,防止细菌侵入。设置培养条件为光照强度 5 000 lx,湿度控制在50%,温度控制在(25+0.5)℃,光暗比12∶12,PH 8.5。
固体培养:取一定量对数期的藻液,精确稀释至合适浓度,取100 μL涂布于BG11固体平板上,设置培养条件为光照强度 5 000 lx,湿度控制在50%,温度控制在(25+0.5) ℃。
1.2.2 5种抗生素及组合除菌效果及对埃氏小球藻生长影响的检测
小球藻敏感性检测:通过液体培养试验进行小球藻对抗生素敏感性的深入研究,Amp,Car,Nw,Cefo4种抗生素试验梯度分别设置为0、100、200、300、400、500 mg·L-1;利福平的试验梯度设置为0、10、30、70、100 mg·L-1。取一定量的对数生长期末期的小球藻藻液加入100 mL的三角烧瓶中,并加入相应的抗生素,封口防止空气中的细菌进入。设置培养条件:光照强度3 500 lx,光暗比12∶12 h,温度25 ℃,pH 8.5,每天固定时间测小球藻的生长量。
细菌敏感性检测:取少许生长至稳定期的藻液,精确稀释到10-1,10-2,10-3,10-4,10-5,10-6倍,取100 μL涂布于固体的2216E平板上,在温度为23 ℃的培养箱内培养10 d,通过统计平板上的菌落数获得此条件下细菌的最佳稀释梯度。取少许生长至稳定期的藻液,按最佳稀释度稀释,取100 μL涂布于固体的2216E平板上。将直径为5.5 mm的已灭菌的滤纸,在不同抗生素浓度下,至少浸泡20 s,将其贴在固体平板的中心位置,3 d后测量抑菌圈的大小。
混合抗生素除菌检测:挑取固体平板上生长状态良好的单菌落进行液体培养,获得不含霉菌的藻液用于后续试验。根据试验结果,选择合适的抗生素,根据各种抗生素的不同特性,设计抗生素的组合方式及试验浓度。按设计要求将各种抗生素加到处于对数生长期末期的三角烧瓶中,2 d后取适量的藻液稀释后涂布于2216E固体平板上检测细菌,每隔3 d按相同的剂量在藻液中追加抗生素,培养2 d后再涂布于2216E固体平板上检测细菌。重复加3次抗生素,在2216E固体平板上初步检测除菌效果。
根据抗生素的抑菌原理,设计组合方式:(1)Amp,Car,Cefo(2)Rif,Cefo。并且以不同的浓度进行组合。
无菌体系的检测:对初步鉴定为无菌体系的藻株进行传代培养,完全消除抗生素的影响后采用LB,2216E,牛肉膏蛋白胨培养基进行细菌的最终检测,培养基配方见表3。
无菌体系下小球藻生长状况检测:将无菌的小球藻和含菌的小球藻按初始OD值0.2的接种量进行接种,置于光照培养箱内,温度25 ℃,光照强度设置为3 500 lx,光暗时间比设置成12 h∶12 h,藻液的pH 值控制在8.5左右培养,每天定时测藻液的生长量,观察小球藻的生长状况及每个生长阶段的变化。
1.2.3 无菌体系下培养条件的优化
将无菌的小球藻按初始OD值0.2的接种量进行接种,置于光照培养箱内,温度25 ℃,光照强度设置为3 500 lx,光暗时间比设置成12 h∶12 h,初始pH 8.5,每天定时测藻液的pH(每天早晚测一次,相隔12 h),监测pH变化。在此条件下分别研究pH、接种量、培养温度、盐浓度对埃氏小球藻生长的影响。其中pH梯度设置为3.5、4.5、5.5、6.5、7.5、8.5、9.5,培养过程中使用1 mol·L-1酸碱调节;接种初始OD设置为0.05、0.10、0.15、0.20、0.25;温度梯度设置为10、17、25、32、40 ℃;盐浓度梯度设置为0.01、0.05、0.1、0.2、0.4 mol·L-1,各组试验每天定时测藻液的生长量。
2 结果与讨论
2.1 液体培养条件下埃氏小球藻对5种抗生素敏感性
试验结果显示,在所设剂量范围内,Amp、Car、Cefo、Nw对固体培养基上埃氏小球藻的正常生长基本没有受到影响。如图1所示,在试验浓度范围内液体培养条件下4种抗生素基本不影响小球藻的生长。图2是在小球藻在加入不同浓度Rif下培养10 d后的结果,藻液颜色鲜绿,显微镜下微藻细胞结构完整,对藻体的生长没有明显的影响。这与固体培养时的试验结果稍有差异(固体培养时100 mg·L-1浓度致死率为53.75%)。可能原因包括:液体中藻细胞能更好的利用溶解在水中的二氧化碳进行光合作用,并且此次试验选取的是小球藻生长稳定期的藻液,藻液中有大量的代谢产物,其中的某些成分可能中和了抗生素的作用,使其药效降低。
表3 LB和牛肉膏蛋白胨培养基配方
Table 3 Medium composition of LB and Beef extract peptone

试剂Reagent工作液/g·L-1WorkingfluidLB培养基牛肉膏蛋白胨培养基胰蛋白胨10酵母提取物5氯化钠10琼脂粉150蛋白胨10牛肉膏3氯化钠5琼脂粉15
试验结果表明这5种抗生素在实验浓度范围内并未对小球藻的生长造成影响,可直接进行无菌培养体系的研究,无需再考虑其对小球藻生长上的影响。

图1 四种抗生素(A)氨苄霉素,(B)头孢霉素,(C)羧苄霉素和(D)硫酸新霉素对埃氏小球藻生长的影响Fig.1 Effect of four kinds of antibiotics(A) Ampicillin, (B) Cephalosporins, (C) Carbenicillin and (D) Neomycin sulfateon on Erichsen Chlorella growth

图2 不同浓度利福平对埃氏小球藻生长的影响Fig.2 Effect of Rifampicinon concentration on Erichsen Chlorella growth
2.2 藻液中细菌对抗生素的敏感性
通常认为抑菌直径超过20 mm表明抗生素对这种菌具有良好的抑制作用[5],通过药敏试剂法[6]得到Cefo、Amp、Car、Nw、Rif在相应浓度下的抑菌直径,结果见表4。硫酸新霉素没有较好的抑菌能力,而利福平霉素却表现出极强的抑菌特性,形成了明显的3个透明圈。最里面的透明圈完全无菌,外面两个透明圈菌落较多,种类不一。可能在较低浓度时只抑制某些细菌的生长。另外羧卞霉素,氨苄霉素对某些细菌的抑制效果较好,考虑到细菌对药物的耐受性及整体的除菌效果,本试验选择多种抗生素混合使用以求达到更好的抑菌效果[7]。
表4 不同抗生素在相应浓度下抑菌直径
Table 4 Suppress diameter of different antibiotics on bacteria
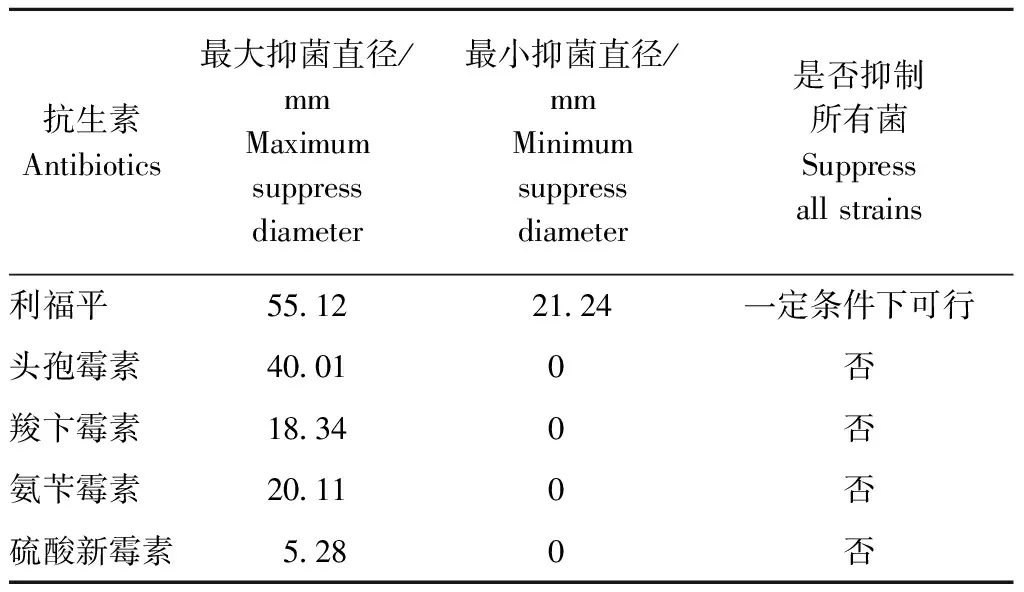
抗生素Antibiotics最大抑菌直径/mmMaximumsuppressdiameter最小抑菌直径/mmMinimumsuppressdiameter是否抑制所有菌Suppressallstrains利福平55122124一定条件下可行头孢霉素40010否羧卞霉素18340否氨苄霉素20110否硫酸新霉素5280否
2.3 埃氏小球藻无菌体系的建立
在埃氏小球藻生长过程中会伴随着多种菌的存在,比如透明的水泡状菌株,乳白色、黄色、橘红色、土黄色的细菌菌株,还有一些性状不规则的细菌等。这些细菌一部分对埃氏小球藻的生长有利,一部分则是埃氏小球藻的竞争者,一旦竞争性强的细菌在生长过程中占据优势,就会严重抑制培养液中埃氏小球藻的生长[9]。
氨苄霉素,羧卞霉素,头孢霉素,利福平等抗生素具有杀菌作用,而且抗生素杀菌原理之一就是选择性毒理[8]。选择适宜的抗生素可以在不影响微藻生长的基础上选择性地抑制或杀死细菌,是一种比较理想的除菌方法[9]。本试验将几种抗菌谱不同的抗生素组合[10~14],建立埃氏小球藻无菌体系。
表5为第一种混合方式(Amp+Car+Cefo),如果只用抗生素处理一次,均不能达到完全除菌的效果,追加一次抗生素处理后,B5浓度下,小球藻生长处于无菌状态。将此小球藻严格无菌操作转接5次左右,完全消除抗生素的影响。然后,用固体平板培养的方法在2216E、LB、牛肉膏蛋白胨等培养基来检测除菌效果,经对比分析,确认B5组合处理方式可得到良好的无菌藻株。

表5 第一种混合方式(Amp+Car+Cefo)的除菌效果
注:B0:无抗生素对照; B1:200+200+50; B2:400+400+100; B3:600+600+150; B4:1 000+1 000+300; B5:2 000+2 000+500/mg·L-1
Note:B0:No antibiotics against B1:200+200+50; B2:400+400+100; B3:600+600+150; B4:1 000+1 000+300; B5:2 000+2 000+500/mg·L-1
表6第二种混合方式(Rif+Cefo)具有良好的除菌效果,用相应的抗生素处理一次,A4,A5这两个浓度下初步判定无细菌存在。用抗生素追加处理一次除菌效果更加明显。在所设置的试验浓度下,将藻液涂布于2216E平板上无细菌出现。将其进行若干次继代培养,完全消除抗生素的影响。然后在2216E,LB,以及牛肉膏蛋白胨等固体培养基上进行细菌检测,确认A2~A5这4种剂量的组合处理两次均可获得埃氏小球藻的无菌体系。考虑到细菌会逐渐对抗生素产生抗性及过多使用抗生素的危害,所以本试验选取A2组合,处理两次作为建立无菌体系的最佳途径。

表6 第二种混合方式(Rif+Cefo)的除菌效果
注:A0:无抗生素对照 A1:10+50; A2:30+100; A3:50+150; A4:70+200; A5:100+300/mg·L-1
Note:A0:No antibiotics against A1:10+50; A2:30+100; A3:50+150; A4:70+200; A5:100+300/mg·L-1
2.4 无菌体系对埃氏小球藻生长的影响
将获得的完全无菌的埃氏小球藻和带菌的埃氏小球藻置于完全相同的条件下进行培养,小球藻生长曲线如图3所示。从生长趋势来看微藻可以和细菌共存,两种状态下藻液的最终细胞密度基本一致。
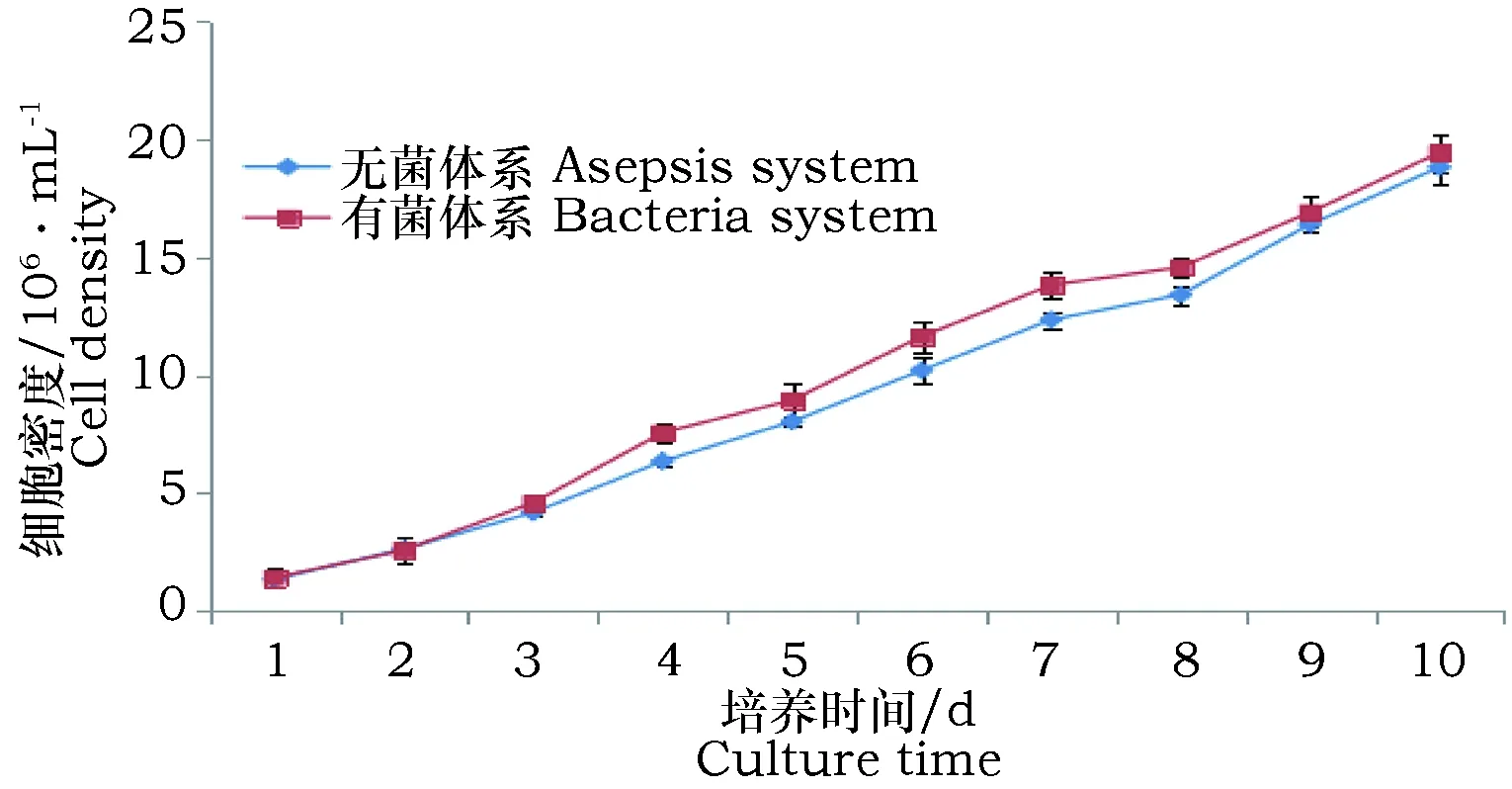
图3 细菌对小球藻生长的影响Fig.3 Effect of bacteria on Chlorella growth
达到稳定期之后,图4所示无菌的埃氏小球藻稳定期20 d后摇动培养瓶,观察到无菌体系的微藻能长期保持鲜绿的颜色,其稳定期时间能达到有
菌培养时小球藻的3~5倍,并且没有聚沉的现象。而杂菌较多时小球藻2周就可能出现聚沉现象。这可能是由于细菌的存在分泌了某些粘性物质,使微藻附着在一起,光合作用降低,产生的有机物减少,造成呼吸作用不顺,产生大量代谢废物,从而导致其生存环境的恶化[15]。
2.5 不同培养条件因子对埃氏小球藻生长的影响
2.5.1 pH对埃氏小球藻生长的影响
由图5(A)可知,小球藻适宜的pH生长范围在5.5~9.5之间,酸度较大不利于小球藻的生长,pH值低至4.5时藻细胞的生长受到很大的影响,生物量极小,尤其是当pH值小于3.5时藻细胞几乎不再生长。pH值过大对藻细胞的正常生长也极为不利,若pH达到11,藻液中大量的OH-离子会与藻液中的Ca2+形成大量沉淀,造成营养成分的缺失,影响藻细胞的生长。
本试验得出藻细胞对pH值的承受范围是7.5~9.5。而平时配制培养基进行批量培养时并不需要灭菌处理,这时培养基的pH值大多处在8.0~8.5,完全处在小球藻生长的最佳pH范围,因此大批量培养时并不需要对培养液的pH值进行调节。从小球藻生长过程中pH的变化来看,最大pH能达到10左右,并最终稳定在碱性环境中生存。这主要是由于藻液中的NO3-和 HCO3-共同作用的结果:藻细胞吸收NO3-时导致H+发生共转运,藻液pH上升;另一方面由于HCO3-的不断消耗使缓冲体系不断向碱性漂移[5]。最终微藻稳定在碱性环境中生存下来,这时藻液的pH值可能达到10左右,但并不会抑制其生长,所以大规模的培养过程中并不需要刻意的调节pH值。

图4 不同条件下(A无菌状态,B有菌状态)埃氏小球藻稳定期生长状态Fig.4 Growth state of Erichsen Chlorella at stable stage under different (A sterile, B unsterile) conditions
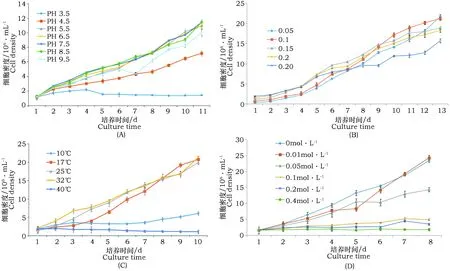
图5 不同培养条件(A) pH、(B)接种量、(C)温度、(D)盐浓度对埃氏小球藻生长的影响Fig.5 Effect of different culture conditions by (A) pH,(B) inoculum dose,(C) temperture,(D) salt concentration on Chlorella Growth
2.5.2 接种量对小球藻生长的影响
由图5(B)可知,当小球藻接种的初始OD值达0.1或以上时,小球藻的生长趋势几乎一致,当小球藻接种的初始OD值为0.05时小球藻的相对生长速率明显降低。在大规模的培养中,接种量对微藻的生长影响较为明显,以本实验室1 000 L的立式光反应器为例,若接种量过低,在生长初期细菌为优势生长种群,细菌的大量繁殖会造成培养液成分的大量损失,另一方面还可能会导致对微藻生长有害的菌类的大量生长,造成微藻的死亡,对生产造成巨大的损失;若接种量过大,一方面会增加成本和工作量,另一方面还会带来旧培养液中大量的代谢物及病原菌,对微藻的生长不利[16],因此合适接种量的选择在大规模生产中非常重要。本实验的研究结果得出接种时OD值为0.15~0.20最佳,综合考虑大规模培养时细菌的影响,选择小球藻接种的初始OD为0.20是较为理想的接种量。
2.5.3 温度对埃氏小球藻生长的影响
由图5(C)可知,小球藻适宜的生长温度在17~32 ℃,温度过高或过低均不利于小球藻的生长;当温度低至10 ℃时,小球藻的生长受到抑制,生长缓慢,但是将其转移到合适的温度时小球藻在短时间内就可以恢复生长,说明低温有延缓其生长的作用。当温度高至40 ℃时,小球藻很快发黄,生长滞缓,将其转移至合适的温度下,也不能恢复生长,说明高温将小球藻全部致死。
17~32 ℃ 是小球藻可正常生长的温度范围,17 ℃时,小球藻的最终生长密度没有降低,但是它的生长速率却比较缓慢。25 ℃和32 ℃时,小球藻的生长速率及最终的生长密度基本一致,但温度过高时,藻液蒸发较快,造成有效营养成分的含量发生变化,对微藻藻细胞的生长不利,所以25 ℃是小球藻生长的最佳温度。
2.5.4 盐浓度对埃氏小球藻生长的影响
由图5(D)和图6可见,盐浓度对藻细胞的生长影响较大,盐浓度过大时,小球藻藻液颜色发黄,生长滞缓。培养液中钠盐的浓度为0.05 mol·L-1时,藻细胞的生长被严重抑制,显微镜下观察到细胞颜色发黄,当培养液中钠盐的浓度达到0.2 mol·L-1及以上时,藻细胞几乎完全停止生长,绝大多数细胞的细胞膜和细胞壁发生破裂,大量内容物流出。其可能原因为随着盐浓度的升高,细胞外液渗透压越来越大,致使藻细胞大量吸水膨胀,最终导致细胞破裂大量内容物流出。

图6 盐浓度对小球藻生长的影响Fig.6 Effect of salt concentration on Chlorella growth
3 结论
通过本试验研究发现,氨苄霉素,羧卞霉素,头孢霉素,利福平均对埃氏小球藻培养液中的细菌有一定的抑制作用,但对小球藻的生长影响不大,可用作埃氏小球藻除菌试剂。利用涂板法除去埃氏小球藻中霉菌,抗生素组合使用A2(Rif+Cefo)(30+100)(单位mg·L-1),处理两次,除菌效果良好,以此建立埃氏小球藻无菌培养体系。其中,组合抗生素的应用可避免杂菌耐药性的问题。在此无菌培养体系下,通过不同培养条件的实验研究,确定在pH 8.5~9.5,接种初始OD值0.2,温度(25±0.5)℃,盐浓度小于0.01 mol·L-1时,埃氏小球藻生长状况良好,该条件即埃氏小球藻最佳生长条件。
[1]周文俊,郑立,郑明刚,等.海洋微藻的无菌化处理及对其生长特性和生化组成的影响[J].海洋学报(中文版),2012,34(6):177-186.
[2]林伟,陈騳,刘秀云.海洋微藻除菌及除菌与自然带菌微藻生长特点比较[J].海洋与湖沼,2000,31(6):647-652.
[3]丁彦聪,高群,刘家尧,等.环境因子对小球藻生长的影响及高产油培养条件的优化[J].生态学报,2011,(18):5307-5315.
[4]钱文倩.微生物对异养小球藻生长及代谢产物影响的研究[D].上海:上海交通大学,2008.
[5]王逸云.小球藻外源基因转化系统的建立及其表达植酸酶的研究[D].大连:大连理工大学,2005.
[6]林伟.几种海洋微藻的无菌化培养[J].海洋科学,2000,24(10):4-6.
[7]赵培,王雪青,朱潮峰,等.3种常用抗生素应用于海洋微藻无菌化培养的研究[J].天津师范大学学报(自然科学版),2007,27(2):27-30.
[8]沈同,王镜岩.生物化学[M].北京:高等教育出版社,1990:381-396.
[9]Cottrell MT,Suttle CA.Production of axenic cultures ofMicromonaspusilla(PrasinoPhyceae) using antibiotic[J].Phycology,1993,29(3):385-387.
[10]Spencer CP.On the use antiobiotics for isolating bacteria-free cultures of marine phytoplankton organisms[J].Journal of the Marine Biological Association of the United Kingdom,1952,31(1):97-106.
[11]Al-Hhmad A,Daschner FD,Kummerer K.Biodegradarbility of cefotiam, ciprofloxacin, meropenem, penicillin G, and sulfamethoxazole and inhibition of waste water bacteria[J].Archives of Environment Contamination and Toxicology,1999,37(2):158-163.
[12]Jones AK,Rhodes ME,Evans SC.The use of antibiotic to obtain axenic cultures of algae[J].European Jouranl of Phycology,1973,8(2):185-196.
[13]Divan CL,Schones HK.Production of axenic Gonyaulax cultures by treatment with antibiotics[J].Applied and Environmental Miocrobiology,1982,44(1):250-254.
[14]Cottrell MT,Suttle CA.Production of axenic cultures of Micromonas pusilla using antibiotics[J].Jouranl of Phycology,1993,29(3):385-387.
[15]杨世平,刘慧玲,李活,等.两种微藻在无菌和带菌状态下生长特点比较研究[J].渔业现代化,2009,36(5):45-49.
[16]郝雯瑾,王悠,唐学玺.除菌处理对强壮前沟藻和青岛大扁藻生长的影响[J].应用与环境生物学报[J].2009,15(3):326-331.
(编辑:马荣博)
The establishment of sterile culture system and optimization of culture conditions fromErichsenchlorella
Wu Zhenjin, Zhou Guanghang, Zhao Kui,Wang Yajun,Ji Chunli, Xue Jinai, Li Runzhi*
(InstituteofMolecularAgriculture&Bioenergy,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]ErichsenChlorellais a promising candidate for biofuel production for its high lipid content and photosynthetic efficiency. However, contamination and cultivation conditions controlling are two important factors affecting the microalgal biomass and lipid accumulation, as well as the large scale production ofChlorella. [Method]In this study, 5 antibiotics cefazolin and Cephalosporins(Cefo), Ampicillin(Amp), Carbenicillin(Car), Neomycin sulfateon(Nw) and rifampicin and amphotericin (Rif) were tested as bacteriostat with different concentrations and combinations, the effect of the antibiotics on the bacteria inhibition and microalgal growth were explored. In addition, the effects of inoculum, medium culture pH, cultivation temperature and salt concentration in culture medium onChlorellagrowth were also studied. [Results]As a result, a sterile system forChlorellacultivation was established and the cultivation conditions were optimized then. [Conclusion]Results showed that the combination of 30 mL·L-1Rif and 100 mL·L-1Cefo was effectively bacteriostatic in the cultivation system ofChlorella. And the optimal conditions forChlorellagrowth were as follows: OD 0.2 for initial inoculum, pH range 8.5-9.5, cultivation temperature(25±0.5) ℃ and salt density lower than 0.01 mol·L-1.
ErichsenChlorella, Antibiotics, Sterile system, Optimization of cultivation conditions
2016-11-12
2016-12-14
武振晋(1992-),男(汉),山西汾阳人,硕士研究生,研究方向:生物能源代谢工程
*通信作者:李润植,教授,博士生导师,Tel:0354-6288374; E-mail:rli2001@hotmail.com
国家“948”项目(2014-Z39);山西省煤基重点科技攻关项目(FT-2014-01)
Q93-335
A
1671-8151(2017)04-0287-08
