沙漠植物盐爪爪(Kalidiumfoliatum)的耐盐碱性及其对碱性盐胁迫的响应
2017-05-16高翱张芸香郭晋平
高翱,张芸香,郭晋平
(1.山西农业大学 林学院,山西 太谷 030801; 2.山西农业大学 城乡建设学院,山西 太谷 030801)
沙漠植物盐爪爪(Kalidiumfoliatum)的耐盐碱性及其对碱性盐胁迫的响应
高翱1,张芸香1,郭晋平2*
(1.山西农业大学 林学院,山西 太谷 030801; 2.山西农业大学 城乡建设学院,山西 太谷 030801)
[目的]盐爪爪是我国西北盐化荒漠地区的一种盐生植物,以中性盐胁迫试验为基础的研究充分证实了它的强耐盐性,而其对于盐碱混合胁迫的耐受性以及适应性如何则需要进一步研究。[方法]本研究以1 a生盐爪爪幼苗为材料,采用盆栽试验的方法,对以Na2CO3和NaHCO3形成的碱性盐处理条件下盐爪爪幼苗生长和生理指标进行试验观测。[结果]盐碱混合胁迫下,低盐中碱(150 mmol·L-1,pH8.4)处理较有利于盐爪爪苗期生长,Na+含量高于250 mmol·L-1同时pH值达到9.1对盐爪爪生长会产生显著抑制作用,但盐爪爪在Na+含量350 mmol·L-1以及pH值9.7的高盐高碱胁迫下仍然可以生长。碱性盐对盐爪爪生长的抑制和伤害显著大于同浓度的中性盐胁迫。盐爪爪叶脯氨酸和可溶性糖含量随着处理强度加大而显著增加。[结论]本研究揭示了盐爪爪生长发育需要环境中一定浓度的盐离子,且自身具有强耐盐碱性,为选择盐碱地植被恢复种植材料提供理论依据。
盐爪爪; 碱性盐胁迫; 盐浓度; 生理特性
土地盐碱化是一个严重的生态问题,统计显示,中国盐渍土总面积达3 600万hm2[1],山西各类盐碱地有261 800 hm2,其中中度和重度盐碱地占到35.75%,有56 533 hm2因过度盐碱而荒废[2]。利用高耐盐碱植物进行盐碱地生物改良是盐碱地恢复和改良的重要途径。其中,选择适宜的种植材料是实施盐碱地生物恢复和改良的关键,但适宜于盐碱地改良或植被恢复规模化利用的植物中,特别是能够耐受重度盐碱的植物还很有限。
盐爪爪(Kalidiumfoliatum)是黎科盐爪爪属半灌木,主要分布在新疆、青海和甘肃等地区盐渍土地上,如盐湖边、盐化沙地、盐化荒漠等立地条件下。目前关于盐胁迫对盐爪爪种子萌发的影响、盐爪爪耐盐性生理特性、根系适盐特性[3],以及盐爪爪种植对土壤盐分影响[4]等方面的研究成果较多,许多中性盐胁迫试验研究表明,盐爪爪适宜在低浓度中性盐土壤上生长,可忍受高盐胁迫,100 mmol·L-1和300 mmol·L-1浓度盐溶液处理下生长最好[5];NaCl溶液浓度达到200 mmol·L-1会抑制盐爪爪种子萌发,随着浓度升高种子萌发率逐渐降低,1 000 mmol·L-1是种子萌发的耐受上限[6];盐爪爪还具有吸收土壤盐分和改良土质的作用[7]。一般认为,高pH和高盐胁迫的危害性比中性盐更大,但盐爪爪在具有较强耐盐性的同时,是否也具有较强的耐碱性,特别是对以Na2CO3和NaHCO3为主的碱性盐胁迫的耐性如何?盐碱胁迫对植物生长和生理的影响如何?回答这些问题都需要进一步的系统研究。
本研究以1 a生盐爪爪幼苗为研究材料,以Na2CO3和NaHCO3两种碱性盐作为土壤盐碱条件调节剂,采用盆栽试验的方法,通过对盐爪爪生长和生理指标的观测分析,阐明盐爪爪对碱性盐胁迫的耐受性和适应性,为确定盐爪爪作为盐碱地植被恢复种植材料的可能性提供依据。
1 材料和方法
1.1 试验地概述
试验地位于太谷县山西农业大学北院苗圃内,位于12°34′41.46″E、37°25′28.39″N,海拔793 m。气候属于暖温带大陆性季风气候,全年平均气温9.9 ℃,1月平均温-2 ℃,极端低温-20 ℃,7月平均温24.5 ℃,极端高温34 ℃,全年无霜期181 d,有效积温3 529 ℃,全年降水量465.8 mm,4月平均气温为14 ℃,极端高温31 ℃,5月平均气温19 ℃,极端高温32 ℃。
1.2 试验材料培养
于2016年4月初,挑选颗粒饱满的盐爪爪种子(采自新疆地区),用0.1 mol·L-1的CaCl2溶液在20 ℃恒温箱内浸泡催芽一天,而后与细沙混匀播种于花盆中。花盆直径为25 cm,以苗圃土和培养基质土1:1混合装入盆中,苗圃土为含有养分较少的中性土,培养基质含有机质30%~40%,pH值6.5~7.0,腐殖质含量为15%~20%。出苗后每盆定苗20株,培育6周后供试验用。
1.3 试验设计
碱性盐处理液的pH值和盐离子浓度综合设为5个梯度,1个对照和4个处理。处理液的基本配制是以两种碱性盐Na2CO3和NaHCO3按摩尔比1:9的混合,按Na+逐渐增大的顺序依次设定对照、低盐低碱、低盐中碱、中盐高碱和高盐高碱处理,具体见表1。
胁迫处理试验从2016年5月21日开始,用配制好的不同浓度处理液浇灌,每盆浇灌量300 mL,对照以等量蒸馏水代替,每5 d浇1次,持续处理30 d,时间在16:00~18:00。花盆底部配有托盘,溢出的液体再倒回盆中。花盆置于遮雨棚下,共分为5个组,每组5盆。处理结束后将植株小心取出,将地下部分与地上部分分开,以供指标测定。
表1 不同盐碱处理液的梯度设定
Table 1 Different saline-alkali processing fluid gradient settings

处理Treatment代号CodeNa+含量/mmol·L-1Na+contentpH对照CK071低盐低碱A5078低盐中碱B15084中盐高碱C25091高盐高碱D35097
1.4 指标测定
(1)主根长和苗高增长率测定:用精度0.01 m直尺分别于处理前测量期初苗高,并于处理结束后测量期末苗高,计算出苗高增长率。计算公式:苗高增长率=(期末苗高-期初苗高)/期初苗高×100%
(2)植株生物量和含水率测定:用精度0.1 mg分析天平测量植物鲜重,并将植物鲜样品通过烘箱在105 ℃下杀青10 min在80 ℃下烘干至恒重后称取干重,计算含水率。计算公式:
含水率=(鲜重-干重)/鲜重×100%
(3)叶绿素含量测定:取新鲜盐爪爪叶片0.5 g,加80%丙酮研磨后离心定容到20 mL,取1 mL提取液,加入80%丙酮4 mL,以80%的丙酮做对照进行比色,分别测量663 nm和645 nm处的OD值。计算公式:
叶绿素浓度=8.02OD663+20.21OD645
叶绿素含量=
式中 OD663和OD645分别为663 nm和645 nm处的OD值,叶绿素浓度单位mg·L-1,叶绿素含量单位mg·g-1。
(4)脯氨酸含量测定:取新鲜叶片0.5 g,用3%磺基水杨酸研磨提取,沸水浴提取10 min,3 000 r·min-1离心10 min,取上清液2 mL,再分别加入2 mL蒸馏水、2 mL冰醋酸、4 mL 2.5%酸性茚三酮试剂置于沸水浴中显色1 h,冷却后加入甲苯静置分层,吸取红色甲苯层于520 nm的波长下比色测量OD值,代入脯氨酸标准曲线中通过计算得到脯氨酸浓度值X(单位mg·L-1)。计算公式:
脯氨酸标准曲线为Y=0.030 7X-0.028 4,R2=0.992 1

(5)可溶性糖含量测定:称取50 mg干样,采用蒽酮比色法,加入80%乙醇,水浴煮沸过滤后定容至10 mL,后取1 mL提取液于分光光度计在 625 nm波长下测定吸光值,根据样品液测定的吸光值从标准曲线上查出相应的可溶糖的浓度值X(单位mg·L-1)。计算公式:
可溶性糖标准曲线为Y=0.008 6X-0.015 4,R2=0.997 5
可溶性糖含量=
(6)丙二醛含量测定:取1 g鲜样品,加10%三氯乙酸研磨,共10 mL,以4 000 r·min-1离心10 min,吸取2 mL上清液加入2 mL 0.6%TBA溶液,煮沸15 min冷却离心,取上清液在450 nm、532 nm和600 nm波长下比色测定吸光值,以水代替上清液 加TBA煮沸离心作为对照。计算公式:
丙二醛浓度=6.45(OD532-OD600)-0.56D450,

式中 OD450、OD532和OD600分别为450 nm、532 nm和600 nm处的OD值,丙二醛浓度单位umol·L-1,丙二醛含量单位nmol·g-1。
1.5 数据统计与分析
通过Excel、SPSS19.0软件对试验数据进行分析处理。其中用SPSS 19.0进行方差分析和多重比较,差异显著性检验采用LSD法,显著水平0.05,用Excel绘图,所有指标测定重复5次以上。
2 结果与分析
2.1 不同强度碱性盐处理下盐爪爪生长指标的差异
对各处理与对照的主根长、鲜重及干重按组进行统计差异分析,结果见表2。
4个处理的各生长指标均高于对照,并随处理强度的加大先增大后减小,其中,主根长以B处理最大,比对照高出44.07%,A、C和D处理分别比B处理低21.32%、8.53%和17.35%,C与D处理间无显著差异;生物量也以B处理的最大,它与A、C、D处理差异极显著,A、C和D处理与B处理相比鲜重分别低23.57%、12.10%、20.45%,干重分别低26.97%、9.44%、13.85%,但C与D处理间的干重无显著差异。
由于期末苗高的组内差异较大,用苗高生长率反映处理间的差异能反映出盐爪爪苗高的变化,分析结果见图1。由图中可以看出,4个处理的苗高增长率都高于对照,分别比对照高出9.83%、30.58%、12.56%、8.45%,其中以B处理的苗高生长率最高,分别比A、C、D处理高出15.89%、13.80%和16.95%。
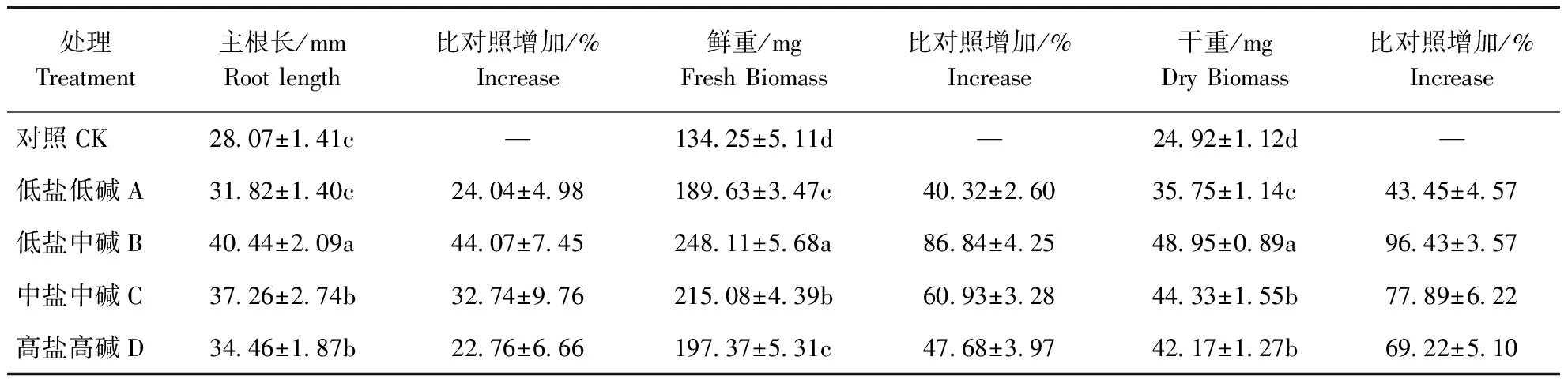
表2 不同强度碱性盐处理下盐爪爪各生长指标的变化
注:同列用不同小写字母表示差异显著(p<0.05)
Note:Different small letters show significant difference at the 0.05 level in the same row
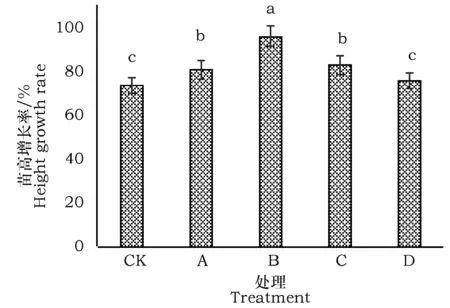
图1 不同强度碱性盐处理下盐爪爪苗高增长率Fig.1 Heightgrowth rateof Kalidium foliatum in different treatments of alkaline salt
2.2 不同强度碱性盐处理下盐爪爪生理指标的差异2.2.1 叶绿素含量的差异
盐爪爪在不同碱性盐胁迫和对照之间的叶绿素含量有差异,见图2。
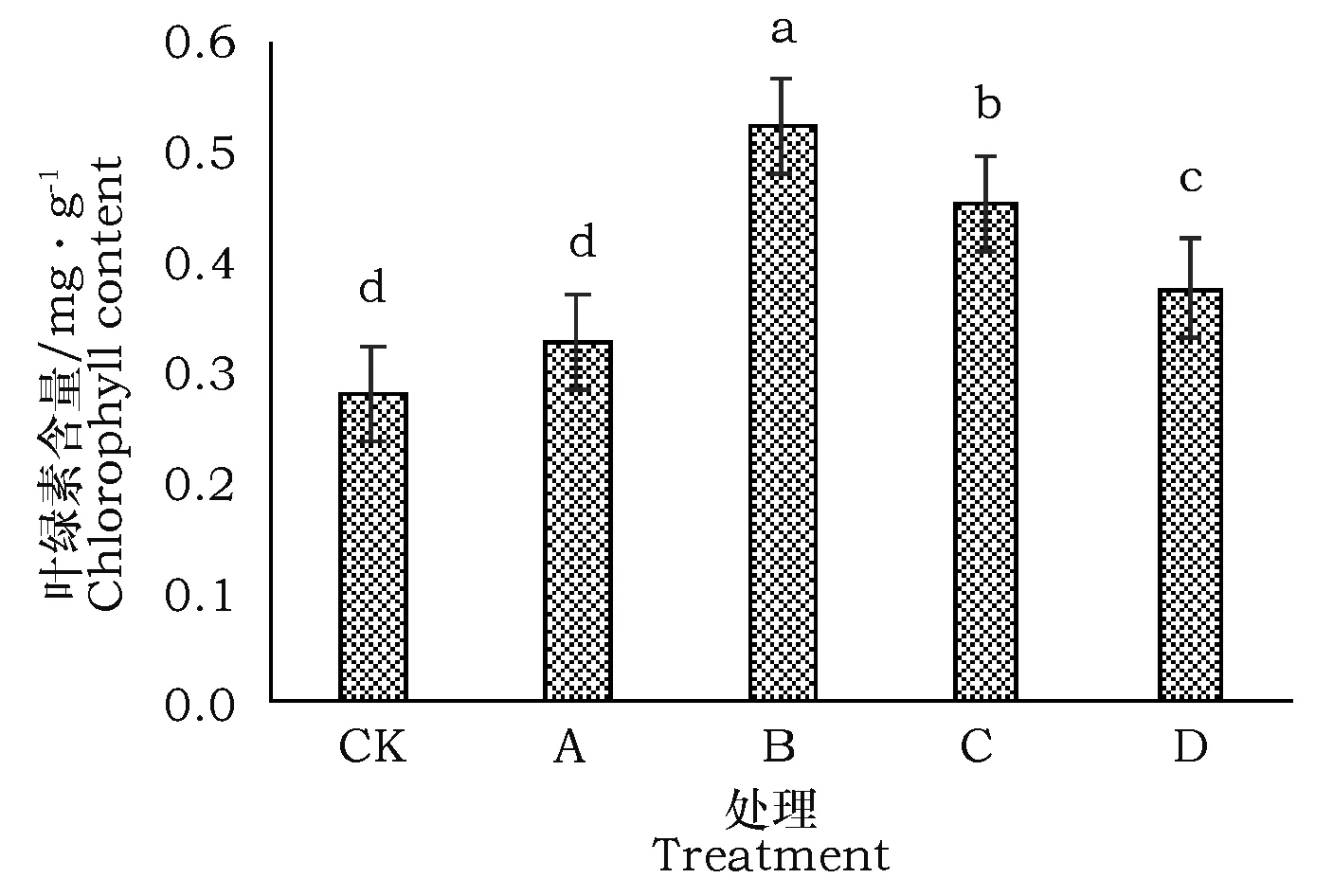
图2 不同强度碱性盐处理下盐爪爪叶绿素含量Fig.2 Leaf Chlorophyll contents of Kalidium foliatum in different treatments of alkaline salt
B、C、D三个处理的叶绿素含量与对照之间的差异极显著,分别高出86.83%、61.21%、34.16%,其中B处理最高,C和D处理比B处理又有显著下降,A处理的叶绿素含量与对照的差异不显著。
2.2.2 脯氨酸含量的变化
不同碱性盐处理与对照之间盐爪爪叶中脯氨酸含量有差异,由图3可见,盐爪爪叶中脯氨酸含量有随盐碱处理强度增加而增加的趋势,B、C、D处理与对照的差异显著,三者分别比对照高出26.12%、31.84%和149.80%,D处理的含量增幅较大,甚至达到了对照的2.5倍。
2.2.3 可溶性糖含量的差异
盐爪爪叶中可溶性糖含量在不同碱性盐处理与对照之间的差异显著,见图4。
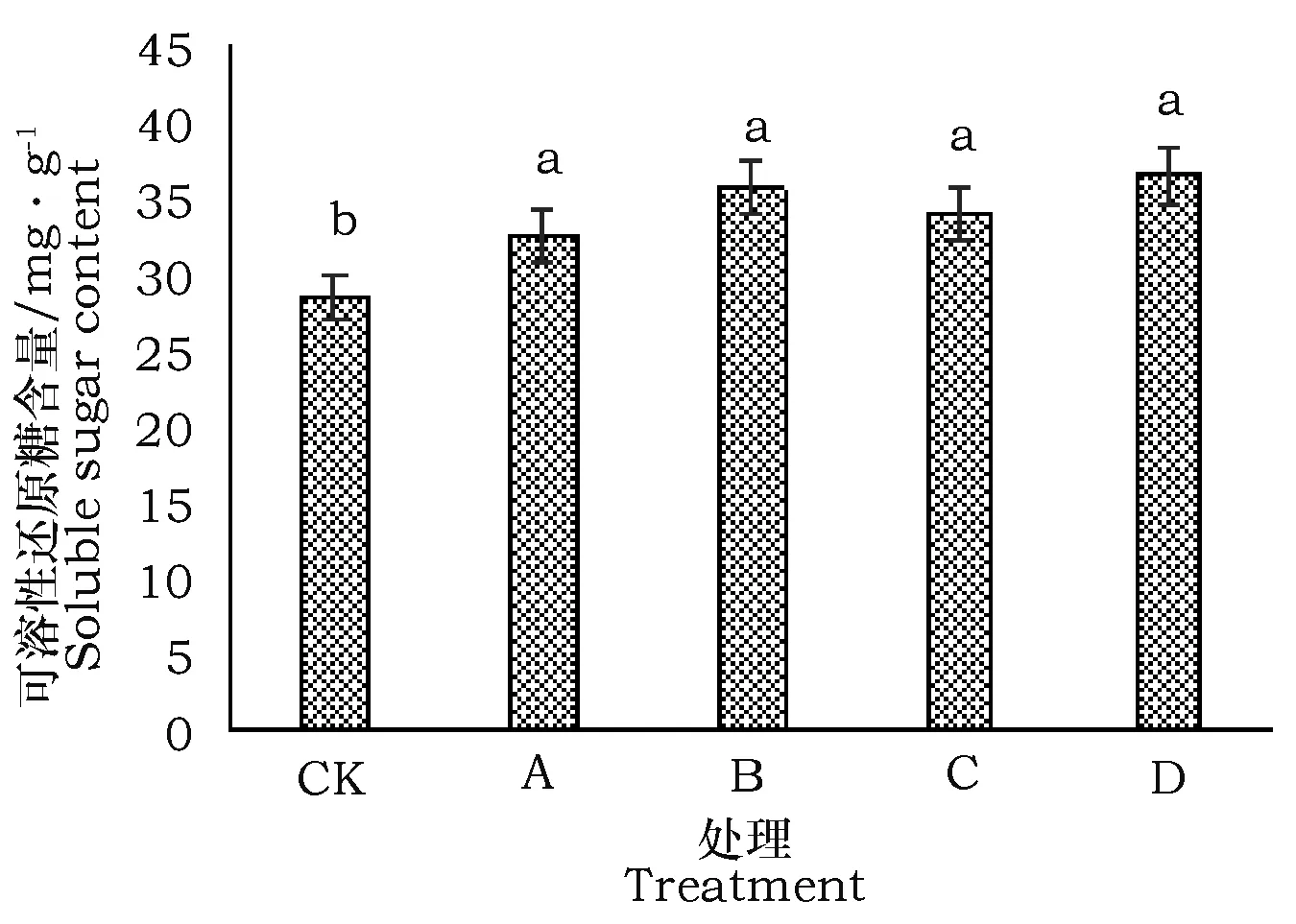
图4 不同强度碱性盐处理下盐爪爪可溶性糖含量Fig.4 Soluble sugar contents of Kalidium foliatum in different treatments of alkaline salt
各处理均明显高于对照,分别比对照高出14.08%、25.02%、19.01%、28.17%,但各处理之间差异不明显,从趋势来看,有随处理强度而升高的趋势。
2.2.4 丙二醛含量的变化
盐爪爪叶中丙二醛含量在不同浓度碱性盐处理间及其与对照之间的存在差异,见图5。可以看出,对照组丙二醛含量最高(11.04 nmol·g-1),依次比各处理高13.94%、61.78%、49.47%、29.72%。各处理中B处理最低,A、C、D处理与B之间差异极显著,分别比B高出41.99%、8.24%、24.71%。

图5 不同强度碱性盐处理下盐爪爪丙二醛含量Fig.5 MDA contents of Kalidium foliatum in different treatments of alkaline salt
2.2.5 植株含水率的差异
由图6可以看出,盐爪爪植株含水率随处理强度的增加逐渐减少,但在不同处理之间没有显著差异,特别是高盐碱处理下也没有显著下降,各处理和对照组的植株含水率在78.63%~81.45%之间,差异很小。

图6 不同强度碱性盐处理下盐爪爪的含水率Fig.6 Moisture contents of Kalidium foliatum in different treatments of alkaline salt
2.3 碱性盐处理对盐爪爪各指标影响的显著性分析
对各测定指标与各处理盐度和pH值以及它们交互作用进行显著性分析,见表3。从表中可以看出,盐度和pH值以及它们的交互作用对盐爪爪苗高增长率、主根长、干重、鲜重以及叶绿素含量、叶脯氨酸含量、叶丙二醛含量的影响极显著(P<0.01),对叶可溶性糖含量的影响显著(P<0.05),对植株含水率影响不显著。
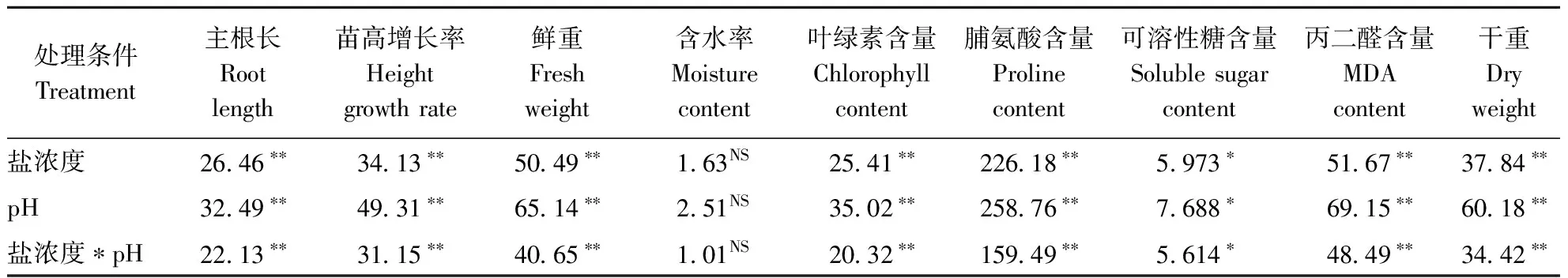
表3 碱性盐处理下盐爪爪各指标的方差分析
注:表内数值均为F值;NS表示不显著;*表示0.05水平上显著;**表示0.01水平上显著。
Note :The numbers are F values in the form. NS show no significant; * show significant at 0.05 level; ** show significant at 0.01 level.
3 讨论与结论
3.1 讨论
盐爪爪是能够生长在盐化荒漠地区的小灌木,由于其生境的特殊,使它成为了研究盐生植物的热点。在总结盐爪爪对中性盐耐受性的基础上进一步研究其对碱性盐处理的响应,分析以Na2CO3和NaHCO3混合组成碱性盐溶液处理下植株生长和生理指标的差异,从而深化盐爪爪对盐碱混合处理的耐受性和适应性。
生境对植物生长的影响会通过生长指标直观的表现出来,如低盐浓度促进盐节木幼苗的生长[8],十分明显的表现在根的生长和生物量的增加,盐碱环境也对盐爪爪的生长产生了显著影响。低盐中碱(150 mmol·L-1,pH8.4)处理下的盐爪爪的各生长指标最高,长势优于其他处理和对照,对盐角草和海滨碱蓬的研究也发现他们适宜在低盐度环境中生长[9],这是因为植物长期在盐渍土壤环境下生长可能形成了需盐适应性,土壤含盐量过少并不利于生长。而中盐高碱(250 mmol·L-1,pH9.1)以上的处理强度对盐爪爪生长抑制显著,生长指标明显降低,但在高盐高碱(350 mmol·L-1,pH9.7)处理下盐爪爪苗高仍有增长,与中盐高碱(250 mmol·L-1,pH9.1)处理相比,根长和干重也没有显著降低,并且生长指标均高于对照,说明尽管中高强度处理对盐爪爪生长有明显抑制,但它的耐盐碱强度高于高盐高碱(350 mmol·L-1, pH9.7)处理。
植物在受到水分胁迫或营养元素吸收不足时,叶绿素含量会降低[10];而丙二醛则是植物在环境胁迫下膜脂过氧化作用而产生的有害物质,过多会大量降解叶绿素对植物生长不利[11]。随着胁迫强度的增加,各组盐爪爪叶绿素含量呈现出先升高后降低的趋势,而丙二醛含量则是先减少后增加,低盐中碱(150 mmol·L-1,pH8.4)处理下叶绿素含量最高,且丙二醛含量最低,说明盐爪爪可能在缺盐环境下获取营养元素不足,在中高强度盐碱环境中又因为盐碱过量而受到离子胁迫[12],而盐爪爪植株含水率并无明显降低。在中性盐胁迫实验中,100 mmol·L-1、300 mmol·L-1和500 mmol·L-1盐浓度下,盐爪爪体内丙二醛含量没有明显差异,生长表现良好,高盐对盐爪爪生长的胁迫不明显[13]。这表明,中高强度碱性盐处理对盐爪爪造成显著伤害,且伤害程度大于同浓度中性盐处理。
植物受到外界盐碱胁迫能够通过合成可溶性有机小分子物质(如游离脯氨酸、可溶性糖等)以降低渗透势,保证从外界吸水,从而缓解高盐环境对植物的渗透胁迫[14],脯氨酸不仅具有渗透调节而且在维护植物体内pH稳定中发挥作用[15],胡枝子[16]和亚麻[17]的盐碱混合胁迫实验都表明,随着盐碱浓度的升高,脯氨酸和可溶性糖含量增加,而小黑麦[18]不具有抗盐碱性,其幼苗含水量随着胁迫的增加而大幅下降。在应对高碱胁迫时,作为酸性代谢物的脯氨酸参与了维持植物体内pH稳定的过程,碱地肤在盐碱胁迫下各部位脯氨酸含量高于单纯盐胁迫[19],在盐碱胁迫下具有双重作用。盐爪爪叶脯氨酸和可溶性糖含量随着处理强度加大而显著增加,使盐爪爪能在一定范围的胁迫下正常吸水以保持植株含水率和pH相对稳定;胁迫强度进一步升高也会导致可溶性糖含量降低,如白刺在盐浓度超过400 mmol·L-1时生长受到严重抑制[20],而盐爪爪可溶性糖含量随胁迫强度加大而始终保持升高趋势,表明高盐高碱(350 mmol·L-1,Ph 9.7)处理未达到对盐爪爪造成致命伤害的程度。
3.2 结论
盐爪爪的生长需要一定浓度的盐离子,在盐碱混合处理下,低盐中碱(150 mmol·L-1,pH8.4)较有利于其苗期生长。
钠离子含量高于250 mmol·L-1同时pH值达到9.1会对盐爪爪生长会产生显著抑制作用,但其在Na+含量350 mmol·L-1以及pH值9.7的高盐高碱胁迫下仍可生长;碱性盐对盐爪爪生长的抑制和伤害显著大于同浓度的中性盐胁迫。随盐碱胁迫强度的加大,盐爪爪通过增加脯氨酸含量和可溶性糖含量以保持植株较高含水率水平,进而保证了相对稳定的植株内环境。表明了盐爪爪具有强耐盐碱性,为选择盐碱地植被恢复种植材料提供理论依据。
[1]王佳丽,黄贤金,钟太洋,等.盐碱地可持续利用研究综述[J].地理学报,2011,66(5):673-684.
[2]车文峰,李帅,穆光远.山西省盐碱地资源调查研究及其开发利用[J].科技情报开发与经济,2012,22(1):106-109.
[3]高瑞如,赵瑞华,杜新民,等.2种盐生植物根系的适盐特性[J].林业科学,2010,46(7):176-180.
[4]彭飞,黄翠华,廖杰,等.盐爪爪群落对土壤盐分影响[J].中国沙漠,2015,35(1):90-93.
[5]张有福,陈拓,费贯清,等.盐度对三种荒漠植物渗透调节物质累积影响的研究[J].中国沙漠,2007,27(5):787-790.
[6]曾幼玲,蔡忠贞,马纪,等.盐分和水分胁迫对两种盐生植物盐爪爪和盐穗木种子萌发的影响[J].生态学杂志,2006,25(9):1014-1018.
[7]赵可夫,范海,江行玉,等.盐生植物在盐渍土壤改良中的作用[J].应用与环境生物学报,2002,8(1):31-35.
[8]高瑞如,赵瑞华,杨学军,等.盐分和温度对盐节木幼苗早期生长的影响[J].生态学报.2009.29(10):5395-5405.
[9]Kurban H,Saneoka H,Nehira K,et al.Effect of salinity on growth, photosynthesis and mineral composition in leguminous plant Alhagi pseudoalhagi(Bieb.)[J].Soil Science and Plant Nutrition,1999,45(4):851-862.
[10]金雅琴,李冬林,丁雨龙,等.盐胁迫对乌桕幼苗光合特性及叶绿素含量的影响[J].南京林业大学学报(自然科学版),2011,35(1):30-33.
[11]Bartels D,Sunkar R.Drought and salt tolerance in plants[J].Critical reviews in plant sciences,2005,24(1):23-58.
[12]赵可夫,范海.盐生植物及其对盐渍生境的适应生理[M].北京:科技出版社,2005:187-245.
[13]杨瑞瑞,曾幼玲.盐生植物盐爪爪的耐盐生理特性探讨[J].广西植物,2015,35(3):366-372.
[14]王东明,贾媛,崔继哲.盐胁迫对植物的影响及植物盐适应性研究进展[J].中国农学通报,2009,25(4): 124-128.
[15]曲元刚,赵可夫.NaCl和Na2CO3对玉米生长和生理胁迫效应的比较研究[J].作物学报,2004,30(4):334-341.
[16]薛菲,王竞红,王磊,等.胡枝子对盐碱胁迫的生理响应[J].东北林业大学学报,2012,40(12):47-50,55.
[17]郭瑞,李峰,周际,等.亚麻响应盐碱胁迫的生理特征[J].植物生态学报,2016,40(1):69-79.
[18]王曙光,周福平,孙黛珍.渗透胁迫对六倍体小黑麦幼苗叶片相对含水量的影响[J].山西农业科学.2007,35(8):3-5.
[19]贾娜尔·阿汗,杨春武,石德成,等.盐生植物碱地肤对盐碱胁迫的生理响应特点[J].西北植物学报,2007,27(1):79-84.
[20]闫永庆,刘兴亮,王崑,等.白刺对不同浓度混合盐碱胁迫的生理响应[J].植物生态学报.2010,34(10):1213-1219.
(编辑:梁文俊)
The saline-alkali resistance of desert plantKalidiumfoliatumand its response to concentration of alkaline salt stress
Gao Ao1, Zhang Yunxiang1, Guo Jinping2*
(1.CollegeofForestry,ShanxiAgriculturalUniversity,Taigu030801,China; 2.CollegeofUrbanandRuralDevelopment,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]Kalidiumfoliatumis a halophyte in the saline desert region of northwest China, these based on the neutral salt stress experiment fully confirmed its strong salt resistance, but it needs to further research to its resistance and adaptability under the saline-alkali mix stress.[Methods]In this study,we used 1aKalidiumfoliatumseedlings as material, adopted the method of pot experiment, observed the growth and physiological indexes ofKalidiumfoliatum’sseedling under condition of alkaline salt treatment formed by Na2CO3and NaHCO3.[Result]Under the saline-alkali mix stress, low salt and middle alkali(150 mmol·L-1, pH8.4) treatment was more favorable for the growth of seedling stage, when Na+content was higher than 250 mmol·L-1meanwhile pH beyond 9.1 would form a significant inhibition for the growth ofKalidiumfoliatum, but it could still live under high salt and high alkali stress of 350 mmol·L-1Na+and pH 9.7. The damage caused by saline-alkali mix stress from alkali salt is significantly bigger than the same concentration of neutral salt.Kalidiumfoliatum’s leaf proline and soluble sugar contents increased with treatment strength.[Conclusion]Kalidiumfoliatumneeded a certain concentration of salt ions to grow and owned strong saline-alkal resistance, it provided the basis for choosing material to plant in saline-alkali land.
Kalidiumfoliatum, Alkaline salt stress, Salinity, Physiological property
2016-11-14
2017-01-06
高翱(1990-),男(汉),山西太原人,硕士研究生,研究方向:生态学
*通信作者:郭晋平,教授,博士生导师,Tel:0354-6288227; E-mail :jinpguo@126.com
Q945.78
A
1671-8151(2017)04-0248-06
