超声波-酶法提取积雪草中积雪草总苷的工艺研究Δ
2017-05-16张丹丹聂绪强赵久凤石秀君杨建文遵义医学院药学院贵州遵义563003遵义医学院附属医院贵州遵义563003
张丹丹,聂绪强,张 涵,赵久凤,石秀君,杨建文,2(.遵义医学院药学院,贵州遵义 563003;2.遵义医学院附属医院,贵州遵义 563003)
超声波-酶法提取积雪草中积雪草总苷的工艺研究Δ
张丹丹1*,聂绪强1#,张 涵1,赵久凤1,石秀君1,杨建文1,2(1.遵义医学院药学院,贵州遵义 563003;2.遵义医学院附属医院,贵州遵义 563003)
目的:优化积雪草中积雪草总苷的提取工艺。方法:以积雪草苷和羟基积雪草苷含量之和为考察指标,采用单因素试验和正交试验对酶用量、酶解时间、酶解温度、乙醇体积分数、液料比、超声提取时间进行考察,优化超声波-酶法提取积雪草中积雪草总苷的工艺条件并进行验证试验。结果:最优提取工艺为纤维素酶用量12mg/g,以10倍液料比加入60%乙醇,60℃酶解60 min,超声提取50min;验证试验中积雪草总苷平均提取率为1.92%(RSD=1.83%,n=3)。结论:超声波-酶法用于积雪草中积雪草总苷的提取,工艺稳定、可行。
积雪草;积雪草苷;羟基积雪草苷;超声波;纤维素酶;提取工艺;正交试验
积雪草[Centella asiatica(L.)Urb.]为伞形科积雪草属植物,全草入药,是我国最早应用的中药之一,中医中药采用积雪草内服和外用已有两千多年的历史,最早记载于《神农本草经》[1-2]。2015年版《中国药典》将积雪草收载为常用中药材,记载其具有清热利湿、解毒消肿的功效,主要用于湿热黄疸、中暑腹泻、痈肿疮毒、跌打损伤等的治疗[3]。积雪草苷为积雪草的主要活性成分,现代药理研究表明,积雪草苷不仅具有显著的促进创面愈合、抑制瘢痕形成作用[4-5],在治疗心血管疾病、抗肿瘤、保护肝脏等方面[6-7]亦具有一定的疗效。
目前积雪草苷的提取方法主要有回流法、超声波法、微波法、酶法等。本课题组基于积雪草总苷(积雪草苷与羟基积雪草苷)的理化性质,同时参考文献[8-9],建立超声波-酶法提取积雪草总苷的方法,同时优化其关键的提取参数,以最大程度地从积雪草药材中提取出该有效成分。
1 材料
1.1 仪器
1260型高效液相色谱(HPLC)仪(美国安捷伦科技有限公司);KQ-500DV型数控超声波清洗器(昆山市超声仪器有限公司);BT125D型十万分之一电子分析天平(德国赛多利斯科学仪器北京有限公司);HH-SL型恒温水浴锅(郑州长城科工贸有限公司)。
1.2 药材、药品与试剂
积雪草(购于遵义药材市场,经遵义医学院生药学教研室杨建文教授鉴定为积雪草全草,符合2015年版《中国药典》收载品种要求);积雪草苷对照品(批号:PS145052301,纯度:98.86%)、羟基积雪草苷对照品(批号:PS14012001,纯度:99.82%)均来源于成都普思科技生物科技股份有限公司;纤维素酶(宁夏夏盛实业集团有限公司,批号:201510,酶活力:40 000U/g);乙腈为色谱纯,其余试剂均为分析纯,水为自制超纯水。
2 方法与结果
2.1 积雪草总苷的含量测定
2.1.1 对照品贮备液的制备 分别取积雪草苷和羟基积雪草苷适量,精密称定,加甲醇制成每1m L含积雪草苷300μg、羟基积雪草苷300μg的溶液,离心(12 000 r/min,离心半径为6.032 cm,下同)15min,取上清液即得对照品贮备液。
2.1.2 供试品溶液的制备 精密称取积雪草苷提取物,加甲醇超声(功率:300W,频率:40 KHz)溶解,制备成含积雪草总苷为5mg/m L的溶液,12 000 r/m in离心15 min,取上清液即得供试品溶液。
2.1.3 色谱条件的确立 参考文献[10]条件。色谱柱:ZORBAX SB-C18(250mm×4.6mm,5μm);流动相:乙腈-2 mmol/Lβ-环糊精溶液(25∶75,V/V);流速:1.0 m L/min;检测波长:205 nm;柱温:30℃;进样量:10μL。在此条件下,供试品中积雪草苷和羟基积雪草苷与相邻主峰均达到良好的基线分离,色谱图见图1。

图1 高效液相色谱图Fig 1 HPLC chromatogram s
2.1.4 线性关系考察 精密吸取积雪草苷和羟基积雪草苷贮备液,加甲醇摇匀制得含积雪草苷和羟基积雪草苷质量浓度均为15、30、60、90、105、120、240μg/m L的混合对照品溶液,进样测定。以混合对照品质量浓度为横坐标(x)、峰面积为纵坐标(y),得二者的回归方程y=2.281 4x(r=0.999 6,n=7)、y=1.911x(r=0.999 4,n=7)。结果表明,积雪草苷和羟基积雪草苷检测质量浓度线性范围均为15~240μg/m L。
2.1.5 精密度试验 取同一供试品溶液,进样6次,测定峰面积。结果,积雪草苷和羟基积雪草苷峰面积的RSD分别为0.73%、0.56%(n=6),表明该仪器精密度良好。
2.1.6 重复性试验 精密称定同一批药材积雪草粉末5 g,共6份,依法制备供试品溶液,进样测定。结果,积雪草苷和羟基积雪草苷含量的RSD分别为3.28%、3.02%(n=6),表明本方法重复性良好。
2.1.7 稳定性试验 取同一供试品溶液适量,分别于0、2、4、6、8、12、24 h进样测定。结果,积雪草苷和羟基积雪草苷含量的RSD分别为0.79%、0.37%(n=7),表明供试品溶液在24 h内基本稳定。
2.1.8 准确度试验 精密量取已知浓度的供试品溶液9份,加入高、中、低3个质量浓度的混合对照品溶液,分别进样测定。结果,积雪草苷和羟基积雪草苷的平均回收率分别为99.8%、101.8%(RSD分别为3.38%、2.27%,n=9),表明本方法准确度良好。
2.1.9 样品中积雪草总苷的含量测定 按“2.1.2”项下方法制备供试品溶液,测定积雪草总苷的含量,计算积雪草总苷质量分数及积雪草总苷提取率:积雪草总苷提取率=[积雪草苷质量分数(g/g)+羟基积雪草苷质量分数(g/g)]×提取物的质量(g)/积雪草质量(g)×100%。
2.2 单因素试验
2.2.1 酶用量的考察 精密称定5.0 g积雪草粉末,5份,分别加入4、8、12、16、20mg/g纤维素酶,以液料比10∶1加入60%乙醇,50℃水浴回流加热60m in,100℃水浴5m in灭酶。在超声功率为300W、温度为25℃条件下超声提取30m in,提取液离心(3 800 r/min)15m in,取上清液备用。上清液经干燥箱干燥后,减压干燥至恒质量,即得积雪草总苷提取物。按“2.1.2”项下方法制备供试品溶液,测定并计算,结果见图2A。

图2 各影响因素对积雪草总苷提取率的影响Fig 2 Effects of different factors on the extraction rateofasiaticosides
由图2A可知,纤维素酶用量在4~8mg/g时,积雪草总苷提取率随酶量增加而增加;当纤维素酶大于8 mg/g后,积雪草总苷提取率下降。因此,选择纤维素酶量为4、8、12mg/g进行后续考察。
2.2.2 酶解时间考察 精密称取5.0 g积雪草粉末,5份,分别加入8mg/g纤维素酶,以液料比10∶1加入60%乙醇,50℃水浴回流加热40、60、80、100、120 m in,100℃水浴5 m in灭酶,超声提取30 min。提取液同“2.2.1”项下方法处理后进样测定,结果见图2B。
由图2B可知,纤维素酶最优酶解时间为60m in。
2.2.3 酶解温度考察 精密称取5.0 g积雪草粉末,5份,分别加入8mg/g纤维素酶,按液料比10∶1加入60%乙醇,水浴(酶解)温度分别为40、50、60、70、80℃,回流加热60m in,100℃水浴5m in灭酶,超声提取30m in。提取液同“2.2.1”项下方法处理后进样测定,结果见图2C。
由图2C可知,当酶解温度为40~50℃时,积雪草总苷提取率呈上升趋势,当温度大于50℃时,积雪草总苷提取率有所下降。因此,选择酶解温度为40、50、60℃进行后续考察。
2.2.4 乙醇体积分数考察 精密称取5.0 g积雪草粉末,5份,分别加入8mg/g纤维素酶,按液料比10∶1分别加入40%、50%、60%、70%、80%乙醇,50℃水浴回流加热60min,100℃水浴5m in灭酶,超声提取30min,提取液同“2.2.1”项下方法处理后进样测定,结果见图2D。
由图2D可知,当乙醇体积分数为60%时,积雪草总苷提取率最高。
2.2.5 液料比考察 精密称取5.0 g积雪草粉末,5份,分别加入8mg/g纤维素酶,分别以液料比10∶1、15∶1、20∶1、25∶1、30∶1加入60%乙醇,50℃水浴回流加热60 m in,100℃水浴5m in灭酶,超声提取30m in。提取液同“2.2.1”项下方法处理后进样测定,结果见图2E。
由图2E可知,当液料比为10∶1~15∶1时,积雪草总苷提取率随液料比的增加而增加;当液料比大于15∶1时,积雪草总苷提取率下降。因此,选取液料比为10∶1、15∶1、20∶1进行后续考察。
2.2.6 超声提取时间选择 精密称取5.0 g积雪草粉末,5份,分别加入8mg/g纤维素酶,以液料比15∶1加入60%乙醇,50℃水浴回流加热60min,100℃水浴5min灭酶,分别超声提取30、50、70、90、110m in。提取液同“2.2.1”项下方法处理后进样测定,结果见图2F。
由图2F可知,当超声提取时间为30~50m in时,积雪草总苷提取率随时间延长而增加;当超声提取时间大于50m in时,积雪草总苷提取率下降。因此,选择超声提取时间为30、50、70m in进行后续考察。
2.3 正交试验优化积雪草总苷提取工艺
前期研究发现,积雪草总苷在60%乙醇中溶解度比较好,故选用乙醇作为溶剂的主要目的是其可溶解药材中浸出的积雪草总苷,单因素试验已筛选出了最优乙醇体积分数和酶解时间,故在正交试验时不再对这2个因素进行考察,而确定以酶用量(A)、酶解温度(B)、液料比(C)和超声提取时间(D)为考察因素,以积雪草总苷(积雪草苷和羟基积雪草苷的含量总和)提取率为评价指标。设计L9(34)正交试验并重复3次以确定最优提取工艺。因素与水平见表1;正交试验结果见表2;方差分析结果见表3。

表1 因素与水平Tab 1 Factorsand levels
由表2和表3可知,各因素对积雪草总苷提取率的影响大小顺序为液料比>酶解温度>酶用量>超声提取时间,其中前三者对积雪草总苷的提取工艺均有显著影响(P<0.05)。最终确定最优提取工艺为A3B3C1D2,即酶用量为12mg/g、酶解温度为60℃、液料比为10∶1、超声提取时间为50m in。
2.4 验证试验
取同一批积雪草药材粉末3份,每份200 g,按照上述最优工艺进行提取,测定积雪草总苷提取率。结果,3次试验中积雪草中积雪草总苷的提取率分别为1.96%、1.92%、1.89%,平均提取率为1.92%(RSD=1.83%,n=3),与正交试验最高值相当,且重现性较好。
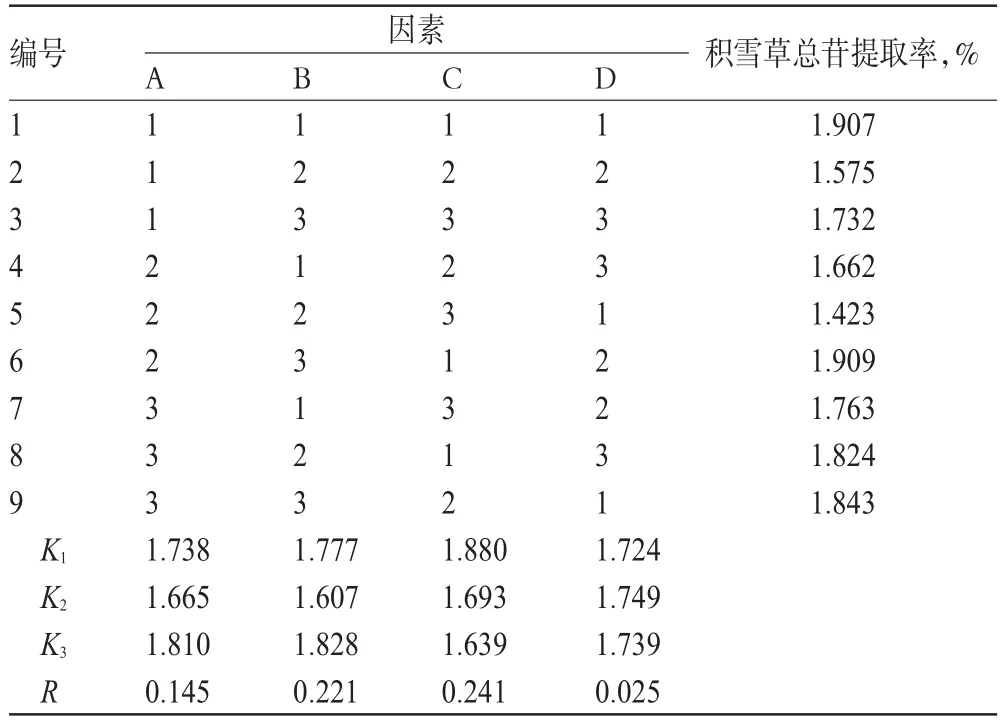
表2 正交试验结果Tab 2 Resultsof orthogonal tests

表3 方差分析结果Tab 3 Resultsof variance analysis
3 讨论
积雪草主要分布于热带、亚热带地区,在我国长江以南各地广泛分布,资源丰富,具有巨大的开发潜力。近年来,对积雪草结构鉴定和活性研究取得诸多进展,但有很多问题尚待解决,如其主要活性成分在天然产物中含量偏低、提取利用率低等。张开莲等[8]以积雪草苷和羟基积雪草苷为考察指标,比较了超声提取、索氏回流和加热回流3种提取方法对积雪草总苷提取率的影响,发现超声提取积雪草总苷质量分数最高,提取率为0.427%,但提取效率仍不高;陈瑶等[11]发现药材与75%乙醇的料液比为1∶20时,超声提取积雪草总苷含量最高,为1.25%,但此提取方法相关要求较多。
植物中的有效成分往往被包裹于细胞壁内难以溶出,如果对细胞壁进行破坏,则有利于内容物的溶出。超声波以一种机械的方法将细胞壁破碎,可以增大物质运动分子的运动频率和速度,增加溶剂的渗透性,从而加速内容物进入溶剂[12],促进积雪草总苷的溶出。酶对药材细胞壁有降解作用。酶的种类很多,包括纤维素酶、果胶酶、蛋白酶等,均能破坏植物细胞的细胞壁。韩伟等[13]运用酶法提取积雪草苷时对纤维素酶、果胶酶、蛋白酶进行比较,结果发现以纤维素酶提取效果最优;樊亮等[14]在提取积雪草总苷时也是采用纤维素酶进行提取。故本试验也选择纤维素酶进行提取。
为节约时间、降低工艺成本,本试验通过超声波辅助纤维素酶法对积雪草总苷进行提取,希望通过二者的结合可以更好地破坏细胞壁及细胞膜,增加有效成分的穿透能力,促进积雪草总苷的溶出。结果表明,与积雪草总苷其他常规提取法比较,超声波辅助酶法能耗低、提取率较高,且耗时短,可降低生产成本。
[1] 贾广韬.积雪草苷的提取、分离纯化与水解[D].杭州:浙江大学,2010.
[2] 陈俊,张晓龙,杨时.高纯度积雪草总苷的制备工艺研究[J].中草药,2014,45(4):504-508.
[3] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:283-284.
[4] Qi SH,Xie JL,Pan S,etal.Effects of asiaticoside on the expression of Smad protein by normal skin fibroblasts and hypertrophic scar fibroblasts[J].Clin Exp Dermatol,2008,33(2):171-175.
[5] Song J,DaiY,Bian D,etal.Madecassoside inducesapoptosis of keloid fibroblasts via am itochondrial-dependent pathway[J].Drug Develop Res,2011,72(4):315-322.
[6] Belcaro G,Dugall M,HosoiM,et al.Pycnogenol®and Centella Asiatica for asymptomatic atherosclerosis progression[J].IntAngiol,2014,33(1):20-26.
[7] Marques NF,Stefanello ST,Froeder AL,et al.Centella asiatica and its fractions reduces lipid peroxidation induced by quinolinic acid and sodium nitroprusside in rat brain regions[J].Neurochem Res,2015,40(4):1197-1210.
[8] 张开莲,张炜.正交试验优化积雪草总苷的提取工艺[J].中国药房,2008,19(21):1618-1620.
[9] 张炜.积雪草总苷提取工艺和含量测定研究[J].泸州医学院学报,2008,31(5):498-500.
[10] 刘宇,陈璐.高效液相色谱法测定三金胶囊中积雪草苷和羟基积雪草苷的含量[J].中国药业,2013,22(22):61-62.
[11] 陈瑶,韩婷,秦路平,等.正交设计法优选积雪草总苷的提取方法[J].中药材,2003,26(3):24-25.
[12] 叶陈丽,贺帅,曹伟灵,等.中药提取分离新技术的研究进展[J].中草药,2015,46(3):257-464.
[13] 韩伟,陈惠丹,樊亮,等.酶法提取积雪草苷[J].南京工业大学学报,2009,31(3):18-22.
[14] 樊亮,王承潇,陈惠丹,等.用酶解预处理-微波法提取积雪草总苷[J].华东理工大学学报,2009,35(4):591-595.
Study on the Extraction Technology of Asiaticosides from Centella asiatica by Ultrasonic-enzyme M ethod
ZHANG Dandan1,NIE Xuqiang1,ZHANG Han1,ZHAO Jiufeng1,SHI Xiujun1,YANG Jianwen1,2(1.College of Pharmacy,Zunyi Medical University,Guizhou Zunyi 563003,China;2.A ffiliated Hospital of Zunyi Medical University,Guizhou Zunyi563003,China)
OBJECTIVE:To optim ize the extraction technology of asiaticosides from Centella asiatica.METHODS:Using total amounts of asiaticoside and hydroxy asiaticoside as investigation indexes,single factor and orthogonal testwere used to investigate the enzyme amount,enzymolysis time,enzymolysis temperature,ethanol volume fraction,liquid material ratio and ultrasonic extraction time and optimize the extraction technology of asiaticosides from C.asiatica by ultrasonic-enzymemethod,and verification testwas conducted.RESULTS:Optimal extraction technology was as follow as cellulose dosage of 12mg/g,10-fold liquidmaterial ratio added into 60%ethanol,enzyme hydrolysis for 60 m in at 60℃,ultrasonic assisted extraction for 50 m in.Average extraction rate of total asiaticosideswas 1.92%(RSD=1.83%,n=3)in verification test.CONCLUSIONS:Ultrasonic-enzymemethod is stable and feasible for the extraction technology of asiaticosides from C.asiatica.
Centella asiatica;Asiaticoside;Hydroxy asiaticoside;Ultrasonic;Cellulose;Extraction technology;Orthogonal test
R284.2
A
1001-0408(2017)13-1816-04
2016-09-09
2017-02-18)
(编辑:刘 萍)
国家自然科学基金资助项目(No.81560712);贵州省科学技术基金项目(No.黔科合LH字〔2014〕7566号);贵州省科技计划课题(No.黔科合重大专项字〔2015〕6010)
*硕士研究生。研究方向:中药质量标准。电话:0851-28642516。E-mail:1450024131@qq.com
#通信作者:副教授,博士。研究方向:生药的质量标准及活性成分分析。电话:0851-28642516。E-mail:niexuqiang@126.com
DOI10.6039/j.issn.1001-0408.2017.13.25
