杜仲不同部位总黄酮含量及抗氧化活性研究
2017-05-16钟淑娟李咏梅黎行山广州医科大学附属第五医院药学部广州50700广州中医药大学中药学院广州50006
钟淑娟,杨 欣,李 静,李咏梅,黎行山(.广州医科大学附属第五医院药学部,广州 50700;.广州中医药大学中药学院,广州 50006)
杜仲不同部位总黄酮含量及抗氧化活性研究
钟淑娟1*,杨 欣1,李 静2,李咏梅1,黎行山1(1.广州医科大学附属第五医院药学部,广州 510700;2.广州中医药大学中药学院,广州 510006)
目的:比较杜仲皮、叶、雄花及籽中总黄酮含量与抗氧化活性。方法:采用紫外分光光度法测定各部位总黄酮含量;以半数清除/还原浓度(IC50)值为评价指标,对各部位样品进行清除2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)(ABTS+)、1,1-二苯基-2-三硝基苯肼(DPPH)自由基试验以及对铜离子(Cu2+)的还原能力试验,并以维生素C为阳性对照。结果:杜仲不同部位总黄酮含量由高到低为叶>雄花>皮>籽,其中除杜仲皮与籽总黄酮含量比较差异无统计学意义外(P>0.05),其余各部位间比较差异均有统计学意义(P<0.05);各样品对ATBS+、DPPH自由基清除作用由强到弱为叶>雄花>籽>皮,其中除杜仲叶与雄花比较各指标差异无统计学意义外(P>0.05),其余各部位间比较差异均有统计学意义(P<0.05);各样品对Cu2+还原能力由强到弱为叶>雄花>皮>籽,其中叶、雄花与皮、籽比较差异有统计学意义(P<0.05)。结论:杜仲叶与雄花部位总黄酮含量较高、抗氧化活性较强,可进行相应的开发利用以弥补传统药用部位杜仲皮资源的不足。
杜仲;皮;叶;雄花;籽;总黄酮;抗氧化活性
杜仲(Eucommia ulmoides Oliv.)是杜仲科杜仲属植物,又名丝连皮、胶木、思仙、思杜等,是我国特有贵重中药材,亦为我国二级珍稀濒危保护品种。杜仲具补中益气、坚筋骨、强志、安胎之功效,在《神农本草经》和《本草纲目》中均被列为药之上品[1-2]。杜仲中含有黄酮类、木脂素类、苯丙素类、萜类、环烯醚萜类、多糖类等成分,具有降血压、降血脂、降血糖、抗炎、保肝、抗肿瘤等药理作用[3-4]。但随着杜仲的消耗量逐渐增加,且其传统药用部位为皮部,导致杜仲资源日益枯竭,故研究者开始发掘杜仲其他部位的利用价值。现代药理研究表明,杜仲雄花、籽、皮、叶有相似的化学成分,提示其具有相似的药理活性。目前已有的文献报道多单独研究杜仲某部位的总黄酮含量或抗氧化活性[5-6],而未综合比较杜仲不同部位的总黄酮含量及其抗氧化活性,故本文对杜仲不同部位总黄酮含量及抗氧化活性进行比较研究,为合理开发杜仲相关制剂及产品提供依据。
1 材料
1.1 仪器
8453E型紫外-可见分光光度计(美国安捷伦科技有限公司);XT220A型分析天平(瑞士Precisa公司,d=0.000 1 g);BP211D型分析天平(德国Sartorius公司,d=0.00 001 g);KQ-500型超声波清洗器(昆山市超声仪器有限公司,频率:40 kHz,功率:500W);DFY-200型粉碎机(浙江温岭大德中药机械有限公司);M illi-Q型超纯水仪[默克化工技术(上海)有限公司]。
1.2 药材、药品与试剂
各批杜仲皮、杜仲叶、杜仲雄花和杜仲籽样品产自陕西汉中、湖北宜昌和山西长治等地,经广州中医药大学中药学院林吉教授鉴定为杜仲科杜仲属植物杜仲的皮、叶、雄花和籽;芦丁对照品(中国食品药品检定研究院,批号:100080-200707,纯度:92.5%);1,1-二苯基-2-三硝基苯肼[DPPH,梯希爱(上海)化成工业发展有限公司,批号:QQQDM-KN,纯度:97%];2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)(ABTS+)二铵盐(ABTS二铵盐,批号:20150315,纯度:98%)、新亚铜试剂(批号:20141206,纯度:98%)均来源于美国阿拉丁公司;维生素C(VC,天津市天新精细化工开发中心,批号:20151208,纯度:>99.7%);亚硝酸钠、硝酸铝、氢氧化钠、乙酸铵、乙酸、无水乙醇等试验所用试剂均为分析纯,试验用水为超纯水。
药材样品来源信息见表1。

表1 杜仲不同部位样品来源信息Tab 1 Source inform ation of different parts of the E. ulmoides sam ples
2 方法与结果
2.1 统计学方法
利用SPSS 20.0统计软件对杜仲不同部位总黄酮含量及其抗氧化试验中的半数清除/还原浓度(IC50)进行数据分析。计量资料以±s表示,用方差分析进行组间比较,P<0.05表示差异具有统计学意义。
2.2 总黄酮含量测定
按文献[7-8]方法测定。
2.2.1 供试品溶液的制备 取杜仲皮、叶、雄花、籽粉末(过24目筛)各1 g,精密称定,置于50m L具塞锥形瓶中,加入80%乙醇20m L,超声提取30min,滤过;滤渣再加80%乙醇20m L,超声提取20min,滤过;合并2次滤液,定容至50m L,即得。
2.2.2 芦丁对照品溶液的制备 取芦丁对照品50mg,精密称定,置于25m L量瓶中;加甲醇适量,置于水浴上微热使溶解;放冷至室温,加甲醇至刻度,摇匀,即得芦丁对照品母液。精密量取母液10m L,置于100m L量瓶中,加甲醇至刻度,摇匀,即得(每1m L中含芦丁0.2mg)。
2.2.3 线性关系考察 精密量取芦丁对照品溶液1、2、3、4、5、6m L,分别置于25m L量瓶中,各加水至6.0m L,采用亚硝酸钠-硝酸铝-氢氧化钠显色法:先加入5%亚硝酸钠溶液1m L,混匀,放置6min;后加入10%硝酸铝溶液1m L,摇匀,放置6m in;然后加入4%氢氧化钠溶液10m L,最后加水至刻度,摇匀,放置15min。以相应的试剂为空白,同法显色。在500 nm波长处测定吸光度(A),计算芦丁质量浓度(X,mg/m L)。以A为纵坐标、X为横坐标,绘制标准曲线,用最小二乘法对标准曲线进行线性回归,得回归方程A=12.18X+0.085(r=0.999 5),即芦丁检测质量浓度线性范围为0.008 9~0.053 5 mg/m L。
2.2.4 方法学考察 按相关方法进行方法的精密度、重复性、稳定性、准确度考察。结果,精密度考察中6次连续测定吸光度的RSD为0.56%(n=6),表明仪器精密度良好;重复性考察中杜仲皮、叶、雄花和籽样品中芦丁吸光度的RSD分别为0.45%、0.5%、0.64%、0.78%(n=6),表明试验重复性良好;稳定性考察中杜仲皮、叶、雄花和籽样品中芦丁含量的RSD分别为0.85%、1.10%、0.94%、1.78%(n=6),表明供试品显色结果在30m in内稳定;准确度试验中杜仲皮、叶、雄花、籽样品中芦丁平均回收率为95.0%~101.0%(RSD均不超过1.50%,n=6)。方法学考察结果表明该方法准确、简便,可用于杜仲不同部位总黄酮的含量测定。
2.2.5 各部位样品中总黄酮含量测定 取杜仲皮、叶、雄花和籽样品各5份,照“2.2.1”项下方法制备供试品溶液,各供试品溶液分别吸取5.0、0.5、3.0、3.0m L置于25 m L量瓶中,照“2.2.3”项下方法显色后测定A,计算杜仲不同部位总黄酮含量:总黄酮含量(%)=(提取液浓度×体积×稀释倍数)/供试品质量×100%,结果见表2。
表2 杜仲不同部位总黄酮含量比较(±s,n=5)Tab 2 Com parison of total flavonoids content in differentpartsof E.ulmoides(±s,n=5)
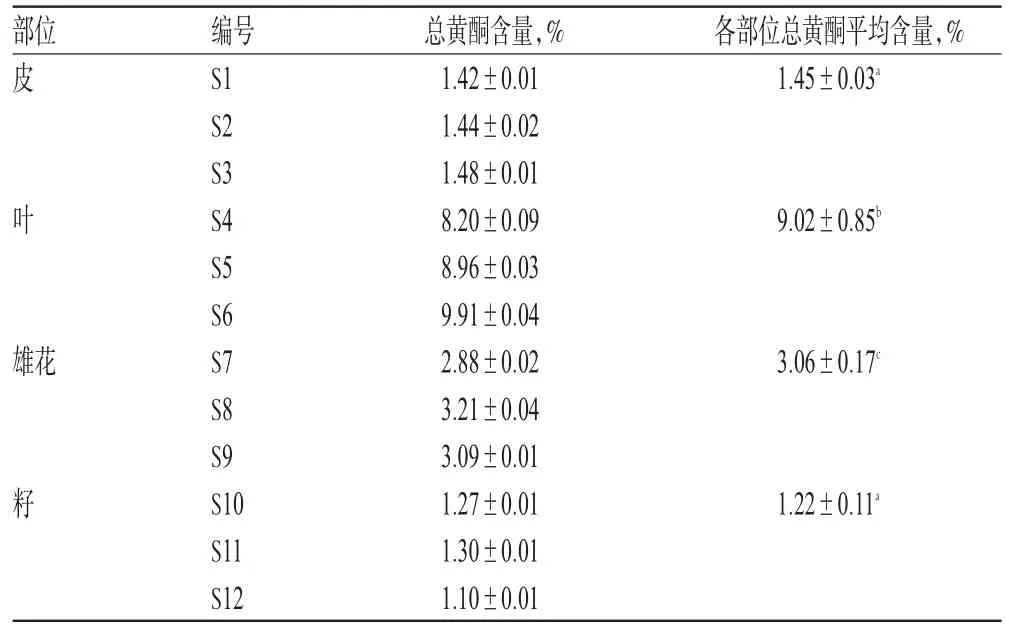
表2 杜仲不同部位总黄酮含量比较(±s,n=5)Tab 2 Com parison of total flavonoids content in differentpartsof E.ulmoides(±s,n=5)
注:同一指标不同组别间,若字母相同,则代表差异无统计学意义(P>0.05);若字母不同,则代表差异具有统计学意义(P<0.05)Note:if there are same letters in the same index among different groups,it indicates the difference is not statistically significant(P>0.05);if the lettersare different,then it indicates the difference is statistically significant(P<0.05)
部位皮编号S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12总黄酮含量,% 1.42±0.01 1.44±0.02 1.48±0.01 8.20±0.09 8.96±0.03 9.91±0.04 2.88±0.02 3.21±0.04 3.09±0.01 1.27±0.01 1.30±0.01 1.10±0.01各部位总黄酮平均含量,% 1.45±0.03a叶9.02±0.85b雄花3.06±0.17c籽1.22±0.11a
由表2可见,杜仲皮、叶、雄花、籽总黄酮平均含量分别为1.33%、9.02%、3.02%、1.22%,排序为叶>雄花>皮>籽。杜仲皮与籽之间比较,P=0.575>0.05,差异无统计学意义;杜仲皮分别与叶、雄花比较,籽分别与叶、雄花比较,叶与雄花比较,P均小于0.05,差异有统计学意义。
2.3 杜仲不同部位抗氧化活性测定
2.3.1 供试品溶液的制备 按“2.2.1”项下方法制备各样品液,用80%乙醇将各部位样品液分别制成质量浓度为0.5、2.0、4.0、6.0、8.0mg/m L(以生药量计)的供试品溶液,备用。
2.3.2 各部位样品对ABTS+自由基的清除作用 分别取“2.3.1”项下各部位系列质量浓度供试品溶液0.6m L置于具塞试管中,分别加入含ABTS+自由基的溶液[分别取ABTS二铵盐(8.1mmol/L)、过硫酸钾(3.2mmol/L)各5m L,混合后暗处放置12 h以上,使用时用80%乙醇稀释至其在734 nm波长处A为0.83左右]3.0m L,室温下放置6min。以80%乙醇为空白溶液,于734 nm波长处测定各样品A;以VC(0.02mg/m L)为阳性对照,其测定方法与各部位样品相同。每组平行测定3次,取平均值,计算自由基清除率[(1-A1/A01)×100%,A01为ABTS+自由基的A值,A1为样品对ABTS+自由基作用后的A值]并计算IC50值,结果见表3。
表3 抗氧化活性试验结果(±s,n=3)Tab 3 Resultsof antioxidantactivity test(±s,n=3)
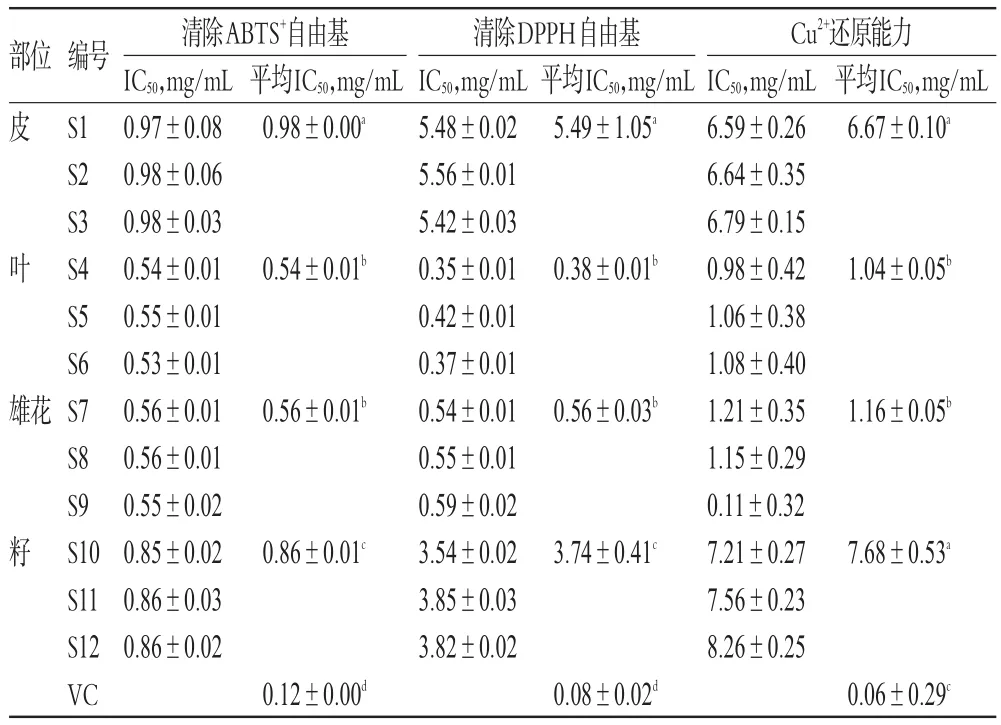
表3 抗氧化活性试验结果(±s,n=3)Tab 3 Resultsof antioxidantactivity test(±s,n=3)
注:同一指标不同组别间,若字母相同,则代表差异无统计学意义(P>0.05);若字母不同,则代表差异有统计学意义(P<0.05)Note:if there are same letters in the same index among different groups,it indicates the difference is not statistically significant(P>0.05);if the lettersare different,then it indicates the difference is statistically significant(P<0.05)
部位皮清除ABTS+自由基 清除DPPH自由基IC50,mg/mL 0.97±0.08 0.98±0.06 0.98±0.03 0.54±0.01 0.55±0.01 0.53±0.01 0.56±0.01 0.56±0.01 0.55±0.02 0.85±0.02 0.86±0.03 0.86±0.02 IC50,mg/mL 5.48±0.02 5.56±0.01 5.42±0.03 0.35±0.01 0.42±0.01 0.37±0.01 0.54±0.01 0.55±0.01 0.59±0.02 3.54±0.02 3.85±0.03 3.82±0.02 Cu2+还原能力IC50,mg/mL 6.59±0.26 6.64±0.35 6.79±0.15 0.98±0.42 1.06±0.38 1.08±0.40 1.21±0.35 1.15±0.29 0.11±0.32 7.21±0.27 7.56±0.23 8.26±0.25平均IC50,mg/mL 0.98±0.00a平均IC50,mg/mL 5.49±1.05a0.54±0.01b平均IC50,mg/mL 6.67±0.10a叶0.38±0.01b1.04±0.05b雄花0.56±0.01b0.56±0.03b1.16±0.05b籽0.06±0.29c编号S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 VC 0.86±0.01c3.74±0.41c7.68±0.53a0.12±0.00d0.08±0.02d
由表3可见,杜仲不同部位对ABTS+自由基的清除作用大小排序为叶>雄花>籽>皮。杜仲叶与雄花的IC50值比较,差异无统计学意义(P>0.05);其余两两比较,IC50值差异均有统计学意义(P<0.05)。
2.3.3 各部位样品对DPPH自由基的清除作用 参考文献[9]方法试验,分别取“2.3.1”项下各部位系列质量浓度供试品溶液3.0m L置于具塞试管中,加入DPPH溶液(精密称取DPPH 16.0 mg,加入80%乙醇定容至200 m L,超声10m in后于暗处放置2 h使其完全溶解,即得0.2mmol/L的DPPH自由基溶液。紫外分光光度计测定其A值在1.1~1.2之间,5 h内稳定)2.0m L,振荡混合均匀,常温下密封后避光静置30m in,于517 nm波长处测定A。以VC(0.08mg/m L)为阳性对照,其测定方法与各部位样品相同。每组平行测定3次,取平均值,计算自由基清除率[(1-A2/A02)×100%,A02为空白溶液的A值,A2为样品溶液的A值]并计算IC50值,结果见表3。
由表3可见,杜仲不同部位DPPH自由基清除作用大小排序为叶>雄花>籽>皮。杜仲叶与雄花比较,IC50值差异无统计学意义(P>0.05);其余两两比较,IC50值差异均有统计学意义(P<0.05);清除DPPH与ABTS+自由基作用结果一致。
2.3.4 各部位样品对Cu2+的还原能力 参考文献[10]方法试验,分别取“2.3.1”项下各部位系列质量浓度供试品溶液0.5 m L置于具塞试管中,依次加入硫酸铜溶液(0.01 mol/L)0.25 m L、新亚铜试液(7.5 mol/L)0.25 m L与乙酸铵-乙酸缓冲液(0.12mol/L,pH=7.5)3.0m L,振荡混合均匀,室温下静置30min。以乙酸铵-乙酸缓冲液为空白,于450 nm波长处测定各供试品溶液的A。以VC(0.02mg/m L)为阳性对照,其测定方法与各部位样品相同。每组平行测定3次,取平均值,计算Cu2+还原百分率[(A3-A03)/(Amax-A03)×100%,A3为样品溶液的A值,A03为空白对照溶液的A值,Amax为本试验中A最高值]并计算IC50值,结果见表3。
由表3可见,杜仲不同部位Cu2+还原能力叶大小排序为>雄花>皮>籽。杜仲叶与雄花、杜仲皮与籽比较,IC50值差异均无统计学意义(P>0.05);其余两两比较,IC50值差异均有统计学意义(P<0.05)。
3 讨论
由本试验结果可知,杜仲不同部位中以叶的总黄酮含量最高,雄花次之,而皮和籽中的总黄酮含量较低。在杜仲不同部位的体外抗氧化活性试验中,杜仲叶与雄花的抗氧化活性最强,且二者间比较差异无统计学意义;杜仲籽次之,而杜仲皮最弱。杜仲叶与雄花的总黄酮含量较高,且其抗氧化活性亦较强,但二者并非呈正相关趋势,可见二者抗氧化活性的机制较复杂,故其抗氧活性作用的成分及其相关性有待进一步研究。杜仲皮的总黄酮含量较杜仲籽高,然而杜仲皮的抗氧化活性较杜仲籽弱,可能是因为杜仲不同部位中具有抗氧化活性的物质不完全相同所致。而杜仲籽中α-亚麻酸和亚油酸等多不饱和脂肪酸的含量较高,具有一定的还原能力,故杜仲籽的抗氧化活性较杜仲皮强。
作为传统药材使用的杜仲皮中总黄酮含量及体外抗氧化活性都较弱,而杜仲叶的总黄酮含量及体外抗氧化活性远高于杜仲皮,且杜仲叶的生产周期短、产量高,可长期采收,资源较充足;杜仲雄花中总黄酮含量及体外抗氧化活性亦高于杜仲皮,且杜仲是雌雄异株,此部位药材便于收集,可为医疗使用提供稳定且质量合格的药材来源。因此,在开发杜仲相关抗氧化活性功能产品时,可首选杜仲叶和雄花。
[1] 姚丽娜,苏艳芳.杜仲化学成分研究[D].天津:天津大学,2010.
[2] 丁艳霞,郭洋静,任莹璐,等.杜仲雄花中黄酮类化学成分及抗氧化活性研究[J].中草药,2014,40(3):323-327.
[3] 范彦博,周妍,刘大鹏,等.杜仲主要化学成分分类总结[J].中国药师,2014,17(10):1756-1759.
[4] Jin X,Am itaniK,Zamam iY,etal.Ameliorative effectof Eucommia ulmoides Oliv.leaves extract(ELE)on insulin resistance and abnormal perivascular innervation in fructose-drinking rats[J].J Ethnopharmacol,2010,128(3):672-678.
[5] 杨芳,岳正刚,王欣,等.杜仲叶化学成分的研究[J].中国中药杂志,2014,39(8):1445-1449.
[6] 邱高翔,董娟娥,马希汉,等.杜仲雄花提取物的体外抗氧化活性评价[J].林业科学,2013,49(3):63-69.
[7] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:355-356.
[8] 原江锋,杨建雄,张志琪,等.产地和季节对柿叶中总黄酮、芦丁和齐墩果酸含量的影响[J].中成药,2006,28(12):1757-1759.
[9] 曾丹,李旭,高佩,等.DPPH法评估火棘提取物抗氧化活性体系的建立[J].中国实验方剂学杂志,2014,20(21):79-83.
[10] 邓亚运,周绿颖,李元彬,等.沉香叶不同提取部位的体外抗氧化活性研究[J].中国药房,2016,27(16):2181-2184.
(编辑:刘 萍)
Study on the Total Flavonoids Content and Antioxidant Activity in Different Parts of Eucomm iae ulmoides
ZHONG Shujuan1,YANG Xin1,LI Jing2,LIYongmei1,LIXingshan1(1.Dept.of Pharmacy,Fifth Affiliated Hospital of Guangzhou Medical University,Guangzhou 510700,China;2.School of TCM,Guangzhou University of Chinese Medicine,Guangzhou 510006,China)
OBJECTIVE:To compare the total flavonoids content and antioxidant activity in the barks,leaves,male flowers and seeds of Eucommiae ulmoides.METHODS:UV spectrophotometry was used to determ ine the total flavonoids content in different parts;tests was conducted to clear 2,2′-nitrilobis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS+),1,1-diphenyl-2-trinitrophenylhydrazine(DPPH)radicals and the reducing ability of Cu2+,using half clear/reduction concentration value(IC50)as evaluation indexes,and vitam in C was regarded as positive control.RESULTS:The total flavonoids content of the E.ulmoides from hight to low was as follows as leaves>male flowers>barks>seeds,except there was no significant difference in barks and seeds(P>0.05),the other parts had significant differences(P<0.05);the ability of different parts elim inating DPPH and ABTS+free radical was as follows as leaves>male flowers>seeds>barks,except there was no significant difference in the indicators of leaves and male flowers(P>0.05),the other parts had significant differences(P<0.05);the ability of reducing Cu2+free radical was as follows as leaves>male flowers>barks>seeds,there was significant difference in leaves and males flowers w ith barks and seeds(P<0.05).CONCLUSIONS:The content of total flavonoids in leaves and male flowers is high,and the antioxidant activity is strong,which has a great prospect of exploitation and utilization tomake up for deficiencies in barks of E.ulmoides.
Eucommiae ulmoides;Bark;Leaf;Male flower;Seed;Total flavonoids;Antioxidant activity
R285.5
A
1001-0408(2017)13-1787-04
2016-09-29
2016-12-12)
*主管药师。研究方向:临床药学、医院制剂。电话:020-82288145。E-mail:843118547@qq.com
DOI10.6039/j.issn.1001-0408.2017.13.17
