12种市售亚微乳制剂稳定性评价及稳定性考察方法研究Δ
2017-05-16周君卓董武军乔涌起李国辉国家癌症中心中国医学科学院肿瘤医院北京000中国医学科学院药物研究所北京00050
陈 伟,周君卓,董武军,王 宇,乔涌起,李国辉#(.国家癌症中心/中国医学科学院肿瘤医院,北京000;.中国医学科学院药物研究所,北京 00050)
12种市售亚微乳制剂稳定性评价及稳定性考察方法研究Δ
陈 伟1*,周君卓2,董武军2,王 宇1,乔涌起1,李国辉1#(1.国家癌症中心/中国医学科学院肿瘤医院,北京100021;2.中国医学科学院药物研究所,北京 100050)
目的:评价12种市售亚微乳制剂的稳定性,并筛选稳定性考察方法。方法:选取市售的12种亚微乳制剂,分别采用高压灭菌(121℃,30m in)、高速离心(4 000 r/m in,15m in)、加速试验[温度(40±2)℃、相对湿度(75±5)%的条件下放置6个月]3种考察方法对亚微乳的pH、粒径等指标进行测定,通过SPSS 22.0软件进行粒径分布方差、卡方检验并评价3种考察方法的相关性。结果:在稳定性考察方面,12种亚微乳pH值在加速试验后有不同程度下降,平均粒径大于300 nm的亚微乳有6种;9种亚微乳的粒径方差分布在0.05~0.15之间,8种亚微乳卡方检验结果分布在1以下;加速试验后4种亚微乳平均粒径变化大于10 nm。在稳定性考察方法方面,高压灭菌与加速试验皮尔森(Pearson)卡方渐进显著性为0.665>0.05,表明两者无相关性(没有显著性),高压灭菌稳定性结果并不能说明加速试验的结果;高速离心与加速试验Pearson卡方渐进显著性为0.004<0.05,表明高速离心稳定性与加速试验结果有显著相关性。结论:市售亚微乳稳定性评价结果均符合要求;高速离心可在一定程度上代替加速试验。
亚微乳;稳定性;高压灭菌;高速离心;加速试验;粒径
亚微乳粒径在0.1~1.0μm之间,为热力学不稳定体系,亚微乳的物理稳定性往往成为制剂研发的瓶颈和关键因素。2015年版《中国药典》未明确规定亚微乳的稳定性评价方法。目前,多数研究通过测定粒径、电位进行筛选[1-5],但并不能准确地反映亚微乳稳定性,而加速稳定性试验和长期稳定性试验却又太过费时。有研究将各指标进行归一化处理后计算几何平均值[6],但是,在未研究指标影响程度时,将指标加权处理数据用于处方筛选的依据不足。因此,探索快速、准确的稳定性评价方法成为亚微乳研究过程中亟需解决的问题。本研究对12种市售亚微乳制剂的稳定性进行了评价,并对3种稳定性评价方法进行了筛选,以期找到能对亚微乳处方和工艺进行快速、准确筛选的稳定性考察方法。
1 材料
1.1 仪器
SYQ-DSX-280B蒸汽灭菌器(上海申安医疗器械厂);KBF240恒温恒湿箱(德国Binder公司);HC-2518高速离心机(安徽中科中佳科学仪器有限公司);380ZLS粒度及Zeta电位检测分析仪(美国PSS粒度仪公司);FE20 pH计[梅特勒-托利多仪器(上海)有限公司)]。
1.2 药品
ω-3鱼油脂肪乳注射液[编号1,华瑞制药有限公司,批号:16HG0101,规格:100m L∶10 g(精制鱼油)∶1.2 g(卵磷脂)/瓶];脂肪乳注射液(C14-24)[编号2,西安力邦制药有限公司,批号:14112022,规格:250m L∶25 g(大豆油)∶3 g(卵磷脂)/瓶];脂肪乳注射液(C14-24)[编号3,华瑞制药有限公司,批号:80HC149,规格:250m L∶75 g(大豆油)∶3 g(卵磷脂)/瓶];结构脂肪乳注射液(C6-24)[编号4,华瑞制药有限公司,批号:10HK1876,规格:250m L∶50 g(结构三酰甘油)/瓶];康莱特注射液(编号5,浙江康莱特药业有限公司,批号:1410192-2,规格:100m L∶10 g/支);鸦胆子油乳注射液(编号6,江苏九旭药业有限公司,批号:20141206,规格:10m L/支);鸦胆子油乳注射液(编号7,广州白云山明兴制药有限公司,批号:141005,规格:10 m L/支);脂肪乳氨基酸(17)葡萄糖(11%)注射液(编号8,瑞典费森尤斯卡比公司,批号:10HK1998,规格:1 440m L/袋);脂溶性维生素注射液(编号9,华瑞制药有限公司,批号:80HL52901,规格:10 m L/支);氟比洛芬酯注射液(编号10,北京泰德制药股份有限公司,批号:2E015A,规格:5m L∶50mg/支);肠内营养乳剂(TPF-T)(编号11,德国费森尤斯卡比股份有限公司,批号:29H1654,规格:500 m L/瓶);肠内营养乳剂(TPF-D)(编号12,德国费森尤斯卡比股份有限公司,批号:29HL2052,规格:500m L/袋)。
2 方法
选取12种市售的亚微乳制剂,分别测定其pH值、粒径,计算粒径分布的方差和卡方检验。对每种亚微乳分别采取高压灭菌(121℃,30min)、高速离心[半径为10 cm、转速4 000 r/min(约1 800×g)离心15min]、加速试验[温度(40±2)℃、相对湿度(75±5)%的条件下放置6个月]3种考察方法进行处理,处理后测定亚微乳平均粒径,计算粒径分布的方差和卡方检验等指标。
2.1 稳定性考察项目
2.1.1 外观 观察亚微乳的外观,应为乳白色液体。考察流动性,观察与空气接触液体表面及与容器接触液体表面有无油滴,是否分层。
2.1.2 pH值 使用pH计分别测定12种样品原pH值,然后进行加速试验,之后再次测定pH值。
2.1.3 粒径 采用动态光散射原理进行粒径测定。具体步骤如下:取亚微乳1m L,用适量纯化水稀释,稀释液加入比色皿中,使用380ZLS粒度及Zeta电位检测分析仪进行测定,记录亚微乳平均粒径等数据。
2.1.4 粒径分布方差、卡方检验 在粒径测定过程中,同时记录粒径分布方差、卡方检验结果来代表乳剂中乳滴的粒径分布情况。其中,方差是衡量随机变量或一组数据时离散程度的度量。此处方差值用来度量粒径和平均粒径之间的偏离程度,是各个粒径分别与平均粒径之差的平方和的平均数。卡方检验是对样本的频数分布所来自的总体分布是否服从某种理论分布或某种假设分布所作的假设检验。此处卡方值代表粒径分布是否服从正态分布。
2.2 稳定性考察方法评价
通过SPSS 22.0分析粒径分布方差、卡方检验并考察3种考察方法的相关性。
3 结果
3.1 外观观察结果
12种市售亚微乳制剂外观观察结果见表1。

表1 12种市售亚微乳制剂外观观察结果Tab 1 Observation resu lts of appearance of 12 kinds of subm icro emulsion inmarket
3.2 pH值测定结果
12种市售亚微乳制剂加速试验前后pH值测定结果见表2。

表2 12种市售亚微乳制剂加速试验前后pH值测定结果Tab 2 Determ ination results of pH value of 12 kinds of subm icro emu lsion in m arket before and after accelerated test
从表2可以看出,亚微乳加速试验后pH值均出现不同程度下降,但使用多聚复合膜塑料袋包装的编号4、8样品的pH值下降最为显著。
3.3 3种方法试验评价结果
12种市售亚微乳制剂3种方法试验评价结果见表3。
从表3可以看出,高速离心、高压灭菌、加速试验三者均会造成亚微乳的粒径改变。比较三者结果,高压灭菌后粒径变化较大,该结果与加速试验后粒径变化结果相差较大,而加速试验后粒径变化较大的亚微乳在高速离心后粒径也呈现了较大变化,说明两者有一定相关性。各样品测定结果中,平均粒径大于300 nm的亚微乳有6种,而其中4种在加速试验后粒径变化较大,说明粒径较大者稳定性更差,更容易在储存过程中出现粒径增大的情况。9种亚微乳粒径的方差主要分布在0.05~0.15之间,其中粒径变大的4个品种中有3个品种方差在0.1以上,说明粒径分布的差异越大越会增加亚微乳的不稳定性。8种亚微乳卡方检验结果分布在1以下,只有4个品种卡方值大于1,其中3个品种大于2。所有加速试验后粒径增大的品种,都出现在卡方值大于2的范畴。从原理上来讲,乳滴粒径的分布越接近正态分布,说明乳滴生产过程中的均质工艺和乳滴形成作用越均匀和全面,所以最后得到的亚微乳也越稳定。因此,在生产亚微乳的处方和工艺筛选试验中可以将粒径分布的卡方检验结果作为评价指标之一。
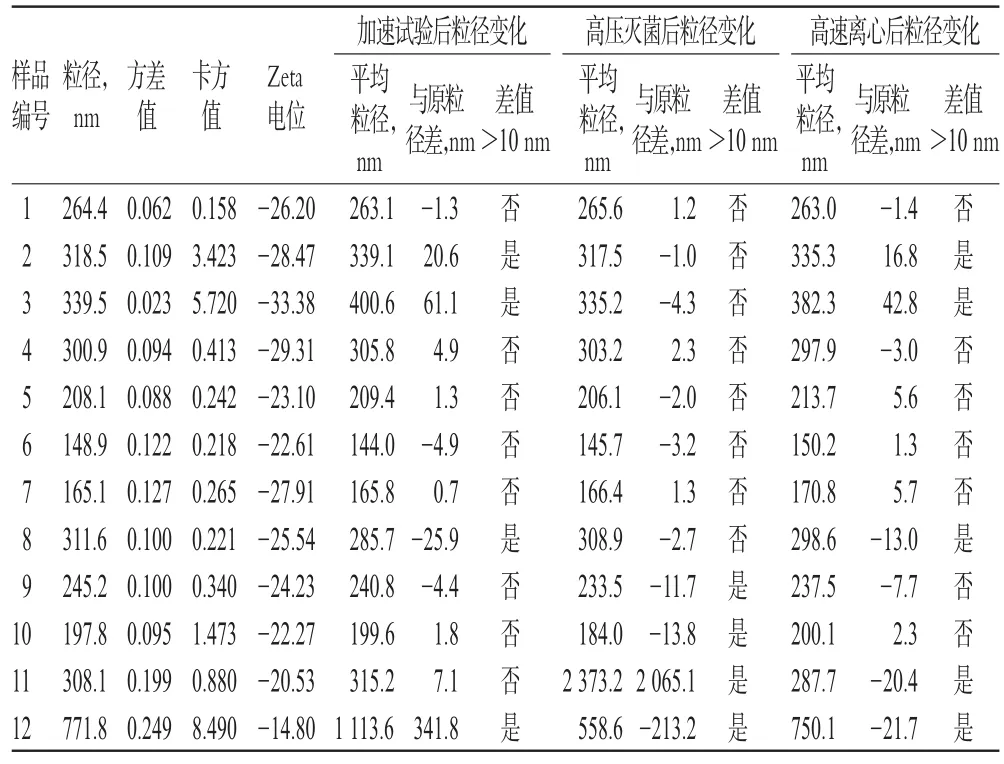
表3 12种市售亚微乳制剂采用3种方法试验的评价结果Tab 3 Investigation results of 12 kinds of subm icro emulsion inmarketby 3 kindsofmethod
3.4 平均粒径等指标的频数分析
应用SPSS 22.0进行描述性统计分析,对平均粒径、粒径分布方差值、粒径分布卡方值等数据进行频数分析,结果见表4。

表4 3种方法考察下平均粒径的频数分析结果Tab 4 Frequency analysis resultsof the average particle size by 3 kindsofm ethod
从表4可以看出,高压灭菌后粒径变化平均数和标准差均显著高于加速试验后和高速离心后的相应指标;从百分位数来看,高压灭菌后粒径变化的分布状态与加速试验后和高速离心后也有显著区别。以上说明高压灭菌对粒径的影响更大。
3.5 高压灭菌与加速试验相关性分析
应用SPSS 22.0对高压灭菌与加速试验粒径差的相关性进行方差分析,结果显示高压灭菌和加速试验后粒径均未发生变化的有5个样品(占41.67%),粒径均发生变化的有1个样品(占8.33%)。皮尔森(Pearson)卡方渐进显著性为0.665,其值大于0.05,表明两者无相关性(没有显著性),高压灭菌稳定性结果并不能说明加速试验的结果。
3.6 高速离心与加速试验相关性分析
应用SPSS 22.0对高速离心与加速试验粒径差的相关性进行方差分析,结果显示高速离心和加速试验后粒径均未发生变化的有7个样品(占58.33%),粒径均发生变化的有4个样品(占33.33%)。Pearson卡方渐进显著性为0.004,其值小于0.05,表明高速离心检测粒径变化与加速试验结果有显著相关性,高速离心可以在一定程度上代替加速试验的结果。
4 讨论
4.1 影响pH值的因素和pH值对稳定性的影响
亚微乳中含有磷脂分子,其在存储过程中可能发生酯键水解,会产生脂肪酸,亦或发生氧化则会产生溶血卵磷脂和脂肪酸等,这些变化中产生的酸性成分会导致pH值下降。所以,pH值下降可以作为磷脂分子变化程度的度量指标。
pH值对于亚微乳的稳定性有双重影响,适宜的pH值可使卵磷脂膜表面上的磷酸基团电离,从而得到最佳的表面电位;适宜的pH值还可以减少卵磷脂水解,从而保证亚微乳稳定性[7]。低pH值(低于5)可以导致乳化油滴之间的静电斥力减小,从而导致乳滴尺寸的增大和聚合几率升高。
从表2结果可见,编号4、8的样品pH值下降最为显著,两者均为多聚复合膜塑料袋包装。其原因可能由于多聚复合膜塑料袋的透氧和透湿性高于其他材质,导致氧气和水分透入,造成亚微乳中三酰甘油和卵磷脂快速水解释放出游离脂肪酸,从而导致pH快速下降。国外已有研究证实,包装容器对于亚微乳有较大影响。Driscoll DF等[7-8]比较了使用塑料容器和玻璃容器包装的脂肪乳,证明使用塑料容器包装的静脉注射脂肪乳,在24 h后大粒子明显增加。Martin CR等[9]研究发现,与玻璃容器相比,塑料容器包装的脂肪乳给药以后患者高三酰甘油血症发生率升高。pH的显著变化可能是由于不同塑料包装的影响,但证实此结论有待进一步研究。
4.2 影响稳定性的因素
乳剂的稳定性与粒径及其分布有关,粒径越小、粒径分布越窄,乳剂越稳定[10]。粒径的大小和变化是反映亚微乳稳定性的另一项重要指标,亚微乳制备完成后粒径较小,说明其油水表面张力在乳化剂的作用下得到了更好的缓解和释放,因此可以说明其乳化效果更好、稳定性增加。同时,亚微乳粒径也能说明其在存储过程中的稳定性,存储过程中发生乳滴合并和破乳必然会导致粒径的改变。因此,检测粒径的变化就显得尤为重要。
平均粒径变化的数据可以在一定程度说明乳剂的稳定性,然而,如果乳剂在制备、灭菌、存储过程中分布在平均粒径两侧的乳滴同时出现增大或减小,或者出现多峰现象,虽然平均粒径有可能没有发生显著变化,但是此种情况同样会造成乳剂的稳定性降低。
4.3 高压灭菌与加速试验的可替代性
高压灭菌不能替代加速试验用于稳定性研究,其原因可能在于高压灭菌过程中发生了重新乳化,乳化剂在油相与连续介质水相间重新分布,再次形成亚微乳的乳滴[11]。同时,由于高压灭菌温度过高、压力过大,显著超过了亚微乳的日常存储温度,显著加剧了乳化剂中化学成分之间的化学反应。另外,张娜等[12]考察了灭菌工艺对不同乳化剂及油相所制亚微乳物理稳定性的影响,证明了处方不同也会造成高压灭菌与加速试验的差异。以上替代加速试验因素均导致不确定性增加,因而无法使用高压灭菌替代加速试验来检验亚微乳的稳定性。
4.4 高速离心与加速试验的可替代性
高速离心可以在一定程度上代替加速试验,其原因在于高速离心增加了乳滴之间的碰撞几率,碰撞的几率增加可以在短时间内达到模拟乳剂长期存放后乳滴间碰撞、合并的结果,所以高速离心法能比较准确地测定乳剂的稳定性。
综合考虑上述试验结果,市售亚微乳稳定性评价结果均符合要求,高速离心可在一定程度上代替加速试验,对处方和工艺进行快速、准确的筛选。研究过程中,为了快速筛选稳定的亚微乳,可以考虑在处方和工艺筛选时选择乳化剂粒径小于300 nm的亚微乳;同时,选择粒径方差分布小于0.1的亚微乳也会有更好的稳定性。并且采用在高速离心后测定平均粒径差的方法来代替加速试验进行快速的处方筛选。本研究建立了快速确定亚微乳稳定性的筛选条件,为亚微乳的研发奠定了基础。然而,由于受到经费和时间等原因限制,本研究考察样本数量有限。因此,此快速筛选条件有一定局限性,尚需进一步研究予以证实。
[1] 刘芸,赵鹏,张丽华,等.槲皮素亚微乳的制备及特性表征研究[J].中成药,2014,36(5):1077-1080.
[2] 冯欣,张须学,姬诚.丹参酮亚微乳制剂的制备工艺和质量评价[J].中国医药指南,2012,10(28):51-53.
[3] 张晶,刘志宏,王慧娟,等.环孢素A眼用亚微乳的制备[J].中国医院药学杂志,2014,34(18):1558-1562.
[4] 卢秀霞,何琳,李家敏,等.辣椒碱亚微乳注射剂的制备及其质量评价[J].中国新药杂志,2013,22(16):1956-1961.
[5] 兰洁,管璐晗,朱学琳.帕立骨化醇亚微乳注射液的处方和工艺研究[J].中国药房,2014,25(29):2743-2746.
[6] 史亚军,施俊辉,陈世彬,等.基于“溶质相转移”技术的黄芩提取物鼻用亚微乳制备工艺研究[J].中国中药杂志,2015,40(14):2825-2831.
[7] Driscoll DF,Ling PR,Bistrian BR.Physical stability of 20%lipid injectable emulsions via simulated syringe infusion:effects of glass vs plastic product packaging[J].J ParenterEnteralNutr,2007,31(2):148-153.
[8] Driscoll DF,SilvestriAP,Bistrian BR,etal.Stability of total nutrientadmixturesw ith lipid injectable emulsions in glass versus plastic packaging[J].Am JHealth-Syst Pharm,2007,64(4):396-403.
[9] Martin CR,Dumas GJ,Shoaie C,etal.Incidence of hypertriglyceridem ia in critically ill neonates receiving lipid injectable emulsions in glass versus plastic containers:a retrospective analysis[J].JPediatr,2008,152(2):232-236.
[10] 张会丽,李阳杰,李书平.氨溴索亚微乳理化性质研究[J].中国药业,2015,24(24):66-68.
[11] Lu Y,Zhang Y,Yang Z,et al.Formulation of an intravenous emulsion loaded w ith a clarithromycin-phospholipid complex and its pharmacokinetics in rats[J].Inter JPharma,2009,366(1):160-169.
[12] 张娜,储婷,张青,等.处方因素对亚微乳物理稳定性的影响[J].华西药学杂志,2012,27(4):391-394.
Study on the Stability Evaluation of 12 K inds of Subm icro Emulsion in M arket and the Test M ethod for the Stability
CHENWei1,ZHOU Junzhuo2,DONGWujun2,WANG Yu1,QIAO Yongqi1,LIGuohui1(1.National Cancer Center/ Cancer Hospital,Chinese Academy of Medical Sciences,Beijing 100021,China;2.Institute of Materia Medica,Chinese Academy of Medical Sciences,Beijing 100050,China)
OBJECTIVE:To evaluate the stability of 12 kinds of submicro emulsion in market,and screen the testmethod for the stability.METHODS:12 kinds of subm icro emulsion in market were selected,high pressure sterilization(121℃,30 min),high speed centrifugation(4 000 r/m in,15 m in),accelerated test[placing 6 months under temperature of(40±2)℃,relative humidity of(75±5)%]were conducted to investigate the pH,particle size and other indexes,and SPSS 22.0 was used to analyze the distribution variance and chi-square test,and investigate the correlation of 3 evaluation methods.RESULTS:In terms of stability investigation,the pH value of 12 kinds of subm icro emulsion decreased to some extent after accelerated test,average particlesize of 6 kinds of subm icro emulsion sampleswere greater than 300 nm,the variance of the particle size distribution of 9 kinds appeared in 0.05-0.15,the chi-square test results of 8 kinds distributed below 1.The average particle size of 4 kinds of subm icro emulsions changed more than 10 nm after accelerated test.In terms of stability testmethod,Pearson chi-square progressive significance of high pressure sterilization and accelerated test was 0.665,which was higher than 0.05,indicating there was no correlation(no significance),the stability results of high pressure sterilization can not represent the results of accelerated test;that of high speed centrifugation and accelerated testwas 0.004,which was lower than 0.05,indicating stability results between high speed centrifugation and accelerated test results were significantly correlated.CONCLUSIONS:The subm icro emulsion in market can meet the requirements of stability.To a certain extent,high speed centrifugation can replace the acceleration test.
Subm icro emulsion;Stability;High pressure sterilization;High speed centrifugation;Accelerated test;Particle size
R944.1
A
1001-0408(2017)13-1769-05
2016-08-30
2017-02-09)
(编辑:余庆华)
中国癌症基金会“北京希望马拉松”专项基金资助项目(No.LC2014B05)
*硕士。研究方向:药物制剂、药动学、临床药学。电话:010-87788577。E-mail:sorros900@126.com
#通信作者:主任药师。研究方向:医院药学。电话:010-87788574。E-mail:lgh0603@126.com
DOI10.6039/j.issn.1001-0408.2017.13.12
