肠易安汤对溃疡性结肠炎大鼠溃疡组织中NF-κB p65及IL-10表达的影响
2017-05-16马春花罗京艺朱东华荆淑娟尚毅
马春花 罗京艺 朱东华 荆淑娟 尚毅
肠易安汤对溃疡性结肠炎大鼠溃疡组织中NF-κB p65及IL-10表达的影响
马春花 罗京艺 朱东华 荆淑娟 尚毅
目的 观察中药方“肠易安汤”对实验性大鼠溃疡性结肠炎结肠粘膜组织NF-κB p65、白细胞介素-10(IL-10)表达的影响。方法 采用2,4,6-三硝基苯磺酸(TNBS)加免疫诱导法复制UC大鼠模型,39只大鼠,随机分组为模型组,肠易安汤组,柳氮磺胺吡啶(SASP)组。治疗21 d后观察大鼠结肠组织黏膜的病理改变(CMDI)、NF-κB p65、IL-10表达水平的变化。结果 治疗21 d后,肠易安汤组大鼠CMDI评分和NF-κB p65表达明显低于模型组(t=58.28,P=0.003;t=6.01,P=0.016)和SASP组(t=-22.10,P=0.026;t=-2.80,P=0.038),肠易安汤组IL-10表达明显高于模型组和SASP组(t=-403.56,P=0.022;t=35.76,P=0.036)。结论 肠易安汤对溃疡性结肠炎大鼠结肠组织黏膜有良好的修复作用,其作用机理可能与降低NF-κB p65表达和提高IL-I0水平有关。
结肠炎,溃疡性; 白介素-10; 核因子κB p65; 肠易安汤
溃疡性结肠炎(ulcerativ olitis,UC)是一种慢性非特异性炎症性肠病,主要累及直肠、结肠黏膜,以腹痛、腹泻、黏液血便及里急后重为主要临床表现,病程迁延不愈,长达十几年甚至几十年,并存在着高于正常人群5~8倍的癌变率。该病发病率在欧美国家约为5~12/10万,在我国发病率呈逐年上升趋势,且癌变率在2~5%[1]。该病发病机制尚不明确,目前认为与机体免疫调节和炎性细胞因子等密切相关[2]。研究发现[3]溃疡性结肠炎发病与促炎因子和抗炎因子平衡失调关系密切。有关研究发现NF-κB p65及其介导的炎症通路在UC发生发展中发挥着重要作用[4]。而IL-10可以抑制其他相关细胞因子的分泌、迁移。西药治疗UC远期疗效较差,且容易产生药物依赖及毒副作用[5]。本研究主要观察中药方肠易安汤对UC大鼠症状、大鼠溃疡组织中IL-10、NF-κB p65表达水平的影响,从而探讨肠易安汤治疗UC的作用机制。
资料与方法
一、一般资料
(一)实验动物
50只Wistar健康大鼠,4~6周龄,雌雄各半,体重(200±30)g,购自南京医科大学实验动物中心。
(二)模型制备
参考段征等[6]的2,4,6-三硝基苯磺酸(2,4,6-TNBS)诱导联合免疫复合法。用4只大鼠结肠黏膜制成组织匀浆,以10000 r/min速度离心5~10分钟,提取上清液提纯,用考马斯蓝染色法检测蛋白质含量(浓度为16 mg/ml),与等量完全佛式佐剂配成抗原乳化液备用。39只大鼠在禁食24小时后开始造模。用100 mg/kg氯胺酮腹腔注射麻醉,将直径2 mm,长15 cm的硅胶管轻轻插入肛门8 cm,注入100 mg 0.5% TNBS/kg+50%乙醇0.65 ml,14天后在大鼠腹股沟、足跖处注射抗原乳化液(含抗原8 mg)2次。造模后,随机选取2只模型大鼠处死,截取部分结肠组织,用10%中性福尔马林固定,以作病理检测(造模及灌胃过程中死亡5只大鼠),验证模型制备成功后将大鼠随机分为模型组、肠易安汤组及柳氮磺吡啶组各13只大鼠。
(三)主要试剂与仪器
浓度为5%的2,4,6-三硝基苯磺酸(2,4,6-TNBS)(试剂编号:P22970,美国Sigma公司产品);弗氏完全佐剂(试剂编号:F5506,美国Sigma公司产品);0.1%盐酸氯胺酮44 mL(产品批号:100817,福建古田药业有限公司产品);匀浆机(型号:985-370)。
IL-10抗体IgG rabbit(产品编号:BA1201,武汉博士德生物工程有限公司);goat Anti-Mouse IgG(产品编号:HRP-10004302,美国Jackson公司产品);goat Anti-Rabbit IgC(产品编号:SC-2004,美国Jackson公司产品);NF-κB p65磷酸化检测试剂盒(批号:20130125,北京中杉金桥生物技术有限公司);免疫组化试剂盒(晶美生物工程有限公司生产,批号:DEC 022005);BH2系统显微镜(日本Olympus公司产品);I Leica QWin图像分析软件(上海申腾信息技术有限公司);摄像机(PANASONIC公司,型号:MV-CP410);切片机(德国徕卡公司产品 型号:RM2145)。
(四)实验药物
肠易安汤:党参30 g,黄芪45 g,白术15 g,山药15 g,薏苡仁15 g,芡实15 g,马齿苋15 g,紫草9 g,川芎9 g,将肠易安汤方中药物水煎高浓度梯度(75%、95%)乙醇提纯有效成分,制成使其含生药浓度为3.75 g/mL中药制剂;柳氮磺吡啶(SASP)制剂:将SASP药片碾成细末,溶于蒸馏水中制备悬浊液,使其含SASP浓度为0.093 g/mL。
二、实验方法
(一)给药方法
模型复制成功后第1天开始给药,连续给药21天。(二)标本采集
在给药第2l天将大鼠用脱颈椎法处死,解剖腹腔,取下距肛门约6~8 cm处长度3~5 cm的结肠组织,并对大鼠结肠组织进行CMDI(colon macroscopi amag ndex)评分,用冰生理盐水反复冲洗后,置于10%甲醛中保存备用。CMDI评分标准见表1。

表1 CMDI评分标准(分)
(三)检测指标及方法
1.免疫组化实验操作
采用免疫组化PAP二步法:将组织切片脱蜡反复洗涤后,用Ph 6.0的CB柠檬三钠缓冲液热诱导修复抗原。室温下,20%正常羊血清室温孵育后,滴加上述抗体,次日加羊抗免IgG-HRP(羊抗小鼠IgG-HRP)。洗涤后用DAB~H2O2底物显色,苏木素液复染。每个步骤间用0.01 MPBS反复洗涤2~3次。
2.NF-κB p65表达结果判断
免疫组织化学法检测结果显示,正常大鼠结肠织仅可见少量阳性细胞,且染色浅淡;UC大鼠结肠组织可见大量NF-κB p65阳性细胞,主要为核着色或胞质着色。
3.免疫组化阳性着色定量分析
染色结果应用LeicaQWin图象分析软件在250倍显微镜下,随机选取3个视野,计算区域的阳性面积(μm2),求出3个视野平均值。
三、统计学分析
实验结果采用SPSS 18.0软件进行统计学分析,三组计量资料均进行方差齐性检验,均服从正态分布,计量资料采用均数±标准差(±s)方式表达,三组计量资料组间两两比较均采用单因素方差分析,P<0.05认为差异有统计学意义。
结 果
三组UC大鼠CMDI评分、NF-κB p65、IL-10表达的数据列示于表2,整体比较(单因素方差分析)知:3组间整体比较均有显著性统计学差异(P<0.05),肠易安汤组、SASP组与模型组比较差异均具有统计学意义(t=58.28,P=0.003;t=-38.11,P=0.002),肠易安汤组与SASP组比较具有统计学差异(t=-22.10,P=0.026),与模型组相比,肠易安汤组、SASP组大鼠结肠组织NF-κB p65表达量明显降低,差异有统计学意义(t=6.01,P=0.016;t=-1.27,P=0.008),肠易安汤组与SASP组比较明显降低,差异具有统计学差异(t=-2.80,P=0.038)。与模型组比较,肠易安汤组、SASP组IL-10水平明显升高,差异具有统计学意义(t=-403.56,P=0.022;t=41.70,P=0.018),肠易安汤组与SASP组比较,IL-10水平明显升高,差异具有统计学意义(t=35.76,P=0.036)。
表2 三组UC大鼠CMDI评分、NF-κB p65、IL-10表达的比较(s)
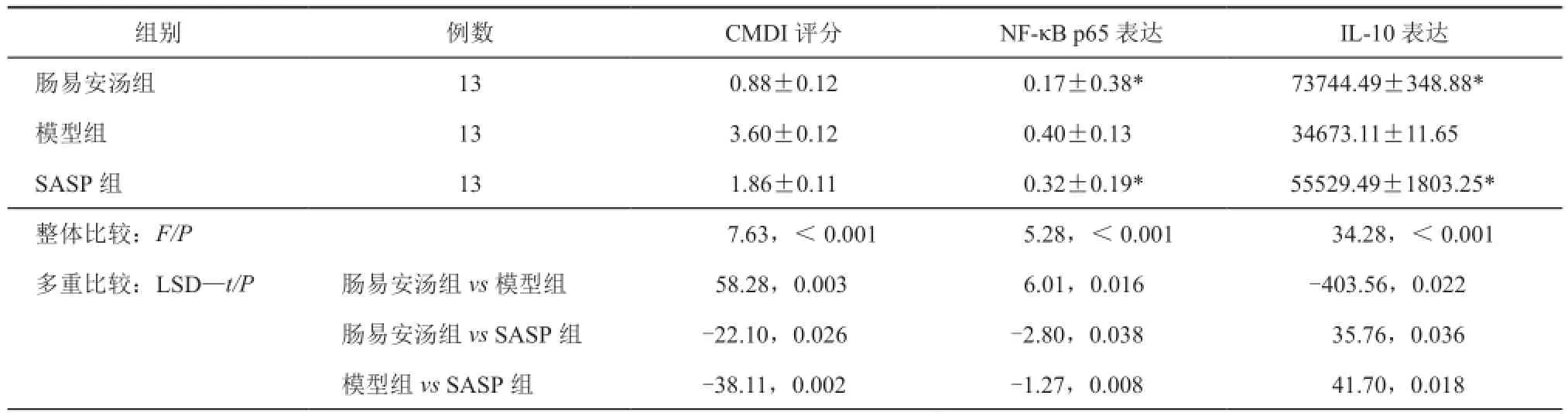
表2 三组UC大鼠CMDI评分、NF-κB p65、IL-10表达的比较(s)
组别例数CMDI评分NF-κB p65表达IL-10表达肠易安汤组130.88±0.120.17±0.38*73744.49±348.88*模型组133.60±0.120.40±0.1334673.11±11.65 SASP组131.86±0.110.32±0.19*55529.49±1803.25*整体比较:F/P7.63,<0.0015.28,<0.00134.28,<0.001多重比较:LSD—t/P肠易安汤组vs模型组58.28,0.0036.01,0.016-403.56,0.022肠易安汤组vs SASP组-22.10,0.026-2.80,0.03835.76,0.036模型组vs SASP组 -38.11,0.002-1.27,0.00841.70,0.018
讨 论
目前,溃疡性结肠炎的发病机制尚不完全明确,大多数学者认为免疫反应异常是造成UC发病的重要因素,而相关细胞因子失衡在这个免疫调节和炎症过程中充当重要角色[7]。参与早期免疫反应和各阶段炎症反应的许多分子都受NF-κB 通路的调控,通过抑制肠组织NF-κB的活性、减轻UC炎症反应,可能是中西医药物治疗UC的重要机制之一[8-9]。NF-κB家族由5个成员构成,包括NF-κB1(p50/p105),NF-κB2(p52/p100),p65(ReIA),ReIB及C-Rel等,其中p65(ReIA)具有显著的促炎活性[10]。NF-κB在核内与κB序列结合促进多种炎性细胞因子如IL-1β,IL-2,IL-6,IL-8,TNF-α及TNF-β等的基因转录,所以NF-κB活化可能是UC发生发展的关键点[11]。有研究发现[12]NF-κB在UC大鼠结肠中表达明显升高,还有研究发现[13-14]NF-κB在UC患者结肠黏膜中处较高的表达水平,参与了UC的发生发展过程,检测其变化对疾病活动度的评价具有重要的临床意义。张夏梦等[15]研究显示清热燥湿凉血方能促进UC大鼠结肠组织上皮修复和结肠微血管生成,抑制结肠组织NF-κB的表达。实验结果显示,肠易安汤能够抑制UC大鼠模型过度表达NF-κB p65,控制炎症反应,减轻肠道损伤。
IL-10为细胞因子合成抑制因子,对激活的单核细胞、巨噬细胞、粒细胞及T细胞等有抑制作用,可下调IL-2、IL-3、γ干扰素等促炎因子水平,具有广泛的免疫抑制活性。实验发现[16]补充IL-10能够减缓UC的发生与发展,表明IL-10对调节肠道黏膜免疫系统的平衡,保护肠黏膜具有重要作用。而剔除大鼠IL-10基因(IL-10-/-)能诱发大鼠结肠炎[17]。其他研究结果也显示[18],健脾中药能有效对抗UC模型大鼠IL-10的降低。
本研究表明,肠易安汤能有效降低大鼠结肠组织CMDI评分,同时降低NF-κB的表达水平,增加IL-10表达水平,表明肠易安汤可调节UC大鼠促炎因子NF-κB p65与抗炎因子IL-10的平衡,从而抑制大鼠UC的炎性反应。因此,免疫调节可能是肠易安汤有效促进UC结肠黏膜修复的作用机制之一,但其更深入的作用机制有待于进一步的研究。
[ 1 ] Jun Yun, Chang-Tai Xu, Bo-Rong Pan.Epidemiolog nd genemarker lcerativ oliti he Chinese [J]. World J Gastroenterol, 2009, 15(7):788-803.
[ 2 ] Bamias G, Kaltsa G, Ladas SD.Cytokine h athogenesi f ulcerativ olitis [J]. Discow Med, 2011, 11(60):459-467.
[ 3 ] Anand AC, Adya CM.Cytokine n nf l ammator owe isease [J]. Trop Gastroenterol, 1999, 20(3):97-106.
[ 4 ] 加秀凤, 沈霖, 范恒, 等.NF-κB p65在溃疡性结肠炎与结直肠癌患者肠黏膜中的表达差异与意义 [J]. 世界华人消化杂志, 2014, 22(2):279-285.
[ 5 ] 闫伟, 潘一滨, 陆金根.溃疡性结肠炎的中医药治疗特色与优势 [J].辽宁中医药大学学报, 2010, 12(12):136-138.
[ 6 ] 段征, 汪维伟, 姜蓉.两种溃疡性结肠炎大鼠模型的比较 [J]. 重庆医科大学学报, 2008, 33(1):66-72.
[ 7 ] Wine E, Nack DR, Hyams J, e l. Interleukin-6 i ssociate ith steroi esistanc n eflect iseas ctivit ever ediatric ulcerativ olitis [J]. J Crohns Colitis, 2013, 7(11):916-922.
[ 8 ] Sakthivel KM, Guruvayoorappan C. Amentoflavon nhibits iNOS, COX-2 expressio n odulate ytokin rofile, NF-κB signa ransductio athway at it lcerativ olitis [J]. Int Immunopharmacol, 2013, 17(3):907-916.
[ 9 ] Sakthivel KM, Guruvayoorappan C.Protectiv ffec f Acacia ferrugine gains lcerativ oliti i odulatin nflammatory mediators, cytokin rof i l nd NF-κB signa ransductio athways [J]. J Environ Pathol Toxicol Oncol, 2014, 33(2):83-98.
[ 10 ] Schreiber S, Nikolaus S, Hampe J.Activatio uclea acto appa B inf l ammator owe isease.Gut 1998, 42(10):477-484
[ 11 ] Sen P, Wallet MA, Yi Z, e l.Apoptoti ell nduce Me yrosine kinase-dependen lockad f NF-kappaB activatio endritic cells.Blood, 2007, 109(8):653-660.
[ 12 ] 李海龙, 程小丽, 董晓丽, 等. NF-κB和ICAM-1在溃疡性结肠炎大鼠结肠中表达及中药干预的影响 [J]. 中国老年学杂志, 2011, 31(9):1594-1596.
[ 13 ] 李林静, 李治国, 朱丽萍, 等. 溃疡性结肠炎体内Toll样受体5核因子-κB及白细胞介素17表达及相关性研究 [J]. 中国实用内科杂志, 2014, 34(10):996-999.
[ 14 ] 刘胜楠, 卢雪峰, 孙娜, 等. Toll样受体2、4及核因子-κB在溃疡性结肠炎黏膜组织中的表达及临床意义 [J]. 山东大学学报: 医学版, 2012, 50(2):60-63.
[ 15 ] 张夏梦, 梦折星, 范恒, 等. 清热燥湿凉血方对溃疡性结肠炎大鼠结肠组织修复的影响 [J]. 中医杂志, 2014, 55(20):1764-1767.
[ 16 ] 魏炜, 黄萍, 张绍丹, 等. 白细胞介素-4和内细胞介素-12对纯化培养小鼠视网膜神经节细胞存活的影响 [J]. 中国实验动物学报, 2011, 19(4):282-286.
[ 17 ] Matteo Bosani, Sandro Ardizzone, Gabriele Bianchi Porro. Biologic Targetin h reatmen nflammator owe isease [J]. Biologics, 2009, 3(8):77-97.
[ 18 ] 秦震声, 王软, 赵耀, 等. 舒肝健脾颗粒对溃疡性结肠炎大鼠模型VIP和IL-10水平的影响 [J]. 吉林中医药, 2007, 27(3):48-50.
Effect of Changyian on the expression of nuclear factor kappa B and interleukin-10 in ulcerative colitis rats
Ma Chunhua, Luo Jingyi, Zhu Donghua, Jing Shujuan, Shang Yi.
Department of Anorectal Surgery, Liaocheng Second People′s Hospital, Shandong 252600, China
Ma Chunhua, Email: mahuaqinghe@163.com
Objective T bserv h ffec f Changyia h xpressio f NF-κB p65 and interleukin-10 i lcerativ oliti ats. Methods Ulcerativ oliti a ode a opie y 2, 4, 6-TNBS. Thirty-nin at er andoml ivide nto 3 groups:mode roup, Changyia rou n alazosulfapyridine (SASP) group. After 21 days′ treatment, th hange oloni ucosa amag ndex (CMDI) , level f NF-κB p65 and IL-10 wer bserved. Results After 21 days′ treatment, the CMDI an h xpressio f NF-κB p65 of Changyia rou a ignif i cantl owe ha h ode roup (t=58.28, P=0.003; t=6.01, P=0.016) and SASP group (t=-22.10, P=0.026; t=-2.80, P=0.038) . Th xpressio nterleukin-10 wa bviously highe ha ha ode rou nd SASP group (t=-403.56, P=0.022; t=35.76, P=0.036) . Conclusion Changyia a oo epai ffec lcerativ oliti at olo ucosa. It echanis a elate o reduc h xpressio f NF-κB p65an mprov h eve f IL-I0.
Colitis, ulcerative; IL-I0; Nuclea acto appa B p65; Changyian
2016-09-22)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2017.02.007
252600 山东省聊城市第二人民医院肛肠科
马春花,Email:mahuaqinghe@163.com
