沉积物不同提取态有机物特征及水文地球化学意义
——以河套盆地典型研究区为例
2017-05-15李晓萌郭华明曹永生
李晓萌 ,郭华明,曹永生,张 迪,修 伟
(1.中国地质大学(北京)水资源与环境学院,北京 100083;2.教育部地下水循环与环境演化重点实验室,北京 100083)
沉积物不同提取态有机物特征及水文地球化学意义
——以河套盆地典型研究区为例
李晓萌1,2,郭华明1,2,曹永生1,2,张 迪1,2,修 伟1,2
(1.中国地质大学(北京)水资源与环境学院,北京 100083;2.教育部地下水循环与环境演化重点实验室,北京 100083)
地下水系统中有机物(OM)特征和活性对于地下水化学特征的形成和演化起着十分重要的作用。将内蒙古河套盆地表层湖相沉积物按10 cm间隔采集,并对沉积有机质的性质及来源进行重点分析。测量了不同深度上不同岩性沉积物的色度、水溶性有机物(WEOM)和盐溶性有机物(SEOM)含量及其光谱学特性。结果显示,沉积物的色度(R530-520)与TOC含量呈现相反的变化趋势:色度值较大时,TOC含量反而较小。相对于细砂层,黏土层的色度值较低,但TOC含量较高。相同的沉积物中,SEOM含量高于WEOM,但WEOM更易迁移至地下水中。有机物的光谱指数表明,WEOM以微生物来源为主,而SEOM以陆源为主。通过三维荧光光谱分析发现,荧光强度和沉积物有机碳(SOC)含量呈正相关;黏土层沉积有机物荧光强度更高;WEOM和SEOM均含类腐殖质成分和类蛋白成分,但SEOM中腐殖质成分较高;类腐殖质是所研究的沉积物中OM最主要的存在形式。
沉积物;地下水;有机碳;光谱指数;三维荧光光谱
有机碳(OC)是指存在于沉积物中,与有机质有关的碳素。溶解有机物(DOM)对地下水质量具有关键作用[1~2],DOM在海底地下水排泄过程中为微生物呼吸提供氮和磷[3]。有机碳(OC)作为微生物代谢活动的主要能量来源和碳源,不仅影响元素的氧化-还原过程,而且在一定程度上决定着元素的迁移转化[4]。因此,探究沉积物中的有机物特征及生物地球化学效应具有重要的意义。
沉积物中可溶性/可提取有机物(EOM)是沉积有机质(SOM)中很小但很不稳定的活性组分,国内外很多学者采用不同盐溶液和沉积物混合的方法提取有机物。根据提取试剂的不同,可以分为水溶性有机物(WEOM)和盐溶性有机物(SEOM)。EOM光学活跃的组分被称为有色溶解有机质(CEOM),可作为总EOM 池的动态和特征的示踪物。在吸收光(有色)的同时,CEOM在受到光谱紫外区和蓝区的激发时也会发出荧光[5]。三维荧光光谱(又称激发发射矩阵,EEM)技术是一种用于研究OM来源及组成的较为简便、快捷的光谱指纹技术[6]。通过荧光峰发射/激发波长范围,可鉴定有机物中某些成分的种类或来源。由于OM具有吸收光和散发荧光的能力,荧光测量可以用来表征并跟踪OM荧光组分的动态[7],从而有效地表征OM的特性。因此,OM特别适合于光谱表征,光谱指数的测定也具有较强的指示意义。采用该技术的研究表明,高砷地下水中溶解性有机物(DOM)与沉积物中WEOM的性质较为相似,而与SEOM存在差异[8]。然而,高砷含水层沉积物和高砷地下水化学特征呈高度的各项异性[9],只有精细空间尺度上的沉积物有机物分析结果才能精确把握其水文地球化学作用及其对砷释放的影响。
本文主要针对内蒙古河套盆地—海子边(常年性湿地)采集了完整的钻孔沉积物(8 m),并以10 cm为采样间距采集了沉积物样品,并采用不同方法提取了沉积物样品的有机质得到水溶性有机物(WEOM)和盐溶性有机物(SEOM),两种有机物可分别代表沉积物中可提取的不同EOM组分,从而更细致地刻画沉积物中有机质的特征,并且结合光谱指数和三维荧光光谱特征的分析,进一步探讨沉积有机质的来源,揭示其水文地球化学意义。
1 研究区概况
河套盆地是鄂尔多斯盆地北部与阴山—大青山造山带之间的新生代断陷盆地,属黄河沿岸的冲积平原。河套平原南临黄河,北抵阴山(图1)。东西长600 km,南北宽30~90 km,面积约4×104km2,境内地势平缓倾斜,总体呈西高东低,南高北低,局部有一定的起伏。河套地区属于典型的半干旱-干旱气候,降水量少,蒸发强烈,年均降水量仅为130~220 mm,年蒸发量却高达2 000~2 500 mm[10]。年平均气温为5.6~7.8 ℃。由于强烈的蒸散量,约一半的土壤都含盐。

图1 研究区概况及沉积物采样点图Fig.1 Location of study area and sediment sampling point in the Hetao basin
河套平原地下水储量丰富,但由于特殊的地球化学环境和水文地质条件,地下水赋存运移状态非常复杂。高砷、高氟地下水呈条带状广泛分布,腐殖质的富集较为明显。研究区含水层沉积物主要以冲洪积砂、砂质淤泥、富含有机质的冲-湖积相砂质淤泥、淤泥质黏土组成,盆地中心有机质黏土富集[11]。盆地北面边缘以近代山前冲洪积物为主,内部平原主要为黄河早期冲积湖积物,且零星分布有近代湖积物。河套平原是一个封闭的地下水盆地,表现出以垂直交替为主的循环特征。含水层多层交错,形态复杂、成因类型多。研究区北部地下水主要受降水、地表径流和阴山山脉基岩的横向断裂水补给;南部主要以农田的灌溉回流以及黄河的渗漏补给为主。地下水主要通过蒸散发和人工抽取的方式排泄。
2 材料与方法
2.1 样品采集
采样点为内蒙古河套盆地沙海镇,地处冲湖积平原,为湖相沉积。采样时间为2015年4月。在沙海镇丰产7社一小型湖泊附近#2钻孔进行钻探,钻孔位于水位波动带,有较多芦苇及其他植被分布(图1)。沉积物样品采用荷兰Atlas Copco公司生产的汽油冲击钻(型号:cobra pro)直接成孔,岩芯自动保存在聚氯乙烯(PVC)岩芯柱中。岩芯柱现场进行编号、锡箔纸包裹避光密封,运至中国地质大学(北京)生物地质与环境地质国家重点实验室。在实验室,用德国FEIN振动锯(型号:FEIN MultiMaster Start,FMM250)将样品连同岩芯管从中心一分为二,切割过程中尽量保证切割面的平整性并注意切片的清洁,防止不同部位样品交叉污染。取其中一半进行色度扫描、TOC含量的测定以及两种提取态有机物的提取。
钻孔(#2)经纬度为40°59′45.57″N,106°58′27.06″ E(图1)。钻孔高程为1 034 m,钻孔深度为8 m,其中,2~3 m处由于取样管故障未采集样品。按10 cm的采样间隔,共得到70个沉积物样品。
2.2 样品处理
沉积物样品真空冷冻干燥后,研磨至粒径为2 mm以下,提取水溶性和盐溶性两种有机物。具体提取方法参见文献[8]。
水溶性有机物(WEOM)的提取方法为,室温下将沉积物与0.01 mol/L CaCl2按固液比为1∶2进行混合,振动15 min,振动速度保持为110 rpm。然后将萃取液离心(10 min,4 000 rpm),随后通过0.45 μm聚四氟乙烯滤膜过滤至棕色玻璃瓶中,加入浓度为85%的磷酸进行保存。盐溶性有机物(SEOM)的提取与水溶性有机物大致相同,在室温下将沉积物和0.5 mol/L K2SO4按固液比为1∶5进行混合,振动,随后的操作与WEOM相同。两种提取态有机物均置于4 ℃冰箱中冷藏保存。
沉积物色度为530 nm和520 nm之间散射光谱反射率的差值,采用测色计MAV(8 mm)CM-700d(Konica Corp, USA)进行测量。沉积物有机碳含量的测定采用总有机碳分析仪Multi N/C 2100S(Analytikjena, Germany)。水溶性有机碳(WEOC)及盐溶性有机碳(SEOM)含量的测定采用TOC-CRDS分析仪。
2.3 荧光光谱分析
三维荧光光谱及光谱指数采用高灵敏一体式荧光光谱仪-FluoroMax-4(HORIBA JobinYvon)进行测量分析。光源为150W氙灯;激发(Ex)波长为250~400 nm,步长为4 nm;发射(Em)波长为300~550 nm,步长为2 nm;狭缝宽度为3 nm,扫描信号积分时间为0.1s。得到的荧光光谱通过减去超纯水背景荧光信号进行调控[8],以去除拉曼散射的影响。
荧光光谱指数主要包括生物指数(BIX)、腐殖化指数(HIX)、荧光指数(FI)、芳香度指数(SUVA254)。生物指数(BIX)是在310 nm激发下,发射波长为380 nm和430 nm处的荧光强度值之比,用以指示原生生物活性以及OM来源[11]。腐殖化指数(HIX)是在254 nm激发下,用发射波长434~480 nm的区域积分值除以300~360 nm时的区域积分值,用来指示OM的腐殖化程度、来源以及沉积物中OM的成熟度[12]。荧光指数(FI)为370 nm激发下,发射波长为450 nm和500 nm处的荧光强度值之比,用来表征溶解有机质中腐殖质来源,也可作为区分水生黄腐酸(FA)的简单指标[13]。芳香度指数(SUVA254)由254 nm下测得的紫外吸光度(UV254)除以TOC浓度得到,可反映总有机物中具有芳香结构的比例,并间接体现有机物的腐殖化程度[14]。其中,紫外吸光度UV254使用UV-8100型分光光度计测定。
3 结果与讨论
3.1 沉积物色度及总有机碳特征
沉积物TOC含量为0.06~9.64 g/kg,平均值为2.83 g/kg,且黏土层含量较高。氧化还原特征表征因子色度530~520 nm值(R530-520)范围为0.24~0.96 nm。色度的大小取决于沉积物的矿物成分,能够反映沉积物的沉积环境以及当时环境下的氧化-还原程度。R530-520色度越大,沉积物能够反射的光越强,沉积物偏氧化性。黏土层的色度值比细砂层小,可以看出黏土层沉积物偏还原性。由图2可见,TOC含量与沉积物色度呈现相反的变化趋势,这是因为沉积环境氧化性越强,TOC的消耗量越大,因此含量越低。
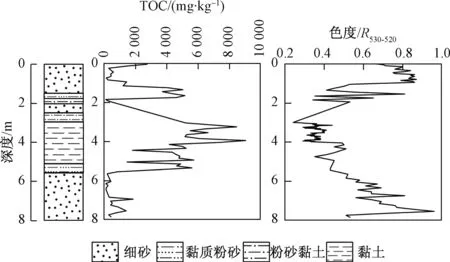
图2 沉积物中TOC及色度随深度及岩性变化图Fig.2 Depth distributions of TOC (a) content and R530-520values(b) in sediments
3.2 不同提取态有机物含量特征
利用两种溶液提取出沉积物中的有机物,测量其有机碳含量,可直观地反映沉积物中可氧化的有机物含量。WEOM的TOC浓度范围为2.57~72.7 mg/kg,平均值为19.5 mg/kg,明显低于SEOM(8.54~128 mg/kg,平均值为50.1 mg/kg),且两者之间相差3~5 倍。该结果与黄爽兵等人的研究结果一致,他们测得SEOM中TOC含量高出WEOM约2~5倍[10]。由此表明,SEOM具有更强的活性。
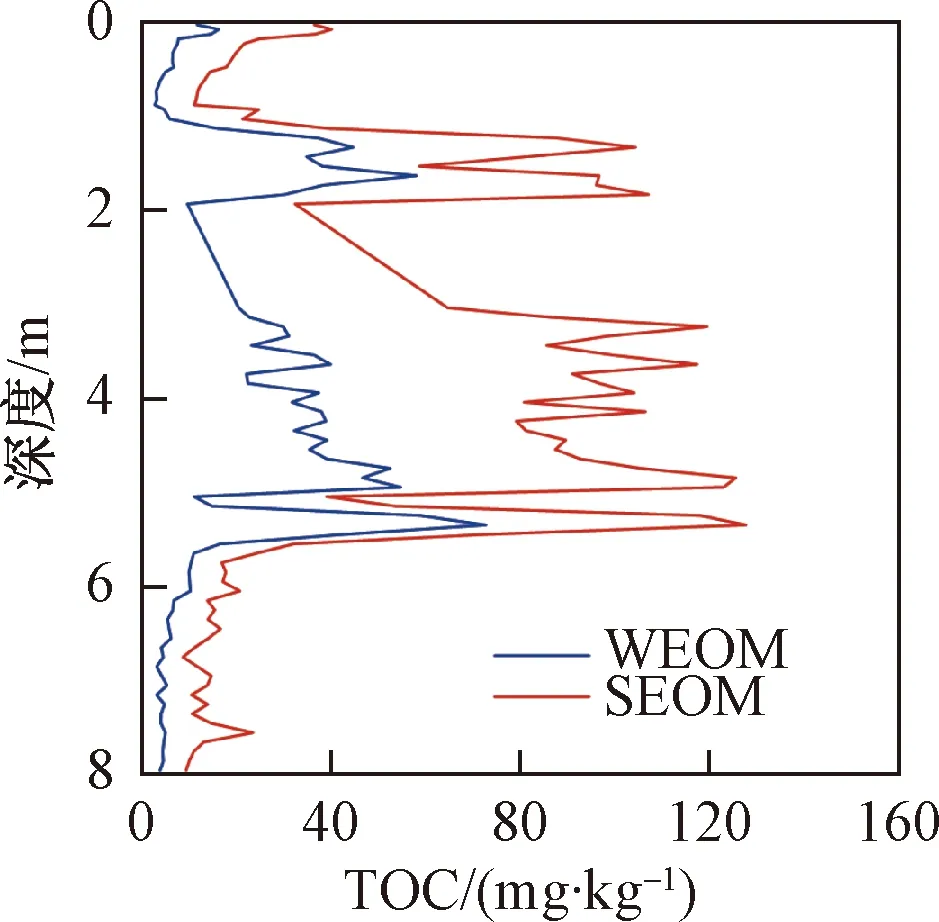
图3 两种提取态有机物有机碳含量垂向变化图Fig.3 Depth distributions of TOC contents of WEOM and SEOM
比较两种提取态有机物有机碳浓度随深度的变化,可以发现两者呈现相似的规律,深度小于1 m及大于5.5 m的沉积物为粉细砂,小于1 m的两种提取态有机物OC含量较高,并随深度的增大而逐渐减小(图3)。这是由于采样点位于湿海子附近,可能与湖泊中沉积的生物碎屑有关。在1 m处OC含量变大,主要是由于该深度以下出现黏土的原因。黏土矿物具有更大的比表面积和负电荷,能够吸附大量的有机物质,从而使得黏土中有机物的含量更加丰富。
3.3 荧光光谱指标及指示意义
为进一步探讨SOM 的来源特征属性,采用生物指数BIX、腐殖化指数HIX、荧光指数FI和芳香度指数SUVA254来研究沉积物中OM的特征。
腐殖质的形成与C/H的增加有关,BIX和HIX均可用于判断沉积物中OM的成熟度。由图4看出,四种荧光指数中,BIX和HIX与沉积物岩性呈现出一定的规律。Hurget等人表示,BIX大于1时,代表生物或细菌引起的自生来源,包括浮游植物和细菌的有机降解产物等,而当BIX值介于0.6~0.7之间时,则表示为陆源输入或受人类影响较大[15]。HIX小于4时,DOM以生物活动为主,腐殖化程度较弱;HIX值介于10~16之间时,是陆地来源腐殖化有机物的重要标志[15]。本研究区域沉积物中WEOM的BIX范围为0.72~1.28,平均值为0.89;SEOM的BIX范围在0.47~0.84,平均值为0.60。WEOM的HIX范围在0.53~5.08,平均值为2.34;SEOM的HIX范围在2.19~15.22,平均值为6.98。不同深度不同岩性指标差异较大。
相比于深度小于1 m的细砂层,深度大于5.5 m的细砂层EOM的BIX值更大并随深度呈现递增的趋势,HIX值更小并随深度呈现递减的趋势,说明沉积时间越长,细砂层生物细菌的活动加强,沉积物EOM属微弱腐殖质特征,且以自生源为主。深度在3~5.5 m的黏土层EOM的BIX值较小,HIX值较大,且随深度的变化不大,说明黏土层中的有机物更不易被降解,从而导致腐殖化程度偏高,稳定性较高,随着沉积时间的增加,仍然能够长期保留在沉积物中。
荧光指数FI值可用于判断EOM的陆地来源和微生物来源。FI值随深度的增加及岩性的不同,没有明显的变化(图4)。McKnight等人表示,FI值接近于1.9表明OM为微生物来源,主要来源于微生物代谢等过程;接近于1.4则表示是陆地沉积物来源,陆源占主要贡献[13]。WEOM的FI范围为1.43~1.81,平均值为1.59;SEOM的FI范围为1.11~1.40,平均值为1.27。说明该研究区沉积物中WEOM可能以微生物来源为主,而SEOM以陆源为主。其中,WEOM在深度小于1 m内FI值在1.4左右,其余均在1.6左右,近地表FI值较小是因为表层光降解较为强烈,其主要来源还是微生物活动。

图4 两种提取态有机物光谱指数(BIX、HIX、FI、SUVA254)随深度变化图Fig.4 Depth distributions of spectral index of WEOM and SEOM
SUVA254可以用来说明OC的芳香性,是判定OC腐殖组分很好的一个指标[14]。WEOM的SUVA254范围在0.92~10.79 L/(mg·m),平均值为2.44 L/(mg·m);SEOM的SUVA254范围为1.52~15.21 L/(mg·m),平均值为3.94 L/(mg·m)。SUVA254值在深度小于1 m时较大,大于1 m后开始变小,并基本保持不变(图4)。近地表沉积物中所含有的芳香性有机碳或共轭不饱和双键比例更高一些;深层沉积物中DOM主要是由碳水化合物组成,芳香族有机物较少,分子结构较为简单。

图5 WEOM和SEOM的HIX, BIX, FI和SUVA254盒状晶须图(其中SUVA254不包含1 m以上的值)Fig.5 Box-whisker plots of BIX (a), HIX (b), FI(c), and SUVA254 (d) for WEOM and SEOM(SUVA254 does not contain values of sediments at depths less than 1 m)注:盒子的上线是上四分位数、下线是下四分位数,中间的黑线为中值;两个晶须端表示最大值和最小值。
WEOM的BIX值高于SEOM(图5a),WEOM的HIX值低于SEOM(图5b),WEOM的FI值高于SEOM(图5c)。根据这三个荧光指数可以初步判定,WEOM主要为微生物自生来源,SEOM主要为陆地来源。HIX与BIX均可反映OM来源,两者之间呈现出较好的负相关关系(图6),当BIX较大时,HIX应较小,即OM以生物来源为主时,其他来源OM相对较少。研究结果与以往研究沉积物有机质的结果相似,即WEOM是可溶有机质,充当沉积物生物群不稳定的OM池[16],而SEOM是相对难降解组分,补充微生物消耗的可溶有机质[17]。由此可以解释WEOM中OC含量较低是因为WEOM中微生物活动加强,促进了微生物对OC的消耗,从而减少了OC的积累。此外,WEOM的SUVA254值低于SEOM(图5d),说明SEOM具有较高的芳香性水平,含有更多芳香结构的腐殖化成分,腐殖化程度更强。SEOM的高腐殖化、高芳香性有利于DOM的迁移[18]。而WEOM的腐殖化程度和芳香性低,有利于DOM的厌氧降解,从而导致DOC含量较低。
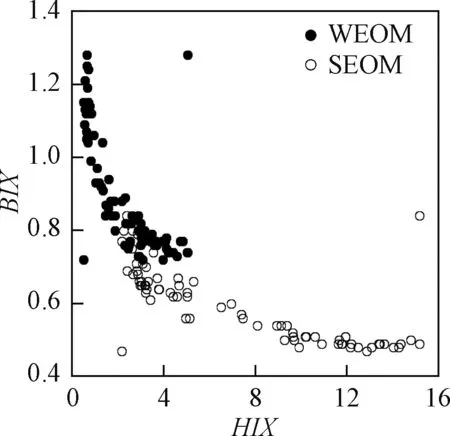
图6 BIX和HIX之间的相关关系图Fig.6 Plots of BIX vs. HIX
3.4 三维荧光光谱及荧光信号强度
根据WEOM和SEOM的三维荧光光谱图,可以发现WEOM和SEOM在不同深度上出现三个荧光峰,与前人已报道DOM组分的特征荧光峰[19~20](表1)进行对比,鉴定出这三种荧光DOM组分(图7):A(Ex=318~330 nm,Em=396~454 nm)为类腐殖酸,B(Ex<250 nm,Em=400~450 nm)为类富里酸,C(Ex=270~280 nm,Em=320~330 nm)为色氨酸成分,推测是由氨基酸或蛋白质中有机成分组成的,类蛋白荧光峰与DOM中的芳环氨基酸结构有关。腐殖质通过微生物和植物前体的降解而形成,并在陆地和水生环境中的天然有机物中占重要比例。腐殖质具有氧化还原活性,在厌氧微生物呼吸中可以作为终端电子受体。WEOM和SEOM在所有深度上都存在A峰和B峰,且A峰荧光强度低于B峰,说明沉积物中的类腐殖酸成分低于类富里酸成分。此外,SEOM的荧光峰强度高于WEOM,说明SEOM中所含腐殖质成分高于WEOM。在大部分粉细砂的WEOM和SEOM中可见C峰,但荧光峰强度有高有低,且出现位置不定,没有一定的规律,这可能是由于OM混合荧光信号掩盖了含量低的组分,也可能与沉积物本身质地有关,色氨酸成分非连续地分布于沉积物中。

表1 前人研究中报道的荧光峰成分
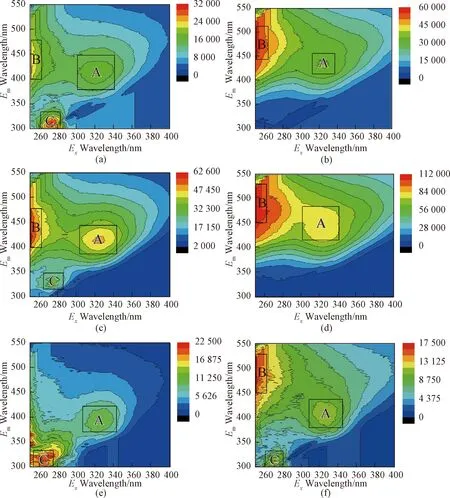
图7 代表性样品的WEOM、SEOM三维荧光光谱图(图例为荧光强度范围,单位A.U.;横、纵坐标分别为发射、激发波长;a,c,e分别为WEOM在1 m, 4 m, 8 m处的光谱图,b, d, f分别为SEOM在1 m, 4 m, 8 m处的光谱图)Fig.7 3D fluorescence spectra ofrepresentative samples of WEOM and SEOM(X axis is the emission wavelength, Y axis is the excitation wavelength; a,c,e for WEOM at 1 m, 4 m, 8 m, respectively; b,d,f for SEOM at 1 m, 4 m, 8 m, respectively).
图7分别显示了#2钻孔1 m、4 m、8 m处的沉积物不同提取态有机物的三维荧光光谱图。其中1 m(a、b)和8 m(e、f)处的沉积物为粉细砂,4 m(c、d)处沉积物为黏土。由此可见,黏土中的荧光强度更高一些,粉细砂随着深度的增大,荧光强度逐渐减弱。不同粒径的沉积物颗粒具有不同的比表面积和重量,从而表现出不同的特征,黏土矿物的比表面积较大,对化学组分有较强的吸附能力,因此腐殖质含量较高。
由于峰B最大荧光强度的具体位置不能够确定,峰C的出现无明显规律,这里不作过多讨论。为探讨荧光OM特性和两种提取态有机物含量之间的关系,对三维荧光光谱荧光峰A的最大荧光强度进行提取,考察最大荧光强度和WEOC、SEOC之间的关系。由此可见,两种提取态有机物的OM来源虽然不同,但荧光强度和OC呈现良好的正相关关系(图8)。OM的荧光强度可能与OC中的荧光有机质部分有关,荧光OM是主要的溶解性有机物,其相对含量的变化也可以解释有机物浓度的变化趋势。

图8 两种提取态有机物OC含量与A峰最大荧光强度的相关关系图(a: WEOM; b: SEOM)Fig.8 Correlations between Peak A intensity and TOC concentrations of WEOM (a) and SEOM (b)
3.5 不同提取态有机物的水文地球化学意义
湖泊沉积物中有机质主要有两大来源:内源的湖泊水生植物或外源的由入湖水流带入的陆源生物。结合WEOM和SEOM的荧光光谱指标和三维荧光光谱的特征可知,研究区内WEOM与微生物来源有机质更为相关;而SEOM是陆源腐殖化有机物的代表。两种提取态有机物均含有腐殖质成分及蛋白质成分,并且类富里酸高于类腐殖酸成分。有机质多为现代生物残体和水生生物机体经过生物化学作用代谢的产物。WEOM代表沉积物中可生物降解的不稳定OM池;SEOM代表沉积物中相对难降解组分。对于近地表的沉积物,好氧微生物较为活跃,生源性OM组分丰富。
研究区处于山前冲洪积平原向冲湖积平原过渡的区域,地势较为平坦,邻近地下水排泄区,地下水流动缓慢,浅层多以细砂与黏土互层。第四纪沉积物主要为湖相泥砂质沉积物,晚更新世以来,由于黄河的水动力分异作用,沉积层在垂向上出现沉积物粒度由细到粗的双层结构。该研究中的沉积物主要为全新统(Q4)为主的湖积物,多以黏砂土、砂黏土以及黏土为主;局部为粉细砂。而上部的黏土层OC含量较高,微生物可利用的碳源随之增加,促进微生物的分解作用,并消耗氧气,从而形成有利于地下水中As富集的还原环境。此外,所研究钻孔位于常年性湖的水位波动带上,由于受湖泊环境的影响,表层沉积物富含各种水生生物。尽管WEOM中OC含量低于SEOM,但是WEOM易于被微生物利用,微生物降解有机物消耗氧气,促进还原环境的形成,从而导致铁锰氧化物的还原以及地下水As的富集。虽然SEOM难于降解,但可与As形成竞争吸附或螯合物,也可与As共同沉积;竞争吸附作用或螯合作用下,OC可促进As从沉积物释放到地下水中。
地下水中有机物的类型和丰度,也决定着某些元素的聚集和迁移。这方面仍需进一步讨论。
4 结论
(1)沉积物的色度与TOC含量呈现相反的变化趋势。黏土层沉积物氧化性较弱,TOC消耗量较小,TOC含量相对于细砂层较高。
(2)利用0.01 M CaCl2和0.5 M K2SO4对沉积物中的有机质进行提取,得到水溶性有机物(WEOM)和盐溶性有机物(SEOM),可分别充当沉积物生物群不稳定的OM池和沉积物中相对难降解组分,沉积物中SEOM的活性更强。
(3)沉积物中OC是由不同来源OM混合而成,包括微生物来源有机质和陆源有机质的贡献。WEOM以微生物来源为主,SEOM以陆源输入为主。通过SUVA254的比较发现,SEOM腐殖化程度较高,具有更多芳香性结构的腐殖成分。黏土层中的有机物更不易被降解,腐殖化程度偏高。
(4)WEOM和SEOM均含类腐殖质成分和类蛋白成分,其中类富里酸成分高于类腐殖酸成分。黏土层中荧光强度与两种提取态有机物的OC浓度呈现正相关关系,表明沉积物中OM的荧光强度可能与OC中的荧光有机成分有关。总的来说,类腐殖质OM被认为是所研究的沉积物样品中OM最主要的存在形式,并且随深度的增加,相同岩性沉积物的氧化性逐渐增强,有机物中的类腐殖物质被降解,导致其成分逐渐减少。
[1] 徐芬, 马腾, 石柳,等. 内蒙古河套平原高碘地下水的水文地球化学特征[J]. 水文地质工程地质, 2012, 39(5): 8-15.[XU F, MA T, SHI L,etal. Hydrogeochemical characteristics of high iodine groundwater in the Hetao Plain,Inner Mongolia[J]. Hydrogeology & Engineering Geology, 2012, 39(5): 8-15.(in Chinese)].
[2] Mladenov N, Zheng Y, Miller M P,etal. Dissolved organic matter sources and consequences for iron and arsenic mobilization in Bangladesh aquifers[J]. Environmental Science & Technology, 2010, 44(1): 123-128.
[3] Gleeson J, Santos I R, Maher D T,etal. Groundwater-surface water exchange in a mangrove tidal creek: Evidence from natural geochemical tracers and implications for nutrient budgets[J]. Marine Chemistry, 2013, 156(11): 27-37.
[4] 周殷竹, 郭华明, 逯海. 高砷地下水中溶解性有机碳和无机碳稳定同位素特征[J]. 现代地质, 2015, 29(2): 252-259. [ZHOU Y Z, GUO H M, LU H. Stable Isotope Characteristics of Dissolved Organic Carbon and Inorganic Carbon in High Arsenic Groundwater[J]. Geoscience, 2015, 29(2): 252-259.(in Chinese)]
[5] Stedmon C A, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy [J]. Marine Chemistry, 2003, 82(3-4): 239-254.
[6] Stedmon C A, Markager S. Resolving the variability in dissolved organic matter fluorescence in atemperate estuary and its catchment using Parafac analysis[J]. Limnology & Oceanography, 2005, 50(2): 686-697.
[7] Huang S B, Wang Y X, Chao L,etal. Characterization of DOM from soil in unsaturated zone and its implications on arsenic mobilization into groundwater[J]. Earth Science(Journal of China University of Geosciences), 2012, 37(3): 605-611.
[8] Huang S B, Wang Y X, Ma T,etal. Linking groundwater dissolved organic matter to sedimentary organic matter from a fluvio-lacustrine aquifer at Jianghan Plain, China by EEM-PARAFAC and hydrochemical analyses[J]. Science of the Total Environment, 2015, 529: 131-139.
[9] Guo H M, Zhang B, Li Y,etal. Hydrogeological and biogeochemical constrains of arsenic mobilization in shallow aquifers from the Hetao basin, Inner Mongolia[J]. Environmental Pollution, 2011, 159(4): 876-883.
[10] 高存荣, 李朝星, 周晓虹,等. 河套平原临河区高砷地下水分布及水化学特征[J]. 水文地质工程地质, 2008, 35(6): 22-28.[GAO C R, LI C X, ZHOU X H,etal. Occurrence and hydrochemical characteristics of As-rich groundwater in the Linhe district of the Hetao Plain[J]. Hydrogeology & Engineering Geology, 2008, 35(6): 22-28.(in Chinese)]
[11] Toosi E R, Castellano M J, Singer J W,etal. Differences in soluble organic matter after 23 years of contrasting soil management[J]. Soil Science Society of America Journal, 2012, 76(2): 628-637.
[12] Zsolnay A, Baigar E, Jimenez M,etal. Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying [J]. Chemosphere, 1999, 38(1): 45-50.
[13] Mcknight D M, Boyer E W, Westerhoff P K,etal. Spectrophotometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity [J]. Limnology & Oceanography, 2001, 46(1): 38-48.
[14] Weishaar J L, Aiken G R, Bergamaschi B A,etal. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science & Technology, 2003, 37(20): 4702-4708.
[15] Huguet A, Vacher L, Relexans S,etal. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2008, 40(6): 706-719.
[16] Reemtsma T, Bredow A, Gehring M. The nature and kinetics of organic matter release from soil by salt solutions [J]. European Journal of Soil Science, 1999, 50(1): 53-64.
[17] Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen (DON) and dissolved organic carbon (DOC) in soil[J]. Soil Biology & Biochemistry, 2006, 38(5): 991-999.
[18] 何小松, 张慧, 黄彩红,等. 地下水中溶解性有机物的垂直分布特征及成因[J]. 环境科学, 2016, 37(10): 3813-3820.[HE X S, ZHANG H, HUANG C H,etal. Vertical Distribution Characteristics of Dissolved Organic Matter in Groundwater and Its Cause[J]. Environmental Science,2016, 37(10): 3813-3820.(in Chinese)]
[19] Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy [J]. Marine Chemistry, 1996, 51(4): 325-346.
[20] Chen W, Westerhoff P, Leenheer J A,etal. Fluorescence excitation-emission matrix regional integration toquantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2003, 37: 5701-5710.
Characteristics of different extractable organic matter in sediments and its hydrogeochemical significance:A case study of the typical study area in hetao basin
LI Xiaomeng1,2, GUO Huaming1,2, CAO Yongsheng1,2, ZHANG Di1,2, XIU Wei1,2
(1.SchoolofWaterResourcesandEnvironment,ChinaUniversityofGeosciences(Beijing),Beijing100083,China;2.MOEKeyLaboratoryofGroundwaterCirculationandEnvironmentalEvolution,Beijing100083,China)
Characteristics and reactivity of organic matter (OM) in groundwater systems play very important roles in the formation and evolution of groundwater chemical characteristics. In this study, 70 fluviolacustrine sediments were taken at 10 cm interval near the land surface in the Hetao Basin of Inner Mongolia to characterize sedimentary organic matter properties. The diffuse spectral reflectance of sediments, water soluble organic matter (WEOM) and salt soluble organic matter (SEOM) contents and their spectroscopic properties were measured. Results showed that diffuse spectral reflectance between 530 nm and 520 nm(R530-520) of sediments and TOC content showed the opposite trend: When theR530-520value was higher, the TOC content was lower. In comparison with fine sand, clay layer had lowerR530-520values, but higher TOC contents. In the same sediment, contents of SEOM were higher than those of WEOM, but WEOM was easier to migrate into groundwater. The spectral index showed that WEOM possesses more biological/microbe-associated materials, but SEOM is representative of terrigenous materials.Excitation-emission matrix spectroscopy analysis showed that the fluorescence intensities were positively correlated with OC contents in sediments (SOC),which were high in clay layer. Moreover, both WEOM and SEOM had similar humic-like components and protein-like components, but the humic-like components in SEOM were higher than those in WEOM. Humic-like OM is considered to be the most important form in sedimentary OM in this study.
sediment; groundwater; organic carbon; spectral index; excitation-emission matrix spectroscopy
10.16030/j.cnki.issn.1000-3665.2017.02.06
2016-10-08;
2017-01-08
国家自然科学基金(41222020 、 41672225)
李晓萌(1994-),女,硕士,主要从事地下水科学与工程研究。E-mail:lixiaomeng@cugb.edu.cn
郭华明(1975-),男,教授,主要从事水文地质学方面的研究。E-mail:hmguo@cugb.edu.cn
P641.3
A
1000-3665(2017)02-0040-08
