利格列汀联合门冬胰岛素50治疗肝源性糖尿病的效果观察
2017-05-15姜晓笛
杨 硕, 姜晓笛
(1 中国医科大学人民医院, 辽宁省人民医院 内分泌科, 沈阳 110016;2 中国医科大学附属盛京医院 感染科, 沈阳 110004)
利格列汀联合门冬胰岛素50治疗肝源性糖尿病的效果观察
杨 硕1, 姜晓笛2
(1 中国医科大学人民医院, 辽宁省人民医院 内分泌科, 沈阳 110016;2 中国医科大学附属盛京医院 感染科, 沈阳 110004)
目的 观察利格列汀联合门冬胰岛素50治疗肝源性糖尿病(HD)的疗效和安全性。方法 选取2014年10月-2016年2月于辽宁省人民医院就诊的HD患者57例。随机分为门冬胰岛素50治疗组(A组,28例),利格列汀联合门冬胰岛素50治疗组(B组,29例),比较2组基线水平和治疗12周后血糖、胰岛素、C肽、葡萄糖处置指数(DI)、糖化血红蛋白、胰高血糖素、胰岛素日剂量,观察低血糖事件及其他不良反应。计量资料组内比较采用配对t检验,组间比较采用成组t检验,计数资料组间比较采用χ2检验。结果 治疗12周后,2组4个时间点血糖较治疗前下降,差异均有统计学意义(t=5.357~21.380,P值均<0.05),30、60、120 min胰岛素高于治疗前,差异均有统计学意义(t=2.222~6.491,P值均<0.05)。B组糖化血红蛋白、胰高血糖素、胰岛素日剂量、30、60、120 min血糖和胰岛素值低于A组,差异均有统计学意义(t=3.136~15.096,P值均<0.05),DI、4个时间点C肽值高于A组,差异均有统计学意义(t=2.994~10.813,P值均<0.05)。A组低血糖事件发生率(28.6%)高于B组(3.4%),差异有统计学意义(χ2=5.005,P<0.05)。结论 利格列汀联合门冬胰岛素50治疗HD能更有效控制血糖,且安全。
肝疾病; 糖尿病; 利格列汀; 门冬胰岛素50; 治疗
肝脏是维持人体血糖代谢平衡的重要器官,任何肝脏疾病都有可能由于肝实质损伤,导致糖代谢紊乱、糖耐量异常而诱发糖尿病的发生,这种继发于肝实质病变而发生的糖尿病症候群称为肝源性或肝性糖尿病(hepatogenous diabetes,HD),其发病率较高,危害大,且影响肝病患者预后[1]。目前HD的降糖治疗主要以注射胰岛素为主,口服药物的研究很少。HD患者肝糖原储备及糖异生能力减退,患者应用胰岛素治疗过程中易出现低血糖,导致血糖波动较大[2]。利格列汀属于二肽基肽酶4 (dipeptidylpeptidase 4, DPP-4)抑制剂,临床研究[3]表明,其与二甲双胍、磺脲类、吡格列酮及胰岛素联用,均能发挥良好的降糖效果,且不会增加低血糖和不良反应的发生率。本研究对HD患者应用利格列汀联合门冬胰岛素50进行降糖治疗,观察其疗效及安全性,现报道如下。
1 资料与方法
1.1 研究对象 选取2014年10月-2016年2月于辽宁省人民医院内分泌科和感染科就诊的HD患者63例。6例因依从性差未按时随访而脱落,最终完成随访57例。入选患者中慢性乙型肝炎36例,慢性丙型肝炎7例,肝炎后肝硬化10例,酒精性肝硬化4例,其中病毒性肝炎及肝炎后肝硬化患者的病毒量已得到有效控制。本研究获得本院医学伦理委员会批准,患者均签署知情同意书。
1.2 入选标准 (1)年龄40~75岁;(2)既往未应用降糖药物;(3)HD诊断符合:①有慢性肝病史,肝病发生在糖尿病之前或同时发生;②无糖尿病既往史和家族史,糖尿病症状轻或无;③有肝病的临床表现和生化学检查异常,或影像学检查证据[4];④糖尿病的诊断符合1999年世界卫生组织诊断标准[5];⑤排除垂体、肾上腺、甲状腺等疾病所引起的继发性糖尿病及原发性糖尿病;(4)肝功能Child-Pugh分级A、B级;(5)7%≤糖化血红蛋白≤12.0%;(6)7.0 mmol/L≤空腹血糖≤13.3 mmol/L。
1.3 排除标准 (1)利格列汀使用禁忌证者;(2)严重心、肺、肾功能不全者;(3)糖尿病酮症、高血糖高渗综合征等急性并发症者;(4)精神神经障碍者;(5)哺乳期、妊娠期及计划3个月内妊娠者;(6)服药依从性差者。1.4 分组及治疗方法 所有入组患者均给予抗病毒、保肝、降酶、退黄及抗肝纤维化等基础治疗,均接受糖尿病专科护士的指导,包括合理饮食、适当运动及规范注射胰岛素、服药。将57例患者随机分为门冬胰岛素50治疗组(A组,28例),给予门冬胰岛素50(商品名:诺和锐50,诺和诺德公司)降糖治疗。利格列汀联合门冬胰岛素50治疗组(B组,29例),给予利格列汀(商品名:欧唐宁,勃林格殷格翰药业有限公司)5 mg,口服,1次/d,联合门冬胰岛素50降糖治疗。2组患者连续治疗12周,门冬胰岛素50起始剂量为0.4 U·kg-1·d-1),早、晚餐前皮下注射,血糖水平前4周每周随访1次,4周后每月随访1次,患者自行监测空腹及三餐后2 h血糖,根据复诊时患者血糖记录情况调整胰岛素剂量,血糖控制目标为空腹血糖<7.0 mmol/L,餐后2 h血糖<11.0 mmol/L。随访期间若患者出现低血糖症状,并实际测得血糖值符合低血糖标准(末梢血糖<3.9 mmol /L),或仅监测到低血糖均应及时记录并电话汇报,由随访医师调整胰岛素剂量。
1.5 观察指标 2组患者分别在试验前后行75 g无水葡萄糖粉糖耐量试验(OGTT),测定0、30、60、120 min 血糖及胰岛素、C肽水平。计算简易葡萄糖处置指数(DI)[6],DI=△I30/△G30/Homa-IR,其中△I30 = 30 min胰岛素-0 min胰岛素,△G30 =30 min血糖-0 min血糖,Homa-IR为稳态模型胰岛素抵抗指数,Homa-IR=空腹胰岛素×空腹血糖/22.5。观察治疗前后糖化血红蛋白、胰高血糖素、血常规及肝、肾功能变化,胰岛素用量,随访期间低血糖人次,若血清胰淀粉酶、ALT、TBil升高则视为不良反应。
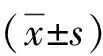
2 结果
2.1 一般资料 2组患者性别构成、年龄、糖尿病病程、BMI差异均无统计学意义(P值均>0.05)(表1),具有可比性。
2.2 临床疗效 治疗前2组血糖、胰岛素、C肽、DI、糖化血红蛋白、胰高血糖素、肝功能指标差异均无统计学意义(P值均>0.05)。治疗12周后,两组OGTT中4个时间点血糖均较治疗前下降(P值均<0.05),B组30、60、120 min血糖值均低于A组(P值均<0.05);2组30、60、120 min 胰岛素值均高于治疗前(P值均<0.05),且A组高于B组(P值均<0.05);B组各时间点C肽、DI均增高,且高于A组(P值均<0.05),胰高血糖素下降,且明显低于A组(P<0.05);2组糖化血红蛋白值均下降,且B组低于A组(P<0.05);胰岛素日剂量B组明显低于A组(P<0.05);2组血清ALT、TBil较治疗前下降,血浆Alb较治疗前增高(P值均<0.05),但2组间比较差异无统计学意义(P值均>0.05)(表2)。
2.3 不良反应 2组均无严重低血糖事件发生(血糖≤2.8 mmol/L),A组发生轻度低血糖(血糖3.1~3.8 mmol/L)8例(28.6%),B组发生1例(3.4%),2组比较差异有统计学意义(χ2=5.005,P<0.05)。治疗前后血清淀粉酶、肾功能均无明显变化。
3 讨论
HD是临床上较为常见的一种继发于慢性肝实质损伤的糖尿病,该类糖尿病在医学上归属于2型糖尿病,但又不同于原发性2型糖尿病。HD患者胰岛素抵抗程度更重,胰高血糖素水平明显增高,餐后血糖增高更明显[7-8]。Blaslov等[9]最新研究结果表明肝胰岛素抵抗患者血清DPP-4的活性明显增高。利格列汀是新一代DPP-4酶抑制剂,抑制胰高血糖素样多肽降解,从而提升内源性胰高血糖素样多肽的浓度,以葡萄糖依赖的方式促进胰岛素分泌,同时抑制胰高糖素分泌,减少肝糖输出,降低餐后血糖作用更明显[10]。因C肽测定不受外源性胰岛素干扰,且C肽大部分经肾脏代谢,不受肝功能异常影响,在HD患者中可准确反映胰岛β细胞功能。本研究中联合治疗组C肽值明显增高,因利格列汀通过调节肠促胰素效应改善胰岛素分泌,缓解β细胞功能障碍所致。

表1 2组患者一般资料比较
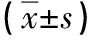
表2 2组治疗前后各项指标比较
注:与A组治疗后比较,1)t=2.994~15.096,P<0.05
门冬胰岛素是将胰岛素分子上P链第28位的脯氨酸用天门冬氨酸代替,这一变动使其皮下吸收更快,血糖浓度能够在更短的时间内下降。门冬胰岛素具有作用快、排泄快的特点,使其在体内的蓄积量减少,从而降低了全天的高胰岛素血症。本研究基于HD患者餐后血糖增高为主的特点,选用利格列汀联合门冬胰岛素50降糖。
因利格列汀体内基本不代谢,仅为细胞色素P450 3A4底物,而对其他细胞色素P450异构酶均无激动或抑制作用,90%经肠道排出体外[11]。在利格列汀Ⅰ期临床研究中,轻、中、重度肝功能受损患者单次及多次服用利格列汀5 mg/d后,其暴露量与正常肝功能者相比未见明显改变,分析其原因可能是肝功能受损患者P-糖蛋白功能上调,使利格列汀肠吸收减少,经肾排泄增加,并促进其直接排泄入肠道,故未见利格列汀暴露量有显著变化,且对DPP-4活性的抑制仍维持在80%以上,故肝功能受损患者使用本药无需调整用药剂量。
本研究结果显示,联合治疗12周后,患者血糖、糖化血红蛋白、胰高血糖素、胰岛素日剂量均较单用胰岛素组下降,OGTT中口服葡萄糖粉后各时间点C肽水平显著增加,DI明显提高。表明利格列汀联合门冬胰岛素50可有效降低血糖,节省胰岛素用量,减轻外源性高胰岛素血症及胰岛素抵抗,改善胰岛功能。该方案低血糖事件发生率较单用胰岛素组明显减少,这可能与DPP-4酶抑制剂能够改善胰岛α细胞功能有关[12]。另外,诱发胰腺炎是人们对DPP-4酶抑制剂治疗不良反应的关注点。本研究中应用利格列汀治疗后血淀粉酶未见增高,提示其短期治疗并不引起胰腺炎。
本研究中2组治疗12周后肝功能均较治疗前改善,但组间比较未见差异, 尚未观察到联合治疗组胰岛素抵抗程度减轻所带来的肝功能好转,考虑与观察时间短有关。另外,入组患者中病毒性肝炎患者所占比例高达93%,联合治疗对病毒学应答及肝脏组织学的影响将是下一步研究的重点。
综上所述,在HD降糖治疗中,应用利格列汀联合门冬胰岛素50是一种有效、安全的方案。因利格列汀具有独特的改善α细胞功能,抑制胰高血糖素分泌、提高体内DPP-4酶活性的作用,其在HD治疗中能否获得降糖以外的额外收益仍有待进一步研究。
[1] PETRIDES AS. Hepatogenic diabetes: pathophysiology,therapeutic options and prognosis[J]. Z Gastroenterol, 1999, 16(Suppl 1): 15-21.
[2] ELKRIEF L, RAUTOU PE, SARIN S, et al. Diabetes mellitus in patients with cirrhosis:clinical implications and management[J]. Liver Int, 2016, 36(7): 936-948.
[3] INZUCCHI SE, NAUCK MA, HEHNKE U, et al.Improved glucose control with reduced hypoglycaemic risk when linagliptin is added to basal insulin in elderly patients with type 2 diabetes[J]. Diabetes Obes Metab, 2015, 17(9): 868-877.
[4] JIANG LP, ZHAO JM. Diagnosis and therapy of hepatogenous diabetes[J]. World Chin J Dig, 2007, 15(6): 617-621. (in Chinese) 姜丽萍, 赵金满. 肝源性糖尿病的诊断与治疗[J]. 世界华人消化杂志, 2007, 15(6): 617-621.
[5] Chinese Medical Association Diabetes Society. Chinese type 2 diabetes prevention guide[J]. Chin J Diabetes Mellitus, 2014, 6(7): 447-498.(in Chinese) 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华糖尿病杂志, 2014, 6(7): 447-498.
[6] MATTHEWS DR, HOSKER JP, RUDENSKI AS, et al. Homeostasis model oplasma glucose insulin concentration in man[J]. Diabetologia, 1985, 28(7): 412-419.
[7] TAKAHASHI H, EGUCHI Y, ANZAI K. Pathogenesis of hepatogenous diabetes[J]. Nihon Rinsho, 2016, 74(Suppl 2): 587-591.
[8] LI N, CUI WL, QIAO B, et al. Therapeutic effects of entecavir and adefovir dipivoxil in hepatitis B cirrhosis patients with hepatogenous diabetes: a comparative analysis[J]. J Clin Hepatol, 2016, 32(6): 1108-1111. (in Chinese) 李娜, 崔伟丽, 乔兵, 等. 恩替卡韦和阿德福韦酯治疗乙型肝炎肝硬化合并肝源性糖尿病患者的效果比较[J]. 临床肝胆病杂志, 2016, 32(6): 1108-1111.
[10] RETLICH S, DUVAL V, GRAEFE-MODY U, et al. Population pharmacokinetics and pharmacodynamics of linagliptin in patients with type 2 diabetes mellitus[J]. Clin Pharmacokinet, 2015, 54(7): 737-750.
[11] INAGAKI N, SHEU WH, OWENS DR, et al. Efficacy and safety of linagliptin in type 2 diabetes patients with self-reported hepatic disorders: a retrospective pooled analysis of 17 randomized,double-blind, placebo-controlled clinical trials[J]. J Diabetes Complications, 2016, 30(8): 1622-1630.
[12] ARULMOZHIRAJA S, MATSUO N, ISHITSUBO E, et al. Comparative binding analysis of dipeptidyl peptidase IV(DPP-4) with antidiabetic drugs-an Ab initio fragment molecular orbital study[J]. PLoS One, 2016, 11(11): e0166275.
引证本文:YANG S, JIANG XD. Clinical effect of linagliptin combined with insulin aspart 50 in treatment of hepatogenous diabetes[J]. J Clin Hepatol, 2017, 33(5): 928-931. (in Chinese) 杨硕, 姜晓笛. 利格列汀联合门冬胰岛素50治疗肝源性糖尿病的效果观察[J]. 临床肝胆病杂志, 2017, 33(5): 928-931.
(本文编辑:王亚南)
Clinical effect of linagliptin combined with insulin aspart 50 in treatment of hepatogenous diabetes
YANGShuo,JIANGXiaodi.
(DepartmentofEndocrinology,ThePeople′sHospitalofChinaMedicalUniversity&ThePeople′sHospitalofLiaoningProvince,Shenyang110016,China)
Objective To investigate the clinical effect and safety of linagliptin combined with insulin aspart 50 in the treatment of hepatogenous diabetes (HD). Methods A total of 57 patients with HD who visited The People′s Hospital of Liaoning Province from October 2014 to February 2016 were enrolled and randomly divided into insulin aspart 50 group (group A, 28 patients) and linagliptin combined with insulin aspart 50 group (group B, 29 patients). The two groups were compared in terms of blood glucose, insulin, C-peptide, glucose disposition index (DI), glycosylated hemoglobin A1c (HbA1c), glucagon, and daily insulin dose at baseline and after 12 weeks of treatment. The adverse events including hypoglycemia were observed. The pairedt-test was used for comparison of continuous data within one group, and the independent-samplesttest was used for comparison of continuous data between groups; the chi-square test was used for comparison of categorical data between groups. Results After 12 weeks of treatment, both groups had significant reductions in blood glucose at four time points (t=5.357-21.380, allP<0.05) and significant increases in the insulin level at 30, 60, and 120 minutes (t=2.222-6.491, allP<0.05). Compared with group A, group B had significantly lower levels of HbA1c and glucagon, daily insulin dose, and blood glucose and insulin levels at 30, 60, and 120 minutes (t=3.136-15.096, allP<0.05), as well as significantly higher DI and levels of C-peptide at four time points (t=2.994-10.813, allP<0.05). Group A had a significantly higher incidence rate of hypoglycemia than group B (28.6% vs 3.4%,χ2=5.005,P<0.05). Conclusion Linagliptin combined with insulin aspart 50 can effectively control blood glucose in patients with HD and has good safety.
liver diseases; diabetes mellitus; linagliptin; insulin aspart 50; therapy
10.3969/j.issn.1001-5256.2017.05.028
2016-11-25;
2017-01-05。
杨硕(1983-),女,主治医师,主要从事糖尿病发病机制研究。
R575; R587.1
A
1001-5256(2017)05-0928-04
