TGFβ1对原发性肝癌诊断价值的Meta分析
2017-05-15莫晓丽诸佳瑜毛素菲
莫晓丽, 刘 洁, 诸佳瑜, 陈 闯, 欧 杰, 毛素菲
(1 广西中医药大学, 南宁 530001; 2 广西医科大学附属肿瘤医院 中医科, 南宁 530021)
论著/肝脏肿瘤
TGFβ1对原发性肝癌诊断价值的Meta分析
莫晓丽1, 刘 洁1, 诸佳瑜1, 陈 闯2, 欧 杰2, 毛素菲2
(1 广西中医药大学, 南宁 530001; 2 广西医科大学附属肿瘤医院 中医科, 南宁 530021)
目的 采用Meta分析方法系统评价TFGβ1在原发性肝癌(以下简称肝癌)诊断中的价值。方法 计算机检索PubMed、EMBASE、Cochrane Library、中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、万方数据库及维普数据库中公开发表的TGFβ1诊断原发性肝癌的文献,检索时间为数据库建库至2016年6月30日。筛选出的文献采用OQAQ量表进行评价质量。通过Stata 13.0软件进行效应量诊断比值比、阳性似然比、阴性似然比等指标合并,并绘制综合受试者工作特征曲线(SROC曲线),进行发表偏倚检验。可信度以95%可信区间(95%CI)表示。异质性检验采用Q检验和I2检验,同时进行亚组分析。结果 共纳入16篇文献,合计肝癌组1124例,对照组1443例。敏感度及95%CI为0.68(0.52~0.80),特异度及95%CI为0.85(0.74~0.92),诊断比值比及95%CI为11.75(6.18~22.36);阳性似然比及95%CI为4.6(2.7~7.9),阴性似然比及95%CI为0.38(0.26~0.56),SROC曲线下面积及95%CI为0.84(0.80~0.87)。亚组分析所得结果显示,ELISA检测方法的阳性似然比、诊断比值比和SROC曲线下面积均高于免疫组化检测,阴性似然比小于免疫组化检测。纳入的文献存在异质性,主要来源为研究对象的肝病背景不同,非原发性肝癌组的构成不统一(包含良性对照组和正常对照),以及实验设计差异等导致。描绘Deeks漏斗图,提示无明显发表偏倚。结论 TGFβ1在肝癌的诊断中具有较高的灵敏度及特异度,有可能成为肝癌的一种辅助诊断指标。
肝肿瘤; 转化生长因子β1; 诊断; Meta分析
据2009-2011年的癌症登记数据显示,在2015年约有4 292 000例新发的癌症病例,其中约有466 100例为原发性肝癌(以下简称肝癌),而每年约有422 100例肝癌患者死亡[1],病死率约为90%。目前临床上诊断肝癌的方法除了病理确诊外,更多是采用血清甲胎蛋白及影像学检查。但仅有50%~70%的肝癌患者血清甲胎蛋白高于正常值,而在直径<3 cm的小肝癌中甲胎蛋白的阳性率仅为33%~65%,提示其敏感度有待提高。且在急慢性肝炎、肝硬化等肝脏非恶性疾病时,血清甲胎蛋白也常常出现非特异性升高,因而降低了甲胎蛋白对肝癌的诊断价值。TGFβ1在肝细胞增殖方面起负相调节作用,参与控制肿瘤细胞的数量,抑制肝细胞的增殖,打乱细胞信号通路,使细胞避开由TGFβ1介导的生长抑制作用,促进肝癌的发生[2]。肝癌细胞产生的TGFβ1可以减少细胞毒性T淋巴细胞和自然杀伤细胞的增殖或激活,从而提高肝癌细胞逃脱免疫监测的能力[3]。Shirai等[4-5]研究发现,肝癌患者血浆中TGFβ1的水平明显高于慢性肝病组及正常对照组,且治疗后肝癌患者血浆TGFβ1水平明显下降。本研究对国内外研究TGFβ1诊断肝癌的结果进行Meta分析,为TGFβ1辅助临床诊断肝癌提供依据。
1 资料与方法
1.1 文献检索 计算机检索PubMed、EMBASE、Cochrane Library、中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、万方数据库及维普数据库,检索时间为数据库建库至2016年6月30日。外文检索式为: (“TGF-β1”OR “transforming growth factor-β1”OR“tumor marker”) AND (“hepatocellular carcinoma”OR“liver cancer”);中文检索式为:(“TGFβ1”或“转化生长因子β1”或“瘤标志物”)与(“肝癌”或“原发性肝癌”)。
1.2 文献纳入标准 (1)研究文献为TGFβ1表达与肝癌相关性的临床病例对照试验;(2)文献中TGFβ1有明确的检测方法、阳性判断方法;(3)病例组样本均为明确诊断为肝癌患者;对照组样本均为非肝癌患者;(4)病例组及对照组检测前均未经过任何治疗;(5)文献语种限制为英文或中文。
1.3 文献排除标准 (1)重复检出或重复发表的文献;(2)文章类型为综述、个案报道、病例报告、总结、理论探讨或者实验研究类的文献;(3)文献数据不全,无法提取有用数据的文献;(4)研究病例样本量少于30例的文献。
1.4 文献质量评价 质量评价按照OQAQ(overview quality assessment of questionnair) 量表进行评价,共10个条目,9个条目用“是”、“部分”/“不清楚”、“否”评价,1个条目是对9个条目的结果做出的综合评分;共1~7分,7分表示无缺陷,5~6分表示极小或是小缺陷,3~4分表示有大缺陷,≤2分表示极大缺陷。
1.5 数据提取 所有文献由2名研究者独立进行筛选,当对纳入的文献存在分歧时,通过讨论进行解决,若不能达成一致意见,由第3参与者决定是否纳入。提取的主要内容包括第一作者姓名、文献出版年份、国家、病例组和对照组的样本来源、病例组和对照组的样本量、检测方法等。
1.6 统计学方法 采用Stata 13.0软件进行效应量的合并,选取效应量为诊断比值比、阳性似然比、阴性似然比、敏感度和特异度,并绘制综合受试者工作特征曲线(SROC曲线)。如果纳入的文献大于7篇,进行发表偏倚检验,可信度以95%可信区间(95%CI)表示。采用Q检验和I2检验探究各研究间的异质性,若P>0.1且I2<50%,说明各研究间异质性较低,用固定效应模型对数据进行合并分析;若P≤0.1或I2≥50%,则认为异质性较高,尝试分析找出异质性来源,或进行分亚组分析,当找不出明显方法学异质性时,则采用随机效应模型进行合并效应量。
2 结果
2.1 文献检索结果 共检出文献1698篇,其中CNKI 353篇,万方数据库389篇,维普数据库189篇,PubMed 116篇,EMBASE 164篇,Cochrane Library 2篇,中国生物医学文献数据库485篇。删除重复文献645篇,初筛选出1053篇文献。阅读题目和摘要,排除研究对象和研究结果不符合文献。再进一步获取全文,剔除666篇实验研究文献,294篇无相关数据文献,24篇对照病例不符文献,26篇重复数据文献,27篇纳入病例数<30的文献,最终纳入16篇[6-21]文献,其中3篇[6,16-17]外文文献,13篇[7-15,18-21]中文文献(表1)。病例组共纳入1124例肝癌患者;对照组纳入1443例非肝癌患者。纳入的文献中,有3篇文献[6,16-17]得6分,11篇文献[7-10,12-14,18-21]得5分,2篇文献[11,15]得4分,除了2篇文献[11,15]有可能存在较大缺陷外,纳入的文献质量总体较高。
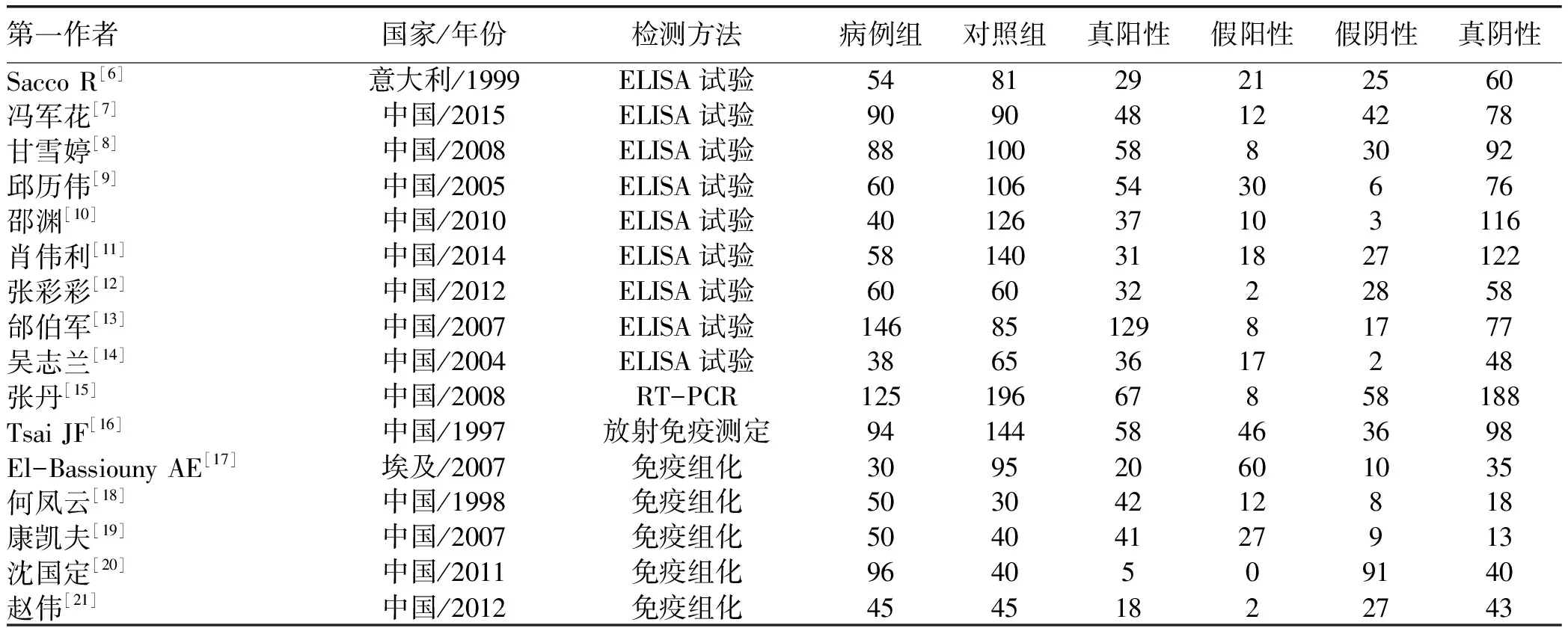
表1 纳入文献的一般情况(例)
2.2 合并效应量的Meta分析
2.2.1 阈值效应图型分析 SROC曲线不呈“肩臂”状分布,绘制诊断比值比、灵敏度及特异度森林图(图1,2),可见各个研究的精确效应量与合并值不呈同一直线分布(P值均<0.05),表明纳入研究不存在阈值效应。
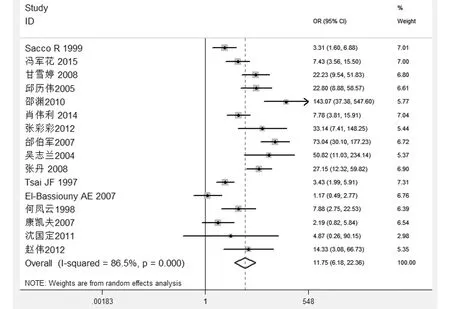
图1 纳入文献的诊断比值比森林图
2.2.2 SROC曲线与效应量数值分析 SROC曲线下面积及95%CI为0.84(0.80~0.87)(Z=0.43,P=0.665)(图3),提示SROC是对称的,反映诊断试验判别能力的效应指标(对应“Lambda”)的估计值及95%CI为2.44(1.77~3.11)。将5个诊断文献进行效应量合并,结果显示TGFβ1诊断肝癌的敏感度及95%CI为0.68(0.52~0.80),特异度及95%CI为0.85(0.74~0.92),诊断比值比及95%CI为11.75(6.18~22.36),阳性似然比及95%CI为4.6(2.7~7.9),阴性似然比及95%CI为0.38(0.26~0.56)。
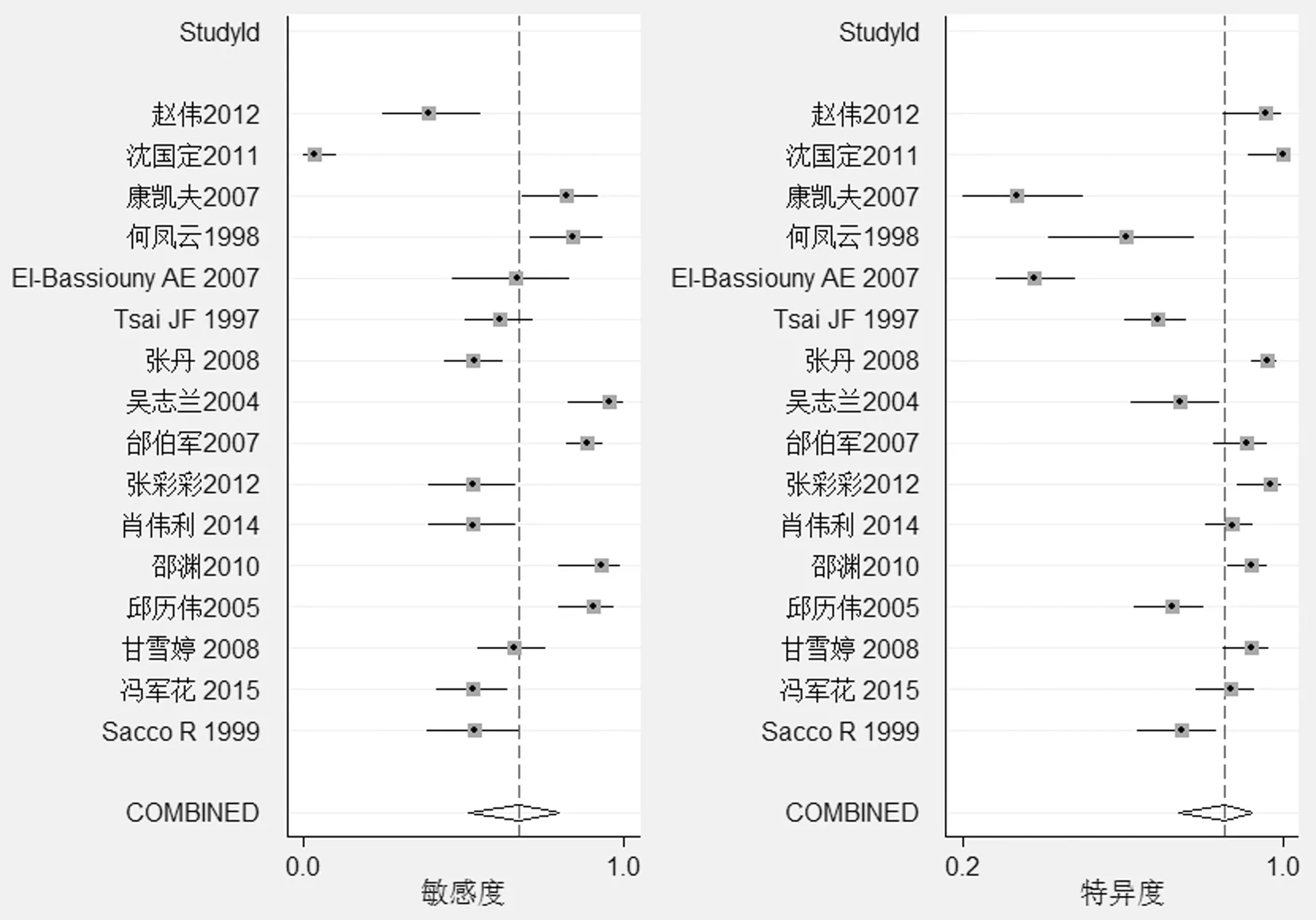
图2 纳入文献的灵敏度、特异度检测图
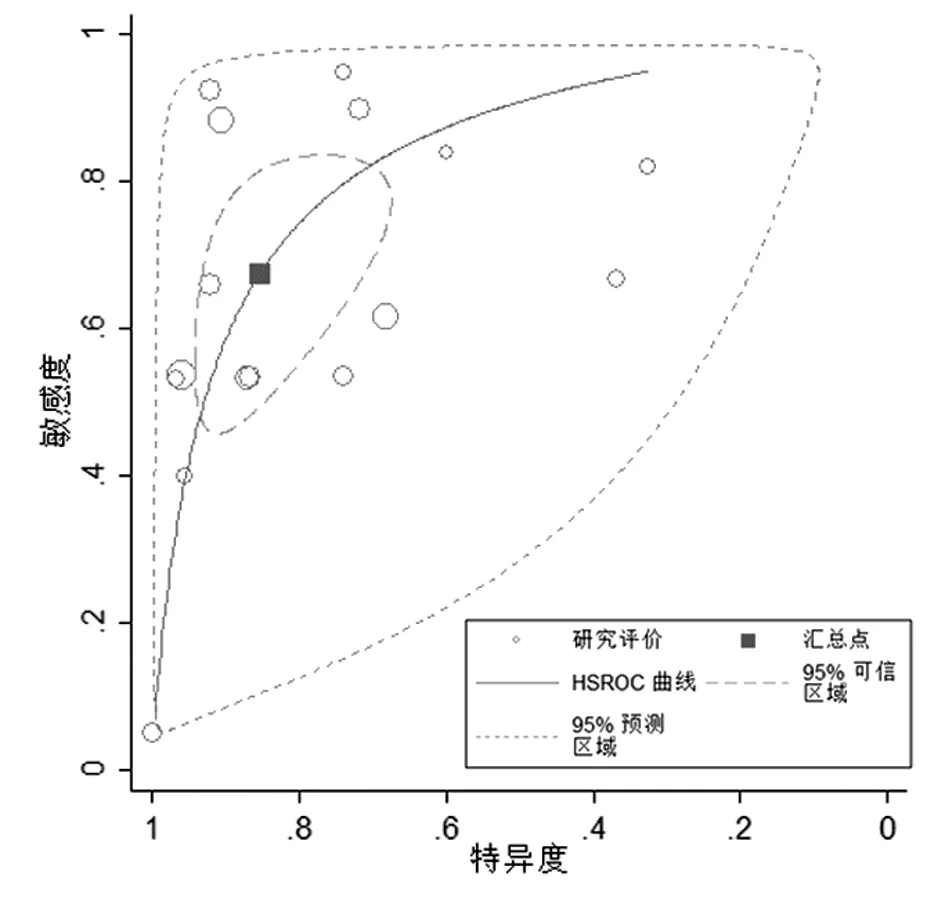
图3 纳入文献的SROC曲线
2.2.3 对合并诊断比值比森林图进行分析 纳入的16个研究中,TGFβ1在肝癌组与对照组的合并诊断比值比结果如图1所示,其结果显示异质性较大(P<0.005,I2=86.5%),故采用随机效应模型进行效应量的合并。2.3 亚组分析 对研究对象按检测方法分组,进行亚组分析,半定量RT-PCR方法检测的1个研究[15],诊断比值比及95%CI为27.15(12.32~59.82);放射免疫检验的1项研究[16],诊断比值比及95%CI为3.43(1.99~5.91);ELISA试验检测的9项研究[6-14],I2=87%,P<0.05,异质性较大,合并效应量曲线下面积及95%CI为0.90(0.87~0.92)(Z=-1.18,P=0.239),反应诊断试验判别能力的效应指标(对应“Lambda”)的估计值及95%CI为3.28(2.37~4.18),诊断比值比及95%CI为20(10~43),阳性似然比及95%CI为5.7(3.8~8.5),阴性似然比及95%CI为0.28(0.16~0.4);免疫组化检测的5个研究[17-21],I2=68%,P<0.05,异质性较大,曲线下面积及95%CI为0.72(0.68~ 0.76)(Z=1.61,P=0.107),反应诊断试验判别能力的效应指标(对应“Lambda”)的估计值及95%CI为1.50(0.70~2.30),诊断比值比及95%CI为6(1~30),阳性似然比及95%CI为3.5(0.6~18.8),阴性似然比及95%CI为0.55(0.34~0.89)。由于放射免疫法及RT-PCR均各纳入1篇,因此只分析ELISA检验及免疫组化检验。ELISA试验检测方法的阳性似然比、诊断比值比、敏感度、特异度和曲线下面积均高于免疫组化检测,阴性似然比小于免疫组化检测。
2.4 发表偏倚分析 以效应量诊断比值比为横坐标,效应量诊断比值比标准误取对数的倒数(ESS)为纵坐标,制作Deeks漏斗图。结果显示纳入研究文献围绕中心线数据对称分布(P=0.36),提示无明显发表偏倚,通过纳入研究文献得出的结论真实客观(图4)。
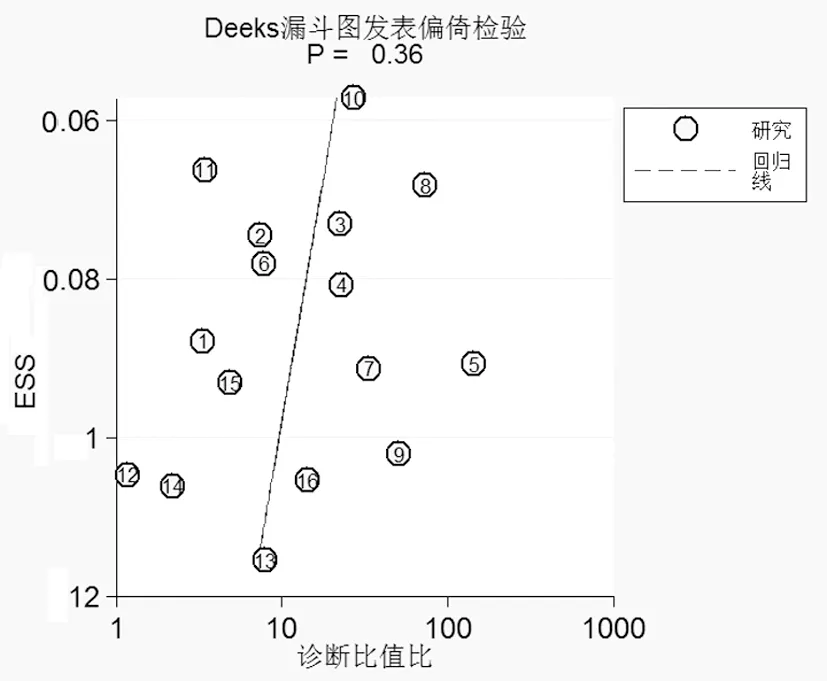
图4 纳入文献的漏斗图
3 讨论
TGFβ1是一种与正常、变异细胞生长和分化调节有关的多功能细胞因子,具有强大而可逆的生长抑制活性及免疫抑制作用,与肝癌发生时的细胞免疫抑制有着密切的关系[22-23],它既能促进细胞增殖信号传递,在癌变早期抑制细胞增殖,进展期促进肝癌的发展,同时亦可通过增加蛋白水解活性及促进与细胞黏附分子的结合,进而促进肿瘤的侵袭与转移[24]。TGFβ1还可通过减少调节性T淋巴细胞而损害免疫系统对肝癌细胞的抑制作用,致使患者预后不良[25]。许多研究[6-21]对TGFβ1诊断肝癌的作用进行了探索,由于研究方法、选择对象、检测水平等方面的差异,导致研究结果的不统一,结果的可靠性降低。
SROC曲线是以敏感度为纵坐标,以特异度为横坐标绘制的曲线,曲线下面积越大,诊断的准确度越高。本研究中纳入文献的SROC曲线靠近左上角,曲线下面积为0.84(0.80~0.87),表明TGFβ1诊断肝癌的准确度较高。本研究的合并诊断比值比为11.75,肝癌组TGFβ1阳性率明显高于非肝癌组,敏感度为0.68,特异度为0.85,提示TGFβ1诊断肝癌具有较高的特异度及敏感度。似然比综合了敏感度和特异度,可以较全面的反映诊断试验的准确度,本研究阳性似然比为4.60,阴性似然比为0.38,提示TGFβ1对肝癌具有较准确的诊断价值。综合以上分析说明,TGFβ1有可能成为一种辅助诊断肝癌的血清标志物。研究结果显示ELISA检测的准确性高于免疫组化,而在临床中,大部分采用血清ELISA检测,就操作过程而言,ELISA试验方法操作更为简便,可同时检测较大量样本,其结果较客观及准确,易于读取、保存,可自动化、标准化、大批量同时检测。综合考虑,ELISA方法检测较免疫组织化学法具有明显优势,更有利于临床推广及应用。
[1] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] ARENDS JW.Molecular interactions in the vogelstein model of colorectal carcinoma[J].J Pathol, 2000, 190(4): 412-416.
[3] MOURI H, SAKAGUCHI K, SAWAYAMA T, et al. Suppressive effects of transforming growth factor-beta1 produced by hepatocellular od mononuclear cells[J]. Acta Med Okayama, 2002, 56(6): 309-315.
[4] SHIRAI Y, KAWATA S, ITO N, et al. Elevated levels of plasma transforming growth factor-beta in patients with hepatocellula carcinoma cell lines on interferon-gamma production by peripheral blor carcinoma[J]. Jpn J Cancer Res, 1992, 83(7): 676.
[5] SHIRAI Y, KAWATA S, TAMURA S, et al. Plasma transforming growth factor-β1 in patients with hepatocellul arcarcinoma. Comparison with chronic liver disease[J]. Cancer, 1994, 73: 2275.
[6] SACCO R, LEUCI D, TORTORELLA C, et al. Transforming growth factor-β1 and soluble Fas serum levels in hepatocellular carcinoma[J]. Cytokine, 2000, 12(6): 811-814.
[7] FENG JH, LIU ZQ, WEI YY, et al. Diagnosis value of the joint test of serum GPC3 and TGFβ1 in AFP negative primary liver cancer patients[J]. Int J Lab Med, 2015, 36(19): 2787-2788. (in Chinese) 冯军花, 刘志权, 魏媛媛, 等. 血清GPC3与TGFβ1联合检测对AFP阴性原发性肝癌的诊断价值[J]. 国际检验医学杂志, 2015, 36(19): 2787-2788.
[8] GAN XT, BAI XG, HUANG TX, et al. Clinical significance of transforming growth factor-β1 in urine of patients with primary hepatic carcinoma[J]. Med J Chin People′s Armed Police Forces, 2003, 14(9): 535-538. (in Chinese) 甘雪婷, 白宪光, 黄团新, 等. 尿转化生长因子β1在原发性肝癌中的检测及临床意义[J]. 武警医学, 2003, 14(9): 535-538.
[9] QIU LW, YAO DF, HUANG F, et al. Expression levels of TGFβ1, TNF-alpha and MMP-13 and their clinical values in patients with chronic liver diseases[J]. J Nantong Univ: Med Sci, 2005, 25(4) 244-246, 249. (in Chinese) 邱历伟, 姚登福, 黄峰, 等. 慢性肝病患者转化生长因子-β1、肿瘤坏死因子-α和基质金属蛋白酶-13表达与临床价值[J]. 南通大学学报: 医学版, 2005, 25(4): 244-246, 249.
[10] SHAO Y, WANG ZR, LI F.The diagnostic value of transforming growth factor-β1 and alpha-fetoproteinL3 combined examination in hepatocellular carcinoma[J]. J Mod Oncol, 2010, 18(10): 2009-2012. (in Chinese) 邵渊, 王作仁, 李峰. 转化生长因子-β1联合甲胎蛋白异质体二联检测对原发性肝癌诊断的意义[J]. 现代肿瘤医学, 2010, 18(10): 2009-2012.
[11] XIAO WL, HA S, REN ZH, et al. Clinical value of combined detection of GP73, AFP-L3 and TGFβ1 in early diagnosis of hepatocellular carcinoma[J]. Int J Lab Med, 2014, 35(14): 1839-1841. (in Chinese) 肖伟利, 哈斯, 任志宏, 等. GP73、AFP-L3和TGFβ1联合检测在肝细胞癌早期诊断中的临床价值[J]. 国际检验医学杂志, 2014, 35(14): 1839-1841.
[12] ZHANG CC, CHU RH, HAN P, et al. Diagnosis value analysis of serum AFP, GPC3, TGFβ1 single and combined testing on primary liver cancer[J]. Qingdao Med J, 2012, 44(2): 108-110. (in Chinese) 张彩彩, 褚瑞海, 韩鹏, 等. 血清AFP、GPC3、TGFβ1单独及联合检测对原发性肝癌的诊断价值分析[J]. 青岛医药卫生, 2012, 44(2): 108-110.
[13] TAI BJ, YAO DF, QIU LW, et al. Diagnostic value of circulating transforming growth factor-β1 and free insulin-like growth factor-II abnormalities for hepatocellular carcino ma[J]. Clin Focus, 2007, 22(24): 1757-1760. (in Chinese) 邰伯军, 姚登福, 邱历伟, 等. 外周血转化生长因子β1和游离胰岛素样生长因子II异常与肝癌诊断[J]. 临床荟萃, 2007, 22(24): 1757-1760.
[14] WU ZL, YAO DF, DONG ZZ, et al.Dignostic and differential diagnostic values of plasm-a transforming growth factor-β1 in patients with primary liver cancer[J]. Chin J Gastroenterol Hepatol, 2004, 13(5): 502-504. (in Chinese) 吴志兰, 姚登福, 董志珍, 等.转化生长因子-β1对原发性肝癌诊断与鉴别的临床价值[J]. 胃肠病学和肝病学杂志, 2004, 13(5): 502-504.
[15] ZHANG D, LI Y, XU ZQ, et al . Clinical value of tumor marker in peripheral blood to the diagnosis of hepatocellular carcinoma[J]. J Chin Practical Diagn Ther, 2011, 25(8): 742-744. (in Chinese) 张丹, 李远, 徐泽强, 等. 外周血肝癌标志物在肝癌诊断中的价值[J]. 中华实用诊断与治疗杂志, 2011, 25(8): 742-744.
[16] TSAI JF, JENG JE, CHUANG LY, et al .Elevated urinary transforming growth factor-beta1 level as a tumour marker and predictor of poor survival in cirrhotic hepatocellular carcinoma[J]. Br J Cancer, 1997, 76(2): 244-250.
[17] El-BASSIOUNY AE, ZOHEIRY MM, NOSSEIR MM, et al.Expression of cyclooxygenase-2 and transforming growth factor-beta1 in HCV-induced chronic liver disease and hepatocellular carcinoma[J]. Med Gen Med, 2007, 9(3): 45.
[18] HE FY, ZHENG YL, WANG Y, et al. Clinical significance of TGF-β1 and PCNA expression in primary human hepatocarcinoma tissues[J]. World Chin J Dig, 1998, 6(7): 165-166.(in Chinese) 何凤云, 郑英兰, 王颖, 等. 原发性肝癌组织TGFβ1和PCND的表达和意义[J]. 世界华人消化杂志, 1998, 6(7): 165-166.
[19] KANG KF, SHI XC, CHEN XW, et al. Expression of PTTG and TGFβ1 with its receptor in hepatocellular carcinoma and their clinical significant[J]. Chin J Cancer Prev Treat, 2007, 14(6): 1223-1225.(in Chinese) 康凯夫, 石祥呈, 陈小伍, 等. 肝癌组织中PTTG与TGFβ1及受体的表达及其临床意义[J]. 中华肿瘤防治杂志, 2007, 14(6): 1223-1225.
[20] SHEN GD, JIANG RQ, SUN BC. Expressions of inflammation-associated factors IL-1β, TGF-β and MCP-1 in human hepatocellular carcinoma[J]. Jiangsu Med J, 2011, 37(7): 797-799.(in Chinese) 沈国定, 姜润秋, 孙倍成. 炎症相关因子IL-1β, TGF-β及MCP-1在肝细胞肝癌的表达[J].江苏医药, 2011, 37(7):797-799.
[21] ZHAO W, LI ZY. The expression of Runx3、TGFβ1、β-catenin and Cyclin D1 in primary liver cancer and their correlation studies[D]. Yinchuan: Ningxia Med Univ, 2012.(in Chinese) 赵伟, 李昭宇. Runx3、TGFβ1、β-catenin 及 Cyclin D1在原发性肝癌中的表达及相关性研究[D]. 银川:宁夏医科大学, 2012.
[22] ARENDS JW .Molecular interactions in the vogelstein model of colorectal carcinoma[J]. J Pathol, 2000, 190(4): 412-416.
[23] KIM KY , JEONG SY , WON J , et al .Induction of angiogenesis byexpression of soluble type II transforming growth factorbeta receptorinmouse hepatoma[J].J Biol Chem, 2001, 276 (42): 38781-38786.
[24] TAI BJ, YAO DF, ZOU L, et al. Dynamic expressions of transforming growth factor-β1 and tumor necrosis factor-α in hepatic oncogenesis[J]. Chin J Gastroenterol Hepatol, 2006, 15(3): 277-280.(in Chinese) 邰伯军, 姚登福, 邹黎, 等.肝细胞癌变过程中TGF-β1 及TNFα的动态表达与改变[J].胃肠病学和肝病学杂志, 2006, 15(3): 277-280.
[25] WANG Y, LIU T, TANG W, et al. Hepatocellular carcinoma cells induce regulatory T cells and lead to poor prognosis via production of transforming growth factor-β1[J]. Cell Physiol Biochem, 2016, 38(1): 306-318.
引证本文:MO XL, LIU J, ZHU JY, et al. Value of transforming growth factor-β1 in diagnosis of primary liver cancer: a meta-analysis[J]. J Clin Hepatol, 2017, 33(5): 864-868. (in Chinese) 莫晓丽, 刘洁, 诸佳瑜, 等. TGFβ1对原发性肝癌诊断价值的Meta分析[J]. 临床肝胆病杂志, 2017, 33(5): 864-868.
(本文编辑:朱 晶)
Value of transforming growth factor-β1 in diagnosis of primary liver cancer: a meta-analysis
MOXiaoli,LIUJie,ZHUJiayu,etal.
(GuangxiUniversityofChineseMedicine,Nanning530001,China)
Objective To investigate the value of transforming growth factor-β1 (TGFβ1) in the diagnosis of primary liver cancer using a meta-analysis. Methods PubMed, EMBASE, Cochrane Library, CBM, CNKI, Wanfang Data, and VIP were searched for articles on TGFβ1 in the diagnosis of primary liver cancer published up to June 30, 2016. The Overview Quality Assessment Questionnaire was used to evaluate the quality of articles screened out. Stata 13.0 software was used for the analysis of diagnostic odds ratio, positive likelihood ratio, and negative likelihood ratio, the summary receiver operating characteristic (SROC) curve was plotted, and publication bias was tested. The confidence level was expressed as 95% confidence interval (95%CI). TheQtest andI2test were used for testing heterogeneity, and a subgroup analysis was also performed. Results A total of 16 articles were included, with 1124 patients in liver cancer group and 1443 patients in control group. The sensitivity was 0.68 (95%CI: 0.52-0.80) and the specificity was 0.85 (95%CI: 0.74-0.92). The diagnostic odds ratio, positive likelihood ratio, and negative likelihood ratio were 11.75 (95%CI: 6.18-22.36), 4.6 (95%CI: 2.7-7.9), and 0.38 (95%CI: 0.26-0.56), respectively. The area under the SROC curve was 0.84 (95%CI: 0.80-0.87). The subgroup analysis showed that compared with immunohistochemistry, ELISA had higher positive likelihood ratio and diagnostic odds ratio and a larger area under the SROC curve, as well as a lower negative likelihood ratio. There was heterogeneity among the articles included, and the main sources of heterogeneity were different underlying liver diseases in patients, different types of diseases in non-primary liver cancer group (including benign control group and normal control group), and difference in experimental design. The Deeks funnel plot showed no significant publication bias. Conclusion TGFβ1 has high sensitivity and specificity in the diagnosis of liver cancer and may become an auxiliary index for the diagnosis of liver cancer.
liver neoplasms; transforming growth factor beta1; diagnosis; meta-analysis
10.3969/j.issn.1001-5256.2017.05.014
2016-12-07;
2017-01-17。
广西科学研究与技术开发计划项目(桂科攻1598012-54);广西自然科学基金面上项目(2014GXNSFAA118191)
莫晓丽(1990-),女,主要从事中西医结合防治肿瘤方面的研究。
陈闯,电子信箱:ch1ch2@163.com。
R735.7
A
1001-5256(2017)05-0864-05
