图像叠加法
2017-05-15邢泰宇
邢泰宇
易溶于水的含铝盐与强酸强碱反应的图像问题是高三化学金属元素及其化合物复习中不可回避的一个重要知识点。比如铝盐中分别含有较多的氢离子、铁离子、铵根等离子,加入强碱时,会因为各离子结合氢氧根离子的能力不同,而涉及到离子间的竞争反应,反应过程的图像较为复杂,但是这些反应过程的图像都与铝盐与强碱反应的图像有着密切的联系。图像叠加法是将铝盐与强碱反应、偏铝酸盐与强酸反应的图像进行合理的平移、拆分、叠加其他图像,从而得到与之相关的图像。
1 易溶于水的铝盐与强碱反应的图像
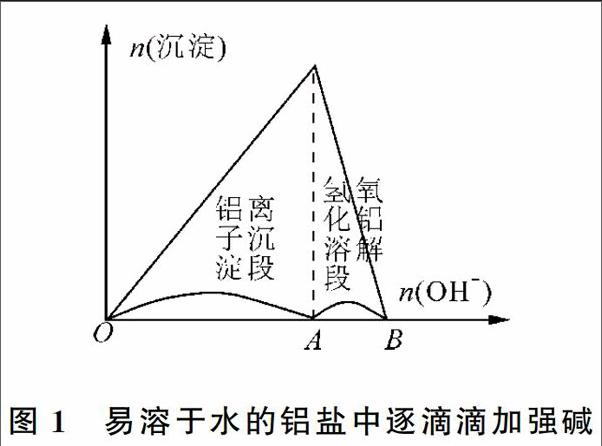
1.1 基础图像——易溶于水的铝盐中逐滴滴加强碱
往鋁盐(Al3+)溶液中逐滴加入强碱(OH-)溶液,反应过程耗碱量[n(OH-)]与沉淀量[n(沉淀)]的关系如图1所示。反应初期OA段(即铝离子沉淀段)发生反应:Al3++3OH-=Al(OH)3↓,有白色沉淀产生,且不断增多。反应后期AB段(即氢氧化铝溶解段),当Al3+沉淀完全,发生反应:Al(OH)3+OH-=AlO2-+2H2O,白色沉淀逐渐溶解直到消失。其中OA段、AB段耗碱量的比例为3∶1。
1.2 变式图像——铝盐中含其他离子
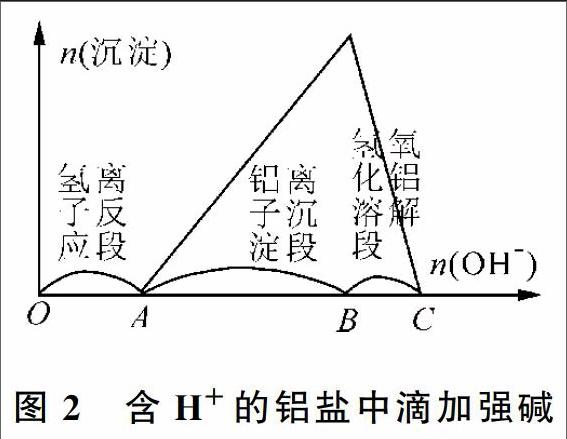
1.2.1 变式图像——铝盐中含有氢离子
若铝盐溶液中含有大量氢离子,往其中逐滴加入强碱溶液,反应过程耗碱量与沉淀量的关系如图2所示。反应初期OA段(即氢离子反应段),由于H+结合OH-的能力比Al3+强,会在Al3+沉淀之前发生反应:H++OH-=H2O,此时溶液中没有沉淀产生。反应中后期AB段(即铝离子沉淀段)、BC段(即氢氧化铝溶解段),当H+消耗完,依次发生反应:Al3++3OH-=Al(OH)3↓,
Al(OH)3+OH-=AlO2-+2H2O,溶液中先产生白色沉淀,后逐渐溶解直到消失。其中AB段、BC段耗碱量的比例为3∶1。
因此,图2的图像可以由图1的图像沿着横坐标向右平移一段距离得到,即是图1中铝离子沉淀段开始之前在横坐标上叠加一段水平线即可,视为氢离子反应段。另外,可以由图2中OA段与BC(或AB)段的耗碱量之比,得到H+与Al3+的物质的量之比。
1.2.2 变式图像——铝盐中含有铁离子
若铝盐溶液中含有一定量铁离子,往其中逐滴加入强碱溶液,反应过程耗碱量与沉淀量的关系如图3所示。反应初期OB段,发生反应:Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,Fe3+和Al3+都沉淀,且沉淀不断增多。反应后期BC段,当Fe3+和Al3+沉淀完全,发生反应:Al(OH)3+OH-=AlO2-+2H2O,沉淀逐渐溶解,但是不会完全消失。其中AB段、BC段耗碱量的比例为3∶1。
因此,图3的图像可以由图1的图像沿着横坐标向右、纵坐标向上平移一段距离得到,即由图1沉淀段开始之前叠加一段铁离子沉淀段(OA段)即可。另外,可以由图3中OA段与AB(或BC)段的耗碱量之比,得到Fe3+与Al3+的物质的量之比。
1.2.3 变式图像——铝盐中含有铵根离子
若铝盐溶液中含有一定量铵根离子,往其中逐滴加入强碱溶液,反应过程耗碱量与沉淀量的关系如图4所示。反应初期OA段(即铝离子沉淀段),由于Al3+结合OH-的能力比NH4+强,发生反应:Al3++3OH-=Al(OH)3↓,有白色沉淀产生,且不断增多。反应中期AB段(即铵根离子反应段),由于NH4+结合OH-的能力比Al(OH)3强,会在Al(OH)3溶解之前发生反应:NH4++OH-=NH3·H2O。反应后期BC段(即氢氧化铝溶解段),当NH4+消耗完,发生反应:Al(OH)3+OH-=AlO2-+2H2O,白色沉淀逐渐溶解直到消失。其中OA段、BC段耗碱量比例为3∶1。
因此,图4的图像可以由图1的图像沿着横坐标向右平移一段距离得到,即由图1铝离子沉淀段之后、氢氧化铝溶解段之前在横坐标上叠加一段平线即可,视为铵根离子反应段。另外,可以由图4中AB段与BC(或OA)段的耗碱量之比,得到NH4+与Al3+的物质的量之比。
1.2.4 变式图像4——铝盐中含有氢离子、铁离子及铵根离子
若铝盐溶液中含有一定量氢离子、铁离子及铵根离子,往其中逐滴加入强碱溶液,反应过程耗碱量与沉淀量的关系如图5所示。根据各微粒结合OH-的能力:H+>Fe3+、Al3+>NH4+>Al(OH)3,在图1的基础上分别叠加氢离子反应段、铁离子反应段和铵根离子反应段。另外,可以由图5中OA段、AB段、BC(或DE)段及CD段的耗碱量之比,得到H+、Fe3+、Al3+及NH4+的物质的量之比。
2 易溶于水的偏铝酸盐与强酸反应的图像
2.1 基础图像——易溶于水的偏铝酸盐中逐滴滴加强酸
往偏铝酸盐(AlO2-)溶液中逐滴加入强酸(H+)溶液,反应过程耗酸量[n(H+)]与沉淀量[n(沉淀)]的关系如图6所示。反应初期,即OA段(偏铝酸根沉淀段),发生反应:AlO2-+H++H2O=Al(OH)3↓,有白色沉淀产生,且不断增多。反应后期AB段(氢氧化铝溶解段),当AlO2-沉淀完全,发生反应:Al(OH)3+3H+=Al3++3H2O,白色沉淀逐渐溶解直到消失。其中OA段、AB段耗酸量的比例为1∶3。
2.2 变式图像-偏铝酸盐中含其他离子
2.2.1 变式图像——偏铝酸盐中含有氢氧根离子
若偏铝酸盐溶液中含有大量氢氧根离子,往其中逐滴加入强酸溶液,反应过程耗酸量与沉淀量的关系如图7所示。反应初期,即OA段(即氢氧根离子反应段),
由于OH-结合H+的能力比AlO-2强,会在AlO-2沉淀之前发生反应:H++OH-=H2O,此时溶液中没有沉淀产生。反应中后期AB段(偏铝酸根离子沉淀段)、BC段(氢氧化铝溶解段),当OH-消耗完,依次发生反应:AlO-2+H++H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,溶液中先产生白色沉淀,后逐渐溶解直到消失。其中AB段、BC段耗酸量
为1∶3。
图7的图像可以由图6的图象沿着横坐标向右平移一段距离得到,即图6偏铝酸根离子沉淀段开始之前在横坐标上叠加一段水平线即可,是为氢氧根离子反应段。另外,可以由图7中OA段与AB(或BC)段的耗酸量之比,得到OH-与AlO-2的物质的量之比。
若偏铝酸盐溶液中含有一定量碳酸根离子,往其中逐滴加入强酸溶液,反应过程耗酸量与沉淀量的关系如图8所示。反应初期OA段(即偏铝酸根离子沉淀段),由于AlO2-结合H+的能力比CO2-3强,发生反应:AlO-2+H++H2O=Al(OH)3↓,有白色沉淀产生,且不断增多。反应中期AB段(即碳酸根离子反应段),由于CO2-3、HCO-3结合H+的能力比Al(OH)3强,会在Al(OH)3溶解之前发生反应:CO2-3+H+=HCO-3,HCO-3+H+=H2O+CO2↑。反应后期BC段(即氢氧化铝溶解段),当CO2-3消耗完,发生反应:Al(OH)3+3H+=Al3++3H2O,白色沉淀逐渐溶解直到消失。其中OA段、BC段耗酸量的比例为1∶3。
2.2.2 变式图像——偏铝酸盐中含有碳酸根离子
图8的图像可以由图6的图像沿着横坐标向右平移一段距离得到,即图6中偏铝酸根离子沉淀段之后、氢氧化铝溶解段之前在横坐标上叠加一段水平线即可,视为碳酸根离子反应段。另外,可以由图8中OA(或BC)段与AB段的耗酸量之比,得到AlO2-与CO2-3的物质的量之比。
2.2.3 变式图像——偏铝酸盐中含有氢氧根离子及碳酸根离子
若偏铝酸盐溶液中含有一定量氢氧根离子及碳酸根离子,往其中逐滴加入强酸溶液,反应过程耗酸量与沉淀量的关系如图9所示。根据各微粒结合H+的能力:OH->AlO-2>CO2-3>HCO-3>Al(OH)3,在图6的基础上分别叠加氢氧根离子反应段、碳酸根离子反应段。另外,可以由图9中OA段、AB(或CD)段及BC段的耗酸量之比,得到OH-、AlO-2及CO2-3的物質的量之比。
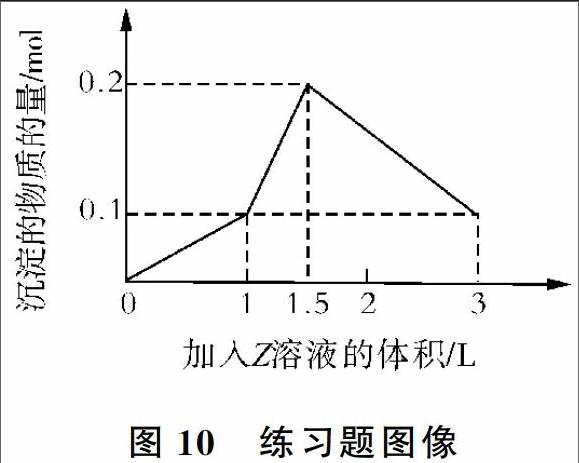
3 反馈练习
某1 L混合溶液中,溶质X、Y的浓度都为0.1 mol/L,向混合溶液中滴加某溶液Z(0.1 mol/L氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图10所示,则X、Y、Z分别是
( )。
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
答案:C。
解析:若X为铝盐,Z为氢氧化钠,生成0.1 mol氢氧化铝、0.1 mol氢氧化铁沉淀,要消耗0.6 mol氢氧化钠,即6 L氢氧化钠;生成0.1 mol氢氧化铝、01 mol氢氧化镁沉淀,要消耗0.5 mol氢氧化钠,即5 L氢氧化钠,与题图不符合,故选项A、B错误。
若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,开始滴入硫酸时同时生成氢氧化铝和硫酸钡沉淀,发生反应:2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4和BaCl2+H2SO4=BaSO4↓+2HCl,生成最大量沉淀氢氧化铝0.1 mol,消耗硫酸0.05 mol,即为0.5 L;生成硫酸钡0.1 mol,消耗硫酸0.1 mol,即为1 L,同时生成盐酸,所以溶液不为中性,并且不符合第1个拐点,故选项D错误。
若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时,由于OH-结合H+的能力比AlO2-强,先后发生如下反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O,2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4。生成硫酸钡0.1 mol,消耗硫酸0.1 mol,即为1 L;生成最大量沉淀氢氧化铝01 mol,消耗硫酸0.05 mol,即为0.5 L。进一步加入硫酸,发生反应2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,0.1 mol氢氧化铝消耗硫酸015 mol,即为1.5 L,剩下0.1 mol硫酸钡不溶解,符合图像的数据变化,满足题目要求,选项C正确。
