外源糖对盐胁迫下小黑麦幼苗糖代谢的影响
2017-05-15王丽华李改玲左师宇曹鑫波佟昊阳
王丽华,李改玲,李 晶,左师宇,曹鑫波,佟昊阳,魏 湜
(东北农业大学农学院,黑龙江哈尔滨 150030)
外源糖对盐胁迫下小黑麦幼苗糖代谢的影响
王丽华,李改玲,李 晶,左师宇,曹鑫波,佟昊阳,魏 湜
(东北农业大学农学院,黑龙江哈尔滨 150030)
外源糖可以缓解盐害,提高植物耐盐性。为探究外源糖对盐胁迫下小黑麦幼苗糖代谢的影响及其机理,以小黑麦品种东农8809为材料,通过施加0.5 mmol·L-1葡萄糖和0.5 mmol·L-1蔗糖,探讨了100 mmol·L-1NaCl胁迫下外源糖处理的小黑麦幼苗相对电导率、碳水化合物含量和糖代谢关键酶活性的变化。结果表明,在盐胁迫下,与未经外源糖处理(CK)相比,外源葡萄糖、蔗糖预处理的小黑麦幼苗叶片的相对电导率显著降低,可溶性糖含量及蔗糖合成酶、蔗糖磷酸合成酶、果糖-6-磷酸激酶和己糖激酶活性提高,尤其是己糖激酶活性显著高于其他处理,丙酮酸激酶活性降低。说明盐胁迫下,施加外源糖可以促进蔗糖和葡萄糖进入蔗糖合成途径和糖酵解途径,促进淀粉向可溶性糖转化,从而提高可溶性糖含量,降低渗透势,提高细胞吸水能力,以缓解盐胁迫对小黑麦的伤害程度。
小黑麦;盐胁迫;外源糖;糖代谢
土壤盐渍化的问题在全世界广泛存在,尤其在干旱和半干旱地区更加严重。据不完全统计,全世界盐碱地面积是9.54亿hm2,中国各类盐碱地面积总计9 913.3万hm2[1]。土壤盐渍化问题严重制约盐碱地区植物的生长,是影响作物生长和高产的逆境因子之一[2-3]。小黑麦(TriticosecaleWittmack)是小麦和黑麦远源杂交并经染色体加倍、人工合成的麦类作物新类型,具有抗逆性强的特点[4],但盐胁迫对其生长依然会产生影响。
葡萄糖和蔗糖作为可溶性糖,参与植物对生物和非生物胁迫响应中的信号调控[5-6]。盐胁迫时植物细胞内积累一些可溶性糖等物质,调节细胞内渗透势,维持水分平衡,因而这些可溶性物质的积累在植物的渗透调节过程中起着重要作用[7-10]。施加一定的外源糖可以缓解盐害,提高植物幼苗的耐盐性。外源葡萄糖和蔗糖可显著提高盐胁迫下玉米体内可溶性糖的含量,降低细胞渗透势,减缓盐胁迫引起的细胞失水[11]。在小麦研究中关于外源糖缓解盐胁迫伤害的报道较多。蔗糖预处理可以缓解盐胁迫对小麦根系生长的抑制作用,提高可溶性糖含量[12]。外源海藻糖可明显缓解盐胁迫对小麦幼苗生长的抑制作用,提高抗盐性[13]。一定浓度的外源壳聚糖浸种可促进盐胁迫下小麦种子萌发和幼苗生长,减缓盐胁迫伤害[14]。浒苔硫酸多糖(EP)能够在不同程度上促进小麦的生长和生物量的积累,提高其抗 NaCl 的能力[15]。1 mg·mL-1EP能够在盐胁迫条件下提高小麦可溶性蛋白、可溶性糖以及脯氨酸含量,增强其渗透调节能力。而在小黑麦上有关外源糖缓解盐害的效应目前尚缺乏系统研究。本研究在生理生化水平探索外源糖缓解盐胁迫下小黑麦糖代谢的作用及其机制,以期为盐碱地农业生产中作物抗盐栽培措施提供参考。
1 材料与方法
1.1 试验材料
供试小黑麦品种为东农8809,由东北农业大学小麦栽培生理研究室提供。
1.2 试验设计
挑选大小一致、没有损坏的小黑麦种子,将表面消毒后置于培养箱中,25 ℃黑暗催芽,选取芽长一致的种子于植物生长室内用1/2 Hoagland营养液(pH 5.5)培养至两叶一心。培养条件:昼夜温度(25±2) ℃/(20±2) ℃,每天光照12 h,光强为1 000 μmol·m-1·s-1,湿度为60%~80%。取两叶一心小黑麦幼苗,分别用1/2Hoagland营养液+0.5 mmol·L-1葡萄糖、1/2 Hoagland营养液+0.5 mmol·L-1蔗糖(前期进行浓度筛选试验,筛选出缓解萌发阶段盐胁迫的最佳糖浓度为0.5 mmol·L-1)、1/2 Hoagland营养液(空白对照)、1/2 Hoagland营养液+0.05 mmol·L-1甘露醇(渗透对照)预处理(浸种)3 d;用100 mmol·L-1NaCl(综合前人研究[16]并经前期盐浓度筛选试验确定)进行盐胁迫处理6 d,以相应糖处理和空白处理为对照。这样共形成7个处理:对照(CK)、葡萄糖预处理(G)、蔗糖预处理(T)、盐处理(S)、葡萄糖预处理后盐处理(G+S)、蔗糖预处理后盐处理(T+S)、等浓度的甘露醇预处理后盐处理(M+S)。每个处理3次重复,每次100粒种子。
1.3 测定项目及方法
1.3.1 相对电导率的测定
相对电导率的测定参照Lutts等[17]的方法并改进。称取0.3 g叶片,用去离子水洗净后放入试管中,加10 mL去离子水,25 ℃浸泡12 h,用电导率仪测定各组浸出液电导率A;然后将试管置于沸水中20 min,再冷却至初始温度,测电导率B,相对电导率=A/B×100%。
1.3.2 小黑麦叶片中碳水化合物含量的测定
可溶性糖含量参照刘丽杰[18]测定糖含量的方法进行测定,具体内容稍作改进。提取叶片可溶性糖时,叶片不需烘干,直接称取0.3 g新鲜叶片剪碎进行测定。
淀粉含量参照刘丽杰[18]测定糖含量的方法进行测定,标准曲线绘制见1.3.2.1可溶性糖标准曲线的绘制方法。
1.3.3 糖代谢关键酶的测定
糖代谢的5个关键酶活性参照李改玲[19]的方法,采用由南京建成生物工程研究所提供配制的试剂盒检测。
1.4 数据处理
试验结果用Excel 2007和DPS 7.05统计软件进行数据处理、分析和绘图。
2 结果与分析
2.1 外源糖对盐胁迫下小黑麦幼苗叶片相对电导率的影响
由图1可以看出,与CK比较,G和T处理的小黑麦叶片相对电导率分别降低了2.34和1.38个百分点。与CK相比,盐胁迫(S)后,小黑麦叶片相对电导率显著升高。盐胁迫下,G+S和T+S处理叶片相对电导率较S处理分别降低了3.83和6.39个百分点,与S处理的差异均达到显著水平,G+S与T+S处理间也差异显著;等浓度的甘露醇预处理没有引起盐胁迫下小黑麦体内相对电导率明显下降。说明外源糖预处理能够维持盐胁迫下小黑麦叶片细胞膜的稳定性。

G:葡萄糖;T:蔗糖;M:甘露醇。图柱上的字母不同表示处理间差异显著。下同。
G:glucose;T:sucrose;M:mannitol.Different letters on the columns indicate the significat differences among the treatments at 0.05 level.The same below.
图1 葡萄糖和蔗糖预处理对盐胁迫下小黑麦幼苗叶片相对电导率的影响
Fig.1 Effects of salt stress on relative electrical conductivity in leaves of triticale seedling pretreated with glucose and sucrose
2.2 外源糖对盐胁迫下小黑麦叶片碳水化合物含量的影响
由表1可知,G、T和S处理的小黑麦叶片可溶性糖含量较CK分别提高了32.87%、33.65%和51.41%,与CK差异均显著。在盐胁迫下,G+S和T+S处理较S处理显著提高了叶片的可溶性糖含量,增幅分别为10.13%和10.87%;而等浓度的甘露醇预处理引起叶片的可溶性糖含量下降。说明在盐胁迫下,外源葡萄糖和蔗糖预处理能够促进小黑麦幼苗可溶性糖的积累,有利于降低细胞渗透势,提高细胞吸水能力。
G和T处理的淀粉含量与CK差异不显著,但S处理显著提高了淀粉含量。盐胁迫下G+S、T+S和M+S处理叶片淀粉含量相比S处理均有所降低,但差异均未达到显著水平。说明外源糖预处理对盐胁迫下小黑麦幼苗叶片淀粉含量影响微弱。
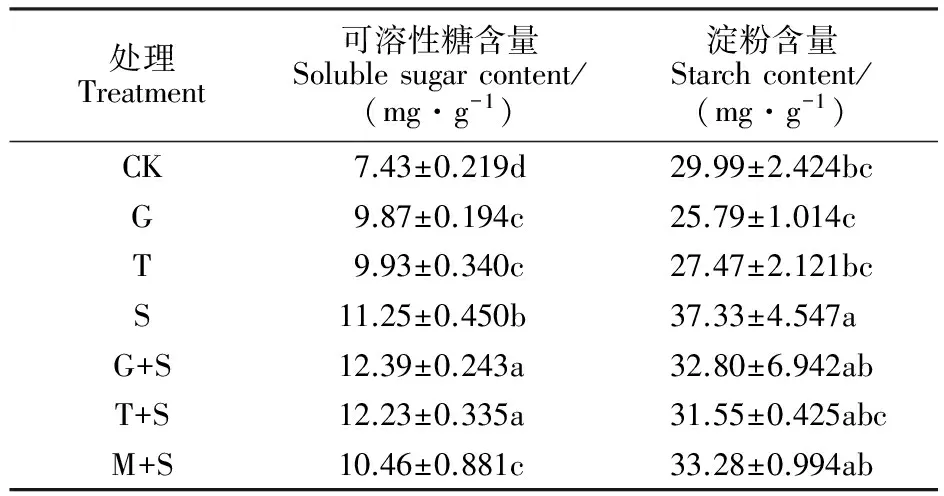
表1 外源糖处理后小黑麦幼苗叶片可溶性糖含量和淀粉含量的变化
同列数值后的字母不同表示处理间差异显著。
Different letters after the values in the same column indicate the significant differences among the treatments at 0.05 level.
2.3 外源糖对盐胁迫下小黑麦幼苗叶片糖代谢关键酶活性的影响
2.3.1 对蔗糖合成酶(SS)活性的影响
与CK相比,G、T和S处理均显著提高小黑麦叶片的SS活性,其中G、T处理增幅分别为21.74%、43.20%(图2)。盐胁迫下,G+S和T+S处理SS活性较S处理分别提高了10.08%和14.07%,其中T+S处理与S处理差异显著;M+S处理显著降低了SS活性。
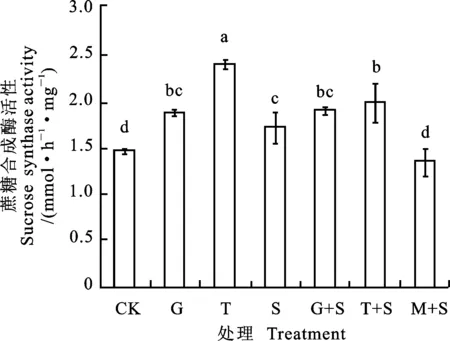
图2 葡萄糖和蔗糖预处理对盐胁迫下小黑麦幼苗叶片蔗糖合成酶活性的影响
2.3.2 对蔗糖磷酸合成酶(SPS)活性的影响
与CK相比较,G和T处理均提高了小黑麦叶片SPS活性,S处理显著降低了SPS活性。盐胁迫下,G+S和T+S处理均显著提高了SPS活性,增幅分别为24.09%和20.02%;M+S处理显著降低SPS活性(图3)。
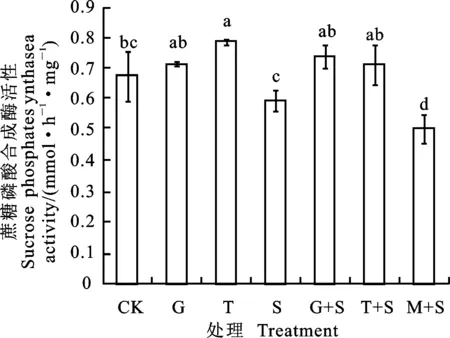
图3 葡萄糖和蔗糖预处理对盐胁迫下小黑麦幼苗叶片蔗糖磷酸合成酶活性的影响
2.3.3 对丙酮酸激酶(PK)活性的影响
G和T处理的小黑麦叶片PK活性与CK相比没有显著差异,S处理显著升高(图4)。盐胁迫下,G+S、T+S和M+S处理的PK活性较S处理均显著降低,其中S处理的PK活性分别是G+S和T+S处理的1.50倍和1.82倍。
2.3.4 对己糖激酶(HK)活性的影响
与CK相比,G、T和S处理均显著提高了小黑麦叶片HK活性,其中G和T处理的HK活性分别是CK的2.73倍和3.50倍(图5)。盐胁迫下,G+T和T+S处理HK活性较S处理显著提高,分别是S处理的3.23倍和3.52倍;M+S处理相对于S处理无明显变化。
2.3.5 对果糖-6-磷酸激酶(PFK)活性的影响
与CK相比,G、T和S处理的小黑麦叶片PFK活性均显著提高,其中G和T处理分别是CK的1.525倍和1.65倍(图6)。盐胁迫下,G+S和T+S处理较S处理均显著提高PFK活性,但M+S处理显著降低了PFK活性。
3 讨 论
盐分胁迫对植物的伤害中,最先接触的是细胞膜。盐胁迫导致细胞质膜透性增大,且盐浓度越高,细胞质膜透性越大,相对电导率增大。丁顺华研究发现,盐溶液中加入海藻糖可以使盐胁迫下小麦幼苗细胞质膜透性显著降低,表明外源海藻糖可在一定程度上保护细胞质膜的完整性。在本研究中,盐胁迫下,小黑麦细胞内浸出液相对电导率均显著升高,而0.5 mmol·L-1葡萄糖和蔗糖浸种均不同程度地降低了盐胁迫下叶片相对电导率,这与前人研究结果相一致。说明外源糖预处理能够降低相对电导率,维持盐胁迫下小黑麦叶片细胞膜的稳定性。

图4 葡萄糖和蔗糖预处理对盐胁迫下小黑麦幼苗叶片丙酮酸激酶活性的影响
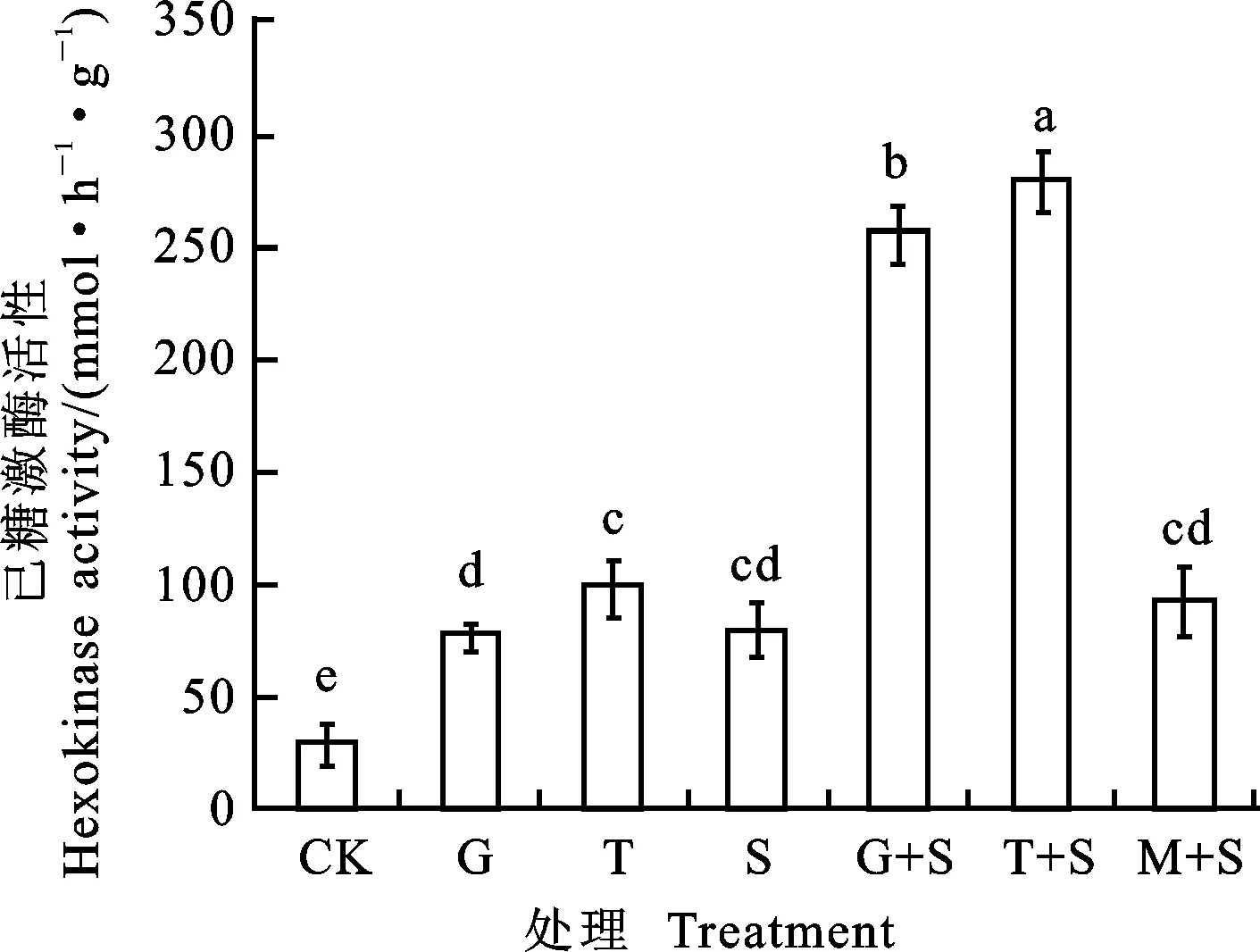
图5 葡萄糖和蔗糖预处理对盐胁迫下小黑麦幼苗叶片己糖激酶活性的影响
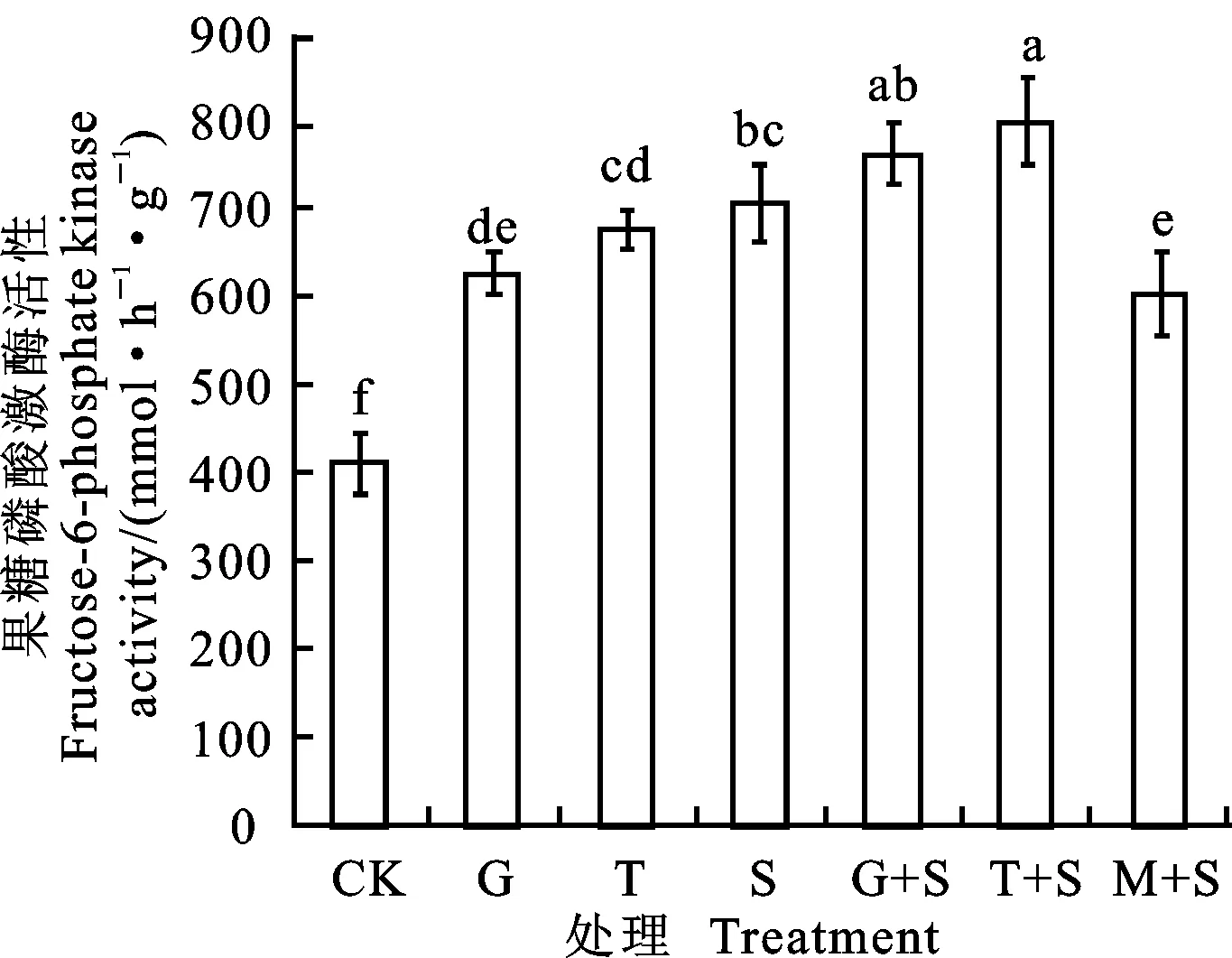
图6 葡萄糖和蔗糖预处理对盐胁迫下小黑麦幼苗叶片果糖-6-磷酸激酶活性的影响
糖是光合作用的主要产物之一,其不仅作为代谢物质为植物生长发育提供能量,还是主要的细胞渗透调节剂之一,并作为植物体内的一种信号分子参与调控植物生长发育进程。已有大量报道表明,外源糖类物质及其他一些碳水化合物可以缓解盐胁迫对植物代谢活动的影响。氨基乙酸甜菜碱可以增加盐胁迫下水稻幼苗可溶性蛋白的含量,缓解盐胁迫对光合系统的伤害作用[20];外源海藻糖能够增强小麦幼苗的耐盐性,外源葡萄糖和果糖可以提高盐胁迫下水稻种子发芽率和发芽指数[21]。王康君等研究发现,盐胁迫下小麦种子萌发期α-淀粉酶活性和可溶性糖含量下降,导致萌发率降低。盐胁迫可以对枸杞产生水分胁迫和离子伤害,为缓解水分胁迫,枸杞叶片可溶性糖含量有所增加,淀粉含量减少[22]。前人的研究都表明,盐胁迫下可溶性糖含量上升有利于提高植物的抗盐性。本研究中不论非盐胁迫还是盐胁迫下,与CK相比,外源糖处理的小黑麦叶片可溶性糖含量均升高。说明在盐胁迫下,外源糖预处理能够促进小黑麦幼苗可溶性调节物质的积累,降低细胞渗透势,提高细胞吸水能力,从而缓解渗透胁迫所造成的伤害。本研究也表明,外源糖预处理能够降低盐胁迫下小黑麦幼苗叶片中淀粉含量,促进叶片中淀粉向可溶性糖转化。
盐胁迫下小麦和大麦生长受抑制,原因在于叶片提前衰老,从而减少了生长部位同化产物的供应。叶片提前衰老则是生理代谢活性降低的结果。Krishnaraj[23]指出,在盐胁迫下,耐盐小麦品种比盐敏感小麦品种的葡萄糖代谢活性高。杨涓对枸杞的研究表明,盐胁迫会提高SS活性,说明了盐胁迫影响了糖类物质的运输[22]。鲁少尉等对番茄的研究表明,盐胁迫下番茄叶片中的蔗糖合成酶和蔗糖磷酸合成酶活性从番茄开花后即开始不断降低[24]。本研究结果与前人研究相同。丙酮酸激酶、已糖激酶和黑糖-6-磷酸激酶是糖酵解中的三个关键酶,它们催化的反应都是不可逆的。己糖激酶催化葡萄糖转化为6-磷酸葡萄糖,在己糖异构酶的作用下生成6-磷酸果糖,在果糖-6磷酸激酶的作用下磷酸化生成1,6-二磷酸果糖。最后在丙酮酸激酶的作用下磷酸烯醇式丙酮酸生成丙酮酸和1分子ATP。本研究中,在盐胁迫下,用外源葡萄糖、蔗糖预处理的小黑麦蔗糖合成酶、蔗糖磷酸合成酶活性比较高,促进蔗糖进入各种途径,催化蔗糖的合成,从而提高可溶性糖含量。果糖-6-磷酸激酶和己糖激酶活性比较高,尤其是己糖激酶活性显著高于其他处理,丙酮酸激酶活性较低,通过糖酵解途径,促进葡萄糖的分解,降低渗透势,提高细胞的吸水能力。综上所述,施加外源葡萄糖和蔗糖均可以明显缓解盐胁迫对小黑麦的伤害程度。
[1] ROLLAND F,BAENA-GONZALEZ E,SHEEN J.Sugar sensing and signaling in plants:conserved and novel mechanisms [J].AnnualReviewofPlantBiology,2006,57:675.
[2] 刘良全,张水利,景小元,等.几种化学调控物质对盐胁迫下小麦幼苗生长及生理指标的调控作用[J].麦类作物学报,2010,30(1):73.
LIU L Q,ZHANG S L,JING X Y,etal.Effect of seed soaking with four chemical regulators on root and seedling growth of different wheat genotypes under nacl stresses [J].JournalofTriticeaeCrops,2010,30(1):73.
[3] 丁顺华.外源海藻糖对小麦耐盐性的效应[D].济南:山东师范大学,2001:3-6.
DING S H.Effect of exogenous trehalose on salt tolerance of wheat [D].Jinan:Shandong Normal University,2001:3-6.
[4]刘 慧,王立群,黄占权.对小黑麦啤酒制麦工艺的探讨[J].黑龙江粮油科技,2000,21(1):28.
LIU H,WANG L Q,HUANG Z Q.Discussion of technology of triticale beer [J].HeilongjiangOilTechnology,2000,21(1):28.
[5]KEUNEN E,PESHEV D,VANGRONSVELD J,etal.Plant sugars are crucial players in the oxidative challenge during abiotic stress:extending the traditional concept [J].PlantCellEnvironment,2013,36:1242.
[6]BAENA-GONZALEZ E,SHEEN J.Convergent energy and stress signaling [J].Cell,2008,12(9):1360.
[7]LIU F,JENSEN C R,ANDERSEN M N.A review of drought adaptation in crop plants:changes in vegetative and reproductive physiology induced by ABA-based chemical signals [J].AustralianJournalofAgriculturalResearch,2005,56:1245.
[8]PRAXEDES S C,DA MATTA F M,LOUREIRO M E.Effects of long-term soil drought on photosynthesis and carbonhyd rate in mature robusta coffee(CoffeacanephoraPierrevar.kouillou) leaves [J].EnvironmentalandExperimentalBotany,2006,56:263.
[9] 王玉凤,王庆祥,商丽威.NaCl和Na2SO4胁迫对玉米幼苗渗透调节物质含量的影响[J].玉米科学,2007,15(5):69.
WANG Y F,WANG Q X,SHANG L W .Effects of NaCl and Na2SO4stress on osmotic adjustment substances in maize seedlings [J].JournalofMaizeSciences,2007,15(5):69.
[10] 阮成江,谢庆良.盐胁迫下沙棘的渗透调节效应[J].植物资源与环境学报,2002,11(2):45.
RUAN CH J,XIE Q L.Osmotic adjustment effect ofHippophaerhamnoidesL.under salt stress [J].JournalofPlantResourcesandEnvironment,2002,11(2):45.
[11] 赵 莹.外源糖缓解玉米盐胁迫生理生化机制研究[D].大庆:黑龙江八一农垦大学,2014:4-5.
ZHAO Y.Effects of exogenous sugar on the attenuation of salt stress and its physiological basis in maize seedling [D].Daqing:Heilongjiang Bayi Agricultural University,2014:4-5.
[12] 闫素芳,于 洋,葛 青,等.外源蔗糖对小麦幼苗耐盐性的影响[J].中国生态农业学报,2012,20(2):225.
YAN S F,YU Y,GE Q,etal.Effect of exogenous sucrose application on wheat seeding salt tolerance [J].ChineseJournalofEco-Agriculture,2012,20(2):225.
[13] 丁顺华,李艳艳,王宝山.外源海藻糖对小麦幼苗耐盐性的影响[J].西北植物学报,2005,25(3):513.
DING S H,LI Y Y,WANG B S.Effect of exogenous trehalose on salt tolerance of wheat seedling [J].ActaBotanyBoreal-OccidentSinica,2005,25(3):513.
[14] 王玉萍,于丹,李成,等.壳聚糖对盐胁迫下小麦种子萌发及幼苗生理特性的影响[J].干旱地区农业研究,2016,34(1):180.
WANG Y P,YU D,LI C,etal.Effect of chitosan on seed germination and seedling physiological characters of wheat under salt stress [J].AgriculturalResearchintheAridAreas,2016,34(1):180.
[15] 李 冰.浒苔硫酸多糖对NaCl胁迫下植物的影响[D].北京:中国科学院大学,2013:2-3.
LI B.Effect of sulfated polysaccharides fromEnteromorphaproliferaon plants under NaCl stress [D].Beijing:Chinese Academy of Sciences,2013:2-3.
[16] 郭 伟,于立河.腐殖酸浸种对盐胁迫下小麦萌发种子及幼苗生理特性的影响[J].麦类作物学报,2012,32(1):90.
GUO W,YU L H.Effect of seed soaking with humic acid on soluble sugar accumulation and allocation in germinated wheat seed under salt stress [J].JournalofTriticeaeCrops,2012,32(1):90.
[17]LUTTS S,KINET J M,BOUHARMONT J.NaCl-induced senescence in leaves of rice (OryzasativaL.)cultivars differing in salinity resistance [J].AnnalsofBotany,1996,78:389.
[18] 刘丽杰.低温下ABA调控冬小麦糖代谢及抗寒基因表达的研究[D].哈尔滨:东北农业大学博士学位论文,2013:11-14.
LIU L J.Effects of ABA on sugar metabolism and expression of antifreeze genes of winter wheat [D].Harbin:Northeast Agricultural University,2013:11-14.
[19] 李改玲.外源糖调控盐胁迫下小黑麦糖代谢及光合特性的研究[D].哈尔滨:东北农业大学,2016.
LI G L.Exogenous sugar alleviate effects of salt stress on the triticale’s sugar metabolism and photosynthetic characteristics [D].Harbin:Northeast Agricultural University,2016.
[20]DEMIRAL T,TRKAN I.Exogenous glycinebetaine affects growth and proline accumulation and retards senescence in two rice cultivars under NaCl stress [J].JournalEnvironmentalandExperimentalBotany,2006,56(1):72.
[21] 凌腾芳,宣 伟,樊颖瑞,等.外源葡萄糖、果糖和NO供体(SNP)对盐胁迫下水稻种子萌发的影响[J].植物生理与分子生物学学报,2005,31(2):205.
LING T F,XUAN W,FAN Y R,etal.Effect of exogenous glucose and fructose and snp on rice seed germination under salt stress [J].JournalofPlantPhysioloryandMolecularBiology,2005,31(2):205.
[22] 杨 涓.盐胁迫下枸杞糖蛋白及糖代谢变化的研究[D].银川:宁夏大学,2005:7-11.
YANG J.Researches on cell wall glycoprotiein and sucrose-metabolizing ofLyciumBarbarumL.under salt stress [D].Ningxia:Ningxia University,2005:7-11.
[23]KRISHNARA S,THORPE T A.Salinity stress effects on [14C-1]-and [14C-6]-glucose metabolism of a salt-tolerant and salt-susceptiblevariety of wheat [J].InternationalJournalofPlantScience,1996,157(1):110.
[24] 鲁少尉,齐 飞,李天来.NaCl及等渗PEG胁迫对番茄叶片光合特性及蔗糖代谢的影响[J].华北农学报,2012,27(3):136.
LU S W,QI F,LI T L.Effect of NaCl and PEG iso-osmotic stresses on photosynthetic characteristics and sucrose metabolizing in tomato leaf [J].ActaAgriculturaeBoreali-Simica,2012,27(3):136.
Effect of Exogenous Sugar on the Sugar Metabolism in Triticale Seedling under Salt Stress
WANG Lihua,LI Gailing,LI Jing,ZUO Shiyu,CAO Xinbo,TONG Haoyang,WEI Shi
(Agricultural College,Northeast Agricultural University,Harbin,Helongjiang 150030,China)
Salt stress destroys the integrity of cells and inhibits the growth of plants. Exogenous sugar can alleviate salt stress and improve salt tolerance in plants. In order to know the effects and antimicrobial properties of exogenous sugar on sugar metabolism in triticale seedling under 100 mmol·L-1NaCl,Dongnong 8809 was used as experimental material and treated with 0.5 mmol·L-1glucose and 0.5 mmol·L-1sucrose. The relative electrical conductivity,carbohydrate content and activities of key enzymes in glycometabolism were studied,and the impact of exogenous sugar on triticale under salt stress was analyzed. The results showed that under salt stress,exogenous glucose and sucrose pretreatment can significantly reduce relative electrical conductivity,improve the content of soluble sugar and the activities of key enzymes,including sucrose synthase,sucrose phosphate synthase,fructose-6-diphosphate kinase and hexokinase,in glycometabolism especially the activity of hexokinase exceeds others significantly. So that exogenous sugar can promote glucose and sucrose to go into the sugar metabolic pathways,promote the transformation of starch to soluble sugar,improve the content of soluble sugar,reduce osmotic potential,and improve the water absorbing capacity. Thus,exogenous sugar can acleviate the injury of salt stress to triticale.
Triticale; Salt stress; Exogenous sugar; Glycometabolism
时间:2017-04-07
2016-10-01
2016-11-28 基金项目:国家科技支撑计划项目(2012BAD14B06) 第一作者E-mail:wanglihua81494@163.com 通讯作者:魏 湜(E-mail:weishi5608@163.com)
S512.4;S311
A
1009-1041(2017)04-0548-06
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170407.1021.034.html
