TUFT1真核表达质粒的构建及其功能研究
2017-05-13袁孔现王继年
袁孔现,王继年
(1.铜陵市人民医院 药剂科,安徽 铜陵 244002;2.安徽医科大学第一附属医院 教育处,安徽 合肥 230032)
TUFT1真核表达质粒的构建及其功能研究
袁孔现1,王继年2
(1.铜陵市人民医院 药剂科,安徽 铜陵 244002;2.安徽医科大学第一附属医院 教育处,安徽 合肥 230032)
设计合成引物,扩增出TUFT1的CDS序列,双酶切后连接到pEGFP-C2载体上,将过表达质粒转染至胰腺癌细胞株中。结果显示,过表达组细胞的增殖率,显著高于空白组和对照组;过表达组细胞的凋亡率,显著低于空白组和对照组。成功构建TUFT1的真核表达载体,并初步确定TUFT1可以明显增强人胰腺癌细胞株的增殖,同时抑制其凋亡,为进一步探索TUFT1基因功能、寻求治疗胰腺癌的新途径提供了细胞学基础。
TUFT1;转染;增殖;凋亡
胰腺癌(PC)作为一种恶性程度非常高的消化系统肿瘤,具有发病隐匿、确诊困难、侵袭性强、转移性高、手术效果差且术后易复发等特点,导致患者病死率居高不下,5年生存率也不容乐观,有“癌症之王”的恶称,严重威胁着人类的生命健康[1-4],因此,对PC发病机制和治疗策略的研究迫在眉睫。近些年来,基因工程技术快速发展,为医学研究和疾病治疗开辟了崭新的道路[5]。TUFT1基因首次发现并克隆于牛的成釉细胞中,其开放阅读框长度为1 170 bp,编码一种由390个氨基酸残基组成的、翻译修饰前分子量约为44 kDa的亲水性蛋白质[6],国外最新研究表明,TUFT1在胰腺癌组织中存在高表达现象,并提示其在胰腺癌的转移中扮演着重要角色[7]。本文以此为线索,通过构建TUFT1的真核表达质粒,国内首次研究其对胰腺癌细胞系的增殖和凋亡的影响,为胰腺癌的治疗提供新方向。
1 材料与方法
1.1 实验材料
胰腺癌细胞系(Panc-1和BxPC-3)、pEGFP-C2载体均由本实验室保存。PrimeSTAR Max酶和DNA Marker均购于日本TaKaRa公司;Xho I、BamH I内切酶和T4连接酶均购于加拿大Fermentas公司;胶回收试剂盒和质粒小抽试剂盒均购于美国Axygen公司;细胞凋亡试剂盒购于上海贝博公司;Lip2000脂质体购于Invitrogen公司;GFP抗体购于美国santa cruz公司;DMSO购于日本SIGMA公司;DMEM高糖培养基、Opti-MEM培养液和胎牛血清均购于Gibco公司;引物合成于上海生工生物。
1.2 方法
1.2.1 质粒构建
利用Primer软件设计引物并送生物公司合成,引物序列如下:F-CCGCTCGAGCGGCATGAACGG GACGCGGAACT;R-CGGGATCCCGTCAGGTTT CCACCACT,利用PCR技术扩增人源TUFT1的CDS片段,并对PCR产物进行琼脂糖电泳,在紫外分析仪中切取含有目的片段的凝胶,并用胶回收试剂盒纯化PCR产物,然后分别用限制性内切酶(Xho I和BamH I)对纯化产物和pEGFP-C2空载体进行双酶切(37 ℃,6 h),然后用T4连接酶对以上酶切产物进行连接(16 ℃,12 h),然后用感受态细胞(TG1或DH5a)对连接产物进行转化并涂布至带有卡那抗性的LB平板上倒置培养(37 ℃,10~16 h),然后挑取单克隆进行扩大培养(37 ℃,250 rpm,10~16 h),并用质粒抽提试剂盒对菌液进行质粒抽提,然后分别用Xho I和BamH I对质粒进行双酶切鉴定,并将鉴定正确的质粒送生物公司进行测序。
1.2.2 细胞培养和质粒转染
复苏细胞后,用完全培养基(90%高糖DMEM+10%胎牛血清+双抗)进行培养,培养环境为含有5%CO2的37 ℃恒温培养箱,根据细胞生长速度和状态,及时进行细胞换液和细胞传代,并以适当密度重新接种至新的培养瓶中继续培养。待细胞生长至适当密度(80%~90%)后,进行质粒转染,转染步骤如下:分别将适量pEGFP-C2-TUFT1质粒(5~10 μg)和Lip2000脂质体(5~15 μL)加入至500 μL左右的Opti-MEM转染液中,轻轻混匀后室温静置5 min,然后将二者溶液充分混匀后室温静置20 min,轻轻加入细胞中并补充适量无双抗的培养基进行培养,4~6 h后更换成完全培养基继续培养至24 h。
1.2.3 免疫印迹
质粒转染48 h后,胰酶消化细胞,低速离心收集细胞后用PBS清洗2~3次,然后加入适量细胞裂解液(RIPA,用前加入PMSF),4 ℃混旋裂解5~10 min,然后高速低温离心(4 ℃,14000 rpm/min)10~15 min,并收集适量的裂解上清,加入等量的SDS上样缓冲液,混匀后沸水浴5~10 min,然后放置冰水中至冷却,即得到蛋白样品,取适量样品进行SDS-PAGE恒压电泳(80~100 V)约2 h,然后进行恒流电转(200 mA)约2 h,即得到负载蛋白的PVDF膜,将膜进行封闭(室温,2 h)后依次孵育GFP一抗(4 ℃,12 h)和二抗(室温,2 h),TBST缓冲液洗膜后用ECL液进行显影。
1.2.4 MTT实验
胰腺癌细胞(Panc-1和BxPC-3)传代后重新接种到96孔培养板中(细胞密度约为1×108·L-1),培养12~24 h后分别转染0.1 μg左右的pEGFP-C2(作为对照)和pEGFP-C2-TUFT1质粒,48 h后更换为无血清培养基,并加入20 μL MTT(5 g·L-1),继续培养4 h,弃去培养基并加入150 μL DMSO,震荡混匀10 min后,测定492 nm波长处的吸光度。
1.2.5 流式细胞术
胰腺癌细胞(Panc-1和BxPC-3)传代后重新接种到25 cm2的培养瓶中,培养12~24 h后分别转染5 μg左右的pEGFP-C2(作为对照)和pEGFP-C2-TUFT1质粒,48 h后收集细胞,并加入400 μL Binding Buffer重悬细胞,并加入5 μL Annexin V染液,轻轻混匀后孵育15 min(4 ℃,避光),然后加入10 μL PI,轻轻混匀后5 min(4 ℃,避光),并用流式细胞仪检测细胞凋亡情况,
1.2.6 统计学处理
利用SPSS软件19.0对统计数据进行分析,计量数据采用均数±标准差(x±s)来表示,组间对比采用t检验,计数资料采用比例表示,组间比较采用卡方检验。P<0.05为差异具有统计学意义。
2 结果
2.1 pEGFP-C2-TUFT1真核表达质粒的酶切
用Xho I和BamH I内切酶对质粒进行双酶切鉴定,结果显示,质粒被酶切成两条带,与DNA Marker比对发现,一条带位于4 268 bp和4 973 bp之间,另一条带位于947 bp和1 375 bp之间,而pEGFP-C2载体和TUFT1片段的大小分别为4.7 kb和1 173 bp,大小均分别位于两个区间,然后经过pEGFP-C2载体和TUFT1PCR产物的酶切结果的横向比较,基本可以确定一条是载体pEGFP-C2的条带,另一条是目的片段TUFT1的条带,表明质粒连接成功,后续测序结果显示TUFT1序列正确,表明pEGFP-C2-TUFT1质粒构建成功(图1)。

图1 重组质粒pEGFP-C2-TUFT1的酶切鉴定M:DNA Marker;1:pEGFP-C2的酶切;2:重组质粒的酶切;3:TUFT1的PCR产物
2.2 pEGFP-C2-TUFT1真核表达质粒的表达
培养胰腺癌细胞(Panc-1和BxPC-3),并瞬时转染约5 μg pEGFP-C2-TUFT1质粒至细胞中,24 h后收集裂解细胞,提取总蛋白后利用蛋白印迹检测TUFT1蛋白的表达情况,结果显示,用GFP抗体免疫印迹后,转染pEGFP-C2-TUFT1组在70 ku左右的位置出现了清晰的条带,其大小基本与GFP-TUFT1(27 ku+44 ku)一致,而未转染的空白对照组未检测到任何条带,表明pEGFP-C2-TUFT1能够在细胞中正常表达(图2)。
2.3 TUFT1对胰腺癌细胞增殖的影响
将胰腺癌细胞(Panc-1和BxPC-3)分成三组,即空白组、对照组和实验组,空白组不转染任何质粒,对照组转染pEGFP-C2空载体质粒,实验组转染pEGFP-C2-TUFT1质粒,并利用MTT技术对各组细胞的增殖情况进行检测和比较,结果显示空白组和对照组的细胞增殖率分别为0.616±0.048/0.634±0.043和0.610±0.041/0.625±0.047,二者不存在统计学差异(P>0.05),而观察组的细胞增值率为0.867±0.045/0.829±0.053,均要显著高于空白组和对照组(P<0.05),表明TUFT1的过表达能够显著促进胰腺癌细胞(Panc-1和BxPC-3)的增殖,见表1。

图2 重组质粒pEGFP-C2-TUFT1的蛋白表达
2.4 TUFT1对胰腺癌细胞凋亡的影响
将胰腺癌细胞(Panc-1和BxPC-3)分成三组,即空白组、对照组和实验组,空白组不转染任何质粒,对照组转染pEGFP-C2空载体质粒,实验组转染pEGFP-C2-TUFT1质粒,并用流式细胞术对各组细胞的凋亡情况进行检测和比较,结果显示空白组和对照组的细胞凋亡率分别为0.236±0.024/0.221±0.031和0.240±0.033/0.223±0.021,二者不存在统计学差异(P>0.05),而观察组的细胞增值率为0.095±0.008/0.091±0.009,均要显著高于空白组和对照组(P<0.05),表明TUFT1的过表达能够显著促进胰腺癌细胞(Panc-1和BxPC-3)的增殖,见表2。

表1 过表达TUFT1基因后对人胰腺癌细胞增殖的影响
* 表示与空白组和对照组相比,P<0.05。
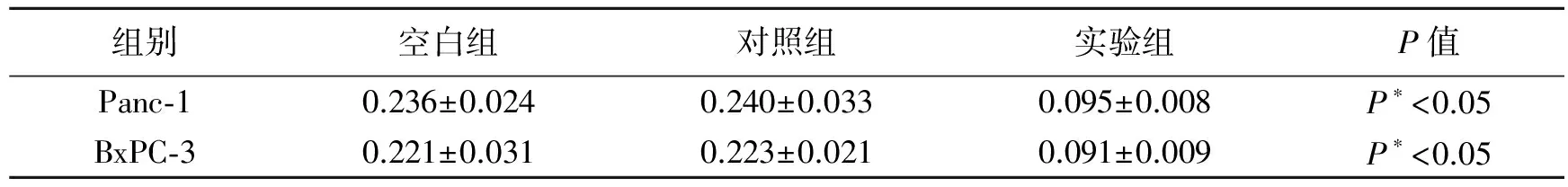
表2 过表达TUFT1基因后对胰腺癌细胞凋亡的影响
* 表示与空白组和对照组相比,P<0.05。
3 讨论
在21世纪,对胰腺癌的治疗仍然是个难题,不但治愈率极低,而且预后效果也很差,患者中位生存期都很难超过6个月,5年生存率也基本低于5% ,但其发病率却有逐年升高的趋势,在有些国家和地区竟上升7倍之多,形势异常严峻[8-9]。目前,对于胰腺癌发病的具体原因还不清楚,可能与吸烟酗酒、过分摄入高糖分、高脂肪、高热量、高蛋白饮食等不良生活习惯、环境污染以及遗传因素有着一定的关系[10]。对于PC的治疗,主要采用以外科手术治疗为主、放化疗结合为辅、免疫和分子等生物治疗综合应用的治疗方法,但由于其发病隐匿,大多数患者确诊是已经失去了手术治疗的机会,因此探索PC的发病机制、寻找治疗其的有效的基因靶点意义重大。TUFT1是一种富含谷氨酸和天冬氨酸典型酸性蛋白,且其在脊椎动物中具有高度保守性,人类的和牛和小鼠的同源性分别高达89%和88%。最初的研究发现,TUFT1表达于牙齿中,在牙釉的发展和矿化中发挥着重要作用[11],随着研究的深入,发现TUFT1在其它组织中也有不同程度的表达[12-13],尤其是癌组织,这将表明TUFT1可能与癌症的发生发展密不可分。
癌细胞的迁移和转移是癌症恶化和致死的重要原因之一,而上皮细胞向间质细胞转变(EMT)在这一过程扮演这十分重要的角色[14],有研究表明TUFT1与胰腺癌细胞中EMT的发生有着密切的关系,过表达TUFT1后能够显著上调HIF1、Snail、Vimentin等蛋白的表达水平,同时降低E-cadherin的表达水平,而这些EMT相关蛋白的异常变化将最终导致胰腺癌细胞的迁移和远处转移,这一研究结果提示TUFT1可能发挥着一定的致癌功能,与癌症的发生和发展有着密切的关系[7]。另外,细胞增殖和凋亡是一对相互并存的矛盾,二者的动态平衡维护这细胞的正常生长,而一旦这种平衡被打破,如细胞增殖的速度加快、细胞凋亡的速率下降最终会导致癌症的发生[15]。因此为了确定TUFT1在癌细胞中的功能,本文进一步研究了TUFT1对胰腺癌细胞系(Panc-1, BxPC-3)增殖和凋亡的影响,我们首先成功构建了pEGFP-C2-TUFT1真核表达载体,然后瞬时转染到Panc-1和BxPC-3细胞系中,裂解细胞提取总蛋白,免疫印迹检测到该质粒能够正常表达,为研究其在细胞增殖和凋亡中的功能奠定了基础。在细胞增殖和凋亡的研究中,结果表明:TUFT1能够促进胰腺癌细胞的增殖,并抑制癌细胞的凋亡,从而有利于癌细胞的迁移和转移,但对于其促增殖抑凋亡的具体机制目前还不清楚,需要进一步研究。
综上,本研究成功构建了人源TUFT1的真核表达载体,并初步确定TUFT1可以明显加速人胰腺癌细胞株(Panc-1和BxPC-3)的增殖,同时又能抑制其凋亡,具有显著的致癌功能,为进一步探索TUFT1基因功能、寻求治疗胰腺癌的新途径提供了细胞学基础。另外本研究探讨的是TUFT1过表达后对胰腺癌细胞的影响,在接下来研究中,我们将利用siRNA干扰技术和CRISPR技术沉默和敲除TUFT1基因,进而探讨其对腺癌和其它癌细胞的增殖、凋亡、以及信号通路的影响,逐渐解开TUFT1基因与癌症的关系。
[1]田碧.胰腺癌的治疗现状[J].肿瘤基础与临床,2014,27(1):86-89.
[2]HX Zhan, JW Xu, D Wu, et al.Pancreatic Cancer Stem Cells: New Insight into a Stubborn Disease[J].Cancer Lett,2016(357):429-437.
[3]D Li, K Xie, R Wolff,et al. Pancreatic Cancer[J].Lancet, 2004(363):1049-1057.
[4]JM Winter, CJ Yeo, JR Brody. Diagnostic, Prognostic, and Predictive Biomarkers in Pancreatic Cancer[J].J Surg Oncol,2013(107):15-22.
[5]郭海涛,何光志.基因工程技术在医学中的应用[J].北方药学,2013(12):54-56.
[6]D Deutsch, Y. Leiser, B Shay, et al.The Human Tuftelin Gene and the Expression of Tuftelin in Mineralizing and Nonmineralizing Tissues[J].Connective Tissue Research, 2002(43):425-434.
[7]Bin Zhou, Hanxiang Zhan,Lamtin Tin, at el. TUFT1 Regulates Metastasis of Pancreatic Cancer throughHIF1-SnailPathway Induced Epithelial-mesenchymal Transition[J].Cancer Letters,2016(1):11-20.
[8]Siegel RL,Miller KD,Jemal A.Cancer Statistics[J].CA Cancer J Clin,2016,66(1):7-30.
[9]Long J,Luo GP,Xiao ZW,et a1.Cancer Statistics:Current Diagnosis and Treatment of Pancreatic Cancer in Shanghai,China[J].Cancer Lett,2014,346(2):273-277.
[10]杨兴无.胰腺癌的流行病学和病因学机制[J].医学与哲学(临床决策论坛版),2015(1):10-11.
[11]Z Mao, B Shay, M Hekmati, et al.The Human Tuftelin Gene: Cloning and Characterization[J]. Gene, 2001(279):181-196.
[12]Deutsch D,Silverstein N,Shilo D,et al.Biphasic Influence of Hypoxia on Tuftelin Expression in Mouse Mesenchymal C3H10T1/2 Stem Cells[J].Eur J Oral Sci,2011,119(1):55-61.[13]Leiser Y,Silverstein N,Blumenfeld A,et al.The Induction of Tuftelin Expression in PC12 cell Line during Hypoxia and NGF-induced Differentiation[J].J Cell Physiol,2011,226(1):165-172.
[14]Diepenbruck M,Christofori G.Epithelial-mesenchymal Transition (EMT) and Metastasis: Yes, no, maybe?[J].Curr Opin Cell Biol,2016,29(43):7-13.
[15]Badisa RB, Darling-Reed SF, Joseph P, et al. Selective Cytotoxic Activities of Two Novel Synthetic Drugs on Human Breast Carcinoma MCF-7 cells[J].Anticancer Res.,2009(29):2993-2996.
Research on Construction of TUFT1 EukaryoticExpression Plasmid and Its Function
YUAN Kongxian1, WANG Jinian2
(1.DepartmentofPharmacy,TonglingPeople’sHospital,Tongling244002,China;2.DepartmentofEducation,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230032,China)
Extract total RNA of human hepatic stellate cells, reverse transcription into cDNA as templates, and obtain amplification TUFT1 CDS sequence, after connect to pEGFP-C2 carrier by using the double enzyme. Eukaryotic expression plasmid was transfected respectively to human pancreatic cancer cell line. Then, result showed that the cell proliferation rate of transfection group was significantly lower than normal group; cell apoptosis rate of transfection group was significantly higher than normal group. TUFT1 can significantly inhibit the proliferation of pancreatic cancer cell line, and promote its apoptosis. These results have a further understanding the function of TUFT1, and lay a foundation for searching a new direction in the therapy of pancreatic cancer.
TUFT1; transfection; proliferation; apoptosis
2017-03-27
袁孔现(1973-),男,安徽当涂人,副主任药师,研究方向:临床药学。通信作者:王继年(1984-),男,安徽阜阳人,助理研究员,硕士,研究方向:医药管理、药理学。
R735.9
A
1009-9735(2017)02-0071-04
