白及多糖超声波辅助提取工艺优化及体外抗氧化活性
2017-05-13何晓梅谷仿丽黄仁术韩邦兴陈乃富
何晓梅,谷仿丽,2,黄仁术,韩邦兴,2,陈乃富,2
(1.皖西学院 生物与制药工程学院,安徽 六安 237012;2.植物细胞工程安徽省工程技术研究中心,安徽 六安 237012)
白及多糖超声波辅助提取工艺优化及体外抗氧化活性
何晓梅1,谷仿丽1,2,黄仁术1,韩邦兴1,2,陈乃富1,2
(1.皖西学院 生物与制药工程学院,安徽 六安 237012;2.植物细胞工程安徽省工程技术研究中心,安徽 六安 237012)
研究野生白及多糖的超声波辅助提取工艺、sevage法脱蛋白及体外抗氧化活性。通过单因素试验和正交试验确定白及多糖最佳超声波提取条件为:超声时间50 min、超声温度60 ℃、超声波功率400 W、液固比(mL/g)50∶1、提取2次,在上述超声波提取条件下,白及多糖得率为(26.023±0.076)%。体外抗氧化实验表明:白及多糖对·O2-、·OH和DPPH·具有清除作用;当浓度为10 mg/mL时,脱蛋白白及多糖对·O2-、·OH和DPPH·自由基的清除率分别为25.32%、88.20%、94.34%,而未脱蛋白的清除率分别为23.15%、63.84%、86.72%。为白及多糖在自由基清除剂、食品添加剂等中的应用提供了科学的参考依据。
白及;多糖;超声波提取;sevage法脱蛋白;抗氧化活性
白及又名白芨、连及草、苞舌兰、箬兰、甘根、白根、百笠、紫蕙,为兰科白及属多年生草本植物白及[Blettilastriata(Thunb.) Reichb.f.]的干燥块茎。全世界白及属植物有9种,我国有4种,即华白及B.sinensis(Rolfe)Schltr.、黄花白及B.ochraceaSchltr.、小白及B.formosana(Hayata) Schltr.及白及[1,2],野生品白及主产于我国河南、甘肃、陕西、山东、安徽、江苏、浙江、福建、广东、广西、江西、湖南、湖北、四川、贵州、云南等省区。白及是研究较多、应用较广的一味中药,被《中国药典》(1995、2005年版)收录。白及具有收敛止血、清热利湿、消肿生肌止痛、延缓皮肤衰老之功效,临床上广泛用于治疗咳血、吐血、外伤出血、疮疡肿毒、皮肤冻疮和皲裂、肺结核咳血、溃疡病出血等症,疗效显著。白及用药历史久远,药用价值高,特别是白及块茎含有黏液质多糖,具有抗癌、防癌、抗肿瘤、抗菌、止血、保护胃黏膜、促进伤口愈合、促进糖尿病创面愈合、抗氧化、增强免疫力等[3-5]作用。目前,国内学者对白及多糖的研究主要集中于采用不同的试验方法优化白及多糖的水提工艺[6-10]以及研究白及多糖及其衍生物作为医药材料[11-14]。研究表明很多疾病是由自由基代谢出现紊乱导致的[15],目前有许多关于植物多糖具有抗氧化能力(清除自由基能力)的研究和报道[16],但是很少报道白及多糖的抗氧化作用。本研究以大别山产野生白及为实验材料,在传统水提法的基础上,利用超声波辅助处理,在单因素实验基础上采用正交实验得出白及多糖的最优提取条件,并对白及多糖进行体外抗氧化活性研究,旨在为白及多糖在生物医学上的应用提供科学的参考依据。
1 材料与方法
1.1 实验材料和试剂
材料:大别山产野生白及BletillaStriata干燥块茎——2015年9月份采挖,除去须根,洗净,置沸水中煮至无白心,晒至半干,除去外皮,晒干,收藏。
试剂:石油醚、无水乙醇、葡萄糖、浓硫酸、苯酚、三氯甲烷、正丁醇、考马斯亮蓝G-250、磷酸、牛血清白蛋白、邻苯三酚、磷酸氢二钠、磷酸二氢钠、盐酸、硫酸亚铁、30%过氧化氢、水杨酸、DPPH·(1,1-二苯基-2-苦基肼)等试剂,均为国产分析纯。实验用水为双蒸水。
1.2 主要仪器设备
ZMD-2型电子分析天平(上海方瑞仪器有限公司)、DXF-20C型1000克密封型粉碎机(西安宝正实业有限公司)、RE-52B型旋转蒸发仪(上海青浦沪西仪器厂)、JK-500B型超声波清洗器(西安常仪仪器设备有限公司)、TU1901型紫外分光光度计(上海元析仪器有限公司)、GL-21M型冷冻离心机(贝克曼库尔特有限公司)、VD53德国binder真空干燥箱(艾利特国际贸易有限公司)。
1.3 实验方法
1.3.1 白及多糖的超声波辅助提取及sevage法脱蛋白
参照秦亚东、魏涛、乔德亮等[17-19]的方法,取干品白及块茎粉碎,过20目筛,50 ℃干燥至恒重。精密称取白及粉末5.000 g左右,石油醚(沸程60~90 ℃)脱脂,将脱脂白及粉末于三角烧瓶中加蒸馏水适量搅拌均匀,进行超声提取(超声频率20 kHz)、离心上清液浓缩到粘稠状,冷却后加95%乙醇,边加边缓慢搅拌,使含醇量达80%,即析出大量白色絮状沉淀,冰箱静置过夜(4 ℃),离心,将沉淀物再加95%乙醇适量,搅拌,静置,使之充分脱水,离心,重复3次,挥干乙醇,加少量蒸馏水,sevage试剂(正丁醇∶氯仿=4∶1)去除游离蛋白,醇沉,低温干燥,研细,即得脱蛋白白及多糖。
1.3.2 单因素实验
以白及粗多糖得率为考察指标,分别研究提取次数(1次、2次、3次)、超声提取时间(10 min、20 min、30 min、40 min、50 min)、超声提取温度(40 ℃、50 ℃、60 ℃、70 ℃、80 ℃)、超声波功率(100 W、200 W、300 W、400 W、500 W)、液固比(20∶1 mL/g、30∶1 mL/g、40∶1 mL/g、50∶1 mL/g、60∶1 mL/g)对白及多糖提取效果的影响。
1.3.3 正交实验
在单因素试验基础上,采用L9(34)设计方案进行正交试验。
1.3.4 白及多糖含量的测定
采用苯酚-硫酸法。以葡萄糖为标准品,其标准曲线方程为:y=11.367x-0.172 7,R2=0.997 4,葡萄糖浓度(mg/mL)在0~0.1之间线性关系良好。
1.3.5 白及粗多糖得率的计算方法
粗多糖得率(%)=[粗多糖质量(g)/白及粉质量(g)]*100%
1.3.6 蛋白质检测
采用考马斯亮蓝G-250(Bradford)法。利用紫外可见分光光度计检测到几乎无蛋白,即得脱蛋白白及多糖。
1.3.7 白及多糖抗氧化活性研究
1)白及多糖清除超氧阴离子自由基(·O2-)能力:采用改良邻苯三酚自氧化法[20]。
(·O2-)清除率(%)=(A对照-A样品)/A对照×100
式中:A样品为样品组邻苯三酚自氧化速率(ΔA/min);
A对照为对照组邻苯三酚自氧化速率(ΔA/min)。
2)羟基自由基(·OH)清除率的测定:·OH清除率的测定采用水杨酸法[21]。
(·OH)清除率(%)=[1-(A样品-A对照)/A空白]×100
A空白——不加多糖溶液的吸光度;A样品——加多糖溶液的吸光度;A对照——不加H2O2的多糖溶液的吸光度
3)DPPH·清除能力的测定
参照王玲、何芳等[22,23]的方法略作修改。样品管中依次加入3 mL不同浓度的多糖溶液和3 mL 10 mmol/L DPPH·溶液充分摇匀;对照管中用3 mL无水乙醇代替DPPH·溶液充分摇匀;空白管中用3 mL蒸馏水代替多糖溶液充分摇匀。上述三组溶液避光静置30 min,测定517 nm处吸光度值。根据公式计算多糖对DPPH·的清除能力。
DPPH·清除率(%)=[1-(A样品-A对照)/A空白]×100
2 结果与分析
2.1 单因素实验
2.1.1 提取次数对粗多糖得率的影响
准确称取约5.000 g恒重白及粉(以下同),在液固比(mL/g)20∶1,30∶1,超声波功率300 W、超声时间30 min,超声温度50 ℃条件下,进行3次超声波辅助浸提,粗多糖得率见图1。随着提取次数的增加,粗多糖得率依次减少,第1次和第2次浸提得率接近,第3次浸提得率减少明显。故后续实验选择2次浸提。

图1 提取次数对粗多糖得率的影响
2.1.2 超声时间对粗多糖得率的影响
在液固比(mL/g)30∶1,超声波功率300 W,超声温度50 ℃,超声时间分别为10 min、20 min、30 min、40 min、50 min条件下,进行2次超声波辅助浸提,粗多糖得率见图2。

图2 超声时间对粗多糖得率的影响
实验研究时,将5个水平15份水溶液按超声时间由长到短的顺序进行超声波处理,超声时间越长多糖得率越高。当超声时间小于40 min时,多糖得率升高迅速,40 min以后增加较缓慢,综合考虑效率和得率因素,后续实验选择超声时间为40 min。
2.1.3 超声温度对粗多糖得率的影响
在液固比(mL/g)30∶1,超声波功率300 W,超声时间40 min,超声温度分别为40 ℃、50 ℃、60 ℃、70 ℃、80 ℃条件下,进行2次超声波辅助浸提,粗多糖得率见图3。
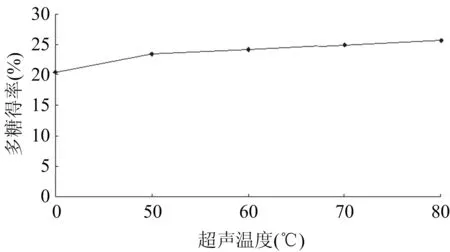
图3 超声温度对粗多糖得率的影响
随着超声温度的提高,多糖得率逐渐升高。在实验研究的温度范围内,多糖得率增加呈现渐升式,考虑到在较高的处理温度下,白及多糖的粘度特性可能受到影响,因而从提高产物稳定性角度考虑,适宜的处理温度应低于80 ℃,本实验选择60 ℃。
2.1.4 超声波功率对粗多糖得率的影响
在液固比(mL/g)30∶1,超声提取时间40 min,超声提取温度60 ℃,超声波功率分别为100 W、200 W、 300 W、400 W、500 W条件下,进行2次超声波辅助浸提,粗多糖得率见图4。

图4 超声功率对粗多糖得率的影响
随着超声波处理功率的增大,白及多糖提取得率先增大后减小,在超声波功率低于400 W时,多糖得率随超声波功率的增大而提高,在超声波功率高于400 W时,多糖得率又随超声波功率的增大而降低,可能是由于大的超声波提取功率所产生机械效应作用使多糖的糖苷键被打断,多糖结构被破坏,导致多糖得率降低,因此选择超声波处理功率为400 W。
2.1.5 液固比对粗多糖得率的影响
在超声时间40 min,超声温度70 ℃,液固比(mL/g)分别为20∶1、30∶1、40∶1、50∶1、60∶1条件下,进行2次超声波辅助浸提,粗多糖得率见图5。
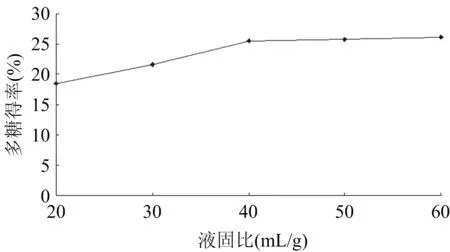
图5 液固比对粗多糖得率的影响
当液固比小于40时,多糖得率随液固比增加而增加。因为随着溶剂量的增加,细胞内外物质形成的浓度差越大,胞内物质扩散越快,浸出物越多,浸提液中糖含量越高。但当液固比大于40时,即随着溶剂量的继续增加,多糖得率增加缓慢,趋于平衡,可能是由于杂质浸出量的增加,同时,考虑到溶剂量过高,不利于后续浓缩、纯化等过程。故后续实验选择液固比为40 mL/g。
2.2 正交实验结果及分析
正交实验结果和方差分析表分别见表1和表2。
极差R值分析表明,影响白及多糖得率因素主次顺序为:液固比〉超声波功率〉超声温度〉超声时间。方差分析结果表明,各因素对多糖得率影响都不显著。正交实验结果表明,白及多糖超声辅助提取的最优条件为A3B1C2D3,即超声时间50 min、超声温度60 ℃、超声波功率400 W、液固比为50 mL/g。在此条件下进行3次重复实验,白及多糖得率为(26.023±0.076)%。

表1 正交实验结果
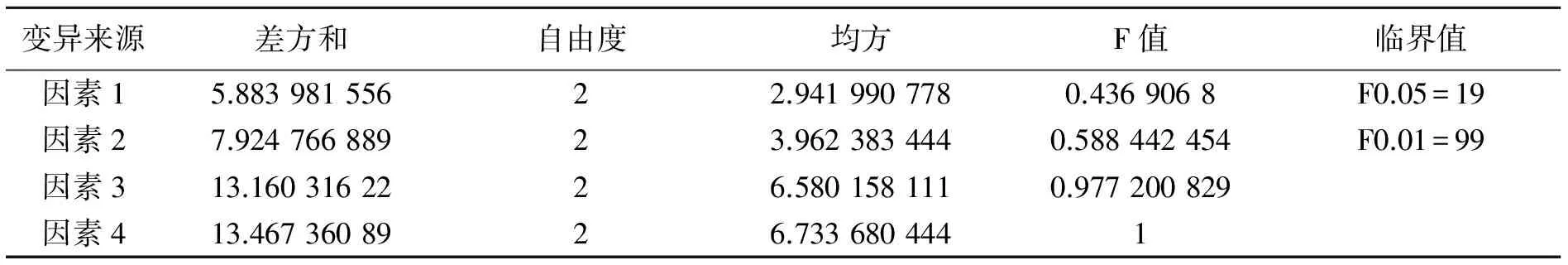
表2 方差分析表
2.3 白及多糖抗氧化活性

图6 未脱蛋白白及多糖对自由基的清除作用

图7 脱蛋白白及多糖对自由基的清除作用
根据1.3.1的方法分别得到未脱蛋白和脱蛋白白及多糖干品,研碎,称重,溶解,配成不同浓度的溶液,研究其对超氧阴离子、羟基自由基和二苯基苦酰肼基自由基的清除作用,结果如图6和7。图6和图7表明:白及多糖对·O2-、·OH 和DPPH·自由基具有清除作用;相同质量浓度的脱蛋白白及多糖较未脱蛋白的白及多糖对自由基的清除能力强,说明有机溶剂sevage试剂(正丁醇和氯仿)的加入没有对多糖的活性产生影响;当实验浓度为10 mg/mL时,脱蛋白白及多糖对·O2-、·OH和DPPH·自由基的清除率分别为25.32%、88.20%、94.34%,而未脱蛋白的清除率分别为23.15%、63.84%、86.72%。
3 结语
(1)以白及多糖得率为考察指标,通过单因素实验和正交实验确定超声辅助提取最优条件为:超声时间50 min、超声温度60 ℃、超声波功率400 W、液固比(mL/g)50∶1、提取2次,在上述超声波提取条件下,白及多糖得率为(26.023±0.076)%。
(2)体外抗氧化实验表明,白及多糖具有清除超氧阴离子自由基、羟基自由基和二苯基苦酰肼基自由基的能力,但清除能力不同。
(3)有机溶剂sevage试剂的使用不影响白及多糖的活性。
[1]李嵘,王喆之.白及的研究概述及其资源利用对策[J].中草药,2006,37(11):1751-1755.
[2]孙乐乐,杨永红,刘军凯,等.白及的本草考证[J].中药材,2010,33(12):1965-1968.
[3]陶阿丽,金耀东,刘金旗,等.中药白芨化学成分、药理作用及临床应用研究进展[J].江苏农业科学,2013,41(11):6-9.[4]张洁,张卫明,史劲松,等.白芨葡甘聚糖在医药中的研究[J].高分子通报,2010(9):52-57.
[5]俞林花,聂绪强,潘会君,等.白芨多糖对糖尿病溃疡创面愈合的作用研究[J].中国中药杂志,2011,36(11):1487-1491.[6]卢少海,马山,周长征.正交试验法优化白及胶提取工艺[J].山东中医杂志,2014,33(10):847-848.
[7]王轶,于国英,高振珅.正交试验法优化白及粗多糖的提取工艺[J].中药材,2012,35(2):314-216.
[8]黄铭,郝永龙,冯堃,等.均匀设计优化白及胶提取工艺研究[J].中国中药杂志,2007,32(24):2672-2673.
[9]刘福强,王艳萍,韩丹,等.白及多糖的提取及其相对分子质量测定和结构研究[J].中成药,2013,35(10):2291-2293.[10]秦亚东,汪荣斌,周宙.不同产地白及多糖含量测定[J].安徽科技学院学报,2014,28(3):41-44.
[11]侯绪浩,刘学蔚,彭凤梅,等.天然药物材料白及胶制备生物支架材料的实验研究[J].中草药,2013,44(16):2230-2233.[12]程安媛.新型胃黏附材料——白及多糖的制备及膜黏附性体内外评价[D].重庆:重庆医科大学(硕士学位论文),2008.
[13]陈景耀,张卫明,王习达,等.白及多糖硫酸酯化及生物学活性的比较研究[J].食品科学,2007,28(4):27-31.
[14]罗仕华,郑传胜,黎维勇,等.白及微球的制备工艺和表征[J].中成药,2013,35(8):1795-1800.
[15]孙志敏,陈群超,黄建颖,等.吡啶壳聚糖的制备、表征及体外抗氧化活性研究[J].核农学报,2016,30(2):295-303.[16]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-11.
[17]魏涛,何培新,封盛雪,等.怀牛膝多糖的超声波辅助提取工艺及其抗氧化性活性[J].食品与发酵工业,2011,37(2):191-194.
[18]王萍,李德海,孙莉洁,等.超声波辅助法提取滑菇多糖的工艺研究[J].中国食品学报,2008,8(2):84-87.
[19]乔德亮,何晓梅,韦传宝,等.三角帆蚌多糖的超声波辅助提取及体外抗菌活性[J].食品工业科技,2014,35(15):72-76.
[20]何晓梅,谷仿丽,张颖,等.芝麻木脂素超声提取工艺优化及其抗氧化性能[J].生物加工过程,2013,11(6):53-57.
[21]鲍素华,查学强,郝杰,等.不同分子量铁皮石斛多糖体外抗氧化活性研究[J].2009,30(21):123-127.
[22]何芳,汪之和,马婉婉,等.不同分子量条斑紫菜多糖体外抗氧化活性研究[J].上海海洋大学学报,2015,24(5):783-788.
[23]王玲,唐德强,王佳佳,等.铁皮石斛原球茎与野生铁皮石斛多糖的抗菌及体外抗氧化活性比较[J].西北农林科技大学学报(自然科学版),2016,44(6):166-172,180.
Ultrasonic-Assisted Extraction and in vitro Antioxidant ActivitiesEvaluation of Polysaccharides fromBlettilastriata
HE Xiaomei1, GU Fangli1,2, HUANG Renshu, HAN Bangxing1,2, CHEN Naifu1,2
(1.CollegeofBiologyandPharmaceuticalEngineering,WestAnhuiUniversity,Lu’an237012,China;2.AnhuiProvinceEngineeringTechnologyResearchCenterofPlantCellEngineering,Lu’an237012,China)
The ultrasonic-assisted extraction technology of crude polysaccharide from wildBlettilastriata, Sevag’s deproteination and its antioxidant activities of the polysaccharide were investigated. On the basis of single factor test,extraction technology condition was optimized by orthogonal test.Our results showed the best extracting condition was as follows: extracting time 50 min,extracting temperature 60℃,ultrasonic power 400W,water-material ratio(mL / g)50:1 and extracting 2 times.Under the above conditions,the extraction rate of the crude polysaccharide can reach to (26.023±0.076)%.Meanwhile,the scavenging activity of the polysaccharide on ·O2-, ·OH and DPPH· free radicals were significant.The clearance rates of the deproteinizedBlettilastriatapolysaccharide was up to 25.32%, 88.20% and 94.34% respectively,and the undeproteinizedBlettilastriatapolysaccharides up to 23.15%, 63.84%, 86.72% respectively. The study will provide scientific basis and reference for application ofBlettilastriataPolysaccharide in the field of free-radical scavengers and food additives.
Blettilastriata; Polysaccharide; ultrasonic extraction; Sevage’s deproteination;antioxidative activity
2016-11-08
安徽省教育厅重点项目(KJ2017A407);中央财政林业科技推广示范项目(2016TG05);皖西学院校级自然科学研究项目(WXZR201622);国家自然科学基金(31271853);安徽省级大学生创新项目(201610376035)。
何晓梅(1974-),女,安徽霍山人,硕士,副教授,研究方向:天然产物研究与开发。
TS202.3
A
1009-9735(2017)02-0001-05
