葡萄糖转运蛋白2在肝源性糖尿病患者肝组织中的表达及意义
2017-05-13何玉兰于红卫孟庆华
何玉兰, 孙 琳, 于红卫, 孟庆华
(1 北京市平谷区医院 感染科, 北京 101200;2 首都医科大学附属北京佑安医院 a.病理科; b.重症肝病科, 北京 100069)
葡萄糖转运蛋白2在肝源性糖尿病患者肝组织中的表达及意义
何玉兰1, 孙 琳2a, 于红卫2b, 孟庆华2
(1 北京市平谷区医院 感染科, 北京 101200;2 首都医科大学附属北京佑安医院 a.病理科; b.重症肝病科, 北京 100069)
目的 探讨葡萄糖转运蛋白2(GLUT2)在肝源性糖尿病肝组织中的表达及意义。方法 选取2012年6月-2014年7月首都医科大学附属北京佑安医院重症肝病科和肝胆外科肝组织标本40例,免疫组化检测各组(正常组、慢性乙型肝炎组、肝硬化组、肝源性糖尿病组)肝组织中GLUT2的表达水平。计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t检验,计数资料比较采用Fisher确切概率法。结果 肝源性糖尿病组的空腹血糖、糖化血红蛋白、糖化血清白蛋白、BMI以及肝组织脂肪变性比例与其他3组比较差异均有统计学意义(P值均<0.05)。免疫组化显示 GLUT2主要表达于肝细胞膜,尤其是靠近窦腔部位的细胞膜上,在正常肝组织、慢性乙型肝炎、肝硬化肝组织的表达均表现为从中央静脉向汇管区逐渐减少的趋势,有1例在肝硬化肝细胞再生结节部位表达增强。肝源性糖尿病肝组织有明显的脂肪变性(6/10),GLUT2在脂变部位呈强阳性表达,且表达相对均匀,在脂变细胞周围肝细胞质中的表达也有所增加,与窦腔侧的表达无明显差别。结论 肝源性糖尿病肝组织易合并脂肪变性,且GLUT2的表达明显增加,可能是其糖代谢异常的发病机制之一。
肝源性糖尿病; 葡萄糖转运体2型; 葡萄糖代谢障碍
肝脏是人体最大的代谢器官,肝功能受损常引起糖代谢的异常,严重者甚至发展为肝源性糖尿病。有研究[1]显示,慢性病毒性肝炎发展为肝源性糖尿病的几率达17.5%,而肝硬化发展为肝源性糖尿病的几率高达27.6%。目前相关研究[2]普遍认为肝源性糖尿病是胰岛素抵抗、胰岛素分泌进行性损害的结果,推测葡萄糖转运异常可能构成其共同基础。因为胰岛周围β细胞的胰岛素分泌依赖于葡萄糖转运及代谢,周围胰岛素抵抗表现为胰岛素刺激的靶细胞葡萄糖转运障碍,而肝细胞的葡萄糖转运系统又是肝糖输出的重要环节。葡萄糖转运蛋白2(glucose transporter,GLUT2)主要在肝脏表达,目前对GLUT2在肝源性糖尿病肝脏组织中的表达情况及意义的报道极少。本研究通过检测GLUT2在肝源性糖尿病肝组织中的表达和分布,探讨其在肝源性糖尿病糖利用障碍中的作用。
1 资料及方法
1.1 研究对象 选取2012年6月-2014年7月首都医科大学附属北京佑安医院重症肝病科和肝胆外科肝组织标本40例,其中10例正常肝组织标本取自肝移植供体肝穿组织,男7例,女3例;10例慢性乙型肝炎肝组织标本取自肝穿刺活组织检查标本,男6例,女4例,病理诊断为轻度慢性乙型肝炎;10例肝硬化组织取自乙型肝炎肝硬化患者脾切除术时送检的肝组织,男8例,女2例,病理诊断为活动性肝硬化;10例肝源性糖尿病肝组织,其中4例为轻度慢性乙型肝炎肝源性糖尿病患者,6例为活动性肝硬化肝源性糖尿病患者。慢性乙型肝炎及肝硬化诊断符合《慢性乙型肝炎防治指南(2010年版)》[3]。肝源性糖尿病符合以下标准[4]:(1)糖尿病发病前有肝病史;(2)有明确的肝损伤及肝功能障碍的临床表现、生化检查及组织学证据;(3) 血糖和糖耐量的改变与肝功能的变化多呈一致性;(4)糖尿病症状轻微或者无,没有糖尿病并发症;(5)空腹血糖≥7.0 mmol/L,餐后2 h血糖≥11.1 mmol/L,或口服葡萄糖耐量试验显示餐前血糖正常或稍增高,但餐后血糖≥11.1 mmol/L;(6)胰岛素释放试验显示,空腹血浆胰岛素水平偏高,餐后胰岛素反应不良或反应延迟,C肽/胰岛素比值明显减少;(7)患者无糖尿病家族史,除外垂体、胰腺、肾上腺、甲状腺疾病,以及药物如利尿剂、激素、降压药和避孕药所致的继发性高血糖。所有标本置于10%福尔马林溶液中固定,石蜡切片。
1.2 试剂与方法 主要试剂:GLUT 2抗体(1∶2000[5]稀释),购自美国Abcam公司,二抗工作液、正常山羊血清、DAB显色剂购自北京中杉公司。采用免疫组化SP法,高压加热修复抗原,以DAB显色。操作过程按照试剂盒说明书操作,以PBS缓冲液代替一抗作为阴性对照,并用已知切片作为阳性对照。
1.3 结果判定 GLUT2主要着色于肝细胞膜,少量表达于肝细胞质。按染色强度的差异分为4级:无着色(阴性)、浅黄色(弱阳性)、棕黄色(阳性)和棕褐色(强阳性)。

2 结果
2.1 一般情况及糖代谢指标比较 肝源性糖尿病组的空腹血糖、糖化血红蛋白、糖化血清白蛋白和BMI与其他3组比较差异均有统计学意义(P值均<0.05),其他3组间的糖代谢指标和BMI差异均无统计学意义(P值均>0.05)。慢性乙型肝炎组的年龄明显小于其他3组(P值均<0.05),其他3组间的年龄差异均无统计学意义(P值均>0.05)。肝源性糖尿病组的肝组织脂肪变性比例高于其他3组(P值均<0.05),其他3组间肝组织脂肪变性比例差异均无统计学意义(P值均>0.05)(表1)。

表1 一般资料及糖代谢指标比较
注:1)与肝源性糖尿病组比较,P<0.05;2)与慢性乙型肝炎组比较,P<0.05
2.2 免疫组化结果 GLUT2主要表达在肝细胞膜上,少量表达在细胞质。在正常肝组织,所有细胞膜都有表达,但表达强度不均匀,主要表达在靠近窦腔部位的肝细胞膜上,中央静脉区强阳性表达,染色强度由中央静脉区(强阳性)到汇管区逐渐降低(阳性)(图1a)。在慢性乙型肝炎、肝硬化肝组织的表达也表现出从中央静脉往汇管区表达减少的梯度变化,且均在肝细胞靠近窦腔侧着色加深。肝硬化组中有1例在中央静脉区强阳性表达,组织病理显示此处为再生结节(图1b,c)。
10例肝源性糖尿病肝组织中有6例存在明显的脂肪变性。GLUT2在肝源性糖尿病肝组织的脂变细胞膜上呈强阳性表达,且表达相对均匀,在脂变细胞周围肝细胞质中的表达也有所增加,与窦腔侧的表达无明显差别。非脂变部位的表达与其相应的基础肝病病理一致(图1d)。

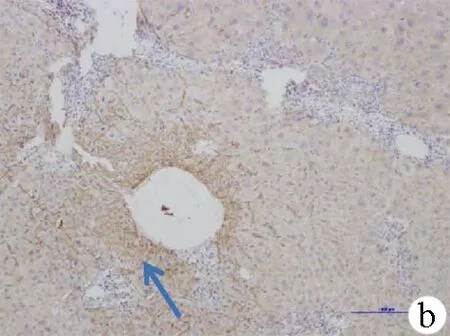

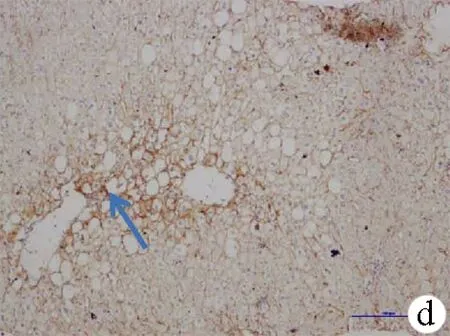
图1 免疫组化结果(×10) a:供肝肝组织GLUT2表达;b:慢性乙型肝炎肝组织GLUT2表达;c:肝硬化肝组织GLUT2表达;d:肝源性糖尿病患者肝组织GLUT2表达
3 讨论
肝源性糖尿病是继发于肝实质损伤的糖尿病,而体内的高糖状态可导致受损的肝细胞加速衰竭,降低患者的长期生存率[6]。肝源性糖尿病的发病机制极其复杂,目前尚未阐明。现有研究[7]认为引起肝源性糖尿病的主要机制包括外周组织的胰岛素抵抗与肝细胞损伤。GLUT2是胰岛β细胞和部分葡萄糖浓度高的组织(如肠、肝脏、肾脏)中负责转运葡萄糖的蛋白,主要定位于细胞膜。GLUT2对葡萄糖亲和力极低,仅在血浆葡萄糖水平比较高时(例如餐后时)发挥转运功能,其葡萄糖转运能力随血糖浓度升高而升高。有研究[8]显示高糖血症可增加肝组织GLUT2 mRNA和GLUT2浓度,而高胰岛素血症则会下调GLUT2 mRNA和GLUT2浓度。葡萄糖转运系统在肝脏调节肝细胞葡萄糖的双向转运。有研究[9]描述了GLUT2在肝癌细胞的表达定位,目前未见有关肝脏中GLUT2表达分布特征与肝源性糖尿病发病机制的研究报道。
本研究免疫组化结果显示,GLUT2在正常人肝组织所有细胞膜均有强度不均的表达,主要表达在靠近窦腔部位的肝细胞膜上,少量表达在细胞质。表达强度由中央静脉区向汇管区逐渐降低。慢性乙型肝炎、肝硬化肝组织也有相似的表现。有研究[10]用基因敲除技术证实肝门静脉周围存在GLUT2依赖的血糖感受器,本研究显示GLUT2在中央静脉区呈强阳性表达,从免疫组化的角度支持了这一结论。GLUT2染色强度的梯度变化,考虑与从中央静脉区到汇管区血糖浓度逐渐降低有关。肝硬化中有1例在再生结节处GLUT2呈强表达,推测与结节处肝细胞的糖代谢活跃有关。
与其他3组相比,肝源性糖尿病组存在明显的脂变(6/10),其GLUT2的表达除了在脂变细胞膜呈强阳性表达外,在中央静脉区肝细胞膜上表达相对均匀,且在脂变细胞周围肝细胞质中的表达增加,提示GLUT2在肝源性糖尿病的表达明显增加,可能是其糖代谢异常的发病机制之一。本研究纳入病例较少且未行定量分析,今后将进一步增加样本量、定量分析,以阐明GLUT2在肝源性糖尿病发病中的作用。
[1] KURIYAMA S, MIWA Y, FUKUSHIMA H, et al. Prevalence of diabetes and incidence of angiopathy in patients with chronic viral liver disease[J]. J Clin Biochem Nutr, 2007, 40(2): 116-122.
[2] JIANG A, LI HC, LI ZF. Progress of hepatogenous diabetes[J]. Med J West China, 2013, 25(12):1912-1915.(in Chinese) 蒋安, 李寒春, 李宗芳. 肝源性糖尿病的研究进展[J]. 西部医学, 2013, 25(12): 1912-1915.
[3] Chinese Society of Hepatology, Chinese Society of Infectious Diseases, Chinese Medical Association.The guideline of prevention and treatment for chronic hepatitis B(2010 version) [J]. J Clin Hepatol, 2011, 27(1): Ⅰ-ⅩⅥ. (in Chinese) 中华医学会肝病学分会, 中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J]. 临床肝胆病杂志, 2011, 27(1): Ⅰ-ⅩⅥ.
[4] GUNDLING F, SCHUMM-DRAEGER PM, SCHEPP W.Hepatogenous diabetes-diagnostics and treatment[J]. Z Gastroenterol, 2009, 47(5), 436-445.
[5] DOI C, NOGUCHI Y, ITO T, et al. Alteration in immunoexpression of glucose transporter 2 in liver of tumour-bearing rats[J]. Int J Exp Pathol, 1998, 79(1): 25-31.
[6] HOLZ LE, YOON JC, RAGHURAMAN S, et al. B cell homeostasis in chronic hepatitis C virus-related mixed cryoglobulinemia is maintained through naive B cell apoptosis [J] . Hepatology, 2012, 56(5): 1602-1610.
[7] HAN HM, PIAO YF. Current research status of the pathogenesis of hepatogenous diabetes[J]. J Clin Hepatol, 2006, 22(2): 152-153. (in Chinese) 韩红梅, 朴云峰. 肝源性糖尿病发病机制的研究现状[J]. 临床肝胆病杂志, 2006, 22(2): 152-153.
[8] BURCELIN R, EDDOUKS M, KANDE J, et al. Evidence that GLUT-2 mRNA and protein concentrations are decreased by hyperinsulinaemia and increased by hyperglycaemia in liver of diabetic rats[J]. Biochem J, 1992, 288 (2): 675-679.
[9] BISHNUHARI P, PRAMILA P, NOBORU O, et al. Clinical implication of glucose transport and metabolism evaluated by 18F-FDG PET in hepatocellular carcinoma[J]. Int J Oncol, 2008, 33(5): 1047-1054.
[10] BURCELIN R, DOLCI W, THORENS B. Glucose sensing by the hepatoportal sensor is GLUT2-dependent. In vivo analysis in GLUT2-null mice[J]. Diabetes, 2000, 49(10):1643-1648.
引证本文:HE YL, SUN L, YU HW, et al. Expression of glucose transporter 2 in liver tissue in patients with hepatogenous diabetes and its significance[J]. J Clin Hepatol, 2017, 33(3): 512-515. (in Chinese)
何玉兰, 孙琳, 于红卫, 等. 葡萄糖转运蛋白2在肝源性糖尿病患者肝组织中的表达及意义[J]. 临床肝胆病杂志, 2017, 33(3): 512-515.
(本文编辑:刘晓红)
Expression of glucose transporter 2 in liver tissue in patients with hepatogenous diabetes and its significance
HEYulan,SUNLin,YUHongwei,etal.
(DepartmentofInfectiousDiseases,BeijingPingguDistrictHospital,Beijing101200,China)
Objective To investigate the immunohistochemical expression of glucose transporter 2 (GLUT2) in patients with hepatogenous diabetes and its significance. Methods A total of 40 liver tissue samples were collected from patients who were treated in Department of Severe Liver Disease and Department of Hepatobiliary Surgery in Beijing YouAn Hospital, Capital Medical University, from June 2012 to July 2014. Immunohistochemistry was used to measure the expression of GLUT2 in liver tissue in all four groups (normal group, chronic hepatitis B group, liver cirrhosis group, and hepatogenous diabetes group). A one-way analysis of variance was used for the comparison of continuous data between groups, and the least significant differencet-test was used for further comparison between any two groups; the Fisher′s exact test was used for the comparison of categorical data between groups. Results There were significant differences in fasting blood glucose, glycosylated hemoglobin, glycosylated serum albumin, body mass index, and proportion of liver tissue with steatosis between the hepatogenous diabetes group and the other three groups (allP<0.05). Immunohistochemistry showed that GLUT2 was mainly expressed in the liver cell membrane, especially the cell membrane near the sinus cavity. In the patients with normal liver tissue, chronic hepatitis B, or liver cirrhosis, the expression of GLUT2 in liver tissue tended to gradually decrease from the central vein to the portal area, and one patient with liver cirrhosis had enhanced expression of GLUT2 in the regenerative nodules of hepatocytes. In the 10 patients with hepatogenous diabetes, 6 had significant steatosis of the liver tissue and strongly positive and relatively even expression of GLUT2 at the site of steatosis, as well as the cytoplasm around steatotic hepatocytes, with no significant difference from the expression of GLUT2 in the sinus cavity. Conclusion Patients with hepatogenous diabetes tend to have steatosis in the liver tissue and a significant increase in the expression of GLUT2, which may be the pathogenesis of abnormal glucose metabolism.
hepatogenic diabetes; glucose transporter type 2; glucose metabolism disorders
10.3969/j.issn.1001-5256.2017.03.023
2016-10-11;
2016-11-20。
何玉兰(1982-),女,主治医师,主要从事慢性肝病的研究。
孟庆华,电子信箱:wj5773@163.com。
R575
A
1001-5256(2017)03-0512-04
