MR扩散峰度成像在浸润性乳腺癌分级及与预后因素的相关性应用研究
2017-05-12成芳所世腾康记文华小兰耿小川张科蓓张庆华佳
成芳,所世腾,康记文,华小兰,耿小川,张科蓓,张庆,华佳
MR扩散峰度成像在浸润性乳腺癌分级及与预后因素的相关性应用研究
成芳,所世腾,康记文,华小兰,耿小川,张科蓓,张庆,华佳*

目的评价MR扩散峰度成像(diffusion kurtosis imaging,DKI)在浸润性乳腺癌分级中的应用及与ER、PR、HER-2、Ki-67的相关性。材料与方法搜集2014年8月至2016年9月在我院经病理及临床确诊为乳腺癌的患者53例,其中男1例,女52例,病理组织学分级:5例(9.4%)为1级,26例(49.1%)为2级,22例(41.5%)为3级。所有患者进行包括DKI序列的乳腺磁共振扫描。通过Matlab 2011b软件计算表观弥散系数(apparent diffusion coefficient,ADC)、平均扩散率(mean diffusivity,MD)和扩散峰度平均值(mean kurtosis,MK)值,对照病理结果,应用Mann-Whitney U检验评价上述参数值与浸润性乳腺癌病理分级及与ER、PR、HER-2、Ki-67的相关性。结果ADC、MD和MK值在不同级别浸润性乳腺癌之间差异没有统计学意义(P>0.05),在不同表达水平的ER、PR、HER-2及Ki-67统计学中发现,仅仅ADC和MD值对ER有统计学意义(P<0.05),而MK值对不同乳腺癌Ki-67高、低表达分组间的统计差异P=0.055,相较ADC、MD值已非常接近于0.05。ADC、MD和MK值在PR、HER-2等其余乳腺癌相关预后因素分组中均无统计学意义(P>0.05)。结论DKI在术前评估浸润性乳腺癌的病理分级的价值有限,但在评估肿瘤增殖活性方面有一定帮助,为肿瘤的化疗方案的制定提供了更多的信息,它的价值仍有待进一步探究。
乳腺肿瘤;磁共振成像;病理学,临床
随着影像技术的不断发展,近几年MRI检查已成为评价乳腺疾病的一种较为有效的方法而被广泛应用于临床。它较传统影像检查具备较多优势,除了形态学分析外,其他MRI技术也在这个领域发挥着很大的作用,扩散加权成像(diffusion weighted MR imaging,DWI)等多种技术已用于临床研究。MR扩散峰度成像(diffusion kurtosis imaging,DKI)是一种检测活体组织内非正态分布水分子扩散的磁共振成像新技术,与单指数DWI相比,DKI能更客观地反映活体内水分子的扩散情况。DKI技术最早是Jensen教授在2005年正式提出,后经中国香港大学吴学奎教授团队发展和完善[1]。本研究旨在探究DKI在浸润性乳腺癌分级中的应用及与雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2 (human epidermal growth factor receptor 2,HER-2)及细胞增殖抗原标记物Ki-67 (antigen identified by monoclonal antibody Ki-67,Ki-67) 四种免疫组化指标的相关性。
1 材料与方法
1.1 临床资料
搜集2014年8月至2016年11月在我院经病理及临床确诊为浸润性乳腺癌的患者53例,均为手术病理或穿刺活检病理证实为原发性浸润性乳腺癌,且在MRI检查前未经任何治疗。其中男性1例,浸润性导管癌2级;女性52例,其中浸润性导管癌39例(73.6%),浸润性小叶癌8例(15.1%),黏液腺癌3例(5.7%)、浸润性乳头状癌1例(1.9%),腺样囊性癌1例(1.9%)。病理组织学分级:5例(9.4%)为1级,26例(49.1%)为2级,22例(41.5%)为3级。由于病理为1级的病例较少,将1级和2级合并为一组作统计分析。患者术前接受MRI常规检查及DKI扫描,术后对肿瘤标本进行HE染色和ER、PR、HER-2和Ki-67免疫组化指标染色,由2名资深病理科医师阅读。
1.2 图像采集与处理
采用3.0 T磁共振成像仪(Ingenia,Philips Medical Systems,Best,the Netherlands),采用乳腺表面相控阵线圈,患者去俯卧位头先进的体位,嘱患者扫描过程中保持不动,自由呼吸状态连续扫描,尽可能减少患者因呼吸、心跳等产生的伪影,有利于提高乳腺组织的信噪比,扫描范围包括双侧全部乳腺组织及腋窝软组织。扫描序列包括T1WI、T2WI、DWI、SPAIR、DCE和DKI。MRI平扫序列参数:横轴面T1WI,TR 569 ms,TE 8 ms,FOV 280 mm×341 mm,矩阵512×512,层厚4 mm,层距 0 mm;横轴面T2WI,TR 3655 ms,TE 120 ms,FOV 280 mm ×341 mm,矩阵=432×432,层厚4 mm,层距0 mm;横轴面T2WI/SPAIR:TR 2951 ms,TE 60 ms,FOV 180 mm×262 mm,矩阵512×512,层厚4 mm,层距0 mm;DKI采用脂肪抑制单次激发自旋回波EPI序列,并在x、y、z轴三个方向上施加扩散敏感梯度脉冲。具体扫描参数:TR 2681 ms,TE 82 ms,FOV 230 mm× 240 mm,层厚5 mm,层距1 mm,层数18,重建矩阵224×224,NEX为2,Sense factor为2,b值=0、800、1000、1500、2000和2500 s/mm2,空间分辨率1.25 cm×1.25 cm× 3 cm;增强扫描Thrive:TR 4.5 ms,TE 2.2 ms,FOV 280 mm×340 mm,矩阵480×480,层厚3.33 mm,层距0.67 mm。对比剂采用钆喷酸葡胺注射液(Gd-DTPA),剂量0.2 mmol/kg,注射速率2.0 ml/s,注射后追加20 ml生理盐水冲洗注射管。增强扫描前先扫描蒙片,如果显影清晰则注射对比剂,注射15 s后开始扫描,扫描4个动态。
1.3 DWI及DKI数据的测量与分析
将所采集的DWI图像传输至磁共振工作站,采用Matlab 2011b软件中的扩散峰度模型拟合计算DKI参数图,包括D (corrected diffusion coeff i cient)图和K (excess diffusion kurtosis coefficient)图,并对DWI图像进行后处理得到ADC图。结合动态增强(dynamic contrast enhanced,DCE)图像,在肿瘤病灶实性成分处勾画感兴趣区(region of interest,ROI),尽量避开液化坏死区,每个感兴趣区的DWI和DKI参数重复测量两次,取其平均值,全部测量层面肿瘤的ADC、平均扩散率(mean diffusion,MD)、扩散峰度平均值(mean kurtosis,MK)均值作为该病灶最终值。
1.4 肿瘤ER、PR、HER-2和Ki-67表达的病理检测
所有标本进行固化、切片,HE染色,观察组织和细胞的形态,采用免疫组化法检测ER、PR、HER-2和Ki-67标志物的表达情况。免疫组织化学染色采用PS法,阳性染色细胞呈棕褐色或棕黄色,ER/PR>1%即评价为激素受体阳性,Her2表达记为阴性、(+)、(++)、(+++)、(++++),其中(+++)、(++++)记为阳性,如表达为(++),则加做Fish,如基因扩增记为阳性,不扩增则记为阴性。Ki-67表达阳性表现为细胞核区域免疫物质染色,随机选取10个高倍镜视野,计算其异常表达的阳性细胞数百分率。
1.4.1 乳腺癌Ki-67的界限值争议
2011年St.Gallen早期乳腺癌国际专家共识曾提出将14%作为Ki-67阳性指数高低的界限值引起广泛争议[2]。有关14%的界限值实际上只来源于一项研究结果[3],后续也没有更多的研究予以支持。2013年St.Gallen共识中,大部分专家同意采用20%作为Ki-67阳性指数的界限值[4]。2015年的St.Gallen大会上,更多的专家表示接受20%~29%之间的数值作为界限值来区分腔面A型和腔面B型[5]。因此笔者应用最新的Ki-67界限值进行分组,由于病理报告中Ki-67都是百分整数,所以本研究中≤20%认为是低表达,>20%认为是高表达。
1.5 统计学分析
所有数据用均数±标准差表示,利用Graphpad prism 5.0.1统计学软件进行分析处理:应用Mann-Whitney U检验方法,比较两组不同级别间浸润性乳腺癌DWI、DKI参数的差异;比较ADC、MD、MK参数与ER、PR、HER-2及Ki-67表达水平的相关性。P<0.05为差异具有统计学意义。
2 结果
53例纳入本研究的患者分为两组,1~2级的浸润性乳腺癌患者31例(其中1级5例,2级26例),3级的患者22例,相应的ADC、MD和MK值见表1所示。ADC、MD和MK值在不同级别浸润性乳腺癌之间没有统计学意义P>0.05),在不同表达水平的ER、PR、HER-2及Ki-67统计学中发现,仅仅ADC和MD值对ER有统计学意义(P<0.05),而MK值对不同乳腺癌Ki-67高、低表达分组间的P=0.055,相较ADC、MD值已非常接近于0.05。ADC、MD和MK值在PR、HER-2等其余乳腺癌相关预后因素分组中均无统计学意义(P>0.05) (图1)。
3 讨论
3.1 扩散模型
在乳腺癌中,DWI已被广泛用于病变的诊断、预后、疗效监测以及复发和转移等方面的评价[6-7]。ADC是根据DWI信号S测算出来的最常用的定量指标,可通过单指数模型拟合得到下式:
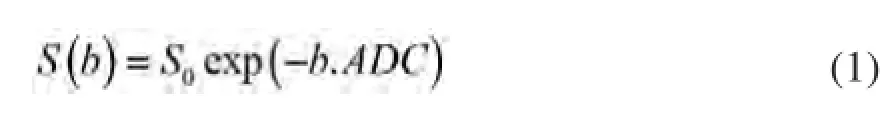
然而有研究报道,在乳腺癌中DWI信号随b值的衰减并不满足单指数曲线,更为复杂的模型可能更能表达这种非高斯弥散形式,进而提供病灶更多的信息。较为常见、且被很多研究证实的非高斯模型有:拉伸指数模型、扩散峰度模型和双指数模型[8-9]。本研究中笔者使用的是扩散峰度模型,其主要公式如下:
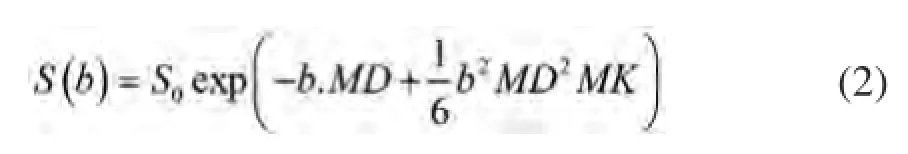
MK是DKI技术最关键的参数,代表空间各梯度方向的扩散峰度平均值[1],是衡量组织结构复杂程度的指标,是无单位参数,MK值与组织复杂程度呈正比,结构越复杂, MK值也越大[10-11]。MD代表经非高斯分布校正过的表观扩散系数值。这项技术于2005年由Jensen等[12]首先提出。其理论基础是在活体状态下,大多数生物组织结构复杂,水分子的运动因细胞间结构、细胞内外受限程度、细胞膜的渗透性及游离、结合水的物理化学特性而表现复杂。
3.2 ADC、MD、MK值在浸润性乳腺癌分级中的价值
本研究显示ADC、MD和MK值在鉴别浸润性乳腺癌不同病理分级中无统计学意义,无论是DWI还是DKI序列都很难直接评估浸润性乳腺癌肿瘤细胞的分化程度。ADC、MD和MK值三种参数从根本上来说均体现出癌组织细胞内外水分子的扩散运动状况,而细胞内外水分子的扩散运动状况受包括细胞核、细胞器的改变、核浆比、细胞密度、细胞内外水分子的比例等多种因素影响[13-14],随着病理级别的增高,肿瘤内部含有更复杂的细胞结构,更多的新生血管及坏死结构[15],导致水分子运动明显受限,并偏离高斯分布。DKI以在中枢神经系统的应用较多,有研究表明MK值随胶质瘤级别的增高而增大[10]。腹部则在对前列腺外周带良恶性病变的鉴别方面,以及肿瘤分化程度的评价方面,MK值显示了很高的敏感性[16]。DKI在乳腺疾病方面相关研究较少,Nogueira等[17]对传统DWI和DKI在乳腺良恶性病变的鉴别诊断进行了评估,发现ADC值、MK 值及MD值在良恶性病变中有显著差异,良性病变的ADC值及MD值较恶性病变高,恶性病变的MK值较良性为高,提示乳腺病变的弥散呈非高斯分布,MK值可以用来鉴别乳腺的良恶性病变。Wu等[18]在用DKI研究乳腺肿瘤特征的应用中也得出了类似结论,并且认为MK值诊断恶性病变的效能大于MD值。而在乳腺癌肿瘤分级及与预后因素的相关性方面仅Sun等[19]认为,DKI在鉴别乳腺病变良恶性方面较DWI具有更高特异性,3级乳腺癌伴随Ki-67高表达表现为高峰度系数和低扩散系数。既往运用于中枢神经系统和腹部肿瘤的研究结果[10-11,16]多提示MD和MK描述组织扩散信息更精确,肿瘤恶性程度越高,分化程度越低,肿瘤结构越复杂,则MD值越低,MK值越高。本研究与之不符,可能与本组入组病例中不同组织学分级的浸润性乳腺癌病例欠均衡有关,如1级的病例相对较少,有待于将来继续扩大样本量、细化病理分级类型作进一步研究。但既往也有研究表明,浸润性乳腺癌不同病理分级与ADC值无相关性[20-22],与本组结果一致,因为ADC与肿瘤的细胞结构是有相关性的,但尚未证明肿瘤细胞结构与组织学分级有关,可能与肿瘤标本的病理取材和笔者所测ROI区域是否一致有关,同理,MD和MK与病理学分级无相关性可能也有这方面原因。
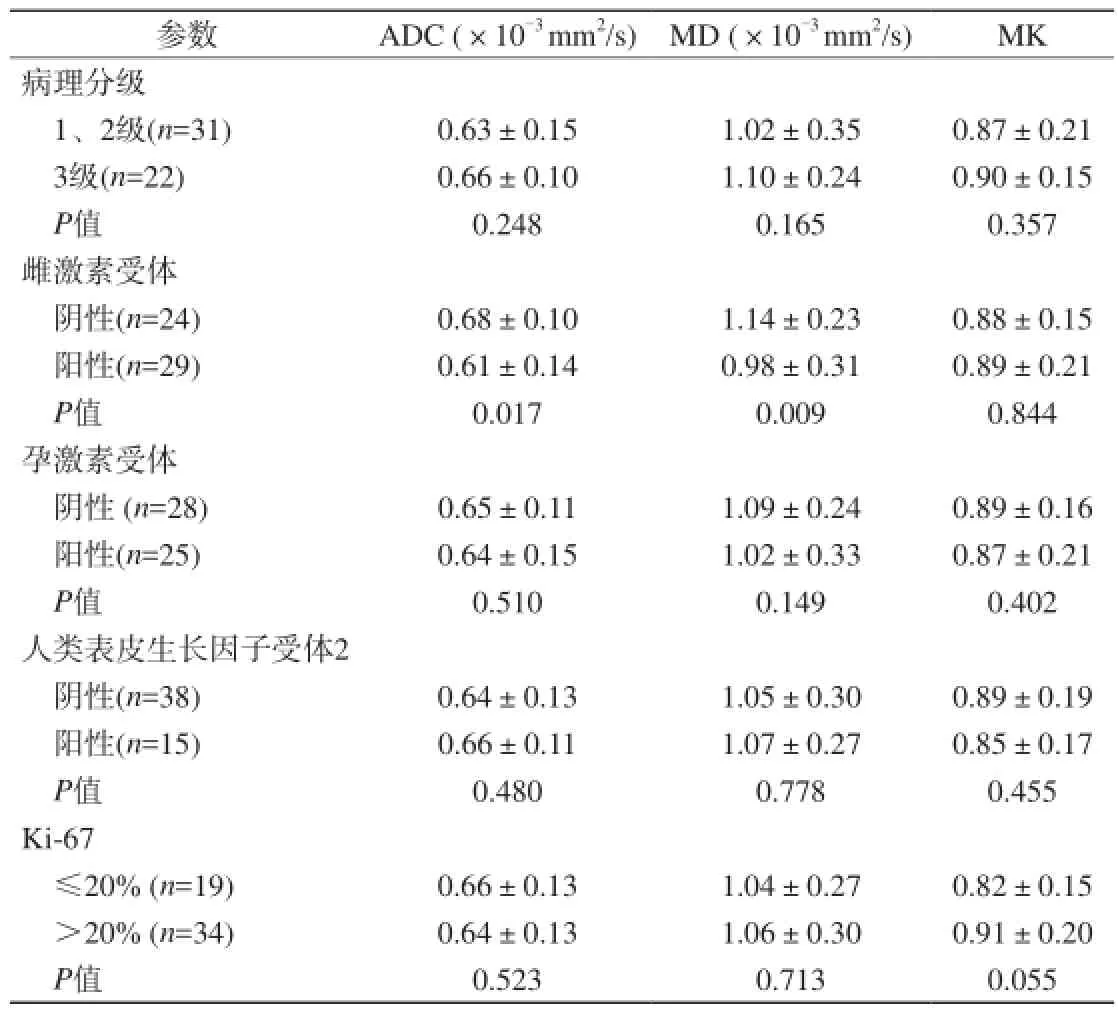
表1 浸润性乳腺癌ADC、MD、MK定量分析及与乳癌预后因素的比较Tab. 1 Comparison of clinicopathologic variables with ADC, MD, MK values
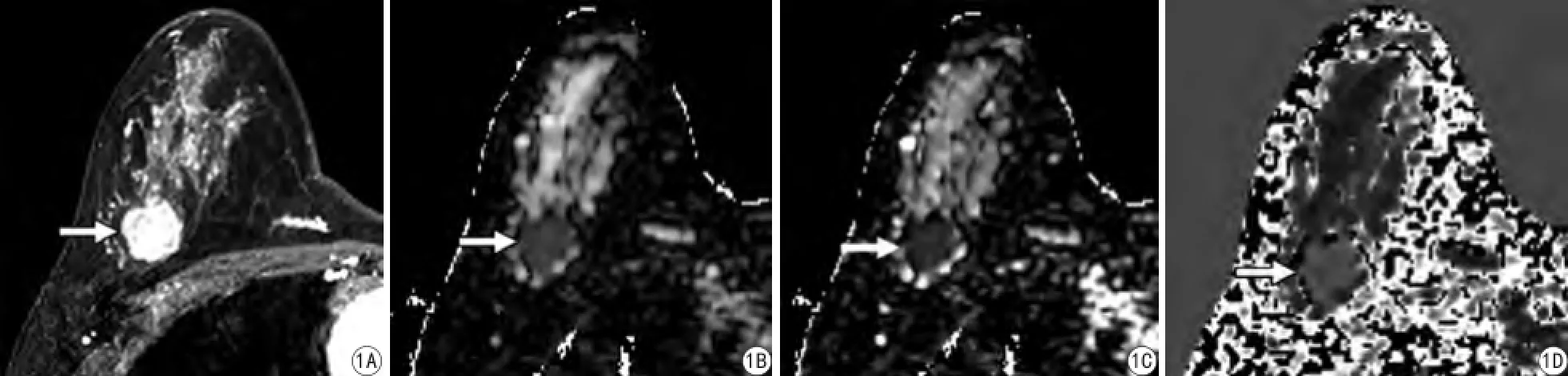
图1 患者女,29岁,右乳浸润性导管癌3级(箭),ER<1% (―),PR 30% (―),HER-2,0,Ki-67 80%。A:动态增强序列示右乳外上象限近胸壁一枚明显强化的结节。B、C:分别为ADC图和D图,病灶较周围腺体组织在ADC图上信号降低,而病灶在D图上信号更低(ADC值,0.555× 10-3mm2/s±0.14; MD值,0.856×10-3mm2/s±0.16)。D:为K图,病灶在K图上信号较周围组织增高(MK值,1.089±0.21)Fig. 1 Images in a 29-year-old woman show the breast cancer lesion in the right breast. The lesion near chest wall (arrow) is invasive ductal carcinoma grade 3 (estrogen receptor negative, <1%; progesterone receptor negative, 30%; HER-2, 0. Ki-67 positive, 80%). A: Axial DCE image shows the irregular obviously enhanced lesions. B, C: ADC and diffusivity maps, respectively, show decreased signal intensity compared with surrounding glandular tissue. Signal intensity on diffusivity map is lower than that on ADC map (ADC, 0.555×10-3mm2/s ± 0.14, diffusivity, 0.856×10-3mm2/s ± 0.16). D: Kurtosis map shows increased signal intensity compared with surrounding glandular tissue. (kurtosis, 1.089 ± 0.21).
3.3 ADC、MD、MK值与浸润性乳腺癌预后因素的相关性研究
目前认为乳腺癌肿瘤组织学类型和 ER、PR、HER-2、Ki-67等癌基因表达情况在一定程度上从不同角度反映了乳腺癌的生物学行为及患者的预后[23]。ER和PR是乳腺癌患者的常规检查指标,乳腺是性激素依赖器官,其生长、发育和细胞的增殖均受雌、孕激素的调控。如果 ER、PR 阳性表达率越低说明乳腺癌分化程度越低,恶性程度高,对化疗敏感度越低,预后越差。本组研究表明,ADC、MD值与ER的表达有相关性,而MK与之无明显相关。可能是因为ER抑制病灶血管生成导致血管灌注减少,也可能与ER阳性肿瘤细胞密度大有关。另外ADC、MD、MK值在PR、HER-2的表达中无明显差异,与部分研究结果相符[19,24],可能与本研究病例数少、纳入标准严格及病理类型单一有关,这方面有待于进一步研究。
本组结果显示,MK值对乳腺癌Ki-67高、低表达分组间的P值较ADC和MD值的已非常接近于0.05,因此笔者可以推断MK值与Ki-67表达的相关性较ADC和MD值强。由于本研究选用了最新的2015年St. Gallen大会上大部分专家的共识,以20%~29%之间的数值作为Ki-67高、低表达界限值,所以可能结果与既往研究有所不同[19]。已有研究证明Ki-67高表达与高复发风险和较差的患者生存率有关[25],且对预测患者的化疗反应性有一定价值。随着乳腺癌级别的增高而增高,肿瘤Ki-67表达越高,瘤内微观结构越复杂,MK值越大。因此DKI参数与Ki-67的表达的相关性研究显得很有必要。
本研究的局限性:(1)乳腺癌是具有高度特异性生物学行为的恶性肿瘤,不同区域的癌细胞密集程度、分化程度差异较大,因此,对DWI和DKI各指标感兴趣区的选定与病理组织取材存在一定差异。(2)本研究样本中,特殊类型乳腺癌和浸润性乳腺癌1级的病例数相对较少,故对不同病理类型、不同级别的乳腺癌预后分析结果可能会存在一定偏差,需在今后的研究中扩大病例数,按照不同病理类型、多个级别乳腺癌进行细化分组分析。
本研究表明DKI在术前评估浸润性乳腺癌的病理分级方面的价值有限,但在预测浸润性乳腺癌增殖活性方面有一定帮助,为肿瘤化疗方案的制定提供了更多的信息,它的价值仍有待进一步探究。
[References]
[1] Hui ES, Cheung MM, Qi L, et al. Towards better MR characterization of neural tissues using directional diffusion kurtosis analysis. Neuroimage, 2008, 42(1): 122-134.
[2] Goldhirsch A, Wood WC, Coates AS, et al. Strategies for subtypes: dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol, 2011, 22 (8): 1736-1747.
[3] Cheang MC, Chia SK, Voduc D, et al. Ki-67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst, 2009, 101(10): 736-750.
[4] Goldhirseh A, Winer EP, Coates AS, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy ofEarly Breast Cancer 2013. Ann Oncol, 2013, 24(9): 2206-2223.
[5] Klauschen F, Wienert S, Schmitt WD, et al. Standardized Ki-67 diagnostics using automated scoring-clinical validation in the GeparTrio breast cancer study. Clin Cancer Res, 2015, 21 (16): 3651-3657.
[6] Inoue K, Kozawa E, Mizukoshi W, et al. Usefulness of diffusionweighted imaging of breast tumors: quantitative and visual assessment. Jpn J Radiol, 2011, 29(6): 429-436.
[7] Rinaldi P, Giuliani M, Belli P, et al. DWI in breast MRI: role of ADC value to determine diagnosis between recurrent tumor and surgical scar in operated patients. Eur J Radiol, 2010, 75(2): e114-e123.
[8] Panek R, Borri M, Orton M, et al. Evaluation of diffusion models in breast cancer. Med Physics, 2015, 42(8): 4833-4839.
[9] Suo S, Lin N, Wang H, et al. Intravoxel incoherent motion diffusionweighted MR imaging of breast cancer at 3.0 tesla: comparison of different curve-f i tting methods. J Magn Reson Imaging, 2015, 42(2): 362-370.
[10] Raab P, Hattingen E, Franz K, et al. Cerebral gliomas: diffusional kurtosis imaging analysis of microstructural differences. Radiology, 2010, 254(3): 876-881.
[11] Wu EX, Cheng MM. MR diffusion Kurtosis imaging for neural tissue characterization. NMR Biomed, 2010, 23(7): 836-848.
[12] Jensen JH, Helpern JA. Ramani A, et al. diffusion kurtosis imaing: the quantification of non-Gaussian water diffusion by means of magnetic resonance imaging. Magn Reson Med, 2005, 53(6): 1432-1440.
[13] Motoshima S, Irie H, Nakazono T, et al. Diffusion-weighted MR imaging in gynecologic cancers. J Gynecol Oncol, 2011, 22(4): 275-287.
[14] Woodhams R, Kakita S, Hata H, et al. Diffusion-weighted imaging of mucinous carcinoma of the breast: evaluation of apparent diffusion coeff i cient and signal intensity in correlation with histologic fi ndings. AJR Am J Roentgenol, 2009, 193(1): 260-266.
[15] Basser PJ, Pierpaoli C. Microstructural and physiological features of tissues elucidated by quantitative-diffusion-tensor MRI.1996. J Magn Reson, 2011, 213(2): 560-570.
[16] Rosenkrantz AB, Sigmund EE, Johnson G, et al. Prostate cancer: feasibility and preliminary experience of a diffusional kurtosis model for detection and assessment of aggressiveness of peripheral zone cancer. Radiology, 2012, 264(1): 126-135.
[17] Nogueira L, Brandão S, Matos E, et al. Application of the diffusion kurtosis model for the study of breast lesions. Eur Radiol, 2014, 24(6): 1197-1203.
[18] Wu D, Li G, Zhang J, et al. Characterization of breast tumors using diffusion kurtosis imaging (DKI). Plos One, 2014, 9(11): e113240.
[19] Sun K, Chen X, Chai W, et al. Breast cancer: diffusion kurtosis MR imaging-diagnostic accuracy and correlation with clinical-pathologic factors. Radiology, 2015, 277(1): 46-55.
[20] Park SH, Choi HY, Hahn SY. Correlations between apparent diffusion coefficient values of invasive ductal carcinoma and pathologic factors on diffusion-weighted MRI at 3.0 Tesla. J Magn Reson Imaging. 2015,41(1): 175-182.
[21] Jeh SK, Kim SH, Kim HS, et al. Correlation of the apparent diffusion coeff i cient value and dynamic magnetic resonance imaging fi ndings with prognostic factors in invasive ductal carcinoma. J Magn Reson Imaging, 2011, 33(1): 102-109.
[22] Choi SY, Chang YW, Park HJ, et al. Correlation of the apparent diffusion coefficiency values on diffusion-weighted imaging with prognostic factors for breast cancer. Br J Radiol, 2012, 85(1016): e474-e479.
[23] Fuckar D, Dekanic A, Stifter S, et al. VEGF expression is associated with negative estrogen receptor status in patients with breast cancer. Int J Surg Pathol, 2006, 14(1): 49-55.
[24] Kim SH, Cha ES, Kim HS, et al. Diffusion-weighted imaging of breast cancer: correlation of the apparent diffusion coefficient value with prognostic factors. J Magn Reson Imaging, 2009, 30(3): 615-620.
[25] de Azambuja E, Cardoso F, de Castro G, et al. Ki-67 as prognostic marker in early breast cancer: a meta-analysis of published studieds involving 12, 155 patients. Br J Cancer, 2007, 96(10): 1504-1503.
The study on the application value of DKI in the classif i cation of invasive breast carcinoma and its correlation with prognostic factors
CHENG Fang, SUO Shi-teng, KANG Ji-wen, HUA Xiao-lan, GENG Xiao-chuan, ZHANG Ke-bei, ZHANG Qing, HUA Jia*
Department of Radiology, Renji Hospital, School of Medicine, Shanghai Jiao Tong University, Shanghai 200127, China
*Correspondence to: Hua J, E-mail: Jill_huajia@163.com
Objective:To evaluate the application value of diffusion kurtosis imaging (DKI) based MD, MK parameters in grading invasive breast carcinoma and compare their diagnostic potential.Materials and Methods:Collecting 53 patients with invasive breast carcinoma diagnosed by pathological examination in this study. One male patient and 52 female patients were included. All patients underwent breast magnetic resonance imaging, including traditional magnetic resonance imaging and diffusion kurtosis imaging. ADC, MK and MD were calculated by using post-processing software, Matlab 2011b. Compared with histological grade, the classif i cation of invasive breast carcinoma and its correlation with prognostic factors were statistically analyzed.Results:ADC, MD and MK values have no signif i cant difference in well, moderately and poorly differentiated invasive breast carcinoma (P>0.05). Only ADC and MD were significantly different in ER expression (P<0.05). ADC, MD and MK values showed no significant difference in PR, HER-2 and Ki-67 expression (P>0.05,P=0.055 with MK in Ki-67).Conclusions:DKI has limited value in the evaluation on the classification of invasive breast carcinoma. However it provides useful information in the assessment of tumor proliferation activity.
Breast neoplasms; Magnetic resonance imaging; Pathology, clinical
上海交通大学医工交叉基金重点项目(编号:YG2014ZD05)
上海交通大学医学院附属仁济医院放射科,上海 200126
华佳,E-mail:Jill_huajia@163.com
2016-12-16
接受日期:2017-01-20
R445.2;R737.9
A
10.12015/issn.1674-8034.2017.03.002
成芳, 所世腾, 康记文, 等. MR扩散峰度成像在浸润性乳腺癌分级及与预后因素的相关性应用研究. 磁共振成像, 2017, 8(3): 164-169.
Received 16 Dec 2016, Accepted 20 Jan 2017
ACKNOWLEDGMENTSThis study was funded by the Multidisciplinary Crossprogram Development Fund Project (No. YG2014ZD05).
