含酯基Gemini表面活性剂在有机醇-水体系中的胶束热力学及聚集行为
2017-05-12张婷沈杰
张 婷 沈 杰
含酯基Gemini表面活性剂在有机醇-水体系中的胶束热力学及聚集行为
张 婷*沈 杰
(安徽科技学院化学与材料工程学院,安徽凤阳233100)
采用电导法研究了不同温度下含酯基Gemini表面活性剂在纯水和在质量分数为10%的甲醇-水(MAWR),乙二醇-水(EG-WR),丙三醇-水(GL-WR)四种体系中的集聚行为和胶束热力学;聚集行为参数包括临界胶束浓度(cmc)和抗衡离子的解离程度(α)以及胶束的热力学参数,包括标准吉布斯自由能吉布斯迁移自由能吉布斯烷基链胶束化自由能标准焓变和标准熵变均被计算和讨论。研究表明在所有的研究体系中,cmc值随着疏水链的增加而减小,随着加入的醇结构中羟基数目的增加而增大,随温度的升高先变小,后变大呈U字形;胶束化过程都是自发进行的,并且在293.15 K下,胶束化过程是吸热的,在293.15 K上,胶束化过程是放热的;通过稳态荧光光谱法研究了表面活性剂在纯水、有机醇-水混合溶液中的微极性,结果表明,在相同溶剂中,随着烷基链长度的增加,溶液微环境的疏水性越强;对于相同的Gemini表面活性剂,随着加入含羟基数目越多的醇,其微环境的疏水性越强。并研究了Gemini表面活性剂在混合体系中形成胶束过程的焓-熵补偿曲线。
Gemini表面活性剂;电导法;醇-水混合溶液;热力学参数
1 引言
Gemini表面活性剂作为新一代表面活性剂,是由间隔基团连接两个疏水链和两个极性头基所组成的化合物。由于特殊的分子结构,使其与传统的单子表面活性剂相比,具有诸多的优良性能,如:较低的临界胶束浓度(cmc),较高的表面活性,良好的乳化性能和聚集行为等1-5。Gemini表面活性剂目前已广泛应用于基因传输6,7、药物靶向技术8、新材料的制备以及分子自组装技术等领域9,10。
Gemini表面活性剂具有诸多的优良性能,主要是由于其在水溶液中形成胶束而引起的。近年来,研究工作者不断地关注不同类型的有机溶剂对Gemini表面活性剂在水相中形成胶束以及胶束聚集行为的影响11-14。Koya等11采用电导法和稳态荧光光谱法研究了Gemini表面活性剂分子在不同体积分数的1,4-二氧六环-水混合溶剂中的胶束行为,研究表明随着1,4-二氧六环体积分数的增加,越不利于胶束的形成,同时形成的胶束聚集数越少,体系的疏水性微环境越强;Saha等12研究了不同温度下,一系列Gemini表面活性剂在纯水和在不同有机共溶剂中的聚集行为和胶束热力学,结果显示随着有机溶剂极性的增加,表面活性剂的胶束化过程就会越滞后,而相比于1,4-二氧六环-水的混合体系,表面活性剂在乙醇-水的混合体系所形成的胶束结构更稳定;同年,朱海林等13也分别采用1,4-二氧六环-水和乙醇-水的混合体系,研究了Gemini表面活性剂在这两种体系中的胶束行为,发现随着有机共溶剂的加入,Gemini表面活性剂的cmc值、吉布斯迁移自由能、胶束化吉布斯自由能都有明显的提高,而表面活性剂在乙醇-水的混合体系比在1,4-二氧六环-水体系中更容易形成胶束;近期,朱海林等14又采用电导法研究了乙二醇对于阳离子Gemini表面活性剂聚集行为的影响,研究表明乙二醇的加入对表面活性剂的聚集行为参数和热力学参数有着非常显著的影响,并且具有较长的疏水链和连接基团的Gemini表面活性剂更容易形成胶束。此外,还有很多研究组报道了DMF、DMSO、乙腈15,16等各种有机溶剂对不同类型的表面活性剂分子在混合体系中胶束化过程的影响。可见,有机助溶剂的加入对于Gemini表面活性剂的聚集行为起着关键性的作用。但是,到目前为止,关于含有不同数目羟基的醇对Gemini表面活性剂聚集的影响还没有得到系统的研究。
基于以上的研究背景,本工作选用羟基数目不同的甲醇、乙二醇和丙三醇与水进行混合,研究不同类型的醇对Gemini表面活性剂在醇-水混合溶剂中形成胶束和胶束集聚行为的影响,以期望能进一步扩大Gemini表面活性剂在有机共溶剂混合体系中的应用范围。本文合成了一系列水溶性较好,含有酯基且疏水链不同的Gemini表面活性剂(Gemini A,Gemini B,Gemini C),具体结构如图1所示。研究了不同温度下,这些表面活性剂在纯水和在质量分数为10%的甲醇、乙二醇和丙三醇水溶液中的胶束化过程和聚集行为,并通过公式计算了不同混合体系形成胶束的热力学参数,推导出不同结构的醇对胶束化过程的影响,从而有利于进一步实现调控表面活性剂的胶束化过程和聚集行为;利用焓变和熵变补偿曲线计算出不同温度下,三种表面活性剂在不同研究体系中的化学部分焓变和温度补偿,有助于进一步解释表面活性剂分子结构中疏水链长度对其胶束化过程的影响。
2 实验部分
2.1 试剂和样品
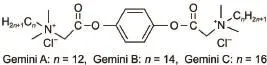
图1 Gemini表面活性剂的分子结构式Fig.1 Chemical structures for the gemini surfactants
甲醇、乙二醇和丙三醇,纯度均≥99.5%,是从阿法埃莎(Alfa Aesar,中国)化学有限公司购买。含酯基的Gemini表面活性剂的合成和纯化是参考相关文献中的方法14。最终产物均通过红外、氢核磁和元素分析的鉴定,具体数据见Supporting Information。所有测试中使用的水均为超纯水(18.2 MΩ·cm)。
2.2 电导率实验
采用超纯水和10%不同醇-水混合体系配制不同浓度的Gemini表面活性剂溶液。在不同温度下,用电导率测定仪(Mettler toledo S320,瑞士梅特勒-托利多公司,配电极,电极用电导率为1413 μS·cm-1,标准的KCl溶液校正)测定不同浓度的Gemini表面活性剂溶液的电导率(κ)。在实验过程中待测溶液放置恒温槽(THD 0506,宁波天恒仪器厂,温度精确到±0.01°C)中确保每个样品能维持在待测的温度。通过电导率(κ)与溶液的浓度(c)作图,求出三种Gemini表面活性剂在不同温度下,不同混合体系中的cmc值。
2.3 荧光光谱实验
以甲醇为溶剂配制1.0×10-3mol·L-1芘的甲醇溶液,用移液枪移取50 μL 1.0×10-3mol·L-1芘的甲醇溶液于50 mL的容量瓶中,用氮气吹干备用,在含有微量芘的50 mL容量瓶中分别加入水、10%甲醇-水、10%乙二醇-水和10%丙三醇-水配制不同浓度的Gemini表面活性剂溶液,然后超声2 h,静止24 h,用荧光光谱仪(Hitachi F4600,日本日立公司)测定Gemini表面活性剂溶液在298.15 K时,10%不同醇-水体系中芘的荧光光谱。仪器的激发波长设置在365 nm,扫描波长范围为345-460 nm,激发狭缝和发射狭缝分别为5.0和2.5 nm,扫描速率为500 nm·min-1。芘用做荧光探针来探究表面活性剂溶液的微极性和聚集行为,在水溶液中芘的荧光光谱有五个发射峰,其中峰1(在373 nm附近)的荧光强度I1和峰3(在384 nm附近)的荧光强度I3的比值(I1/I3)被用来衡量表面活性剂溶液的微极性。
3 结果与讨论
3.1 cmc和抗衡离子的解离程度(α)离子的测定
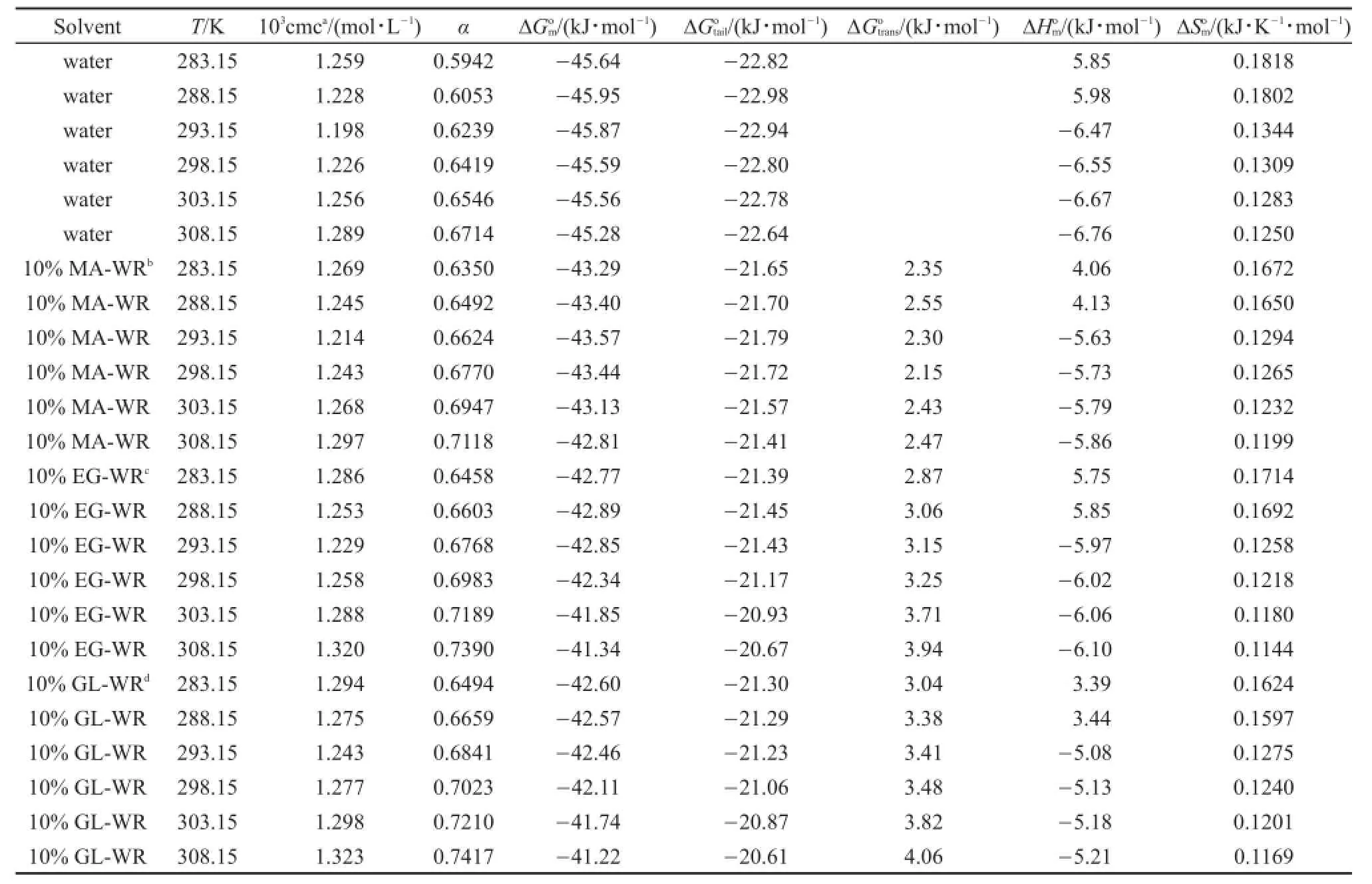
在不同的温度下(283.15,288.15,293.15,298.15,303.15和308.15 K),通过电导率法研究了Gemini表面活性剂(Gemini A,Gemini B,Gemini C)在纯水和在质量分数为10%的甲醇,乙二醇和丙三醇水溶液中的cmc和α值。表1,表S1和表S2(Supporting Information)分别列出了表面活性剂Gemini A、Gemini B和Gemini C在纯水、10%甲醇-水、10%乙二醇-水和10%丙三醇-水混合溶剂中的胶束行为参数。通过测量电导率的数值,采用Carpena方法17计算所有研究体系的cmc和α值,该方法是基于拟合原始实验数据得到非线性方程,再直接对玻耳兹曼s型函数积分得到。玻耳兹曼s型方程如公式(1)所示:
aSD=±0.003;b10%methyl alcohol-water(10%MA-WR);c10%ethylene glycol-water(10%EG-WR);d10%glycerol-water(10%GL-WR)
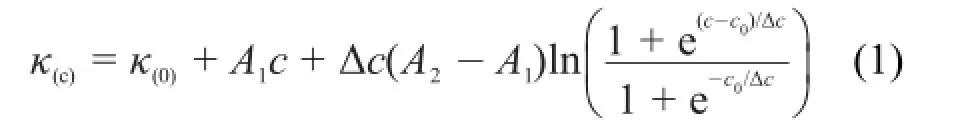
公式(1)中,κ(0)、A1、A2和Δc分别代表纯水的电导率、形成胶束前直线方程的斜率、形成胶束后直线方程的斜率和形成胶束前后溶液的浓度差。两条直线的交点浓度(c0)被认为是cmc值,α为A2/A1的比值。通过Carpena方法处理后,以Gemini A为例,给出它在298.15 K时,10%甲醇-水混合溶液中的电导率与浓度的变化曲线图如图2所示。
从表1,表S1和表S2可以得出,在温度为298.15 K时,Gemini A、Gemini B和Gemini C在纯水中的cmc值分别为1.226、0.3048和0.0690 mmol·L-1,在相同温度下,相同的混合体系中Gemini表面活性剂的cmc值随着烷基链长度的增加而变小,意味着烷基链越长的表面活剂更容易在水中形成胶束。此外,在纯水体系中疏水链每增加两个亚甲基,其cmc值下降4-5倍,而在醇-水混合体系中疏水链的增加对cmc值的影响程度比在纯水中小,主要是因为在醇-水混合体系中由于醇的加入有利于烷基链较长的表面活性剂分子的溶解,导致表面活性剂分子在醇-水体系中的溶剂疏水性降低从而不利于胶束的形成。
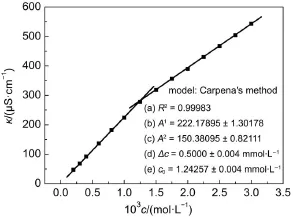
图2 298.15 K时,GeminiA在10%甲醇-水混合溶液中电导率(κ)与浓度(c)的曲线图Fig.2 Plot of specific conductivity(κ)versus the various concentration(c)of GeminiAin 10%MA-WR at 298.15 K
3.2 10%不同醇-水体系对cmc和α值的影响
从表1中可以得到,在相同的温度下,Gemini A的cmc值按照纯水〈10%甲醇-水〈10%乙二醇-水〈10%丙三醇-水顺序逐渐变大,Gemini A的cmc值随着加入的醇结构中羟基数目增加而变大,从而不利于胶束的形成。显然,10%不同结构的醇对Gemini表面活性剂形成胶束和集聚行为有明显的影响,对于Gemini B和Gemini C也得到相似的现象和结论。出现上述现象的主要原因是由于含羟基数目较少的醇其介电常数(ε)也较低,使得Gemini表面活性剂两个亲水性离子型头基的溶剂化作用被降低的少,两个离子型头基之间相互排斥的库伦力增大,因此,与介电常数较大的醇相比更容易形成胶束18-21。因为甲醇的介电常数〈乙二醇〈丙三醇,所以混合体系的cmc值大小按照10%甲醇-水〈10%乙二醇-水〈10%丙三醇-水排序。
3.3 温度对cmc和α值的影响
温度是影响表面活性剂cmc和α值的一个重要因素,从图3,图S1和图S2中可以看出,在相同的研究体系中,表面活性剂Gemini A,Gemini B和Gemini C的cmc值随着温度的升高先减小(283.15到288.15 K)后增大(293.15到308.15 K),呈U字型,在温度为293.15 K时达到最低值,而α值随温度的升高一直增大,这主要是由于表面活性剂形成胶束的过程受到了两种相互竞争行为的影响。首先,随着体系温度的升高,表面活性剂分子中亲水基团的水化程度降低,有利于形成胶束;同时,温度的升高,也会导致表面活性剂分子中疏水结构周围的团簇遭到破坏,这将不利于胶束化过程22,23。因此,在较低的温度时,下降的亲水作用占主导因素,导致cmc值的降低,有利于形成胶束;在较高温度时,下降的疏水作用占主导因素导致cmc值的升高,不利于胶束的形成,使得表面活性剂的cmc值随温度的升高出现了先降低后增大的现象。另外,在293.15 K以上,温度越高,溶剂的介电常数变得越低,Gemini表面活性剂的离子型头基之间的排斥力增加,所以从溶液的介电常数方面来解释,升高温度也是不利于胶束化过程20。
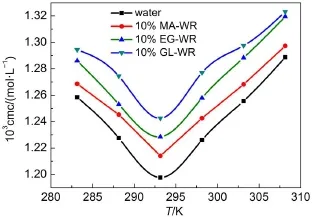
图3 在不同研究体系中GeminiA的cmc值随温度(T)的变化曲线图Fig.3 Variation of cmc as a function of temperature(T) for GeminiAin different systems
3.4 不同醇-水混合溶剂对Gemini表面活性剂溶液的微极性影响
芘常用做荧光探针来探究表面活性剂溶液的微极性和聚集行为,荧光探针发射光谱的强度和形状对溶解荧光发色基团溶液的微环境非常敏感24。当表面活性剂溶液的浓度超过cmc值时,溶液中表面活性剂分子会形成胶束,芘分子会进入到胶束的疏水核内部,导致芘的发射峰强度的比值(I1/I3)会突然下降,当下降到一定程度时,随着表面活性剂浓度的增大而变化很小。I1/I3的值较小时,意味着体系的微环境具有较高的疏水性24,25。
图4,图S3和图S4中给出了不同混合体系中I1/I3的值与Gemini表面活性剂浓度变化的曲线图。从图可以看出,表面活性剂在所有的研究体系中,I1/I3的值都随着Gemini表面活性剂浓度的增加先缓慢降低后突然下降,再到最后的基本保持不变,说明当Gemini表面活性剂浓度增加到cmc值时,研究体系的微环境发生了明显的改变,这主要是由于体系形成胶束所造成的。在相同的研究体系中,随着烷基链长度的增加,I1/I3的最小值变的越来越小,说明随着烷基链的增长,体系微环境的疏水性能逐渐降低,烷基链的长短对形成疏水的微环境有着很大的影响25,26。在其它10%醇-水混合溶液中也可以得到相似的结论。此外,对于相同的表面活性剂,I1/I3的最小值在纯水中比不同的混合溶剂中要小;在混合溶剂中,I1/I3的最小值按照10%甲醇-水>10%乙二醇-水>10%丙三醇-水排序,可能是因为丙三醇-水混合溶剂的极性>乙二醇-水>甲醇-水,使丙三醇-水分子能够渗透到胶核,而极性小的混合溶剂分子渗透不到胶束核内部,甚至渗透不到栅栏层,导致溶液的微极性疏水性下降的少,从而得到较大的I1/I3的值13,27;与纯水体系相比,醇-水混合体系的I1/I3值较大,是因为加入的醇是极性分子,使混合体系的微环境极性变大导致的。

图4 298.15 K时芘在不同研究体系中I1/I3的比值与GeminiA的浓度(c)变化曲线图Fig.4 Pyrene fluorescence intensity ratio I1/I3vs the concentrations(c)for GeminiAin different systems at 298.15 K
3.5 表面活性剂的胶束热力学性能
在不同温度下,从纯水和10%不同醇-水体系中获得的cmc和α值可以用来计算不同条件下Gemini表面活性剂的胶束热力学性能参数。Gemini表面活性剂形成胶束的标准吉布斯自由能由公式(2)得到12:
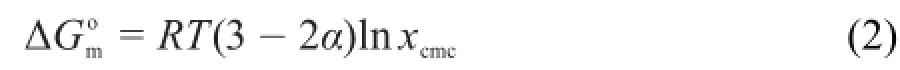
在公式(2)中xcmc是Gemini表面活性剂cmc值的摩尔分数,R是气体平衡常数,T是开尔文温度,xcmc= cmc/(cmc+溶剂的摩尔数)。同时,为了更清楚的解释混合溶剂对Gemini表面活性剂聚集行为的影响,更多的胶束热力学参数,如标准吉布斯迁移自由能和标准吉布斯烷基链胶束化自由能分别通过公式(3)和(4)被计算12,13。

Gemini表面活性剂在纯水、10%甲醇-水、10%乙二醇-水和10%丙三醇-水混合体系中形成胶束的标准焓变通过吉布斯-亥姆霍兹方程计算得到,如公式(5)所示:

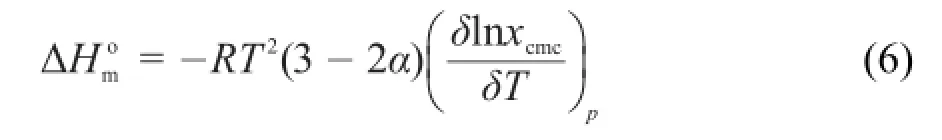
绘制不同研究体系中的lnxcmc值随温度变化的图形,图中直线的斜率是方程中dlnxcmc/dT的值。表1(GeminiA),表S1(Gemini B)和表S2(Gemini C)中列出了在不同温度下,不同研究体系中的值。从表中可以得到,从温度283.15到288.15 K,标准焓变值大于零意味着胶束化过程是吸热过程;从温度293.15到308.15 K形成胶束的标准焓变值小于零说明温度从293.15到308.15 K过程中形成胶束是放热过程;值的改变同混合溶液的极性以及表面活性剂烷基链的长度有关,随着烷基链长度的增加,值越来越负,意味着表面活性剂Gemini C形成胶束时放出的热量比Gemini A和Gemini B要多。同时,在所有的研究体系中,相同的表面活性剂的值,都随着温度的升高,先变大后变小。此外,形成胶束的标准熵变可以通过公式(7)计算得到。

从表1、表S1和表S2中可以看出,在所有的研究体系中形成胶束的值都是正值。在相同的混合体系中,值随着温度的升高而降低。从计算的数据来看,当温度在293.15 K以上时,对于不同的表面活性剂,在所有的研究体系中,随着温度的升高,值都是变的越来越负,而值越接近于零,所以随着温度的升高,焓变值对吉布斯自由能的贡献逐渐比熵变的贡献要大,此过程是焓驱动过程;但是,当温度在293.15 K以下时,形成胶束的值为负值主要是由于形成胶束的值较大所导致的,所以此时形成胶束的过程是熵驱动过程20。
3.6 烷基链长度对Gemini表面活性剂热力学参数的影响
从表1,表S1和表S2可以得出,在相同的温度和相同的研究体系中,对于不同的Gemini表面活性剂,总体来说,其和值随着表面活性剂烷基链长度的增加而逐渐变小;当温度在293.15 K以下时,Gemini表面活性剂在相同温度和相同的研究体系下的和值,随着其烷基长度的增加而增大;而在293.15 K以上时,则随烷基链长度的增加而减小,上述规律与文献中报道的含有不同长度烷基链的Gemini表面活性剂在
表2 293.15到308.15 K,GeminiA,Gemini B和Gemini C在各种混合溶剂中的化学部分的补偿焓变补偿温度(Tc)以及直线的相关系数(r)
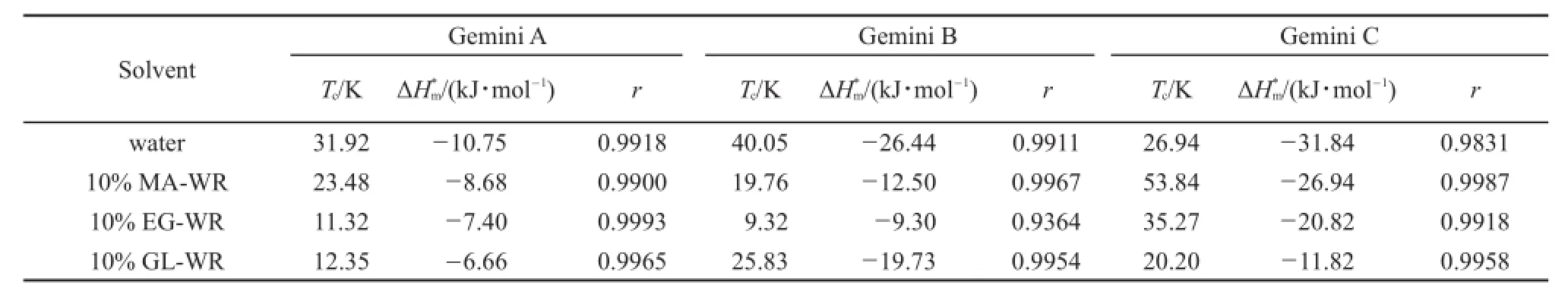
GeminiA Gemini B Gemini C Solvent Tc/K 31.92 23.48 11.32 12.35 ΔH*m/(kJ·mol-1)-10.75-8.68-7.40-6.66 r Tc/K 40.05 19.76 9.32 25.83 ΔH*m/(kJ·mol-1)-26.44-12.50-9.30-19.73 r ΔH*r water 10%MA-WR 10%EG-WR 10%GL-WR 0.9918 0.9900 0.9993 0.9965 0.9911 0.9967 0.9364 0.9954 Tc/K 26.94 53.84 35.27 20.20m/(kJ·mol-1)-31.84-26.94-20.82-11.82 0.9831 0.9987 0.9918 0.9958
Table 2 Chemical part of compensation enthalpycompensation temperature(Tc)and regression coefficient(r)values for GeminiA,Gemini B and Gemini C in all the mixed solvents within the temperature range of 293.15 to 308.15 K极性较低的混合溶剂中的规律是一致的12。但Gemini C在10%丙三醇-水中的和值相对于GeminiA和Gemini B,却出现了与上述规律恰好相反的现象。这主要是由于丙三醇的极性大于甲醇和乙二醇,同样10%丙三醇-水混合溶剂的极性也大于10%甲醇-水和10%乙二醇-水混合溶剂,而Gemini C的烷基链较长,易溶解在极性较大的混合溶剂中,从而导致Gemini C在10%丙三醇-水体系中形成胶束的能力比Gemini A和Gemini B要弱。
3.7 Gemini表面活性剂的胶束化过程的焓-熵补偿
为了进一步研究胶束聚集行为过程的焓熵补偿现象,Lumry和Rajender28提出了在混合溶剂中胶束化过程一般受到化学部分和溶剂部分两个因素的影响,一般在形成胶束过程中的和之间的补偿现象可以用公式(8)描述。


图5 293.15到308.15 K,GeminiA在各种混合溶剂中形成胶束过程的焓熵补偿曲线图Fig.5 Enthalpy-entropy compensation plots for the micellization of GeminiAin all the mixed solvents within the temperature range of 293.15 to 308.15 K
4 结论
研究了不同温度下,含有不同羟基数目的醇对含酯基Gemini表面活性剂胶束化过程及聚集行为的影响。发现对于相同的表面活性剂,加入的醇结构中含羟基数目越多,越不利于胶束的形成,cmc值变的越大;在同一种类型的醇-水溶液中,随着表面活性剂烷基链长度的增加,越有利于胶束的形成,导致cmc值随着烷基链长度的增加而下降;通过稳态荧光光谱法研究了表面活性剂在纯水和在10%不同醇-水混合溶液中的微极性,结果表明,在相同混合体系中,随着烷基链长度的增加,溶液的微环境具有较高的疏水性;而对于相同的Gemini表面活性剂,随着加入含羟基数目越多的醇,其微环境的疏水性越强。在所有的研究体系中,胶束化的吉布斯自由能都为负值,意味中胶束化过程都是自发进行的,并且随着烷基链长度的增加而变小,随着加入有机醇的羟基数目增加而增大;和cmc的值都随着温度的升高呈U字行;在293.15 K以下,,即胶束化过程是吸热的,在293.15 K以上,0,即胶束化过程是放热的。在形成胶束的过程中,存在焓-熵补偿现象,相应的数据变化趋势表明,焓-熵补偿曲线能够修饰混合溶剂中溶剂组分之间的相互作用。
Supporting Information: available free of charge via the internet at http://www.whxb.pku.edu.cn.
(2) Xu,D.Q.;Qi,B.H.;Fang,D.;Zhang,X.M.;Zhang,T.J.Surf. Deterg.2015,19,91.doi 10.1007/s11743-015-1752-0
(3) Xie,D.H.;Zhao,J.X.Langmuir 2013,29,545.doi:10.1021/ la304160s
(4) Menger,F.M.;Littau,C.A.J.Am.Chem.Soc.1991,115, 10083.doi:10.1021/ja00075a025
(5) Fan,Y.X.;Han,Y.C.;Wang,Y.L.Acta Phys.-Chim.Sin.2016, 32,214.[范雅珣,韩玉淳,王毅琳.物理化学学报,2016,32, 214]doi:10.3866/PKU.WHXB201511022
(6) Gregor,M.;Perrin,C.;Monck,M.;Camilleri,P.;Kirby,A.J.J. Am.Chem.Soc.2001,123,6215.doi:10.1021/ja005681c
(7) Camilleri,P.;Kermer,A.;Edwards,A.J.;Jennings,K.H.; Jenkins,O.;Marshall,I.;Magregor,C.;Neville,W.;Rice,S.Q.; Smith,R.J.;Wilkinson,M.J.;Kirby,A.J.Chem.Commun. 2000,14,1253.doi:10.1039/b001742f
(8) Miller,A.J.Angew.Chem.Int.Ed.1998,37,1768. doi:10.1002/anie.19980803
(9)He,S.;Chen,H.;Guo,Z.;Wang,B.;Tang,C.;Feng,Y.Colloids Surf.A:Physicochem.Eng.Aspects 2013,429,98.doi:10.1016/ j.colsurfa.2013.03.068
(10) Honda,K.;Morita,M.;Sakata,O.;Sasaki,S.;Takahara,A. Macromolecules 2010,43,454.doi:10.1021/ma901973t
(11) Koya,P.A.;Ismail,K.;Kabir,D.;Wagay,T.A.J.Mol.Liq. 2013,177,288.doi:10.1016/j.molliq.2012.10.041
(12) Tiwari,A.K.;Sonu;Saha,S.K.J.Chem.Thermnodyn.2014, 70,24.doi:10.1016/j.jct.2013.10.010
(13) Zhu,H.L.;Hu,Z.Y.;Wang,J.L.;Cao,D.L.J.Mol.Liq.2014, 195,54.doi:10.1016/j.molliq.2014.01.030
(14) Zhu,H.L.;Hu,Z.Y.;Liang,D.;Wang,J.L.;Cao,D.L.J.Mol. Liq.2016,216,565.doi:10.1016/j.molliq.2016.01.067
(15) Kabir,D.;Koya,P.A.;Khan,Z.A.J.Colloid Interface Sci. 2010,342,340.doi:10.1016/j.jcis.2009.10.056
(16)Rodriguez,A.;Graciani,M.M.;Munoz,M.;Moya,M.L. Langmuir 2003,19,7206.doi:10.1021/la0301137
(17) Carpena,P.;Aguiar,J.;Galvan,P.B.;Ruiz,C.C.Langmuir 2002,18,6054.doi:10.1021/la025770
(18) Sohrabi,B.;Bazyari,A.;Hashemianzadeh,M.Colloids Surf.A 2010,364,87.doi:10.1016/j.colsurfa.2010.04.042
(19)Wang,X.;Wang,J.;Wang,Y.;Yan,H.;Li,P.;Thomas,R.K. Langmuir 2004,20,53.doi:10.1021/la0351008
(20)Tiwari,A.K.;Sonu;Sowmiya,M.;Saha,S.K.J.Mol.Liq. 2012,167,18.doi:10.1016/j.molliq.2011.12.004B
(21) Chauhan,S.;Jyoti,J.;Sharma,K.;Kumar,K.Fluid Phase Equilibria.2014,375,286.doi:10.1016/j.fluid.2014.05.020
(22) Chen,L.J.;Lin,S.Y.;Huang,C.C.;Chen,E.M.Colloids Surf. A 1998,135,175.doi:10.1016/s0927-7757(97)00238-0
(23) Mata,J.;Varade,D.;Bahadur,P.Thermochim.Acta 2005,428, 147.doi:10.1016/j.tca.2004.11.009
(24) Sorrenti,A.;Illa,O.;Pons,R.;Ortuño,R.M.Langmuir 2015, 31,9608.doi:10.1021/acs.langmuir.5b02700
(25) Chauhan,V.;Singh,S.;Kaur,T.;Kaur,G.Langmuir 2015,31, 2956.doi:10.1021/la5045267
(26) Guan,J.Q.;Tung,C.H.Langmuir 1999,15,1011.doi:10.1021/ la971353n
(27) Nagarajan,R.;Wang,C.C.Langmuir 2000,16,5242. doi:10.1021/la990856l
(28) Lumry,R.;Rajender,S.Biopolymers 1970,9,1125. doi:10.1002/bip.1970.360091002
(29) Chauhan,S.;Sharma,K.J.Chem.Thermnodyn.2014,71,205. doi:10.1016/j.jct.2013.12.019
Aggregation Properties and Thermodynamics of Micellization of Gemini Surfactants with Diester and Rigid Spacers in Organic Alcohol-Water Mixed Media
ZHANG Ting*SHEN Jie
(School of Chemistry and Material Engineering,Anhui Science and Technology University,Fengyang 233100, Anhui Province,P.R.China)
The aggregation behavior and thermodynamics of micellization for three Gemini surfactants with diester and rigid spacers in pure water and 10%(mass fraction)organic alcohol-water co-solvents(MA-WR, EG-WR and GL-WR)across a range of temperatures from 283.15 to 308.15 K were investigated by electrical conductivity measurements.The aggregation behavior parameters,including critical micelle concentration(cmc), degree of counter ion dissociation(α),and the thermodynamic parameters of micellization including standard Gibbs energyGibbs energy of micellization per alkyl tailstandard enthalpyand standard entropywere calculated and discussed.Gemini surfactants with longer hydrophobic chain length have a lower cmc value,which was found to increase with the increasing number of hydroxyl groups of the alcohol in the organic mixed solvent.The temperature dependence of the cmc value for the Gemini surfactants was U-shaped in all the investigated systems.The micellization process is spontaneous, Gibbs energy of transferis endothermic at temperatures below 293.15 K,and becomes exothermic at temperatures above 293.15 K. The micropolarity of the Gemini surfactants in pure water and organic alcohol-water co-solvents were evaluated by steady-state fluorescence spectroscopy.The results showed that the hydrophobicity of the microenvironment for Gemini surfactant solutions becomes stronger with the increasing chain length of the surfactants and the number of hydroxyl groups of the alcohol in the organic mixed solvents.The compensation between the enthalpy and entropy for micellization of all the three gemini surfactants were observed in all the studied mixed media.
Gemini surfactants;Conductivity;Organic alcohol co-solvent;Thermodynamic property
O647.2
Zana,R.;Talmon,Y.Nature 1993,362,228.
10.1038/ 362228a0
Received:October 30,2016;Revised:December 19,2016;Published online:December 20,2016.
*Corresponding author.Email:tingzhang84@163.com;Tel:+86-550-6732096.
The project was supported by the Natural Science Foundation ofAnhui Province,China(KJ2016A184)and Research Funds ofAnhui Science and Technology University,China(AKZDXK2015A01).
安徽省教育厅自然科学基金重点项目(KJ2016A184)和安徽科技学院重点学科项目(AKZDXK2015A01)资助
