手术时机的选择对原发性肝癌破裂出血术后预后生存的影响
2017-05-12钱相君万百顺王效谦
钱相君,贺 涛,万百顺,王效谦,张 玲
郑州大学附属肿瘤医院(河南省肿瘤医院)肝胆胰腺外科,河南 郑州 450008
手术时机的选择对原发性肝癌破裂出血术后预后生存的影响
钱相君,贺 涛,万百顺,王效谦,张 玲
郑州大学附属肿瘤医院(河南省肿瘤医院)肝胆胰腺外科,河南 郑州 450008
目的 研究手术时机的选择对原发性肝癌(primary liver cancer,PLC)破裂出血术后预后生存的影响及大网膜切除联合腹腔热灌注预防腹腔转移的临床疗效。方法 回顾性分析河南省肿瘤医院2011年1月-2016年6月收治的行手术治疗的PLC破裂出血患者52例;手术切除肿瘤的同时行大网膜切除术,术后1 d行腹腔热灌注治疗;并依据PLC破裂出血发病至手术的间隔时间,将患者分为早期(≤2周)手术组21例和延期(>2周)手术组31例,比较两组患者的腹腔转移及生存预后。结果 早期组与延期组术后无病生存时间的差异有统计学意义(P<0.05);总生存时间的差异无统计学意义(P>0.05),但早期组仍优于延期组。术后总的腹腔内种植转移发生率仅为4.2%(2/48),早期组腹腔转移率(0)低于延期组(7.1%)。结论 PLC破裂出血发病至手术间隔时间是影响患者术后无病生存期的显著因素,对腹腔转移、长期生存也有一定影响;肝肿瘤切除同时行大网膜切除联合腹腔热灌注能有效降低PLC破裂术后腹腔种植转移率。
原发性肝癌;破裂出血;手术时机;大网膜;腹腔热灌注;腹腔种植转移
原发性肝癌(primary liver cancer,PLC)破裂出血是其严重并发症,起病急、病死率高[1-2]。肝切除是控制出血和治疗原发病最有效的方法[3],PLC破裂出血后具有较高的腹腔广泛转移率[4-5],且生存预后不佳。在治疗PLC及出血的同时,如何预防术后肿瘤腹腔广泛转移仍是临床工作中的难题,且目前对术后预后生存及腹腔转移的预防研究进展缓慢。我医疗组自2011年以来开始对PLC破裂出血患者实行肝切除联合大网膜切除术、术后行腹腔热灌注治疗[6],在降低PLC破裂术后腹腔种植转移方面取得满意效果;同时发现PLC破裂早期积极手术可提高患者术后无病生存期及长期生存时间,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析河南省肿瘤医院2011年1月-2016年6月收治的52例PLC破裂出血患者的临床资料,男42例,女10例,年龄17~71岁,平均年龄53.5岁;临床首发症状为腹痛40例(76.9%),肝区或腹部胀满不适8例(15.4%),发热2例(3.9%),其他2例(3.9%)。除1例入院时因肿瘤破裂致失血性休克,行抗休克同时急诊手术外,余51例生命体征相对平稳或正常,对症治疗、完善检查及诊断后行手术治疗。本研究中PLC破裂出血患者急诊病例较少,分析与我院肿瘤专科医院的特性有关,大多患者入院时已经过分诊、确诊肝脏病变情况。虽然大部分患者有腹痛等临床症状,但并不显著,提示其出血情况并不严重且随着大网膜的包裹,出血有自行缓解征象,也是破裂出血患者误诊、延诊的重要原因。统计中发现依据PLC破裂发病至手术的间隔时间,以PLC破裂出血Ⅱ期手术时间期限2周为界[7],将52例患者分为早期(≤2周)手术组21例和延期(>2周)手术组31例。两组患者临床资料比较,差异无统计学意义(P>0.05,见表1),具有可比性。
1.2 纳入标准 (1)术前或术中诊断为PLC破裂出血,病理进一步证实为PLC;(2)均行肝切除联合大网膜切除术、术后1 d行腹腔热灌注治疗;(3)一般情况较好,肝功能Child分级为A级或B级;(4)单癌结节或局部多发结节,可以手术完全切除;(5)肿瘤无重要血管侵犯,无远处转移。
表1 临床资料比较
Tab 1 Comparison of clinical data
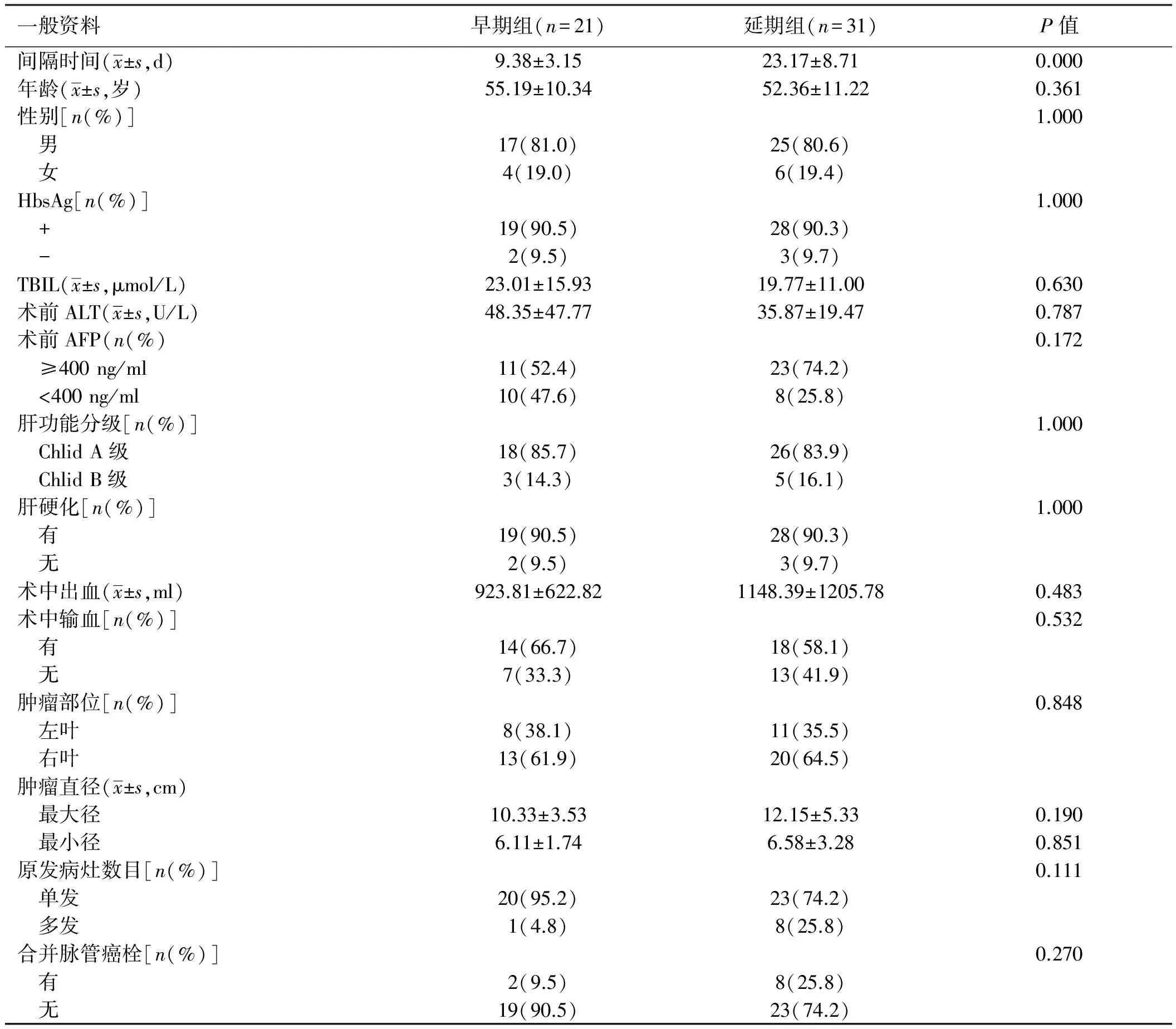
一般资料早期组(n=21)延期组(n=31)P值间隔时间(x±s,d)9.38±3.1523.17±8.710.000年龄(x±s,岁)55.19±10.3452.36±11.220.361性别[n(%)]1.000 男17(81.0)25(80.6) 女4(19.0)6(19.4)HbsAg[n(%)]1.000 +19(90.5)28(90.3) -2(9.5)3(9.7)TBIL(x±s,μmol/L)23.01±15.9319.77±11.000.630术前ALT(x±s,U/L)48.35±47.7735.87±19.470.787术前AFP(n(%)0.172 ≥400ng/ml11(52.4)23(74.2) <400ng/ml10(47.6)8(25.8)肝功能分级[n(%)]1.000 ChlidA级18(85.7)26(83.9) ChlidB级3(14.3)5(16.1)肝硬化[n(%)]1.000 有19(90.5)28(90.3) 无2(9.5)3(9.7)术中出血(x±s,ml)923.81±622.821148.39±1205.780.483术中输血[n(%)]0.532 有14(66.7)18(58.1) 无7(33.3)13(41.9)肿瘤部位[n(%)]0.848 左叶8(38.1)11(35.5) 右叶13(61.9)20(64.5)肿瘤直径(x±s,cm) 最大径10.33±3.5312.15±5.330.190 最小径6.11±1.746.58±3.280.851原发病灶数目[n(%)]0.111 单发20(95.2)23(74.2) 多发1(4.8)8(25.8)合并脉管癌栓[n(%)]0.270 有2(9.5)8(25.8) 无19(90.5)23(74.2)
1.3 方法
1.3.1 治疗方法:52例符合纳入标准者,均评估术前肝功能分级及手术耐受能力,给予对症支持治疗后手术。在手术切除肿瘤病灶的同时,沿大网膜根部行大网膜切除术,然后温热蒸馏水冲洗腹腔;术中预先放置灌注管,分别于左右膈下各置管1根(右侧灌洗管可根据情况由术后腹腔引流管代替),盆底置导管2根,导管戳孔引出体外,关闭腹腔。术后1 d行腹腔热灌注治疗1次,如条件允许,可间隔1 d行第2次治疗。用3 000~5 000 ml灌注液(生理盐水)加2%利多卡因20 ml进行循环灌注,外循环加热至43~46 ℃[6],流量为300~500 ml/min,根据患者的耐受情况,腹腔内灌注量控制在1 000~3 000 ml,持续1~1.5 h。
1.3.2 术后随访:术后半年内,每月行超声或增强CT及甲胎蛋白(alpha-fetoprotein,AFP)检查;术后0.5~1年,每2~3个月行增强CT及AFP检查1次;1年后,每3~6个月行增强CT及AFP检查1次。明确诊断肝内复发、腹腔转移时及时住院治疗。电话或门诊随访评估患者生存及疾病进展情况。如患者死亡,则随访终止。
1.4 统计学处理 采用SPSS 21.0统计软件进行数据分析。定量资料比较使用t检验、Wilcoxon秩和检验;定性资料比较使用χ2检验、校正检验、Fisher确切概率法,生存分析使用Kaplan-Meier法及Log-rank检验、Breslow检验。P<0.05为差异有统计学意义。
2 结果
2.1 术后病理及复发 52例患者术后标本均送病理常规。病理证实肝细胞性肝癌49例、混合型肝癌3例(早期组1例,延期组2例);大网膜受侵:早期组0例,延期组7例(22.6%),差异有统计学意义(P<0.05,见表2)。2例腹腔转移患者中,1例术后病理提示大网膜受侵,随访第3个月发现腹腔单发转移,给予经导管血管化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗后未再复发,已存活10个月;1例术后病理无大网膜受侵,随访第17.5个月时发现腹腔转移,行手术切除治疗,随访第25个月时肝内复发,行射频消融术治疗;后肝内多发转移,随访至31.3个月时死亡。
表2 术后病理及复发转移情况比较
Tab 2 Comparison of postoperative pathology, recurrence, and metastasis

分组例数大网膜受侵+/-腹腔内转移+/-肝内复发+/-肺转移+/-早期组210/210/2015/51/19延期组317/242/2623/51/27P值<0.050.5040.4601.000
注:早期组和延期组围手术期分别死亡1例和3例。
2.2 术后生存状况 术后平均随访25.26个月,期间早期组死亡11例,存活10例;延期组死亡20例,存活11例。早期组中位无病生存时间为9.89个月,延期组2.97个月。两组无病生存近期差异(Breslow检验)、远期差异(Log-rank检验)均有统计学意义(P<0.05)(见图1)。早期组中位总生存时间29.13个月,延期组7.03个月。两组总生存近期差异(Breslow检验)与远期差异(Log-rank检验)虽无统计学意义(P>0.05),但早期组生存期仍优于延期组(见图2)。

图1 术后无病生存期比较

图2 术后总生存期比较
2.3 术后不良反应及并发症 在术后接受腹腔循环热灌注治疗的患者中,两组均有少数患者出现腹痛腹胀、血压下降、心率增mm快等不良反应,给予止痛、液体支持等对症治疗后症状缓解。早期组术后并发症3例(14.3%),延期组8例(25.8%),其中胸腔积液5例(2vs3),术后出血3例(0vs3),肝功能衰竭2例(0vs2),腹腔感染1例(1vs0),肝周积液脓肿1例(0vs1),其中延期组1例术后出血合并肝衰。两组术后并发症发生率比较,差异无统计学意义(P>0.05)。围手术期死亡4例,早期组1例(腹腔感染),延期组3例(2例肝衰,1例术后出血手术止血后再发消化道出血),均终止随访。
3 讨论
PLC破裂出血的发生率随着其早期诊断率的提高有所下降,在西方国家较为罕见,发病率<3%;但东方国家发病率仍为12%~14%[1];死亡率高,占肝癌死亡原因的9%~10%[8],且其再出血率高达43%[9]。PLC破裂出血发病机理目前尚不明确,可能原因有[10]:(1)与肿瘤生长部位、生长速度关系密切。肿瘤位于肝脏表面、生长速度过快、外生性生长等可导致肿瘤表面组织撕裂和内部缺血坏死、腐蚀血管导致破裂出血。(2)与肿瘤癌栓阻塞肝静脉及肿瘤静脉破裂有关。在肝硬化门脉高压、坏死导致PLC组织内静脉充血的基础上,癌栓阻塞肝静脉及肿瘤新生动静脉破裂会增加出血风险。(3)肿瘤小动脉壁受损导致肿瘤破裂出血。PLC破裂出血患者巨噬细胞功能受损、血管免疫性受损,小血管壁易硬化、破裂。本研究中,49例(94.2%)有乙肝病史合并不同程度的肝硬化,肿瘤位置主要位于肝左、右叶边界位置,膈下与膈肌粘连者2例,合并癌栓者10例。
PLC破裂出血治疗关键是急性期止血、控制肿瘤、预防肿瘤的复发与转移。非手术治疗由于其再出血率、死亡率高,远期预后差,应严格掌握适应证;介入治疗为非根治性,且不能清除播散进入腹腔的肝癌细胞,长期疗效差[11]。对肝功能及一般情况允许者,手术切除能获得良好效果,肝癌切除既能止血又能彻底切除肿瘤,其远期疗效较好[2,11-12]。本研究中患者一般情况较好,肝功能均为Child A或B级,肿瘤为单发或多发局限于同一肝段、肝叶。所有患者肝脏肿瘤均一期手术切除,30 d生存率为92.3%,并发症低,优于相关文献[7]报道。
PLC破裂后腹腔内种植转移发生率很高[4-5],其多发、隐蔽及向其他脏器呈浸润生长的特性,使再次手术治疗非常困难且根治率很低。而单纯采用传统的术中创面保护措施和关腹前腹灌洗液灌洗方法是远远不够的[5],因此围手术期采取适当有效的治疗措施,防止腹腔内种植转移的发生极其重要。大网膜具有抗感染功能,PLC破裂出血时,大网膜能够迅速地移向出血部位并形成包裹,起到控制出血和防止癌细胞向腹腔脱落弥散的作用;但受到破裂处肿瘤浸润的风险明显提高[13],且与包裹时间密切相关,这一点在本研究中已经证实。大网膜具有丰富的动脉、静脉和淋巴网,此时大网膜又会加速癌细胞的扩散转移,因此PLC破裂患者完全切除大网膜是必要的。腹腔内游离癌细胞数量与术后种植转移密切相关,降低或完全杀灭腹腔游离癌细胞也是减少腹腔内种植转移的重要途径[5]。研究[6]表明,47 ℃和43 ℃持续1 h被称为正常组织细胞和恶性肿瘤细胞不可逆损伤的临界温度[9];术后1 d行腹腔热灌注治疗能够有效杀灭腹腔内游离癌细胞,相比于热灌注化疗又有肝脏损伤小、并发症少的优点。本研究中52例患者一期肝肿瘤切除的同时行大网膜切除,术后1 d行腹腔热灌注治疗。术后随访腹腔种植转移发生率仅为4.2%(2/48),远低于国内外文献报道,提示PLC破裂患者在肝肿瘤切除同时行大网膜切除联合腹腔热灌注可有效减少术后腹腔种植发生率。而早期组腹腔转移率低于延期组,提示随着PLC破裂出血持续时间延长,腹腔种植转移风险升高。
PLC破裂出血的近期及远期生存很差,有报道[11,13]称一期肝切除或TACE后二期肝切除效果要远优于单纯TACE和保守治疗。但PLC破裂后至手术切除的间隔时间(本研究以发病至手术时间计算)对患者的近期及远期生存影响,国内外尚无文献报道。本研究中,患者入院后术前准备时间并无差异,术后早期组无病生存时间与延期组差异有统计学意义;早期组总生存时间与延期组差异虽无统计学意义,但早期组仍具有较大优势;提示PLC破裂出血后,肿瘤生物学行为随出血及机体反应时间的延长逐渐恶化。而早期组与延期组术前AFP≥400 ng/ml、术中出血、肿瘤最大径、多发病灶数目、合并脉管癌栓、术后并发症也显示出随发病时间延长,肿瘤恶化的倾向。因此,积极尽早手术对患者预后有一定积极意义,特别是在无病生存时间方面;同时,减少误诊、延诊及尽早手术治疗对改善预后是必要和积极的。
总之,对于PLC破裂出血的患者,只要肝功能及一般情况允许,肝肿瘤切除同时行大网膜切除联合腹腔热灌注能有效降低腹腔种植转移的发生率。同时对于PLC破裂出血患者早诊、早治,减少误诊、延诊,缩短PLC破裂发病至手术的间隔时间,尽早手术能够显著改善患者的预后生存。
[1]Battula N, Madanur M, Priest O, et al. Spontaneous rupture of hepatocellular carcinoma: a Western experience [J]. Am J Surg, 2009, 197(2): 164-167.
[2]Zhong F, Cheng XS, He K, et al. Treatment outcomes of spontaneous rupture of hepatocellular carcinoma with hemorrhagic shock: a multicenter study [J]. Springerplus, 2016, 5(1): 1101.
[3]Tanaka S, Kaibori M, Ueno M, et al. Surgical outcomes for the ruptured hepatocellular carcinoma: multicenter analysis with a case-controlled study [J]. J Gastrointest Surg, 2016, 20(12): 2021-2034.
[4]Zhou SJ, Zhang EL, Liang BY, et al. Erratum to: distilled water lavage during surgery improves long-term outcomes of patients with ruptured hepatocellular carcinoma [J]. J Gastrointest Surg, 2015, 19(9): 1737-1738.
[5]孙延富, 程月娥, 王振猛, 等. 肝癌术中腹腔内游离癌细胞与术后种植转移的相关性分析[J]. 肝胆胰外科杂志, 2009, 21(2): 126-128. Sun YF, Cheng YE, Wang ZM, et al. Analysis of the correlation between the number of scattering tumor cells in peritoneal cavity during operation with liver cancer and the incidence of the postoperative seeding metastasis [J]. Journal of Hepatopancreatobiliary Surgery, 2009, 21(2): 126-128.
[6]腹腔热灌注化疗技术临床应用专家协作组. 腹腔热灌注化疗技术临床应用专家共识(2016版)[J]. 中华胃肠外科杂志, 2016, 19(2): 121-125.
[7]Lai EC, Lau WY. Spontaneous rupture of hepatocellular carcinoma: a systematic review [J]. Arch Surg, 2006, 141(2): 191-198.
[8]王颖勃, 徐忠立. 原发性肝癌自发性破裂出血[J]. 肝胆外科杂志, 2002, 10(1): 36-38. Wang YB, Xu ZL. Spontaneous rupture of primary liver cancer [J]. Journal of Hepatobiliary Surgery, 2002, 10(1): 36-38.
[9]Tanaka A, Takeda R, Mukaihara S, et al. Treatment of ruptured hepatocellular carcinoma [J]. Int J Clin Oncol, 2001, 6(6): 291-295.
[10]张华, 罗诗樵, 吴忠均. 肝癌破裂出血的诊断和治疗[J]. 中国普外基础与临床杂志, 2011, 18(12): 1338-1343. Zhang H, Luo SQ, Wu ZJ. Diagnosis and treatment for spontaneous rupture of hepatocellular carcinoma [J]. Chin J Bases Clin General Surg, 2011, 18(12): 1338-1343.
[11]Jin YJ, Lee JW, Park SW, et al. Survival outcome of patients with spontaneously ruptured hepatocellular carcinoma treated surgically or by transarterial embolization [J]. World J Gastroenterol, 2013, 19(28): 4537-4544.
[12]Hiraoka A, Kawamura T, Aibiki T, et al. Prognosis and therapy for ruptured hepatocellular carcinoma: problems with staging and treatment strategy [J]. Eur J Radiol, 2015, 84(3): 366-371.
[13]Ou D, Yang H, Zeng Z, et al. Comparison of the prognostic influence of emergency hepatectomy and staged hepatectomy in patients with ruptured hepatocellular carcinoma [J]. Dig Liver Dis, 2016, 48(8): 934-939.
(责任编辑:王全楚)
Effect of timing of surgery on the prognosis of patients with primary liver cancer after operation
QIAN Xiangjun, HE Tao, WAN Baishun, WANG Xiaoqian, ZHANG Ling
Department of Hepatopancreatobiliary Surgery, Henan Cancer Hospital Affiliated to Zhengzhou University, Zhengzhou 450008, China
Objective To investigate the effect of timing of surgery on the prognosis of patients with primary liver cancer (PLC) after operation and the clinical effect of greater omentum resection combined with hyperthermic intraperitoneal perfusion preventing intraperitoneal metastasis.Methods Fifty-two cases treated by operations from Jan. 2011 to Jun. 2016 were retrospectively analyzed. The tumor and greater omentum were surgically removed simultaneously and the hyperthermic intraperitoneal perfusion were applied one day after the surgery for all the patients. According to the interval between paroxysm after PLC rupture and operation, the patients were divided into early operation group (<2 weeks) 21 cases and delayed operation group (>2 weeks) 31 cases. Then the intraperitoneal metastasis and survival prognosis between two groups were compared.Results There was significant statistical difference in the disease free survival between two groups (P<0.05). There was no significant difference in overall survival between two groups (P>0.05), the early group still had advantages over the delayed group. The total intraperitoneal metastasis rate was only 4.2% (2/48) after opertation, and the rate of the early group (0) was lower than that of the delayed group (7.1%).Conclusion The incidence of rupture of PLC to the time of operation is a significant factor affecting the survival time of patients after operation, it also has a certain effect on the intraperitoneal metastasis and long-term survival. The greater omentum resection combined with hyperthermic intraperitoneal perfusion after hepatectomy can effectively reduce the incidence of intraperitoneal implantation metastasis of the patients with PLC rupture and hemorrhage.
Primary liver cancer; Rupture; Timing of surgery; Greater omentum; Hperthermic intraperitoneal; Intraperitoneal implantation
钱相君,硕士研究生,研究方向:肝胆胰腺肿瘤。E-mail:qixijn@126.com
张玲,主任医师,硕士生导师,研究方向:肝胆胰腺肿瘤。E-mail:zhanglily561@126.com
10.3969/j.issn.1006-5709.2017.04.012
R735.7
A
1006-5709(2017)04-0407-05
2016-08-31
