4株布鲁氏菌弱毒株对小鼠毒力及免疫保护力的评价
2017-05-12
(石河子大学,新疆石河子 107590)
4株布鲁氏菌弱毒株对小鼠毒力及免疫保护力的评价
刘升兰,关 团,王 震,王月丽,刘 洋,刘志科,孟露萍,张 辉,陈创夫
(石河子大学,新疆石河子 107590)
为检测国内外已有的布鲁氏菌疫苗株S19、M5、S2和 RB51的胞内存活力、毒力、免疫保护力以及抗体消长水平,将上述4种疫苗株,分别以100:1的MOI侵染小鼠巨噬细胞,结果发现RB51的胞内存活力最强;以1×106CFU/只免疫昆明小白鼠,测定各疫苗株在小鼠脾脏中的定居力,结果发现M5的定居力最强;待疫苗株在小鼠体内被清除后,以1×105CFU/只腹腔接种2308毒株,进行攻毒试验,检测各疫苗株的保护力,结果发现M5的保护效果最好;免疫后连续10周采集血清,用ELISA检测血清中的IgG滴度、IFN-γ的表达水平及抗体消长水平,结果发现S2、M5组的IgG水平高于其他组,而各组间的IFN-γ水平差异不显著(P>0.05);分别用虎红平板凝集试验(RBPT)和标准试管凝集试验(SAT)检测血清凝集状况,结果发现S2、S19组的抗体持续时间较长;剖检各疫苗株对小鼠脾脏、肝脏、肾脏等组织引起的病理学变化,结果发现M5引起的病变程度最强。
布鲁氏菌;疫苗;毒力;免疫保护力;小鼠
布鲁氏菌病是由布鲁氏菌(Brucella)引起的一种常见的人兽共患传染病。世界动物卫生组织将其列为须通报动物疫病我国将其列为二类动物疫病。
目前,布鲁氏菌病的主要预防措施是接种疫苗。国内应用的疫苗主要是畜用羊种布鲁氏菌M5、猪种布鲁氏菌S2和牛种布鲁氏菌S19。此外,欧美一些国家还广泛应用粗糙型流产布鲁氏菌疫苗RB51(B. abortusRB51)。本实验从细胞水平和动物水平,对目前应用的商业化疫苗弱毒株(M5、S19、RB51、S2)进行比较,来评价其免疫效果,为实践应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株。布鲁氏菌疫苗株S19、M5、S2、RB51及2308强毒株均由本研究室保存。
1.1.2 主要试剂。2种培养基,均购自美国BD公司;布鲁氏菌标准试管凝集抗原,购自中国疾病预防控制中心 ;布鲁氏菌病虎红平板凝集试验抗原,购自青岛易邦生物工程有限公司;小鼠IFN-γ细胞因子ELISA检测试剂盒,购自美国GBD公司;布鲁氏菌IgG ELISA检测试剂盒,购自美国RD公司。
1.1.3 实验动物。100只昆明系小白鼠,购自石河子大学实验动物中心。
1.2 布鲁氏菌胞内存活力试验
1.3 动物毒力试验
1.3.1 脾脏指数法测定细菌毒力。选取6~10周龄昆明系雌性小白鼠,分为5组;将S19、M5、S2和RB51疫苗株,均以1×106CFU/只分别腹腔接种于昆明小鼠,200 μL/只,另设PBS对照组。将各试验组小鼠分别于1、3、5、7周后称量体重处死,无菌分离脾脏,称重并记录。
1.3.2 测定各疫苗菌株在小鼠脾脏内的定居力。在小鼠被处死后,无菌分离脾脏,研磨,稀释成不同的浓度梯度,涂布于布鲁氏菌血清鉴定培养基;取各组平均值,计算菌落形成单位(CFU),观察各疫苗株的定居力。
1.4 各疫苗株抗血清反应试验
分离M5、S19、RB51、S2组小白鼠免疫后1~10周的血清,将各时间段的血清分别进行RBPT和SAT试验。
1.5 小鼠动物免疫保护力试验
这句,看你怎么狡辩!为什么不回我?有什么跟我说,不管怎样,我都不会伤害你,我会尽力让你快乐的。还有这句,我觉得爱是刻在心里的痕迹,爱得越深,刻痕也越深。领导大人,解释啊,为什么给下属的短信要爱啊爱的?
1.5.1 疫苗株保护力测定。分别在S2、RB51免疫小鼠6周后,M5免疫16周后,S19免疫14周后,用强毒株2308攻毒,进行保护力测定试验。
1.5.2 测定免疫后小鼠血清IgG水平。分别在疫苗弱毒株免疫1、3、5、7、9周后,用ELISA方法检测M5、S19、RB51、S2组的IgG滴度水平。
1.5.3 测定免疫后小鼠血清细胞因子IFN-γ水平。分别在疫苗弱毒株免疫1、3、5、7、9周后,检测M5、S19、RB51、S2组的细胞因子IFN-γ的消长水平。
1.6 利用组织切片技术观察小鼠感染后的组织病理学变化
配制组织贮存液、染液,采集并保存小鼠肝、脾、肺、肾脏组织,制作病理组织切片,封固、晾干后显微镜下观察。
2 试验结果
2.1 疫苗株在巨噬细胞内的存活力
胞内复制试验结果显示,各布鲁氏菌疫苗株在侵染巨噬细胞后,细菌数量明显减少,S2显著低于S19,而且S2和S19均低于M5和RB51(图1)。
2.2动物毒力试验结果
2.2.1 脾脏指数法测定细菌毒力。接种M5和S19疫苗株小鼠的脾脏肿大明显(P<0.05),而接种S2和RB51疫苗株的不明显(P<0.05)(图2)。
2.2.2 疫苗株在小鼠脾脏的定居力。统计免疫小鼠不同时期脾脏内的细菌数量,计算平均值,lgCFU±SD即为每组的细菌含量。结果可见,布鲁氏菌 M5菌株和S19菌株可持长时间存留在小鼠体内,而RB51与S2菌株在7周后就会被清除(图3)。
2.3 虎红平板凝集试验(RBPT)和标准试管凝集试验(SAT)结果
分别对各疫苗弱毒株免疫1~10周后的小鼠血清,进行RBPT和SAT试验,检测产生凝集抗体的持续时间,并确定免疫后的具体检测时间(表1、表2)。
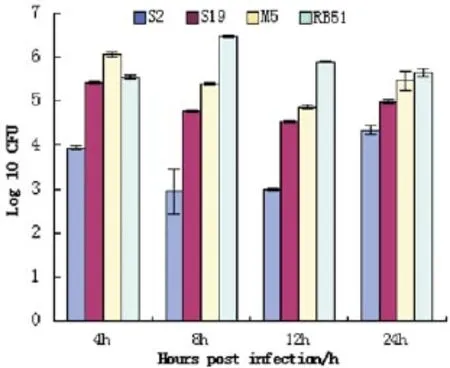
图1 各疫苗株侵染小鼠巨噬细胞情况

图2 各组和空白组的脾脏指数(数量级为1.0×10-3)

图3 各疫苗株在小鼠脾脏的定居力
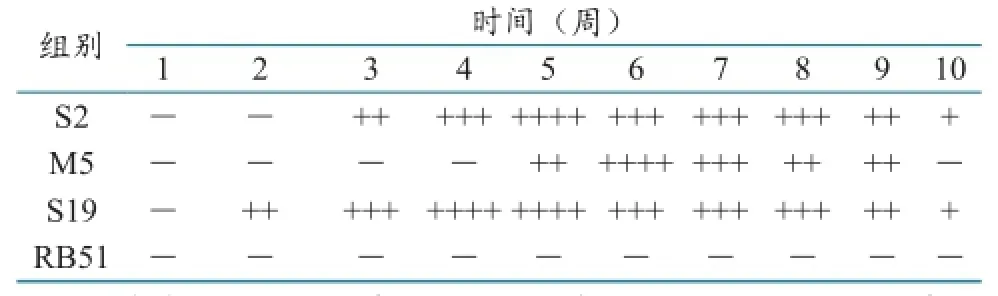
表1 RBPT试验结果
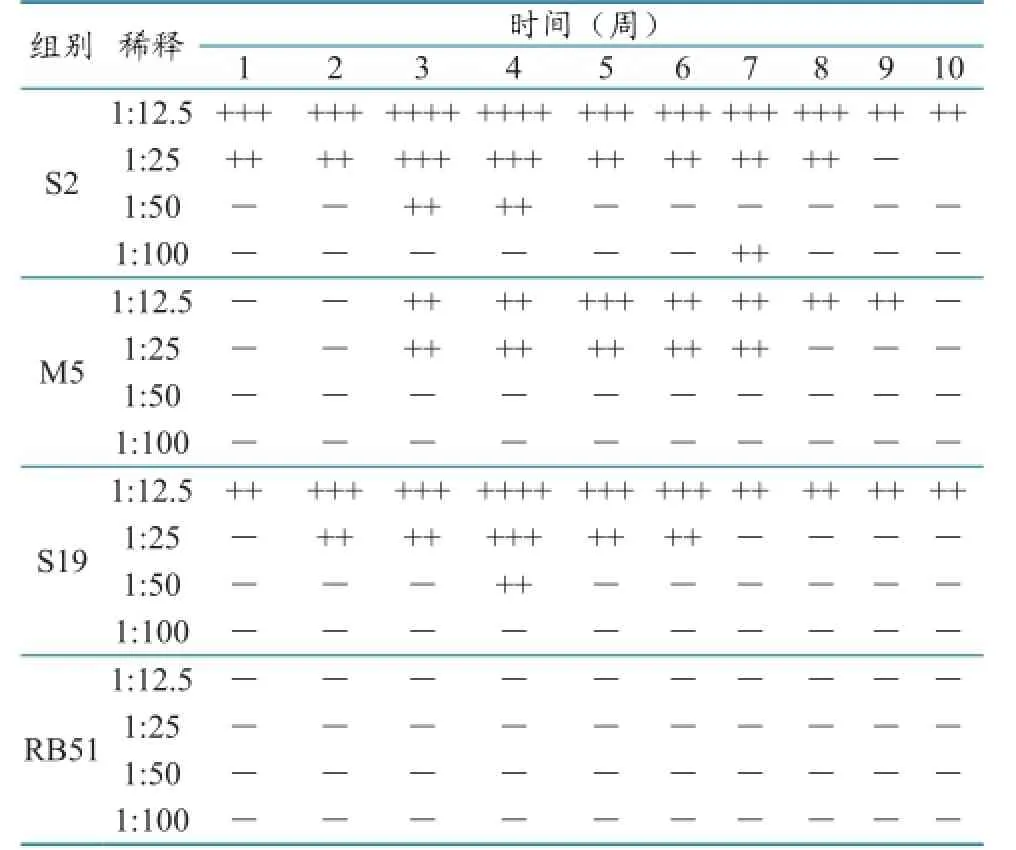
表2 SAT试验结果
SAT试验结果显示,M5疫苗株在免疫3周后开始出现凝集,并持续至第9周,S2、S19疫苗株均于1周后开始出现凝集,并持续10周甚至更久,而RB51始终不出现凝集。
2.4 免疫保护力试验结果
2.4.1 各疫苗株保护力测定结果。用2308菌株攻毒各免疫组小鼠,发现RB51与S2组第1~3周的保护效果明显弱于S19(P<0.05),而S19第1~2周的效果明显弱于M5(P<0.05),具体结果见图4。
2.4.2 免疫后小鼠血清特异性IgG水平测定
2.4.2.1 小鼠布鲁氏菌IgG ELISA检测标准曲线(图5)。用酶标仪检测OD450值,并生成标准方程:y=0.0511x+ 0.1153。
2.4.2.2 小鼠血清中IgG含量。分别用ELISA试剂盒检测免疫后第1、3、5、7、9周及攻毒后的第1~3周血清中的IgG含量,用酶标仪测定检测值。计算各时间段每个样本的IgG含量。结果可见,各疫苗株均能刺激小鼠产生IgG抗体,且抗体水平随着时间延长而升高,但有一定的波动;在免疫后第1、3、7、9周,S2、M5组抗体水平显著高于对照组和其他组(P<0.05),而在第3周时,S2组抗体水平明显高于M5组(P<0.05);免疫菌株在小鼠体内被清除后,用相同剂量的标准株攻毒,第1~3周的S2、M5组抗体水平均显著高于其他组(P<0.05);而S19组、RB51组的抗体水平差异不明显(P<0.05),具体结果见图6。
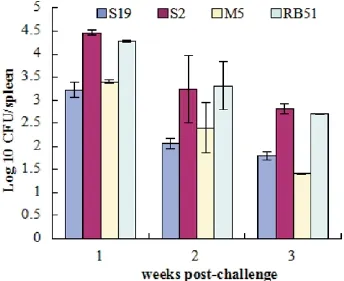
图4 小鼠免疫后攻毒脾脏载菌量
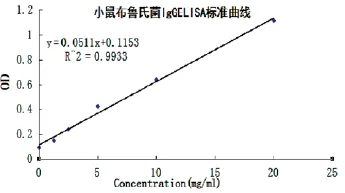
图5 小鼠布鲁氏菌病IgG ELISA标准曲线
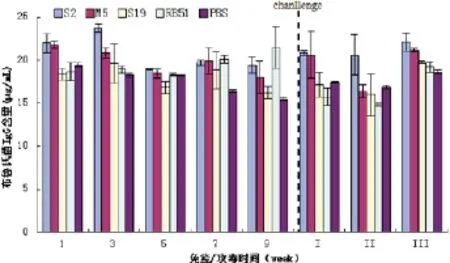
图6 小鼠血液IgG的含量
2.4.3 免疫后小鼠血清细胞因子IFN-γ 水平。小鼠细胞因子ELISA检测值标准曲线见图7。用ELISA试剂盒检测血清中的IFN-γ含量,根据标准曲线计算各时间段、各样本的IFN-γ含量。结果发现,各疫苗株均能刺激小鼠产生抗体,但抗体水平随着时间的延长,差异越来越不明显(图8)。小鼠体内的抗体被清除后,用相同剂量的2308强毒株攻毒,发现1、3周后的小鼠抗体水平显著高于PBS组(P<0.05);而在2周后,S2、RB51组的抗体水平高于其他组(P<0.05)。
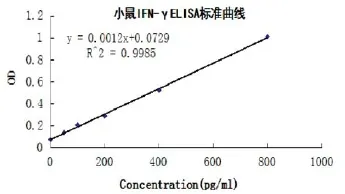
图7 小鼠布鲁氏菌病IFN-γ ELISA标准曲线
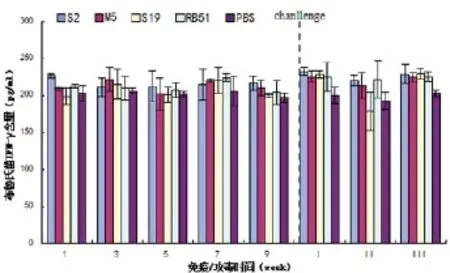
图8 小鼠血液IFN-γ的含量
2.5 病理学切片观察结果
感染15 d后,各组小鼠的肝脏都出现不同程度的病理变化:S19组出现肝细胞肿胀、脂肪变性,细胞核溶解或消失及出现少量结节;S2组出现结节,部分细胞坏死;RB51组没有出现明显病变(图9)。
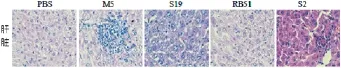
图9 布鲁氏菌感染的小鼠肝组织病理学观察(HE400×)
感染15 d后4组小鼠脾脏也出现不同程度的病理变化。其中,M5组出现脾脏淋巴细胞增生,炎性细胞浸润,部分出现红髓充血;S19组髓质中出现大量红细胞,局部出现结节;RB51组出现数量较多、大小不等的结节,髓质部有淤血;S2组呈现弥漫性散在性出血,其它病变不明显(图10)。

图10 布鲁氏菌感染的小鼠脾组织病理学观察(HE400×)
感染15 d后,4组小鼠肺脏都出现不同程度的病理变化。其中,M5组小鼠肺泡腔间质增宽,有少量炎性细胞浸润;S19组有明显的肺间质增生、大量炎性细胞,肺泡腔内有大量红细胞;RB51组肺泡腔出现炎性细胞、散在红细胞,支气管周围形成支气管周围炎;S2组病变不明显(图11)。

图11 布鲁氏菌感染的小鼠肺组织病理学观察(HE400×)
感染15 d后,4组小鼠肾脏都出现了肾小管上皮管内径变小。其中,RB51、M5和S2组较明显;RB51和S2组部分肾小管上皮细胞肿胀、溶解,肾间质出血、充血;S19组病变相对不明显(图12)。
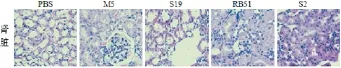
图12 布鲁氏菌感染的小鼠肾组织病理学观察(HE400×)
3 结果分析
本研究基于布鲁氏菌弱毒株的免疫保护性,以小鼠为动物模型,对市场商业化的疫苗弱毒株(M5、S19、RB51、S2)进行系统比较。总体来说,M5、S19、S2、RB51作为现用的布鲁氏菌疫苗株,均有一定的免疫保护效果。RB51在小鼠巨噬细胞内的存活力最强;M5在小鼠脾脏中的定居力最强;攻毒后保护力试验发现M5的保护效果最好;S2、M5的抗体免疫消长水平总体较高;RBPT和SAT试验发现,S2、S19的抗体持续时间较长;M5对小鼠脾脏、肝脏、肾脏等组织产生的病变最明显。总之,这几种疫苗株在不同方面各有优点。
[1] VERGER J M,Grayon M,Zundel E,et al. Comparison of the effi cacy of Brucella suis strain 2 and Brucella melitensis Rev.1 live vaccines against a Brucella melitensis experimental infection in pregnant ewes[J]. Vaccine,1995,13(2):191-196.
[2] MUSTAFA A A,ABUSOWA M F. Field-oriented trial of the Chinese Brucella suis strain 2 vaccine on sheep and goats in Libya[J]. Vet Res,1993,24(5):422-429.
[3] COLBY L A. The humoral response of Elk(Cervus elaphus nelsoni)and mice to vaccination with Brucella abortus strain PB51[D]. Blacksburg,VA,USA:Virginia Polytechnic Institute and State University,1997.
[4] PALMER M V,CHEVILLE N F,Jensen A E. Experimental infection of pregnant cattle with the vaccine candidate Brucella abortus strain RB51:pathologic,bacteriologic and serologic findings[J]. Vet Pathol,1996,33:682-691.
[5] ROOP R M,JEFFERS G,BAGCHI T,et al. Experimental infection of goat fetuses in utero with a stable rough mutant of Brucella abortus[J]. Res Vet Sci,1991(2),51:123-127.
[6] CHEVILLE N F,JENSEN A E,HALLING S M,et al. Immunology:bacterial survival,lymph node changes,and immunologic responses of cattle vaccinated with standard and mutant strains of Brucella abortus[J]. Am J Vet Res,1992,53(10):1881-1888.
[7] CHEVILLE N F,OLSEN S C,JENSEN A E,et al. Effects of age at vaccination on efficacy of Brucella abortus RB51 to protect cattle against brucellosis[J]. Am J Vet Res,1996,57(8):1153-1156.
[8] 殷红萍,陈泳. 羊布鲁氏菌M5号疫苗引起母羊大量流产的情况调查[J]. 中国兽医杂志, 1998,24(9):20.
(责任编辑:朱迪国)
Evaluation on the Virulence and Immunological Protection of 4 Brucella Attenuated Strains in Mice
Liu Shenglan,Guan Tuan,Wang Zhen,Wang Yueli,Liu Yang,Liu Zhike,Meng Luping,Zhang Hui,Chen Chuangfu
(Shihezi University,Shihezi,Xinjiang 107590)
To compare some characteristics of the 4 existingBrucellosisvaccine strains of S19,M5,S2 and RB51,a study was carried out on their viability of living in cells,virulence,immunological protection and the kinetics of antibody levels. Firstly,murine macrophage cells were inoculated with the above 4 vaccine strains(MOI=100:1),results showed strain RB51 had the longest survival time. Then immunizing Kunming white mice(1×106CFU per mouse)with the 4 strains to measure their ability of proliferating in spleen,and strain M5 displayed the strongest proliferation ability. After clearing away the immunized vaccines existing in mice,immunological protection of the vaccines was detected by peritoneal injection of virulent strain 2308 with 1×105CFU,results showed strain M5 worked the best. Subsequently,serum samples were collected for 10 consecutive weeks after vaccination,then the IgG titer,expression levels of cytokine IFN-γ and kinetics of antibodies were tested by ELISA. Results showed the IgG levels of group S2 and M5 were higher than others,while the IFN-γ expression of the 4 groups had no signifi cant difference(P>0.05).Serum agglutination was observed by both Bengal plate agglutination test(RBPT)and the standard tube agglutination test(SAT),results manifested that antibodies from group S2 and S19 were of long duration. At last,pathological autopsy of the immunized mice was conducted to observe the changes in spleen,liver,kidney and other tissues,and results showed pathogenic changes caused by M5 were severest than by other strains.
Brucella;vaccine;virulence;immunological protection;mice
S852.23
:A
:1005-944X(2017)05-0094-05
10.3969/j.issn.1005-944X.2017.05.026
国家自然科学基金项目(31660705)
陈创夫
