重组酶聚合酶扩增技术及其在动物病毒病检测中的应用
2017-05-12
(中国动物卫生与流行病学中心,山东青岛 266032)
重组酶聚合酶扩增技术及其在动物病毒病检测中的应用
秦立得,南文龙,陈义平
(中国动物卫生与流行病学中心,山东青岛 266032)
重组酶聚合酶扩增技术是近年来建立起的一种常温DNA扩增技术,具有灵敏度高、特异性强、反应速度快、所需仪器简单等优点。本文介绍了该技术的检测原理、引物及探针设计和影响因素,分析了该技术在动物病毒病检测方面的应用,指出该技术具有良好的现场快速检测与多重及大量样品检测的应用前景。
重组酶聚合酶扩增技术;动物病毒病;研究进展;展望
1 RPA检测原理
在目的DNA片段扩增的过程中,引物与uvsX重组酶形成的复合物与DNA结合并沿DNA链寻找引物的同源序列,完成定位后发生链交换反应并打开2条DNA单链间的氢键,单链绑定蛋白(SSB)与单链DNA链结合,阻止形成双链,之后Bsu聚合酶从发生链交换反应的位置开始复制DNA;同时反应体系中含有uvsY酶,能与uvsX结合并促进uvsX与单链DNA更加紧密的结合,以发生链交换反应,如此循环,从而完成了对目的DNA片段的扩增(图1)。

图1 RPA扩增目的DNA过程
在RPA反应体系中加入RNA逆转录酶体系,可实现对RNA的检测(RT-RPA);加入nfo、 exo或fpg等DNA损伤修复酶和相应的荧光探针,可建立荧光定量RPA(Real-time RPA ,qRPA)和荧光定量反转录RPA(Real-time RT-RPA ,RT-qRPA)。反应结束后,若采用琼脂糖凝胶电泳进行结果判定,则首先需要回收DNA,以排除反应组份造成的干扰;但是使用exo酶的RPA反应无法使用该方法判定结果,因为反应体系会降解扩增产物。qRPA和RT-qRPA通过实时监测的荧光值来准确判定结果,此外采用nfo酶的RPA还可采用侧流层析试纸条(LFD-RPA)来判定结果。
2 RPA引物及探针设计
2.1 扩增DNA片段选取
RPA能够扩增长约1.5 kb的DNA片段,但通常扩增长度在80~400 bp之间才可提高反应灵敏性和特异性,且在100~200 bp的效果最佳[1]。同时,为避免非特异性扩增,最好选择序列相似度小于64%的片段[3]。
2.2 引物设计
引物的设计原则包括:引物5′端最好为C,并避免出现连续的G,3′端最好为C或G;引物中避免出现回文序列、连续重复序列以及发卡结构;引物GC含量控制在30%~70%;引物长度控制在45 nt内,最好为30~35 nt,并避免形成引物二聚体。但已发表的文献显示,引物设计并没有完全满足上述条件要求。Daher等[2]对已发表的204对RPA引物进行分析统计发现,9% 的 RPA引物长度不足30 nt,7%的引物长度大于35 nt,10%的引物GC含量小于30%,但也有引物GC含量大于65%的情况。
2.3 探针设计
设计RPA探针时应尽量避免引物和探针形成DNA互补,同时探针3´端必须添加阻断物,防止诱导Bsu聚合酶扩增非目的DNA。当荧光探针同时含有荧光基团和淬光基团时,不产生荧光信号;荧光探针与DNA链结合后,DNA损伤修复酶(nfo、exo和 fpg)识别特异位点,以切除淬光基团,荧光基团产生荧光信号并通过仪器读取数值。其中,nfo和exo分别为大肠杆菌核酸内切酶IV和外切酶III,能够识别并切割探针上的四氢呋喃分子(THF ,dSpacer)的删除淬光基团,fpg能够识别并切除探针上与脱氧核糖相连的淬光基团。探针长度有所差异,通常exo和nfo探针长度为46~52 nt,fpg探针长度为35 nt左右。Daher等[2]统计分析已发表的64条RPA探针相关文献时发现,75%为exo探针,14%为fpg探针,11%为nfo探针;17%的exo探针长度为34~44 nt,短于推荐的46~52 nt。
小流域面积相对较小,河道比降大,洪水汇流速度非常快,洪水陡涨陡落,各小流域之间又相互关联,加上山区小河流水文资料缺乏,目前预报方法不多。
3 RPA的影响因素
RPA作为一种分子检测技术,其检测灵敏度受复杂背景DNA的影响。2014年Brittany Rohrman等[4]运用RPA检测血液中人类免疫缺陷病毒时,发现血液中背景复杂的DNA会影响反应的灵敏度,在存在复杂DNA背景的条件下,延长反应时间或增加引物浓度对提升RPA反应灵敏度的效果不明显;通过特异富集目的DNA并去除非特异的背景DNA,可有效提高反应灵敏度。RPA扩增需要引物与重组酶形成复合物,寻找引物的同源序列并发生链交换反应,引物以及与待扩增DNA相似度高的其他序列也会影响RPA。2014年,Daher等[3]研究证明RPA反应同PCR等分子扩增技术相似,也能够非特异扩增高度相似的基因;引物3´端仅存在1个与目的基因非配对脱氧核苷酸碱基,会影响RPA反应,在引物3´端、5´端或中间位置存在3个及以上的与目的基因非配对脱氧核苷酸碱基,同样会影响RPA反应。
4 RPA在动物病毒病检测方面的应用
RPA技术在动物病毒检测方面得到了开发与应用,实验证明这些方法都具有良好的敏感性和特异性,但相关研究较少(表1)。
4.1 猪病病毒检测
2016年,Wang等[5]建立了检测猪圆环病毒II型(PCV-2)的qRPA方法。该方法最低可检测100个PCV-2基因组,灵敏度与qPCR 相同,较普通PCR提高了10倍,平行检测48份病料样品,RPA与qPCR结果一致,与普通PCR符合率为93.7% (45/48) 。2016年,Yang等[6]设计出了检测猪细小病毒(PPV)NS1基因的qRPA和LFD方法。该方法最低可分别检测到300 和400个含NS1基因的重组质粒,平行检测101份病料和27份阴性样品,qRPA和LFD与qPCR结果符合率分别为94.4%和 100%。2016年,Yang等[7]研究了检测高致病性猪蓝耳病病毒的qRPA方法。该方法最低可分别检测到70个含目的基因的重组质粒,平行检测125份临床样品,qRPA与qPCR检测结果敏感性和特异性分别为97.6 %和100 %。
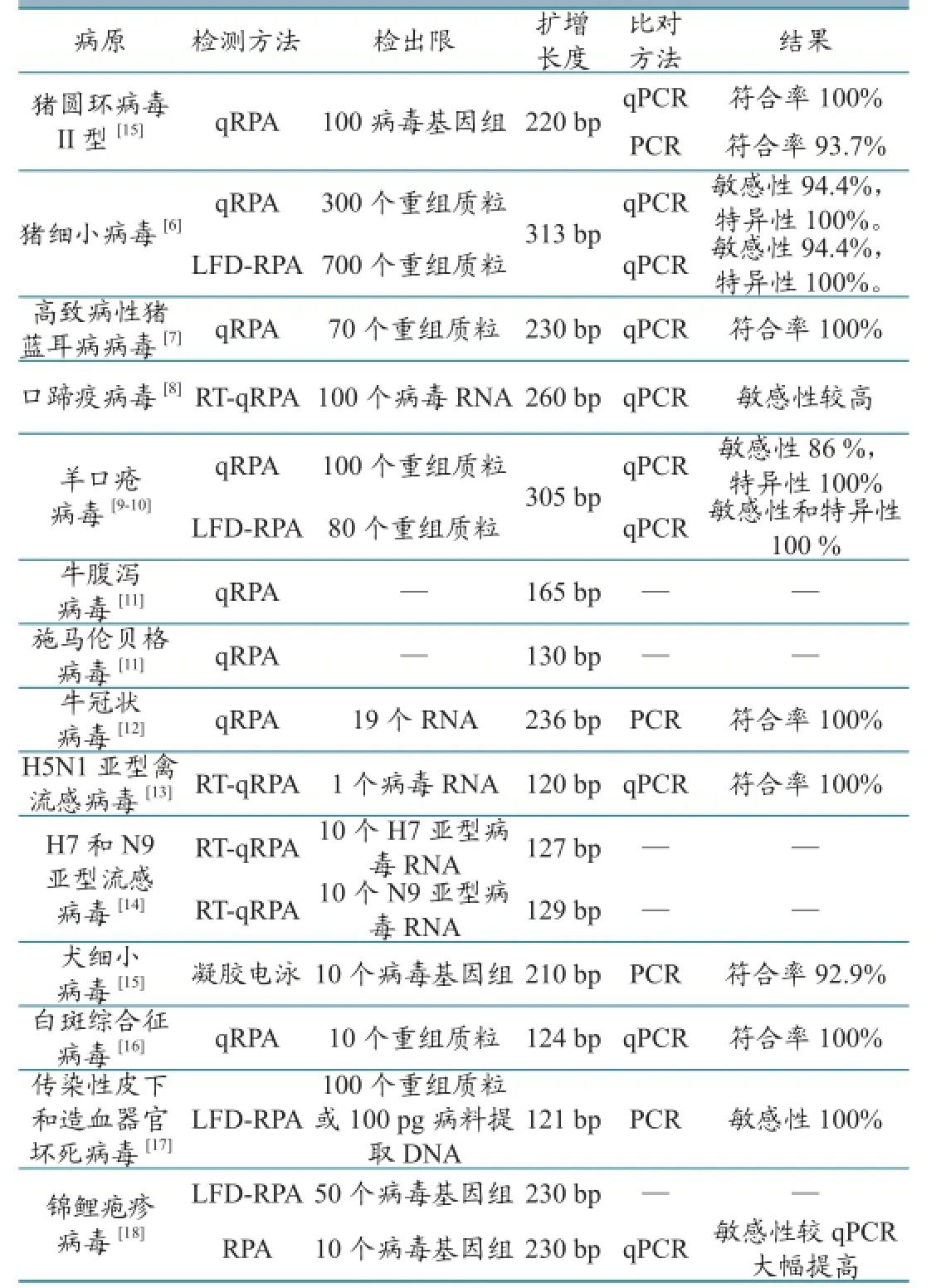
表1 RPA在动物病毒病检测方面的应用及结果统计
4.2 反刍动物病病毒检测
2013年,El Wahed等[8]建立了检测口蹄疫病毒的RT-qRPA和RT-qPCR方法,使用这2种方法平行检测27份临床样品,发现RPA方法检测灵敏度与PCR方法无显著差异,检测灵敏度分别为100% 和98%。2015年,Yang等[9]建立了检测羊口疮病毒的qRPA方法。该方法最低可以检测到100个含目的基因的重组质粒,使用该方法和qPCR方法平行检测35份样品, qRPA检测敏感性和特异性分别为86%和100%;Yang等[10]还建立了LFD-RPA方法。该方法最低可以检测到80个含目的基因的重组质粒,使用该方法和qPCR方法平行检测90份样品,LFD-RPA与qPCR的检测结果一致。此外Andrea Aebischer等[11]开发了可同时检测牛腹泻病毒和施马伦贝格病毒的RPA方法,Amera等[12]开发了检测牛冠状病毒的RT-RPA方法,通过实验证明这2种方法都具有良好的敏感性和特异性。
4.3 禽病病毒检测
2015年,Nahed Yehia等[13]建立了检测H5N1亚型禽流感HA基因的RT-qRPA方法。该方法最低可检测到1个编码禽流感HA基因的RNA分子,平行检测30份样品,检测结果与qPCR一致。2015年, El Wahed等[14]研究了检测H7和N9亚型流感病毒的RT-qRPA方法。该方法可分别检测到10个H7亚型病毒RNA或100个N9亚型病毒RNA。
4.4 宠物病病毒检测
2016年,Wang等[15]建立了检测犬细小病毒的RPA方法。该方法最低可检测到10个病毒基因组DNA,使用该方法和PCR平行检测57份样品,RPA检测结果符合率为92.9 % 。
4.5 水生动物病病毒检测
2014年,Xia等[16]建立了检测白斑综合征病毒的RPA方法。该方法最低可检测到10个含目的基因的重组质粒,使用该方法检测34份临床样品,检测结果与qPCR一致。2014年,Jaroenram等[17]研发了检测传染性皮下和造血器官坏死病毒的LFD-RPA方法。该方法最低可检测到100个含目的基因的重组质粒或100 pg病料提取DNA,使用该方法和PCR同时检测117份样品,RPA敏感性和特异性分别为100% 和94.12% 。2016年,Meagan等[18]建立了检测锦鲤疱疹病毒的普通RPA和LFD-RPA方法。这2种方法可有效检出处于潜伏期鲤鱼的锦鲤疱疹病毒,最低可分别检测到10个和50个病毒基因组,使用普通RPA和qPCR同时检测13份已知病料,RPA方法结果检测出所有12份阳性样品,而qPCR方法仅检出1份。
5 RPA应用前景
5.1 现场快速检测
目前有研究人员设计出了便携式RPA仪器等快捷检测工具,便于在野外或条件差的地区开展现场检测。针对许多艾滋病高发区环境恶劣甚至没有供电的情况,Lillis等[19]设计了用自然温度或简单装置进行RPA反应的方法,Crannell等[20]设计了在人腋窝处用体温进行RPA反应的方法,经实验证明这2种方法敏感性强,检测结果与qPCR相符。2014年,在几内亚暴发埃博拉病毒疫情,科研人员设计出了以太阳能电池供能的用RT-RPA方法检测埃博拉病毒的便携式手提箱。该手提箱中包含RPA反应和结果检测所需的所有仪器设备,在实际运用中发现该手提箱检测结果与qPCR结果一致,但应用较qPCR更方便快捷,更适合于现场快速检测[21]。
5.2 多重及大量样品检测
针对常见病原或经常发生混合感染的疫病,设计不同的RPA检测方法,并实现多重检测,从而有效地提高检测效率,扩大检测范围。目前通过将芯片技术与RPA整合实现了多重检测,并且通过计算机软件进行结果分析。若对该技术进一步开发,则可实现对大量样品的自动化检测,提高检测效率。目前,RPA芯片技术已经在食源性细菌和病毒检测方面得到了开发与应用。2014年,Kersting等[22]设计了可同时检测淋病奈瑟菌、沙门氏菌和耐甲氧西林葡萄球菌的RPA芯片;2016年,Kunze等[23]通过在芯片上布置DNA阵列,实现了同时对多种病毒或细菌进行检测的RPA方法;2016年,Choi等[24]成功开发出可同时检测牛奶中沙门氏菌、大肠杆菌O157和副溶血性弧菌的RPA芯片。
[1] PIEPENBURG O,WILLIAMS C H,STEMPLE D L,et al. DNA Detection Using Recombination Proteins[J]. PLoS biology,2012,4(7):e204.
[2] DAHER R K,STEWART G,BOISSINOT M,et al. Recombinase Polymerase Amplification for Diagnostic Applications[J]. Clinical Chemistry,2016,62(7):947.
[3] DAHER R K,STEWART G,BOISSINOT M,et al. Influence of sequence mismatches on the specificity of recombinase polymerase amplification technology[J]. Molecular & Cellular Probes,2015,29(2):116.
[4] ROHRMAN B A,RICHARDS K,et al. Inhibition of Recombinase Polymerase Amplification by Background DNA:A Lateral Flow-Based Method for Enriching Target DNA[J]. Analytical Chemistry,2015,87(3):1963.
[5] WANG J,WANG J,LIU L,et al. Rapid detection of Porcine circovirus-2 by recombinase polymeraseamplification[J]. Journal of Veterinary Diagnostic Investigation,2016,28(5):1-4.
[6] YANG Y,QIN X,ZHANG W,et al. Rapid and specifi c detection of porcine parvovirus by isothermal recombinase polymerase amplification assays[J]. Molecular and Cellular Probes,2016,30(5):300-5.
[7] YANG Y,QIN X,SUN Y,et al. Rapid detection of highly pathogenic porcine reproductive and respiratory syndrome virus by a fluorescent probe-based isothermal recombinase polymerase amplifi cation assay[J]. Virus Genes,2016,52(6):883-886.
[8] WAHED A A E,ELDEEB A,ELTHOLOTH M,et al. A Portable Reverse Transcription Recombinase Polymerase Amplification Assay for Rapid Detection of Foot-and-Mouth Disease Virus[J]. Plos One,2013,8(8):e7164 2.
[9] YANG Y,QIN X,WANG G,et al. Development of a fl uorescent probe-based recombinase polymerase amplifi cation assay for rapid detec tion of Orf virus[J]. Virology Journal,2015,12(1):206.
[10] YANG Y,QIN X,WANG G,et al. Development of an isothermoal amplifi cation-based assay for rapid vi sual detection of an Orf virus[J]. Virology Journal,2016,13(1):1-6.
[11] AEBISCHER A,WERNIKE K,HOFFMANN B,et al. Rapid Genome Detection of Schmallenberg Virus and Bovine Viral Diarrhea Virus by Use of I sothermal Amplifi cation Methods and High-Speed Real-Time Reverse Transcriptase PCR[J]. Journal of Clinical Microbiology,2014,52(6):1883.
[12] AMER H M,ABD E W A,SHALABY M A,et al. A new approach for diagnosis of bovine coronavirus using a reverse transcription recombinase polymerase amplification assay[J]. Journal of Virological Methods,2013,193(2):337-340.
[13] YEH IA N,ARAFA A S,WAHED A A E,et al. Development of reverse transcription recombinase polymerase amplification assay for avian influenza H5N1 HA gene detection[J]. Journal of Virological Methods,2015,223(2):45-49.
[14] ABD E L WAH ED A,WEIDMANN M,et al. Diagnostics-in-a-Suitcase:Development of a portable and rapid assay for the detection of the emerging avian infl uenza A(H7N9) virus[J]. Journal of Clinical Virology :the offi cial publication of the Pan American Society for Clinical Virology,2015,69:16-21.
[15] WANG J,WANG J,LIU L, et al. Rapid detection of Porcine circovirus 2 by recombinase polymerase amplifi cation[J]. Journal of Veterinary Diagnostic Investigation:offi cial publication of the American Association of Veterinary Laboratory Diagnosticians,Inc,2016,28(5):574-578. [16] XIA X,YU Y,WEIDMANN M,et al. R apid detection of shrimp white spot syndrome virus by real time,isothermal recombinase polymerase amplification assay[J]. PloS One,2014,9(8):e104667.
[17] JAROENRAM W,OWENS L. Recombinase polyme rase amplification combined with a lateral flow dipstick for discriminating between infectious Penaeus stylirostris densovirus and virus-related sequences in shrimp genome[J]. Journal of Virological Methods,2014,208:144-151.
[18] PRESCOTT M A,REED A N,JIN L,et al. Rapid De tection of Cyprinid Herpesvirus 3 in Latently Infected Koi by Recombinase Polymerase Amplifi cation[J]. Journal of Aquatic Animal Health,2016,28(3):173-180.
[19] LILLIS L,LEHMAN D,SINGHAL M C,et al. Non-instrument ed incubation of a recombinase polymerase amplification assay for the rapid and sensitive detection of proviral HIV-1 DNA[J]. PloS One,2014,9(9):e108189.
[20] CRANNELL Z A,ROHRMAN B,RICHARDSKORTUM R. Equipment-Free Inc ubation of Recombinase Polymerase Amplification Reactions Using Body Heat[J]. PloS One,2014,9(11):e112146.
[21] FAYE O,FAYE O,SOROPOGUI B,et al. Development and deployment of a r apid recombinase polymerase amplifi cation Ebola virus detection assay in Guinea in 2015[J]. European Communicable Disease Bulletin,2015,20(44):120.
[22] KERSTING S,RAUSCH V,BIER F F,et al. Multiplex isothermal solid-phase recom binase polymerase amplification for the specifi c and fast DNA-based detection of three bacterial pathogens[J]. Mikrochimica Acta,2014,181(13-14):1715-1723.
[23] KUNZE A,DILCHER M,ABD EL WAHED A,et al. On-Chip Isothermal Nucleic Acid Amplifi cat ion on Flow-Based Chemiluminescence Microarray Analysis Platform for the Detection of Viruses and Bacteria[J]. Analytical Chemistry,2016,88(1):898-905.
[24] CHOI G,JUNG J H,PARK B H,et al. A centrifugal direct recombinase polymerase amplification (direct-RPA)microdevice for multiplex and real-time identifi cation of food poisoning bacteria[J]. Lab On a Chip,2016,16(12):2309-2316.
(责任编辑:杜宪)
Recombinase Polymerase Amplif cation and Its Application in Detection of Animal Diseases
Qin Lide,Nan Wenlong,Chen Yiping
(China Animal Health and Epidemiology Center,Qingdao,Shandong 266032)
In recent years,a novel DNA amplifi cation technique named Recombinase polymerase amplifi cation(RPA)has been established,which possesses advantages of high sensitivity,strong specificity,fast reaction and simple apparatus needed in operation. Here,its detection principles,design of primers and probes and influence factors were introduced,its application in detection of animal viral diseases was also analyzed. Results showed that RPA had promising prospects in rapid detection at the spot,as well as the multiple and large-scale sample detection.
RPA;animal viral disease;research progress;prospect
S851.34
:A
:1005-944X(2017)05-0081-05
10.3969/j.issn.1005-944X.2017.05.023
科技部种禽场疾病综合防控与净化技术体系评估、论证和推广研究(2016YFD0501609)
