酶解条件对麦麸低聚木糖含量及其性质的影响
2017-05-11王伟旭汪丽萍刘艳香田晓红
王伟旭,汪丽萍,于 雷,谭 斌,韩 伟,刘艳香,田晓红
(1.国家粮食局科学研究院,北京 100037;2.吉林农业大学,吉林 长春 130118)
低聚木糖是植物细胞壁中阿拉伯木聚糖的分解产物,其结构一般是由2~7个木糖以β-1,4-糖苷键连接而成的聚合性糖,又称为木寡糖[1]。低聚木糖作为国际上颇受关注的低聚糖具有诸多的功能特性,例如,能够调节肠道菌群,有助于有益肠道菌群增长;有利于糖尿病者,肥胖者等“三高人群”食用;具有抗氧化,提高免疫力等作用,因此被广泛应用于食品、饲料以及医药产业中[2-3]。然而诸多的功能特性通常由低聚木糖的结构所决定,其中木二糖、木三糖是低聚木糖的有效成分[4],同时低聚木糖的聚合度对其产品的理化性质和功能特性具有很大的影响[5]。
目前国内对于低聚木糖的研究主要集中于酶解条件变化对其含量和平均聚合度的影响,或以低聚木糖含量和平均聚合度为指标制备出的低聚木糖进行功能性评价[6-7],而不同酶解条件对低聚木糖功能特性的影响未见报道。因此,本实验采用木聚糖酶酶解麦麸水不溶性阿拉伯木聚糖制备低聚木糖,探讨酶解温度、酶解时间和加酶量对低聚木糖含量、平均聚合度、糖组成以及益生元活性的影响,为低聚木糖的工业化生产提供数据支持。
1 材料与方法
1.1 材料与试剂
小麦麸皮水不溶性阿拉伯木聚糖:本实验室碱法提取制得,阿拉伯木聚糖含量67.1%。
木糖、木二糖、木三糖、木四糖、木五糖、木六糖和木七糖标准品:SIGMA公司;乳酸、乙酸、丙酸、丁酸标准品:北京兰博利德公司;木聚糖酶:诺维信生物科技有限公司;青春双歧杆菌(Bifidobacteriumadolescentis)ATCC 15703:中国食品发酵工业研究院工业微生物菌种保藏中心;其他试剂均为分析纯。
1.2 仪器与设备
SHZ-88A水浴恒温振荡器:太仓市实验设备厂;低速离心机:安慰中科中佳科学仪器有限公司;3-18K低温高速离心机:德国SIGMA公司; DGG-9000型电热恒温鼓风干燥箱:上海森信试验仪器有限公司;T6紫外可见分光光度计:北京普析通用仪器有限责任公司;LGJ-10D冷冻干燥机:北京四环科学仪器厂有限公司;PL3002-IC电子天平:梅特勒—托利多仪器有限公司;ICS-3000离子色谱:美国戴安公司;YQX-II型厌氧培养箱:上海新苗医疗器械制造有限公司;MLS-3781L高压灭菌器:日本Panasonic公司;超净工作台:美国Thermo Scientific公司。
1.3 实验方法
1.3.1 低聚木糖制备工艺[8]
准确称取一定量的麸皮水不溶性阿拉伯木聚糖,均匀分散于pH为5.0,0.1 mol/L的NaAC缓冲溶液中,配制成底物浓度为4%的悬浮液,加入定量的木聚糖酶后在一定温度下水浴振荡一定时间后,在沸水浴中灭酶10 min,冷却后离心(4 000 r/min,20 min),收集上清液。摇匀后一部分上清液测定还原糖和可溶性总糖含量,另一部分上清液冷冻干燥制成粉末状。
1.3.2 酶解条件设定
设置酶解时间2 h,加酶量0.50 g/L,在酶解温度分别为40、45、50、55、60 ℃的条件下水浴振荡。研究酶解温度对低聚木糖性质的影响。
设置酶解温度50 ℃,加酶量0.50 g/L,在酶解时间分别为1、1.5、2、2.5、3 h的条件下水浴振荡。研究酶解时间对低聚木糖性质的影响。
设置酶解时间2 h,酶解温度50 ℃,在加酶量分别为0.125、0.250、0.50、1、2 g/L的条件下水浴振荡。研究加酶量对低聚木糖性质的影响。
1.3.3 木聚糖酶活力测定[9]
参考饲料添加剂木聚糖酶活力的测定分光光度计法,GB/T 23874—2009。
1.3.4 低聚木糖含量测定
AXOs含量测定参考晁正[10]方法,以酶解液中还原糖含量表示。采用3,5-二硝基水杨酸法(DNS)测定(以木糖计,mg/mL)。
1.3.5 总还原糖含量测定
参考张军华[11]方法稍作修改。取一定量的样品溶液加入同体积浓度为8%的H2SO4于121 ℃下反应1 h,冷却后用15%的NaOH溶液中和反应液,过滤后采用DNS法测定。
平均聚合度(DP)=可溶性还原糖的含量/还原糖的含量
1.3.6 低聚木糖糖组成测定
参考Swennen[12]方法稍作修改。准确称取5 mg待测样品溶于5 mL超纯水中,经离心、过滤后,进样10 μL。
色谱条件:色谱柱:Carbopac PA100分析柱(4×250 mm),Carbopac PA100保护住(4×50 mm);流速1 mL/min;进样量:10 μL;柱温:30 ℃;检测器:脉冲安培检测器,AgCl;淋洗液:100 mmol/L NaOH(A)和500 mmol/L NaOAC(B)进行二元梯度洗脱;洗脱程序:0~30 min时B相浓度由0 mmol/L线性增至120 mmol/L,30~40 min时以100%A冲洗系统。
1.3.7 厌氧培养
1.3.7.1 培养基制备[6]
混合0.2 g无水CaCl2和0.48 g MgSO4在300 mL蒸馏水中直到溶解,加500 mL蒸馏水边搅拌边缓慢加入1 g K2HPO4、1 g KH2PO4、10 g NaHCO3、2 g NaCl,继续搅拌直到所有盐全部溶解,加入200 mL蒸馏水,混匀配制成盐溶液。分别称取2.5 g蛋白胨、2.5 g胰胨、5 g酵母粉、5 g葡萄糖、20 mL盐溶液、0.25 g L-半胱氨酸盐酸盐,500 mL蒸馏水于1 000 mL烧杯中配制基础培养基,经过煮沸驱氧后,分装,灭菌,转入厌氧培养箱中,添加还原剂和调节pH值为7.0,最后接种。
增殖培养时将适量样品加入基础培养基中代替葡萄糖,灭菌,添加还原剂和调节pH值,分别在6、12、24 h定时取样分析检测。
1.3.7.2 菌体浓度测定[6]
比浊法和干重法相结合测定发酵液中菌体浓度。吸取10 mL菌体母液进行离心,菌体经生理盐水洗涤3次后用生理盐水定容至10 mL,按一定梯度吸取上述经摇匀的菌液,用生理盐水稀释至5 mL,以生理盐水为空白,用分光光度计在 620 nm测定吸光度,同时测定上述一定体积菌液的固含量,根据吸光度和固含量绘制标准曲线。分别在6、12、24 h取一定量的发酵液离心后(3 000 r/min,15 min),菌体经生理盐水洗涤3次,用生理盐水稀释至同等体积后摇匀,以生理盐水为空白测定吸光值。
1.3.7.3 有机酸含量测定
参考赵梦丽[13]方法稍作改动。分别取6、12、24 h发酵液经10 000 r/min离心10 min,上清液经超纯水适当稀释后过滤,用离子色谱进行测定。
色谱条件:色谱柱:IonPac AS11-HC(4×250 mm)分析柱,IonPac AG11-HC(4×50 mm)保护柱;流速:0.5mL/min;进样量:25 μL;柱温:30 ℃;检测器:电导检测器;抑制器型号:ASRs-4mm;淋洗液:A为100 mmol/L NaOH,B为超纯水,0~7 min 4%A,7.1~15 min 20%A,15.1~22 min 40%A,22.1~33 min 4%A。
1.3.8 数据处理
所有实验重复3次,数据均以平均值±标准偏差表示,数据处理采用Excel和SPSS 17进行统计分析。
2 结果与分析
2.1 酶解条件对低聚木糖含量的影响
不同酶解条件对低聚木糖含量影响见图1。由图1a可知,酶解温度对低聚木糖含量影响较大,随着温度的升高低聚木糖含量显著增加,当酶解温度从40 ℃升高至50 ℃时,低聚木糖含量从74 mg/g增至95 mg/g,提高了约28%,可能由于随着酶解温度的增加,使酶与底物中间体转化为目标物的速度加快,在最适温度50 ℃下木聚糖酶能够长时间发挥作用而不失活;继续增加温度低聚木糖含量反而降低,由于酶是蛋白体,温度升高会降低酶的稳定性,使一部分酶失活。由图1b可看出,酶解时间由1 h延长至2 h时,低聚木糖含量缓慢增加,当继续增加酶解时间含量反而下降,可能由于随着时间的延长酶与底物接触渐渐充分使得更易获取目标物,但随着时间的推移酶的活性降低导致低聚木糖含量下降。由图1c显示,加酶量由0.125 g/L增至1.0 g/L时,低聚木糖含量迅速增加,当超过1 g/L时,含量下降。可能由于较小的加酶量不能够充分的降解底物导致低聚木糖含量低,随着加酶量的增加单位体积水解液中酶分子数量提高,使得酶分子与底物充分结合,提高反应效率。综上所述,酶解温度约50 ℃,酶解时间约2 h和加酶量约1 g/L时,低聚木糖含量最大。
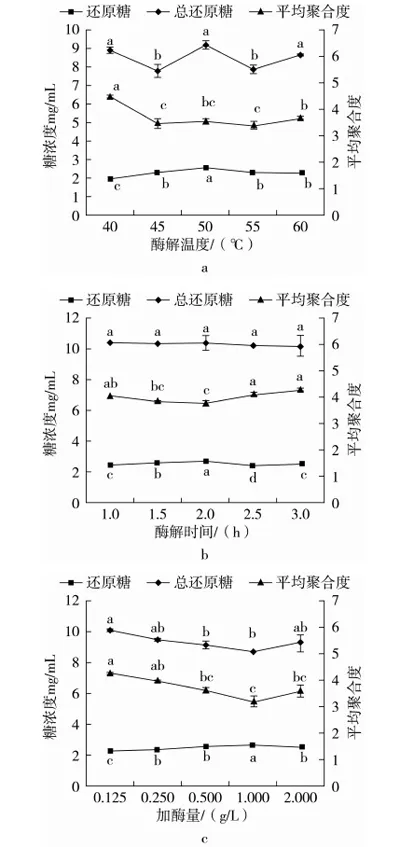
图1 酶解条件对低聚木糖含量的影响
2.2 酶解条件对低聚木糖糖组成的影响
表1~表3显示了不同酶解条件对AXOs糖组成的影响。由表可知不同酶解温度、酶解时间和加酶量获得的AXOs其糖组成主要由木糖、木二糖、木三糖和木四糖组成,其中木二糖和木三糖为主要成分。文献表明[14]木二糖、木三糖和木四糖混和组分的培养基对双歧杆菌的增值效果最好。由表1可知,木糖和木四糖的含量随着酶解温度的增加而增加,当酶解温度为50 ℃时木四糖相对含量达到最大;木三糖含量随着酶解温度由40 ℃增加至50 ℃时没有明显变化,继续增加酶解温度,木三糖含量减小;酶解温度的变化对木二糖相对含量影响较小。由表2可看出,木糖和木四糖含量随着酶解时间的延长而增加,当酶解时间为2 h时,木四糖相对含量达到最大;当酶解时间由1 h延长至2 h时木二糖相对含量缓慢增加,而木三糖相对含量大幅度下降,可能由于随着酶解时间的延长,木三糖之间的1,4-β糖苷键被内切型木聚糖甘酶断裂,被分解为木糖和木二糖。由表2可知,加酶量对木糖和木三糖相对含量影响较明显,随着加酶量的增加,木三糖相对含量大幅度下降,而木糖相对含量明显增加;木二糖和木四糖相对含量随着加酶量的增加而增加。综上所述,酶解时间和加酶量对木三糖的产生具有很大影响,在短时间和低加酶量条件下有利于木三糖的产生,当酶解时间和加酶量越大时木三糖越易分解为木糖或木二糖,导致木三糖相对含量减小;酶解温度、酶解时间和加酶量的增加均有利于木四糖的产生,当酶解温度为50 ℃,酶解时间为2 h和加酶量为1 g/L时木四糖相对含量达到最大,而且木二糖:木三糖:木四糖的比值最小。
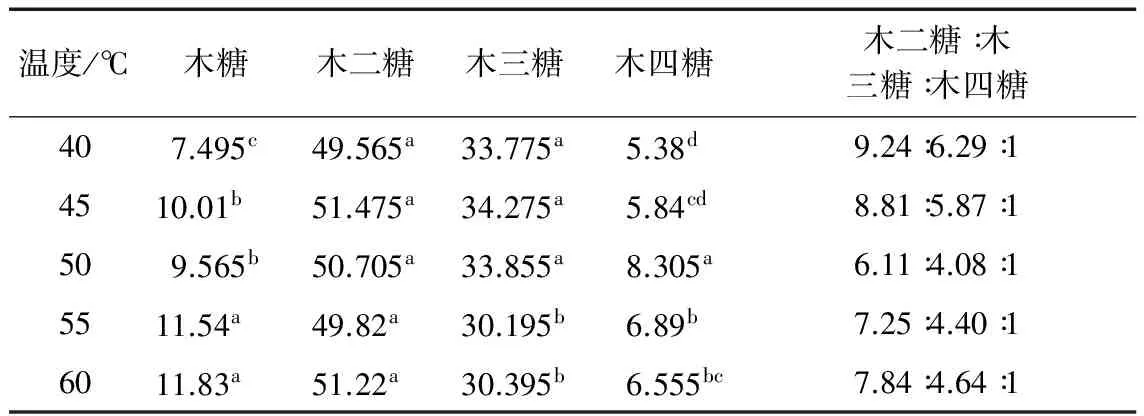
表1 酶解温度对低聚木糖糖组成的影响
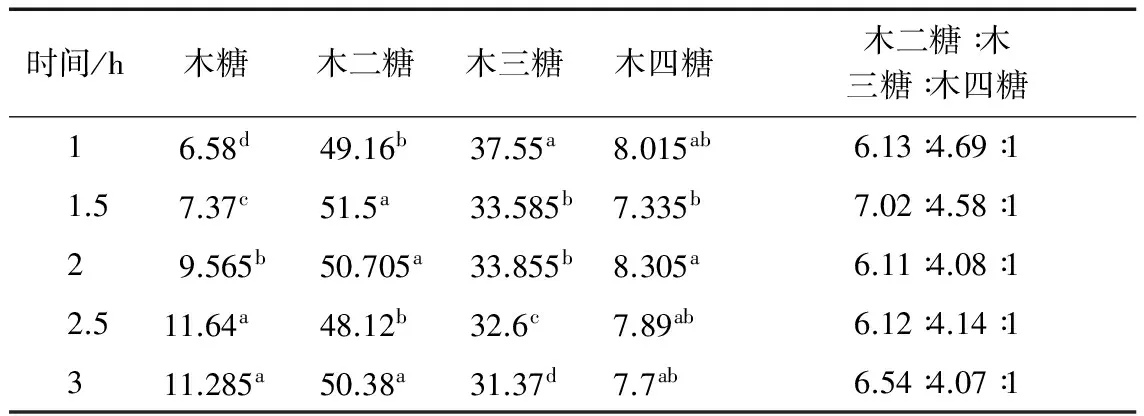
表2 酶解时间对低聚木糖糖组成的影响
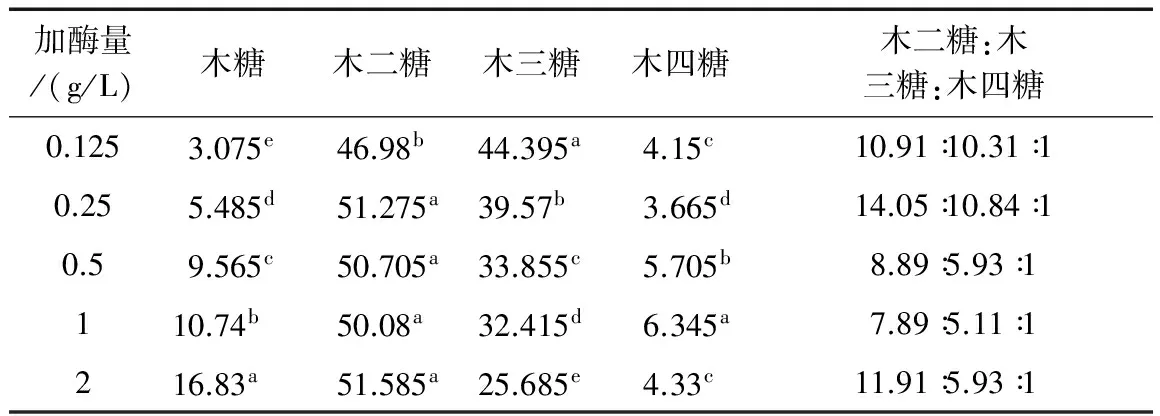
表3 加酶量对低聚木糖糖组成的影响
注:a,b和c表示不同酶解条件下制备的低聚木糖糖组成的差异性,不同小写字母表示处理在P<0.05水平差异显著。
2.3 酶解条件对低聚木糖平均聚合度的影响
酶解条件对低聚木糖平均聚合度的影响见图2。由图2可知,通过不同酶解条件得到的低聚木糖平均聚合度均小于5。由图2a显示,随着酶解温度的增加,总还原糖和还原糖的含量均增加,而平均聚合度呈下降趋势,当酶解温度为50 ℃时,总还原糖浓度和还原糖浓度达到最大,在此条件下的低聚木糖平均聚合度趋于最小;由图2b可看出,随着酶解时间的延长总还原糖含量无明显变化,还原糖含量逐渐增加,平均聚合度减小,当酶解时间增加至2 h时,还原糖含量达到最大,低聚木糖平均聚合度最小;由图2c可知,加酶量对总还原糖含量影响作用小,而对还原糖含量影响较大,当加酶量由0.125 g/L增至1 g/L时,还原糖含量达到最大,总还原糖含量趋于平稳,此时低聚木糖平均聚合度最小。总之,不同酶解条件对低聚木糖平均聚合度影响较大,当酶解温度50 ℃,酶解时间2 h和加酶量1 g/L时低聚木糖平均聚合度趋于最小。
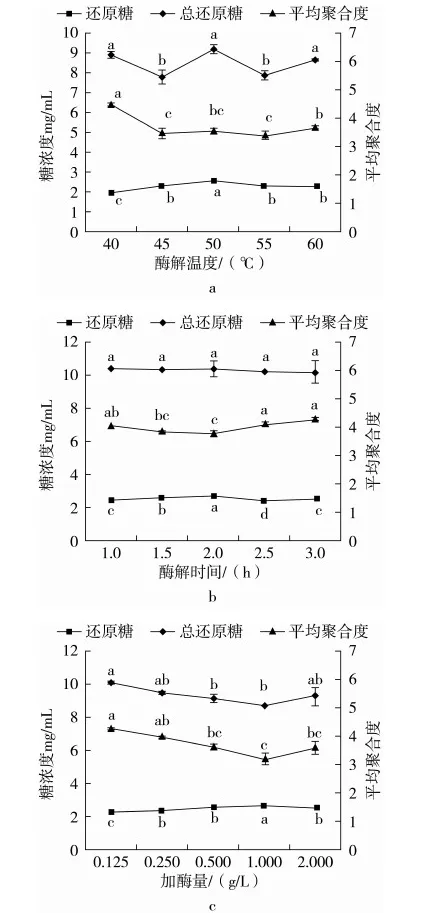
图2 酶解条件变化对低聚木糖平均聚合度的影响注:平均聚合度=可溶性还原糖含量/还原糖含量。
2.4 不同酶解条件制得低聚木糖对益生元活性的影响
2.4.1 不同酶解条件制得低聚木糖对菌体浓度的影响
不同酶解温度、酶解时间和加酶量制得的低聚木糖对青春双歧杆菌增值情况的影响见图3。由图3可知,随着发酵时间的延长不同酶解条件下制得的低聚木糖对菌种增值变化规律均相似,其中发酵时间由0 h增至6 h时呈对数期生长,随后由6 h延长至24 h时呈平稳或缓慢生长的趋势。不同酶解条件下制得的低聚木糖对菌种均有增值作用,但菌体浓度增加量不尽相同,由图3a可知,酶解温度越高得到的低聚木糖用于增值菌体的效果越好,当温度达到50 ℃时,菌体浓度自0.07 g/L增至最大值0.219 g/L,增加了3.1倍。由图3b可看出,WUAX经不同酶解时间处理得到的低聚木糖培养菌种时发酵液中起始菌体浓度为0.07g/L,当代谢由酶解时间1 h延长至2 h制备的低聚木糖时,菌体浓度呈现上升趋势,当酶解时间为2 h时,菌体浓度达到最大,继续增加酶解时间制备AXO将不利于菌体增值。图3c可知,添加不同加酶量制得的低聚木糖作为碳源培养青春双歧杆菌时发酵液中初始菌体浓度为0.06 g/L,随着加酶量的增加,发酵液中菌体浓度呈现上升趋势,当菌体代谢加酶量为1 g/L制备的低聚木糖时,发酵液中菌体浓度达到最大,其值为0.339 g/L,增加到5.65倍,此结果与徐勇[15]实验中菌体增长倍数相一致。综上所述,当酶解温度50 ℃,酶解时间2 h和加酶量1 g/L条件下得到的低聚木糖用于增值青春双歧杆菌的效果最好。结合前述研究结果可得出:当在一定酶解条件下得到的低聚木糖含量最高,平均聚合度最小,木二糖,木三糖和木四糖的含量比值最小时,低聚木糖增值青春双歧杆菌的效果最佳。
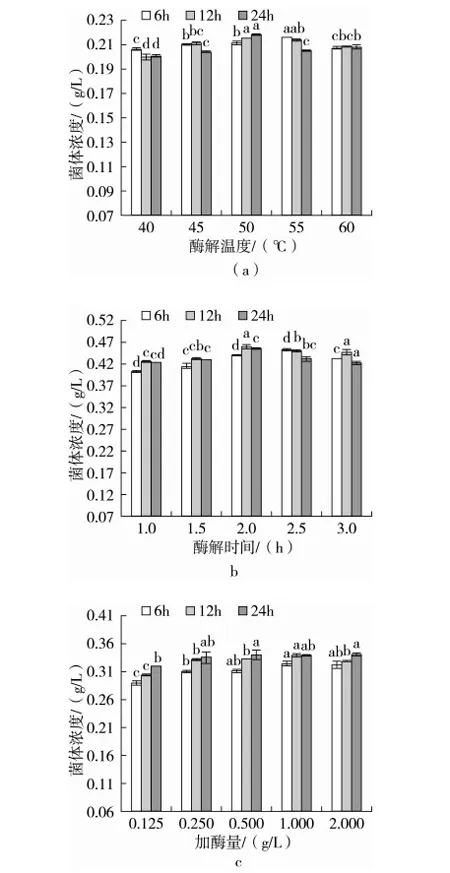
图3 不同酶解条件制得低聚木糖对发酵液中菌体浓度的影响 注:在发酵0 h时,不同酶解温度和酶解时间制备的低聚木糖培养菌种时发酵液中菌体浓度均为0.07 g/L;在发酵0 h时,不同加酶量制备的低聚木糖培养菌种时发酵液中菌体浓度均为0.06 g/L;a,b和c表示在相同发酵时间时,不同酶解条件下制备的低聚木糖培养菌种时菌体浓度差异性, 不同小写字母表示处理在P<0.05水平差异显著。
2.4.2 不同酶解条件得到的低聚木糖对菌种代谢产物的影响
青春双歧杆菌代谢低聚木糖后发酵液的pH值均有明显下降,这是因为双歧杆菌代谢糖类化合物时产生有机酸的影响。表4显示了不同酶解条件得到的低聚木糖培养青春双歧杆菌时对发酵液中代谢产物的影响。由表4~表6可知,以不同酶解温度、酶解时间和加酶量产生的低聚木糖作为碳源培养青春双歧杆菌时代谢产物主要为乳酸、乙酸和丙酸,其中乙酸含量最多;所有碳源发酵时,随着发酵时间的延长,乳酸、乙酸和丙酸的含量均有明显增加,当发酵时间为24 h时乙酸和丙酸含量达到最大,乳酸含量趋于平稳或稍有降低,这与发酵液中pH值的变化趋势相一致。表4表明了青春双歧杆菌代谢经不同酶解温度处理获得的低聚木糖时发酵液中代谢物含量变化,在发酵12 h时,菌种代谢酶解温度由40 ℃升高至50 ℃制备的低聚木糖时发酵液中总有机酸含量逐渐上升,继续增加酶解温度制备低聚木糖培养青春双歧杆菌时发酵液中的总有机酸含量逐渐下降;由酶解温度为45 ℃得到的低聚木糖,当培养24 h时发酵液中乙酸含量最大,占总有机酸的54.81%,酶解温度为50 ℃的次之,占总有机酸含量的52.60%,当代谢酶解温度为50 ℃制备的低聚木糖时丙酸含量最大,占总有机酸含量的41.42%。青春双歧杆菌代谢经不同酶解时间处理得到的低聚木糖产生的代谢物含量。由表5可见,随着酶解时间的延长得到的低聚木糖培养菌种时发酵液中总有机酸含量逐渐增加,当酶解时间为2 h时总有机酸含量达到最大为3.08 g/L;酶解时间为1.5 h得到的低聚木糖在发酵24 h时产生的乙酸含量最多,酶解时间为2 h的次之,丙酸含量在发酵酶解时间为2 h得到的低聚木糖时达到最大。表6显示青春双歧杆菌代谢经添加不同加酶量得到的低聚木糖产生代谢物的含量,当加酶量由0.125 g/L增至0.25 g/L所得到的低聚木糖培养24 h时,发酵液中总有机酸、乙酸和丙酸含量均达到最大,当继续增加加酶量时乙酸和丙酸含量均无明显变化。因此结合不同酶解条件下得到的低聚木糖对青春双歧杆菌增值影响结果可得出,酶解条件对青春双歧杆菌产生代谢物含量的影响与菌种增值变化趋势相一致。

表4 不同酶解温度下得到的低聚木糖对发酵液中代谢产物的影响
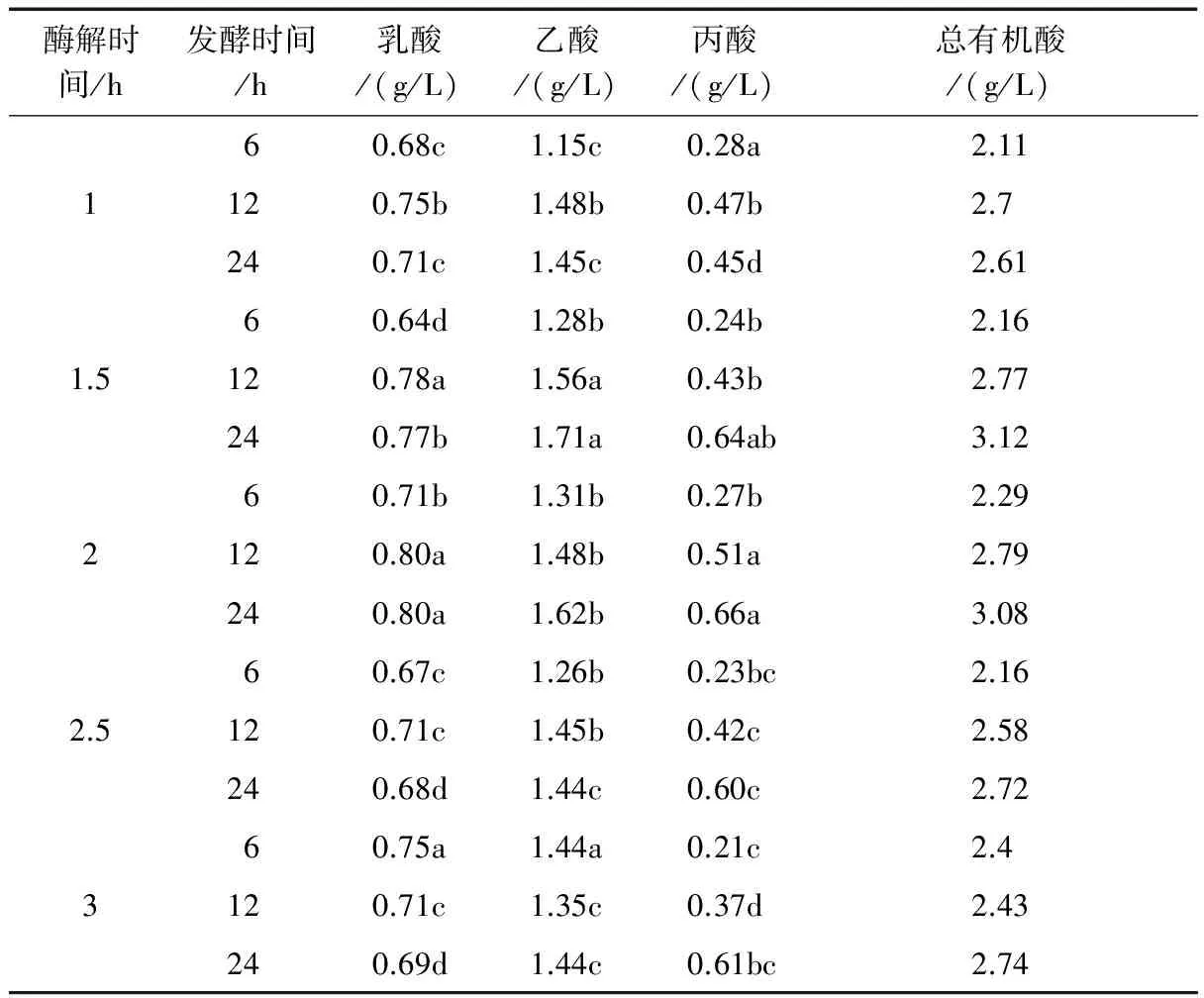
表5 不同酶解时间下得到的低聚木糖对发酵液中代谢产物的影响
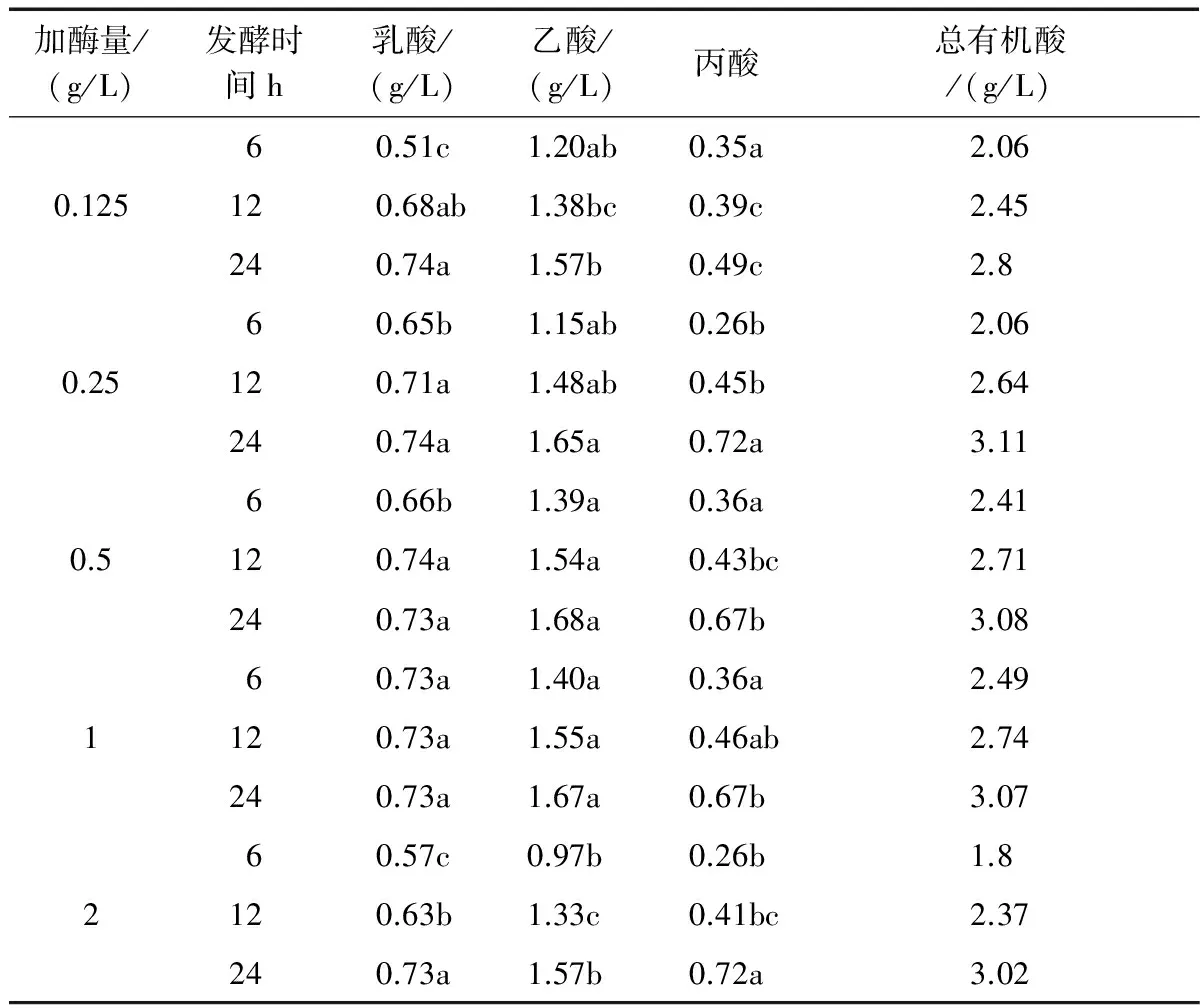
表6 不同加酶量下得到的低聚木糖对发酵液中代谢产物的影响
注: a,b和c表示在相同发酵时间时,不同酶解条件制备的低聚木糖培养菌种时代谢产物含量的差异性,不同小写字母表示处理在P<0.05水平差异显著。
3 结论
通过研究不同酶解条件对麦麸低聚木糖含量、平均聚合度、糖组成和益生元活性的影响可得出,在一定的范围内随着酶解时间的延长、酶解温度和加酶量的增加,低聚木糖含量增加,平均聚合度降低,木二糖,木三糖和木四糖含量比值减小;不同酶解条件下得到的低聚木糖培养青春双歧杆菌的菌体浓度含量均有不同程度的增加,青春双歧杆菌代谢不同酶解条件下得到的低聚木糖发酵液中代谢产物均包含乳酸、乙酸和丙酸,乙酸含量最高,其产酸量变化趋势与菌体浓度和低聚木糖含量相一致,与低聚木糖平均聚合度相反;当酶解温度50 ℃,酶解时间2 h和加酶量1 g/L时,低聚木糖含量达到最大为101 mg/g,平均聚合度降至最小3.23,菌体浓度增值倍数达到最大为5.65倍;可得出低聚木糖结构和益生元活性两者之间的关系:随着酶解条件的变化,低聚木糖含量最大时,平均聚合度趋于最小,木二糖、木三糖和木四糖的相对含量比值趋于最小,低聚木糖的益生元活性最佳。
参考文献:
[1]冯昕,陶静,王吉中.麦麸低聚木糖产品的分离纯化及定性分析[J]. 食品工业, 2012,33(8):80-84.
[2]Wang J,Cao Y,Sun.B,et al. Wheat bran xylooligosaccharides improve blood lipid metabolism and antioxidant status in rats fed a high-fat diet[J].Carbohydrate Polymer,2011,86(3):1192-1197.
[3]Saad N, Delattre C, Urdaci M,et al. An overview of the last advances in probiotic and prebiotic field[J].LWT-Food Science and Technology,2013,50(1):1-16.
[4]张帆.小麦麦麸中低聚木糖的生物酶法制备技术研究[D]. 陕西科技大学, 2012.
[5]蒲江华,赵峡.低聚木糖不同聚合度组分的相对含量分析[C]. 全国第二届海洋与陆地多糖多肽及天然创新药物研发学术会议论文集,2015.
[6]胜华,欧仕益,赵健,等.利用蔗渣制备低聚木糖的工艺[J].食品研究与开发,2010,31(4):23-27.
[7]田龙,王云,马晓建.小麦秸秆酶法制备低聚木糖及其抗氧化活性的研究[J].食品科学,2014,85(20):88-92.
[8]张梅红.小麦麸皮中阿拉伯木聚糖的制备及益生元活性研究[D]. 中国农业科学院,2013.
[9]GB/T 23874—2009,饲料添加剂木聚糖酶活力的测定分光光度计法[S].
[10]晁正,冉玉梅,杨霞,等.麦麸中低聚木糖的制备及抗氧化活性研究[J]. 核农学报,2014,28(4):655-661.
[11]张军华.低聚木糖单一组分的制备分离及其用于双歧杆菌的体外培养[D]. 南京林业大学,2005.
[12]Katrien Swennen, Christophe M Courtin, Geert C J E Lindemans,et al.Large-scale production and characterisation of wheat bran arabinoxylooligosaccharides[J]. Journal of the Science of Food and Agriculture. 2006,86:1722-1731.
[13]赵梦丽.小麦阿拉伯木聚糖益生与免疫调节活性研究[D]. 中国农业科学院,2015.
[14]晓莉.低聚木糖各组分的层析分离及对双歧杆菌的增值[D].南京林业大学,2006.
[15]徐勇,江华,勇强,等. 低聚木糖对青春双其杆菌的增长[J]. 食品科学,2001,22 (7):15-17.●
