微藻去除水中低浓度硝态氮的研究
2017-05-11杨淼施宇震施永生王琳胡柠檬
杨淼+施宇震+施永生+王琳+胡柠檬
摘要:利用微藻去除水中低浓度硝态氮,无需供应氧气、不产生二氧化碳且微藻的生物体尚可有利用价值。研究筛选了3种微藻([FACHB-12]斜生栅藻(Scenedesmus obliquus)、[FACHB-8]普通小球藻(Chlorella vulgaris)、盐藻(Dunaliella sp.))进行水中低浓度硝态氮去除率实验,证明了3种微藻均对水中硝态氮有较好的适应性和去除效果。其中,对NO2-的去除率均大于对NO3-的去除率。淡水藻比盐藻对水中硝态氮的去除率要高。
Abstract: To remove the low concentration nitrate in water by microalgae, there is no need of oxygen supply, no carbon dioxide produced, and the microalgae organisms still can be useful. Three microalgae, including Scenedesmus obliquus, Chlorella vulgaris and Dunaliella sp. are screened for the experiment of removing low concentration nitrate in water. It was proved that the three microalgae had great adaptability and removal effect on nitrate nitrogen in water. The removal rate of NO2- was higher than that of NO3-. The removal rate of NO3+ of fresh algae is higher than that of Dunaliella salina
关键词:微藻;硝态氮;藻类筛选;去除效果
Key words: microalgae;nitrate nitrogen;algae screening;removal effect
中图分类号:X703 文献标识码:A 文章编号:1006-4311(2017)15-0196-05
0 引言
水污染防治中硝态氮是非常重要的控制物[1]。硝态氮在水中主要以NO2-及NO3-形式存在[2、3]。微生物脱氮是目前经济、有效及应用最广泛去除水中氨氮及硝态氮的方法[4、5、6]。但是,微生物脱氮需要动力向水中提供充足的氧气[7、8],微生物脱氮过程中产生大量的二氧化碳,处理后生物残体的处置也是难题[9、10],处理后的再生水用来灌溉土地,会使硝态氮在土壤里残留、积累并对地下水造成一定的污染[11]。若进一步筛选微生物,利用微藻去除水中硝态氮,则微藻的易得、生长速率快、占用空间少、光合效率高等独有特点使硝态氮得到去除的同时,可产生大量氧气并实现生物固碳、固氮,避免传统生物处理中供氧消耗动力、产生大量二氧化碳的问题。精纯的微藻生物质还有较好的商业价值,会使水中硝态氮去除处理过程低碳、环保及资源化。由此可见,此项研究是十分有意义的。
据报道,杜氏盐藻Dunaliella tertiolecta可以直接利用水中的NO2-及NO3-为氮源[12]。李涛等[13]通过对20株淡水和海洋微藻的研究,发现栅藻Scenedesmus sp.是最具产业化潜力的微藻,其总脂收获量和单位体积总脂产率分别为3.5g/L和218.7mg/L.d,并且对亚硝酸盐的吸收有明显的效果。李天培等[14]对15种小球藻菌株进行水中高浓度亚硝酸盐(HN,176.5mmol/L)耐受程度的实验,经过筛选发现小球藻Chlorella sp.菌株能维持稳定的增长率且细胞内TAG积累量比其他实验菌株多2倍。小球藻Chlorella sp.对亚硝酸盐的去除率为60%[15]。
本文主要对12种富油脂微藻(淡水藻9种,盐水藻3种)进行筛选、驯化,对2种野生杂藻进行对比培养,并分析研究了微海藻对水中NO2-及NO3-的适应性及去除效果。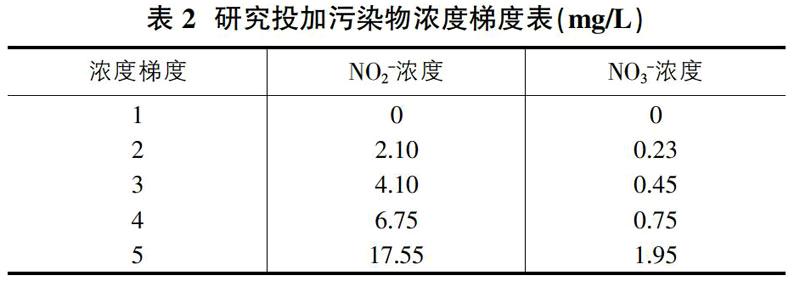
1 方法及内容
1.1 藻类的筛选及培养
藻类的筛选主要目的是通过筛选过程,产生一个生产富含营养素成分高的目标生物产品的菌株,或者能去除非目标产物及营养物的菌株。查閱文献资料得知各种藻类的生长环境、自身生物素含量及对水中NO2-及NO3-的去除率等因素的基础上,确定实验研究藻种,表1是初步筛选出的15种富油脂藻类的营养成分组成。通过对比15种微藻生长周期、生长速度、生长环境及藻类的营养成分组成,最为有利的研究对象为小球藻、栅藻、微绿球藻、衣藻和盐藻、螺旋藻等12种微藻为研究对象。
微藻来源:[FACHB-2]小球藻(Chlorella protothecoides)、[FACHB-5]蛋白核小球藻(Chlorella pyrenoidosa)、[FACHB-8]普通小球藻(Chlorella vulgaris)、[FACHB-12]斜生栅藻(Scenedesmus obliquus)、[FACHB-265]莱茵衣藻(Chlamydomasreinhardtii)来源于中国科学院水生生物研究所(Institute of Hydrobiology,Chinese Academy of Sciences);螺旋藻(Spirula)、螺旋藻淡水(Spirula)、小球藻淡水(Chlorella sp.)、微绿球藻(Nannochloropsisoculta)、微绿球藻淡水(Nannochloropsisoculata)、盐藻(Dunaliella sp.)、小球藻F5(Chlorella sp.)来源于中国科学院海洋生物研究所(Institute of Oceanology, Chinese Academy of Sciences);野生杂藻来源于昆明滇池(第一种来源于滇池草海、第二种来源于滇池排污入口)。
培养基:BG11培养基、SE培养基、f/2培养基。
微藻培养:[FACHB-265]莱茵衣藻(Chlamydomas reinhardtii)使用SE培养基培养,螺旋藻(Spirula)、微绿球藻(Nannochloropsisoculata)、盐藻(Dunalilla sp.)使用f/2培养基培养,其余全部使用BG11培养。每种藻培养时以1:20(藻液5ml:培养基100ml)接种到玻璃三角瓶中,每日定时摇动三角瓶2次,培养温度25℃,光照条件2000Lux,培养基pH值6.8-8.0。培养7天,使微藻的吸光度在0.5Abs以上。
1.2 硝态氮的浓度及投加
根据再生水、地表水及地下水等多类水体的硝态氮浓度调查,水体中总氮含量为18.6mg/L,其中80.6%的存在形式是硝态氮[16]。研究设计,投加硝态氮的总含量为15 mg/L,其中亚硝态氮含量占90%,硝态氮含量占10%。浓度梯度分配见表2。
微藻的培养和筛选研究,将培养基和微藻溶液以20:1的比例,即培养基100mL,微藻溶液5mL接种在250mL锥形瓶中,培养7天,使微藻的吸光度在0.5Abs以上,连续加21天污染物。在100mL微藻培养液中投加0.0148mol/L硝酸钠和0.25mol/L亚硝酸钠溶液,两种溶液的每日投加量见表3。
微藻在培养筛选的过程中,每天在加污染物前用紫外分光光度计(波长600纳米)测定每种微藻的吸光度,换算成微藻的颗粒密度,计算其生长速率,确定对硝态氮抗性强、生长率高的微藻。
1.3 研究过程
由上选出三种微藻[FACHB-12]斜生栅藻(Scenedesmus obliquus)、[FACHB-8]普通小球藻(Chlorella vulgaris)、盐藻(Dunaliella sp.)作研究。
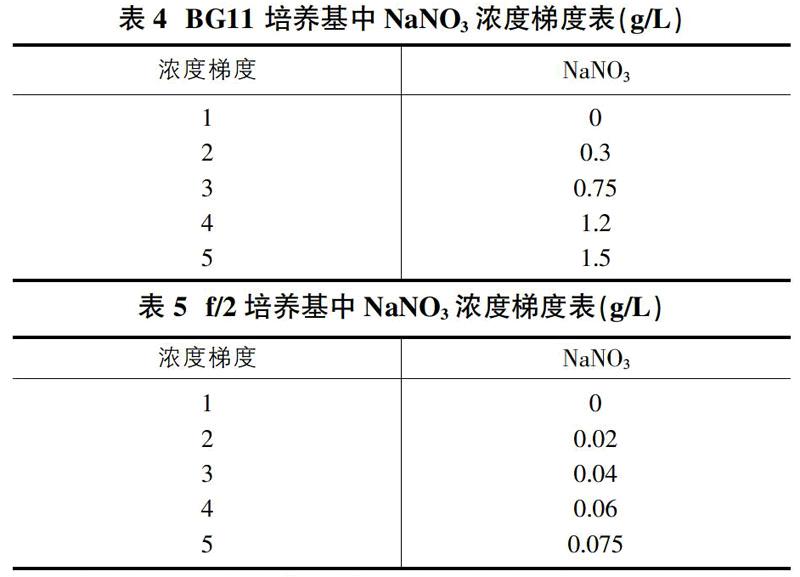
将培养基中用作氮源的NaNO3分5个浓度梯度,具体浓度见表4、表5。
用离子色谱法测定NO2-、NO3-去除率:取第一批筛选试验中培养21天第4浓度梯度的微藻[FACHB-12]斜生栅藻(Scenedesmus obliquus)、[FACHB-8]普通小球藻(Chlorella vulgaris)、盐藻(Dunaliella sp.),分别接种在表4、表5的5种浓度梯度相应的培养基中培养7天,然后每天加入表3中NaNO3和NaNO2第4浓度梯度相应的量,持续加入21天,每天用离子色谱仪测定溶液中NO3-、NO2-的量,计算其去除率。
2 研究结果及分析
2.1 藻类筛选数据分析
对于微藻生长过程中的每日检测发现,溶液中溶解氧高达20.7mg/L,长势良好的微藻的pH值范围为8.5-10.92。微藻的生物质浓度(每升干重)计算方法参考[17]建立的光密度与细胞干重间的关系如下: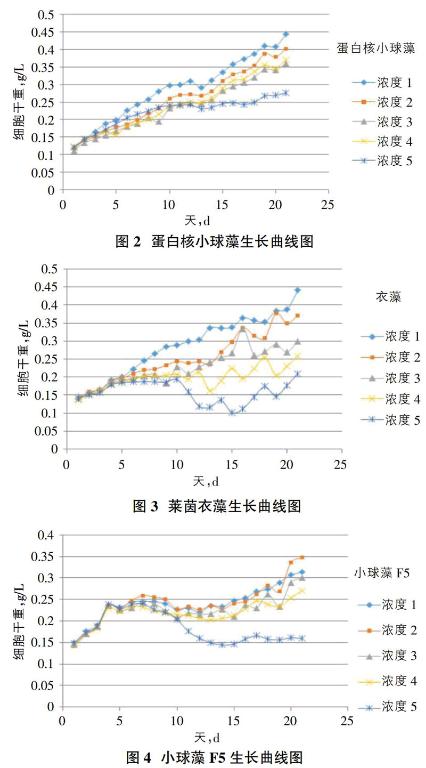
根据7天对微藻的复活培养,螺旋藻、淡水螺旋藻及小球藻(盐水)都没能成功复活,所以最后培养12种微藻,根据12种海藻21天加入表3中硝酸钠和亚硝酸钠的量比较12种藻的生长曲线,见6种有代表性微藻生长曲线图1~4。
根据12种微藻21天培养生长趋势曲线对比,发现[FACHB-2]小球藻(Chlorella protothecoides)、[FACHB-5]蛋白核小球藻(Chlorella pyrenoidosa)、[FACHB-8]普通小球藻(Chlorella vulgaris)、[FACHB-12]斜生柵藻(Scenedesmus obliquus)、小球藻淡水(Chlorella sp.)、盐藻(Dunaliella sp.)这6种微藻在每种浓度梯度加入量情况下生长趋势良好;[FACHB-265]莱茵衣藻(Chlamydomasreinhardtii)、微绿球藻(Nannochloropsisoculata)、微绿球藻淡水(Nannochloropsisoculata)在第1、2、3浓度梯度加入量情况下生长呈上升趋势,第4浓度梯度及第5浓度梯度生长到一星期左右呈现下降趋势,并且[FACHB-265]莱茵衣藻(Chlamydomasreinhardtii)生长过程中附壁现象比较严重,除此之外,其生物细胞会结成大量的团块状物质,严重影响实验数据最终的准确度;小球藻F5(Chlorella sp.)在第1、2、3、4浓度梯度情况下生长呈上升趋势,在第5浓度梯度投加量情况下生长一星期后生长趋势呈下降状态;滇池排污沟取样的杂藻的生长在5种浓度梯度下都呈上升趋势,滇池草海中的野生杂藻没有固定的生长趋势规律。由此可见我们对比第5浓度梯度下各种微藻的生长趋势曲线就可以筛选出在水中硝态氮浓度为15mg/L下能正常存活的微藻,见图5。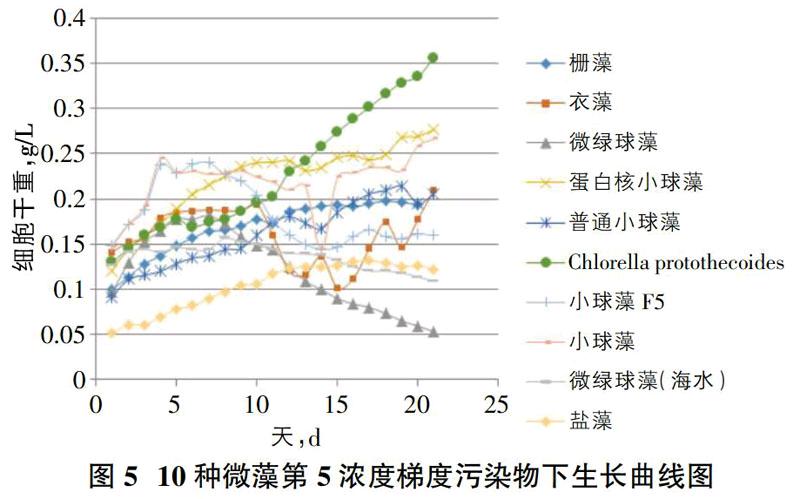
如图5所示,能在第5浓度梯度硝酸钠和亚硝酸钠投加量的情况下依然呈平稳上升趋势的微藻有[FACHB-2]小球藻(Chlorella protothecoides)、[FACHB-5]蛋白核小球藻(Chlorella pyrenoidosa)、[FACHB-8]普通小球藻(Chlorella vulgaris)、[FACHB-12]斜生栅藻(Scenedesmus obliquus)、小球藻(Chlorella sp.)、盐藻(Dunaliella sp.)。通过分析以上6种生长趋势良好微藻的平均生长速率图6,确定此研究筛选的最适微藻。
由图6可知,在加入第5浓度梯度氮氧化物量的21天连续培养过程中[FACHB-2]小球藻(Chlorella protothecoides)、[FACHB-5]蛋白核小球藻(Chlorella pyrenoidosa)、小球藻(Chlorella sp.)、[FACHB-8]普通小球藻(Chlorella vulgaris)、[FACHB-12]斜生栅藻(Scenedesmus obliquus)、盐藻(Dunaliella sp.)的平均生长速率是由大到小的关系。其中前4种都是相同的种类的小球藻系列微藻,由此可见,小球藻种在去除水中硝态氮的方向具有无限潜力。
2.2 硝态氮去除数据分析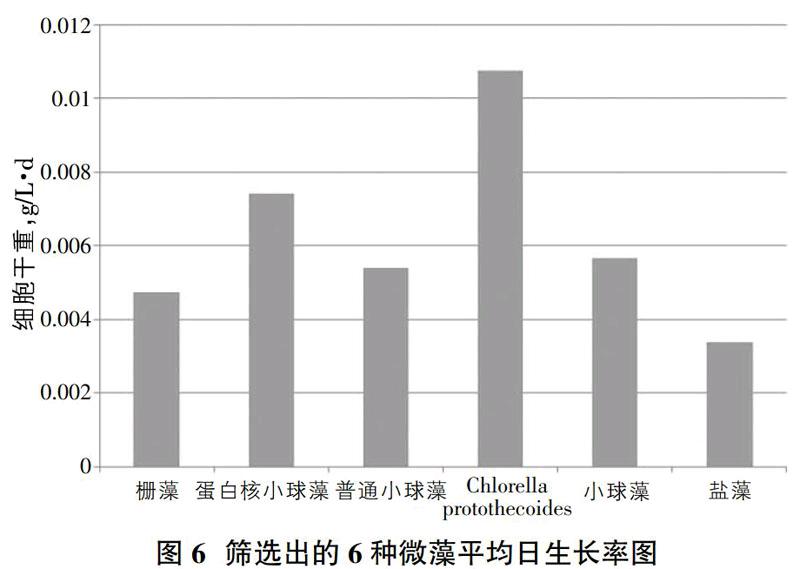
通过筛选试验,发现有6种微藻在添加硝态氮达20mg/L的浓度后仍然能生长良好,证明这6种微藻在加入高浓度硝态氮时能较好存活。
在微藻对硝态氮去除实验中,每天加入NO3-、NO2-,通过离子色谱法测定每天溶液中NO3-、NO2-的浓度,计算微藻对硝态氮的吸收率。
选择的[FACHB-8]普通小球藻(Chlorella vulgaris)、[FACHB-12]斜生栅藻(Scenedesmus obliquus)、盐藻(Dunaliella sp.)3种微藻,连续21天使用离子色谱仪测定NO3-、NO2-含量,计算每天微藻吸收NO3-、NO2-的量。三种微藻21天平均生长率图7~9发现,普通小球藻、栅藻两种淡水微藻培养基中无氮源的情况下,加入的硝态氮污染物的微藻比没有加入硝态氮微藻生长速率快。但是,对于盐藻来说加入硝态氮的微藻平均生长率低于不加硝态氮的微藻。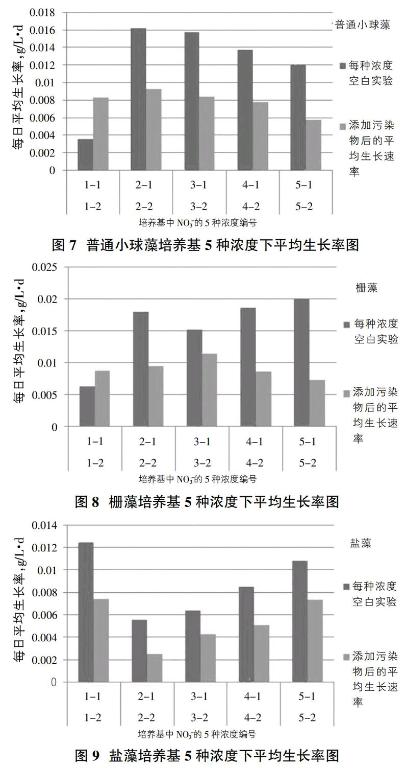
3种微藻对硝态氮的平均每日去除率,见表6。每种微藻对于NO2-的去除率大于NO3-的去除率。普通小球藻在第4浓度梯度(即NaNO3含量1.2g/L)培养基中对NO2-的去除率最高,为72.86%,在没有氮源的培养基中(即NaNO3含量0g/L)对NO3-去除率最高为28.93%。栅藻在第3浓度梯度培养基(即NaNO3含量0.75g/L)中对于NO2-的去除率最高,为85.66%,在第5浓度梯度(即NaNO3含量1.5g/L)培养基中对于NO3-去除率最高,为62.66%。对于盐藻,其吸收效果远没有两种淡水藻吸收效果好,在没有氮源的培养基中(即NaNO3含量0g/L)对NO2-的去除率最高,为17.46%,在第4浓度梯度(即NaNO3含量1.5g/L)对NO3-的吸收率最高为1.64%。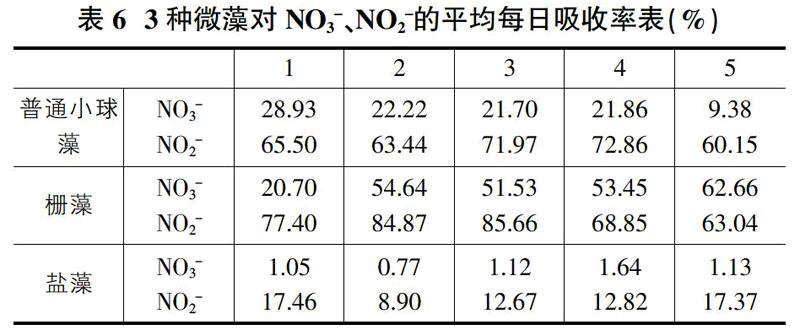
3 结论
①微藻生物能够在硝态氮浓度较高的水中存活(高达20mg/L),并且将水中的氨氮作为微藻生存所需要的氮源。
②微藻生物对水中的NO2-的去除率高达为85.666%,对NO3-去除率高达62.66%;微藻对硝态氮的吸收中,NO2-的去除率大于NO3-去除率。淡水藻对硝态氮吸收效果远比盐藻好。
③微藻脱氮同时产生氧气并吸收二氧化碳,避免传统生物处理中供养耗动力、产生大量的二氧化碳,精纯的微藻生物质还有较好的商业价值。小球藻、栅藻、盐藻因其代谢形成的营养物质丰富且具有降血脂、血压、增阿强免疫力、抗氧化、抗肿瘤、解毒等功效,是很好的保健品。
④微藻对硝态氮去除处理过程低碳、环保及易资源化,将此方法推广到去除水中其他污染物也会有很大的前景。
参考文献:
[1]徐芳香,陆雍森.我国地下水中硝酸盐污染防治及水源保护区划分[J].污染防治技术,1999,12(1):27-31.
[2]张庆忠,陈欣,沈善敏.农田土壤硝酸盐积累与淋失研究进展[J].应用生态学报,2002,13(12):233-238.
[3]宋秀杰,丁庭华.北京市地下水污染的现状及对策[J].环境保护,1999(11):44-47.
[4]Kuenen J G, Robertson L A. Combined nitrification-denitrification process[J]. FEMS Microbiol Rev, 1994, 15(2):109-117.
[5]王建龙.生物脱氮新工艺及其技术原理[J].中国给水排水,2000,16(2):25-28.
[6]李思敏,杜国帅,唐锋兵.改良 A2/O 工艺对低碳源污水的脱氮除磷性能分析[J].中国给水排水,2013,29(12):25-29.
[7]尹超,陆少明,李东,等.曝气生物活性炭滤池深度处理高浓度氨氮原水[J].环境工程学报,2014,8(3):924-928.
[8]桑军强,张锡辉,孟庆宇.水處理中的无泡供氧技术[J].中国给水排水,2003,19(11):25-28.
[9]昝元峰,王树众,沈林华,等.污泥处理技术的新进展[J].中国给水排水,2014,20(6):25-28.
[10]赵华,王海燕,杨金刚,等.污泥减量同步脱氮除磷技术现状分析及研究进展[J].中国给水排水,2013,29(6):28-32.
[11]齐学斌,亢连强,李平,等.不同潜水埋深污水灌溉硝态氮运移试验研究[J].中国农学通报,2007,23(10):188-196.
[12]Negoro, M., Shioji, N. Miyamoto, K., Micira, Y, Growth of Microalgae in High CO2 gas andeffects of SOx and NOx. Applied Biochemistry and Biotechnology, 1991, 28-29(1):877-886.
[13]李涛,李爱芬,桑敏.富油能源微藻的筛选及产油性能评价[J].中国工程生物杂志,2011,31(4):98-105.
[14]Tianpei Li, Gang Xu, Junfeng Rong, Hui Chen, Chenliu Hea, Mario Giordanoe,f,g,Qiang Wang. The acclimation of Chlorella to high-level nitrite for potential application in biological NOx removal from industrial flue gases[J]. Journal of Plant Physiology, 2016, 195:73-79.
[15]Zhang, X., Chen, H., Chen, W., Qiao, Y., He, C., Wang, Q., 2014. Evaluation of an oil-producing green alga Chlorella sp. C2 for biological DeNOx of industrial flue gases[J]. Environ. Sci. Technol. 48 1049, 10497-10504.
[16]陈云峰,文辉,张彦辉.不同固态碳源用于反硝化去除污水处理厂尾水中硝态氮的研究 [J].给水排水,2010(11):140-143.
[17]Yufang Guo.Toluene decomposition performance and NOxby-productformation during a DBD-catalyst process[J].JOURNAL OF ENVIRONMENTAL SCIENCES, 2015,28:187-194.
