香菇寡糖提取及分离纯化研究
2017-05-11王玖玖施永生孙晓红韩梅琳晏卓逸
王玖玖+施永生+孙晓红+韩梅琳+晏卓逸+高红
摘要:为提取食用菌中寡糖,以人工种植香菇子实体为试材,用水提、超滤和纳滤、醇沉等方法提取其中寡糖。①选择料液比、浸提温度和浸提时间3个因素进行单因素实验,确定其条件范围,采用正交试验优化提取条件,得到该工艺下最佳提取工艺参数:料液比1:16,提取温度60℃,提取时间10 min。②优化膜工艺,确定超滤最佳压力为0.75MPa,纳滤最佳压力为1.95 MPa,料液pH为7;③浸提次数为2次,95%乙醇抽提。在此工艺下香菇寡糖的最高得率为1.07%。
Abstract: In order to extract oligosaccharides from edible fungi, taking the artificially cultivated mushroom as the test material, oligosaccharides were extracted by water extraction, ultrafiltration and nanofiltration and alcohol precipitation. First, a single factor experiment was carried out by selecting the ratio of material to liquid, extraction temperature and extraction time to determine the scope of its conditions. The extraction conditions were optimized by orthogonal test, and the optimum extraction parameters were obtained: the ratio of material to liquid was 1:16 , the extraction temperature was 60℃, the extraction time was 10 min. Second, optimized membrane technology to determine the optimal pressure of ultrafiltration was 0.75MPa, the best pressure of nanofiltration is 1.95 MPa, the liquid pH is 7. Third, the extraction times were 2, 95% ethanol extraction. The highest yield of lentinan oligosaccharides was 1.07% under this process.
关键词:香菇寡糖;超滤;纳滤;正交试验
Key words: mushrooms oligosaccharides;ultrafiltration;nanofiltration;orthogonal test
中图分类号:R284.1 文献标识码:A 文章编号:1006-4311(2017)15-0170-05
0 引言
我国人工培育食用菌产业发展迅猛,是一个急待开发的资源宝库[1]。寡糖分子量在300~2000,广泛分布于食用菌类、水果中。但有关香菇寡糖的报道鲜见,香菇寡糖主要成分是β-1,3-葡寡糖[2-4],可以刺激人体产生细胞因子,能有效抗肿瘤、抗辐射[5-7];同时可以诱导植物对病原菌产生抗性,在农业、医药和食品等领域具有广阔的潜在应用价值。
β-1,3-葡寡糖制备主要由多糖水解、人工合成两种方法。这些方法步骤多、产量低、成本高、在实际应用中仍比较困难[8-10]。膜分离是利用半透膜作为选择障碍层,依据膜孔径大小达到分离目的的一门新技术,不仅操作简单,生产过程无污染,而且产物活性高,试验首次采用超滤和纳滤法对香菇寡糖进行分离与纯化,为香菇寡糖的深入研究和全面开发奠定基础。
1 材料与方法
1.1 试验仪器、材料
超滤膜[切割分子量(MWCO)为2000,滤膜的有效面积为0.5m2];纳滤膜[MWCO为300]由厦门福美科技有限公司提供;RNF0460-011卷式膜多功能小试设备。
大批量鲜香菇在收获季节不易储存,因此考虑到实际生产的需要,将香菇烘干粉碎,有利于延长储存时间,试驗以香菇粉为研究对象。
香菇购于北京市蔬菜超市,烘干粉碎机打碎,放置阴凉通风处,备用;无水乙醇(分析纯);苯酚(分析纯);浓硫酸(分析纯);葡萄糖(分析纯)。
1.2 试验方法
1.2.1 香菇寡糖提取流程
香菇寡糖提取流程如图1所示。
1.2.2 不同处理方式对香菇寡糖提取的影响
研究香菇干、鲜程度对寡糖得率的影响:①新鲜香菇洗净、切片,用高速组织捣碎机破碎匀浆;②将新鲜香菇洗净,70℃烘干至恒重后,粉碎机粉碎。
1.2.3 香菇寡糖提取工艺优化
以水为溶剂,采用不同提取时间、温度、料液比[11],分次水提香菇粉,确定单因素最优条件范围。在单因素试验基础上,选取浸提温度(A)、浸提时间(B)、料液比(C)为因素,采取L9(33)正交实验,以提取率为衡量指标。

在确定最优条件后,将水提液加入到RNF0460-011卷式膜设备中过滤,收集滤液,醇沉后冷冻干燥制得成品[12]。
1.2.4 压力对膜通量的影响
膜通量与压力成正比关系,压力越大,通量越大,但是压力越大,能耗越大,成本随之增加,所以研究操作压力的大小对指导实际应用有重要意义。
1.2.5 料液pH对膜通量的影响
料液的pH可以改变聚电解质构型和分散性,分别控制料液pH为3、5、7、9和11,测定膜通量的变化,以及寡糖含量的变化。
1.2.6 水提次数的确定
以上试验基础上,分别测定浸提次数1次、2次、3次对寡糖提取率的影响。
1.2.7 醇抽提方法的确定
甲醇法:5mL水提取液中加入95mL甲醇,搅拌后静置冷却24h后离心。
乙醇法:5mL水提取液中加入95mL甲醇,搅拌后静置冷却24h后离心。
甲醇-乙醇法:5mL水提取液中加入95mL甲醇-乙醇混合物(V:V=1:1),搅拌后静置冷却24h后离心。
1.2.8 香菇寡糖测定
采用苯酚-硫酸法测定香菇寡糖的含量,包括制作标准曲线和测定实验样品香菇寡糖含量两部分[13]。
寡糖提取率根据以下公式计算:
式中,M1寡糖含量、M2香菇粉单位为g。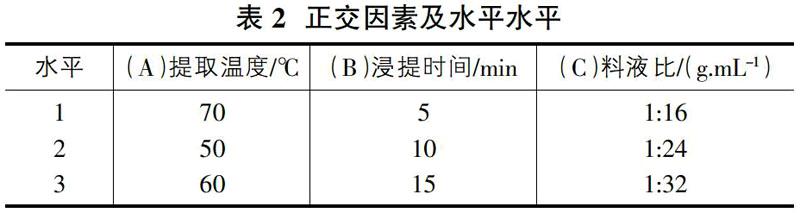
2 结果与分析
2.1 不同处理方式对香菇寡糖提取率的影响
由表1可见,鲜香菇直接破碎匀浆后提取与烘干粉碎再提取,寡糖含量差异不显著,但所得寡糖颜色有明显差异。
2.2 香菇寡糖的提取工艺优化
以水为溶剂,使用不同提取时间、温度、料液比,分次水提香菇粉,过滤后合并提取液,水提液稀释到4L后加入到卷式膜设备中,收集300~2000分子量的寡糖溶液,蒸发溶液至小体积[14],95%乙醇醇沉,过滤,收集滤粉。滤粉复溶于水,真空干燥制得香菇寡糖样品。采用单因素试验和正交试验设计优化提取条件,探讨各条件对香菇寡糖得率的影响。
2.2.1 单因素试验
影响香菇寡糖提取率的因素,经上述分析可知,主要有提取时间、提取温度和料液比3个影响因素。在一定范围内,浸提时间、浸提温度、料液比越大寡糖含量相对越高,但在实际生产过程中,考虑节约成本及提取效率等实际因素,应当综合考虑。
2.2.1.1 单因素提取时间试验结果
20g香菇粉,在提取温度70℃,料液比1:20条件下进行提取,提取时间对寡糖提取率影响结果如图3。
图3所示,随着提取时间的增长,提取率在一定范围内呈上升趋势,10min时达到最大提取率1.04%,之后随着时间的延长呈下降趋势,造成上述现象的原因:①完成上述实验过程需要足够时间,在最初10min,寡糖的含量有明显的增加,随着提取时间延长,寡糖含量下降,这是由于寡糖在长时间提取过程中进一步被水解破坏,致寡糖含量降低,使提取率下降;②随着时间的持续,部分香菇多糖溶解,多糖结构中重复单元的有序链段,能与另一个多糖链的相同序列链段发生缔合,形成双螺旋,构成具有网状结构的凝胶,对寡糖的吸附有一定影响。为缩短工时降低能耗,选择提取时间为5~25min进行正交实验为宜[15~16]。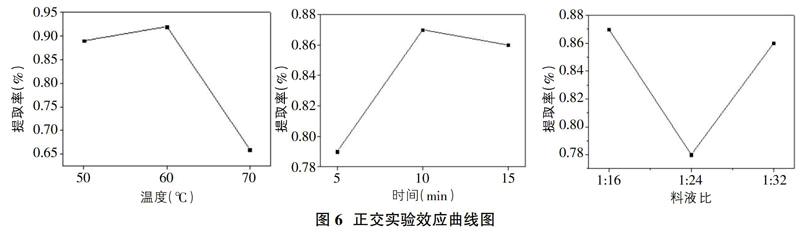
方差齐性检验结果p=0.379>0.05,變异数分析结果F=209.849,显著性p<0.05,影响显著。
2.2.1.2 单因素提取温度试验结果
20g香菇粉,提取时间10min、料液比为1:20条件下,提取温度对寡糖提取率的影响结果见图4。
图4所示,提取率随着提取温度的升高而上升,提取温度为60℃时达到最高提取率1.07%。提取温度大于60℃后,提取率随着温度升高降低。造成上述现象的原因是:①香菇子实体的细胞壁存在多糖和寡糖,这部分多糖对细胞组织起着软化和粘合的作用,随着温度不断升高,水分子运动加快,多糖分子之间的氢键容易被破坏,多糖糖基上的羟基、糖苷键上的氧原子更容易与水分子结合形成氢键,使多糖在水中溶解度增大,部分香菇多糖溶解;②香菇多糖具有β-1,3-葡萄糖苷键,是一种直链多糖,直链多糖粘稠性强于支链多糖,可以吸附一部分寡糖,寡糖提取率降低;③温度可以影响不同聚合度寡糖的提取,有实验研究显示,低聚合度寡糖(聚合度2~6)的水解适宜温度为70°C,但是随着提取温度继续升高,低聚合度寡糖逐渐水解为葡萄糖;游离状态的多糖容易被破坏而生成聚合度较大的寡糖,随着水解进行,多糖分子继续水解生成寡糖速度较慢,而小分子寡糖生成葡萄糖的速度相对较快,导致寡糖收率降低,所以选择提取温度50~70℃进行正交实验为宜[17~18]。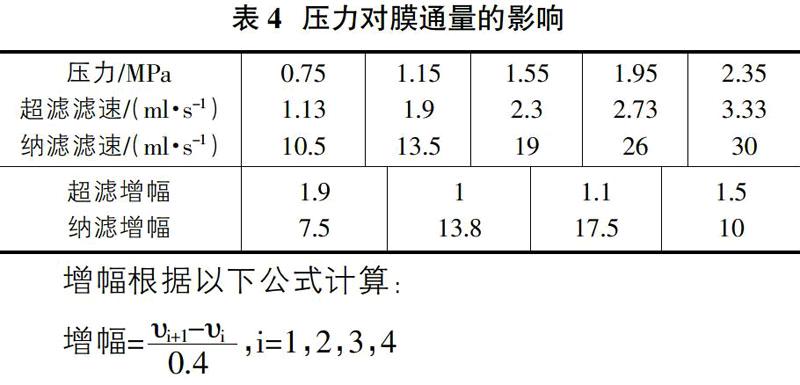
方差齐性检验结果p=0.679>0.05,变异数分析结果F=321.088,显著性p<0.05,影响显著。
2.2.1.3 单因素料液比的影响
20g香菇粉,在提取温度50℃,提取时间10min条件下,料液比对寡糖提取率的影响结果见图5。
如图5所示,料液比增大,香菇寡糖提取率在一定范围内上升,当料液比达到1:24时,提取率达到最高0.84%,继续增加料液比,提取率不再明显上升,反而下降。造成上述现象的原因是:①料液比过小,寡糖溶解不完全,所以寡糖提取率较低,料液比持续增加,香菇寡糖提取量在一定范围内增加,当料液比达到1:24时,基本可以溶解所有寡糖。②卷式膜设备分离寡糖过程中,膜对寡糖也存在一定吸附,也会增加膜对寡糖截留率,致提取率比较低。由于料液比是影响提取率的重要因素,选择料液比1:16~1:32进行正交实验为宜。
方差齐性检验结果p=0.349>0.05,变异数分析结果F=24.670,显著性p<0.05,影响显著。
2.2.2 香菇寡糖提取正交实验
按95%乙醇提取,选取浸提温度、浸提时间、料液比进行三因素三水平正交试验,试验结果见表3。
正交实验效应曲线如图6所示。
图6大致反映了温度(A)、时间(B)、料液比(C)对寡糖提取率的影响,较高的温度对寡糖的提取有益,而相对较短的时间也有利于寡糖的溶解,相对较低的料液比,降低多糖对寡糖的吸附等影响,也对寡糖的提取有益[19-20]。极值R反应了不同因素的水平改变对实验结果影响的大小,其值越大,所在列的因素影响也越明显,极差R值的大小是A>C>B,因此各因素对寡糖提取率的影响主次为A>C>B,最佳寡糖提取工艺条件是A3B2C1,即60℃、10min、1:16时,此优化条件下,香菇寡糖的提取率可达1.07%。
2.2.3 香菇寡糖浸提液的分级纯化过程
利用超滤、纳滤技术实现香菇寡糖的分级纯化,料液初始浓度会影响其截留性能,浓度过大,超滤过程中滤膜上的凝胶层越易形成,膜污染的程度越大,对膜伤害越大;同时操作压力越大,料液循环速度越快,但是操作压力过高,膜的压密效应显著,膜孔径会变小,也不利于膜滤;过滤过程中滤液的温度对膜分离过程的传质效果、膜面沉积等都有着较大影响。
滤膜的污染是不可逆的,因此将浸提液稀释到4L,温度降为室温,控制操作压力为0.75MPa和1.95MPa,把浸提液依次用截留相对分子质量为2000和300的卷式膜过滤,收集300~2000分子量的寡糖溶液,整个过滤过程控制温度在25℃~40℃。
2.2.4 压力对膜通量的影响
操作压力对膜通量的影响可以分为低压、中压、高压,不同压力影响膜通量的主导阻力不相同,相应的有不同的控制方法。在最佳工艺条件下,考察压力对通量的影响,实验结果如表4所示。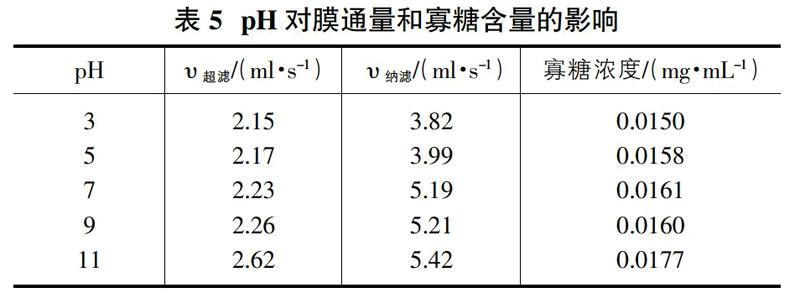
增幅根据以下公式计算:
由表4可知,操作压力由0.75MPa上升到2.35MPa的过程中,超滤和纳滤膜滤速也是呈上升趋势,但料液流速的加快势必会增加系统的能耗,所以料液流速不能无限制地升高,通过对比增幅,可以相对准确的确定膜压力。超滤膜压力由0.75MPa升高到2.35MPa时,压力改变0.4MPa,滤速由1.13增加到1.9,则滤速增幅为1.9;同理可知,纳滤膜从1.55MPa升高到1.95MPa,滤速增幅为17.5。
RNF0460-011卷式膜膜芯2000Dal(超滤)走水测试低压为0.35MPa,高压1.1MPa,超滤最高压力一般控制在1.1MPa以内;模芯300Dal(纳滤)走水测试低压为0.69MPa,中压1.55MPa,高压2.5MPa以上。在实际应用中,操作压力通常选择在中压区,这样既能保证有较高的膜通量,又可以预防凝胶层形成,以免过滤总阻力过高。
综合以上因素考虑,选定超滤膜压力为0.75MPa,纳滤膜为1.95MPa。
2.2.5 料液pH对膜通量的影响
在用膜分離寡糖中,料液中蛋白质、酶会被吸附在膜上,降低膜通量,甚至形成凝胶层,造成膜污染,在不影响寡糖提取率的条件下,将pH值调至远离等电点,可以减少膜污染。相同体积4L,相同初始浓度(多糖和寡糖)0.0219mg/ml的溶液,分别调pH为3、5、7、9、11,膜通量和寡糖含量的结果如表5。
料液中蛋白质、酶等含量很低,如表5所示,pH的改变对膜通量影响不显著,pH过低或者过高,不仅会对膜造成一定程度腐蚀而且可能改变寡糖性质,对比寡糖浓度,最终确定料液pH为7。
2.2.6 浸提次数的确定
在上述试验的基础上,选用提取温度50℃、提取时间10min、料液比为1:24的条件下,浸提次数对糖提取率的影响结果: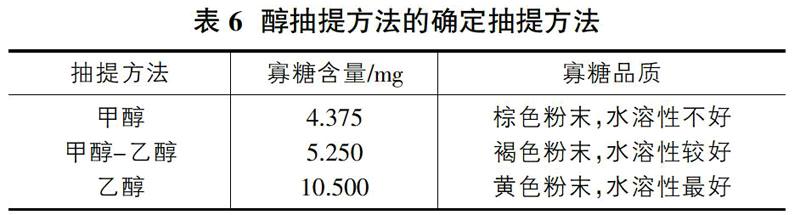
抽提一次,香菇寡糖提取率为0.44%,抽提两次,提取率为0.64%,抽提三次时,香菇寡糖提取最多为0.84%,但是在实验过程中,残渣越来越难过滤,第三次抽滤时间甚至超过第一次和第二次抽滤时间之和,能耗过大,因此确定提取次数为2次。
2.2.7 醇抽提方法的确定
寡糖不溶于醇等有机溶剂,水提醇沉法是常见的提取方法,试验设备简单,操作容易,但耗时长、提取过程醇使用量大,所以为了降低成本,适用于大规模的工业生产,研究不同的醇抽提方法有重要意义。实验结果如表6。
表6可知,乙醇抽提法可以得到品质好、含量高的寡糖,因此确认工艺的醇提方法为95%乙醇抽提。
3 小结
①水提-膜过滤-醇沉工艺提取香菇中寡糖的主要影响因素是料液比、浸提时间和浸提温度。②香菇寡糖的最佳提取工艺参数是:温度为60℃,料液比为1:16(g/mL),浸提时间为10min。超滤膜操作压力为0.75MPa,纳滤膜操作压力1.95MPa,料液pH为7。③将香菇粉按优化出的最佳条件提取2次,经卷式膜过滤和95%乙醇醇沉,最终寡糖的提取率为1.07%。
参考文献:
[1]寇一翾,吕世奇,刘建全,赵长明,等.寡糖类能源植物菊芋及其综合利用研究进展[J].生命科学,2014,26(5):451-455.
[2]LIU Senlin,CHEN Weizhao,WANG Yong,etal.Purification and characterization of a novel neutralβ-glucanase and an alkalineβ-glucanase from an alkaliphilic Bacillus isolate[J]. World Journal of Microbiology and Biotechnology, 2008, 24: 149-155.
[3]KONIG J, GRASSER R, PIKOR H, et al. Determination of xylanase, β-glucanase, and cellulase activity[J]. Analytical and Bioanalytical Chemistry, 2002, 37: 80-87.
[4]QIAO Jiayun, ZHANG Bo, CHEN Yiqun, et al. Codon optimization, expression and characterization of Bacillus subtilisMA139β-1,3-1,4- glucanase in Pichia pastoris[J]. Biologia, 2010, 65(2): 191-195.
[5]Zhang Y Y,Xu X J ,Zhang LN.Gel formation and low-temperature intramolecular conformation transition of a triple-helical polysacchari-delentinan in water[J].Biopolymers ,2008,89 (10) : 852-861.
[6]Surenjav U,Zhang L,Xu X,et al . Effects of molecular structure on antitumor activities of 63( 1) : 97-104.
[7]Zhang L N,Li X L,Xu X J,et al . Correlation between antitumor activity,molecular weight, and conformation of lentinan [J].Carbohydrate Research, 2005, 340( 8) : 1515-1521.
[8]王照波,周文美,徐子婷,等.雪蓮果水溶性低聚糖的提取工艺[J].贵州农业科学,2010,38(2):173-176.
[9]王江浪,许增巍,马惠玲,等.由苹果渣制备果胶低聚糖的工艺[J].农业工程学报,2009,25(S1):122-128.
[10]马红霞,周忠波,包海鹰,等.树舌灵芝中分离得到非还原性二糖-海藻糖[J].菌物学报,2008,27(4):582-586.
[11]王卫国,赵永亮.香菇多糖分离最佳工艺及最佳原料探讨[J].中草药,2000,31(8):584-585.
[12]王湛.膜分离技术基础[M].北京:化学工业出版社,2000.
[13]梁存权.比色法测定植物多糖含量方法概述[J].北方药学,2011,8(12):4-5.
[14]谢红旗,周春山,杜邵龙,等.超滤分离和鉴定三种香菇多糖[J].天然产物研究与开发,2007,19(3):369-373.
[15]宗玉.直链β-1,3-葡寡糖的制备、鉴定及其抗菌活性的初步分析[D].江苏无锡:江南大学,2013.
[16]李盛.香菇三螺旋葡聚糖氢键键合作用及其功能化研究[D].武汉:武汉大学,2013.
[17]蒋忠平.猴头菌子实体寡糖的提取、分离及结构研究[D].浙江杭州:浙江工业大学,2009.
[18]张真庆.褐藻胶酶解寡糖的制备、分离和结构鉴定[D].山东青岛:中国海洋大学2003.
[19]陈吉力.洋根中低聚糖的提取[J].安徽农业科学,2007,35(27):8673-8674.
[20]宗玉,李晶,朱莉,等.两步法硫酸水解热凝胶生产β-1,3葡寡糖[J].工业微生物,2014,44(1):22-27.
