枝顶孢霉制剂防治根结线虫过程中土壤酶活性和微生物数量的变化
2017-05-11路鹏鹏陈锐孙晓宇赵玲侠瞿佳
路鹏鹏+陈锐+孙晓宇++赵玲侠++瞿佳++沈卫荣


摘要:为了了解枝顶孢霉制剂在设施黄瓜根结线虫防治过程中对土壤微生态环境的影响,通过田间试验研究了黄瓜不同生长期土壤酶活性和微生物数量变化。结果发现,枝顶孢霉制剂对土壤酶活性和微生物数量的影响在幼苗期较显著,盛果期和拉秧期影响较小;幼苗期,土壤脲酶活性降低,蔗糖酶活性升高,过氧化氢酶和磷酸酶变化不显著;土壤中细菌数量减少,放线菌数量变化不显著,真菌数量增加;盛果期仅蔗糖酶活性提高,拉秧期土壤酶活性和微生物数量变化均不显著;土壤微生物数量和土壤酶活性具有一定相关性,且随黄瓜生长期发生变化。结果表明,枝顶孢霉制剂对土壤微生态环境的影响主要在幼苗期,此影响有利于黄瓜幼苗生长和根结线虫的防治。
关键词:枝顶孢霉;过氧化氢酶;脲酶;蔗糖酶;磷酸酶;微生物数量
中图分类号: S154.3文献标志码: A文章编号:1002-1302(2017)06-0277-04
随着土壤环境条件的恶化和人们食品安全意识的增强,农药监管日趋严格,市场管理日益规范,新开发的农药必须符合低毒、无公害的发展趋势,微生物农药因符合这样的条件而迅速成为研究热点[1]。土壤酶和土壤微生物是土壤重要的组成部分,其活性和数量变化是土壤质量变化的重要指标。土壤酶参与土壤的物质和能力循环,与土壤有机质含量、土壤养分相关,其活性是土壤肥力的重要指标之一,甚至有人根据土壤酶活性将土壤分级,以此来评价农业土壤的生产力水平[2]。土壤微生物是土壤酶的重要来源,其群落多样性不仅与土壤酶变化相关,而且对农业可持续发展有重要意义,有文章称应用外源微生物提高土壤养分利用率和防治植物病虫害的发生是未来农业发展的方向[3-4]。本研究就设施黄瓜在根结线虫病害胁迫的土壤环境下,通过施用微生物农药枝顶孢霉制剂,研究了土壤过氧化氢酶、脲酶、蔗糖酶、磷酸酶和微生物数量在黄瓜不同生长期的变化及它们相互之间的相关性。了解土壤酶活性和微生物数量的变化,可以掌握微生物农药在防治根结线虫的同时对土壤微生态环境的影响,可以为微生物农药合理安全使用提供参考,能更好地指导微生物农药的施用量、施用时期和施用次数,达到防治害虫和保护环境的双重效果。1材料与方法
1.1枝顶孢霉制剂
陕西省微生物研究所研究开发的用于防治根结线虫的微生物农药,菌种为枝顶孢霉JXC224,含孢量为4×109 CFU/g,剂型为粉剂。
1.2试验地及管理
根结线虫防治试验地在陕西省科学院渭南科技示范基地,位于陕西省渭南市大荔县冯村镇平王村,日光温室,根结线虫病害严重,面积560 m2,土壤类型为黑垆土,pH值为79,相对体积质量为1.31~1.32 g/cm3,饱和含水量为321%~33.2%,供试作物为黄瓜砧木。2014年10月下旬育苗,11月上旬起垄(垄高15~18 cm)覆膜定植,常规管理。
1.3田间试验及样品采集
枝顶孢霉制剂防治根结线虫田间试验共分为4个处理,分别为CK、Z-1、Z-2、Z-3。CK为不施枝顶孢霉制剂的处理,Z-1为枝顶孢霉制剂施用量60 kg/hm2,Z-2为枝顶孢霉制剂施用量120 kg/hm2,Z-3为枝顶孢霉制剂施用量 240 kg/hm2。分别于施药后30 d(幼苗期)、90 d(盛果期)、150 d(拉秧期)取样。在试验田各处理黄瓜根部随机取样,每个处理取3个样,取回实验室低温保藏,待测定过氧化氢酶后于阴凉处风干保藏。
1.4试验方法
过氧化氢酶测定采用滴定法[5],脲酶、蔗糖酶和磷酸酶测定采用分光光度法[6];微生物数量测定采用平板培养法。
1.5数据处理
试验数据处理及分析软件为Excel 2010和SPSS 19.0,差异显著性分析使用LSD法,相关性采用Pearson法进行分析,显著性水平设为0.05,图表中数据均用平均值±标准差表示。
2结果与分析
2.1枝顶孢霉制剂防治设施黄瓜根结线虫过程中土壤酶活性变化
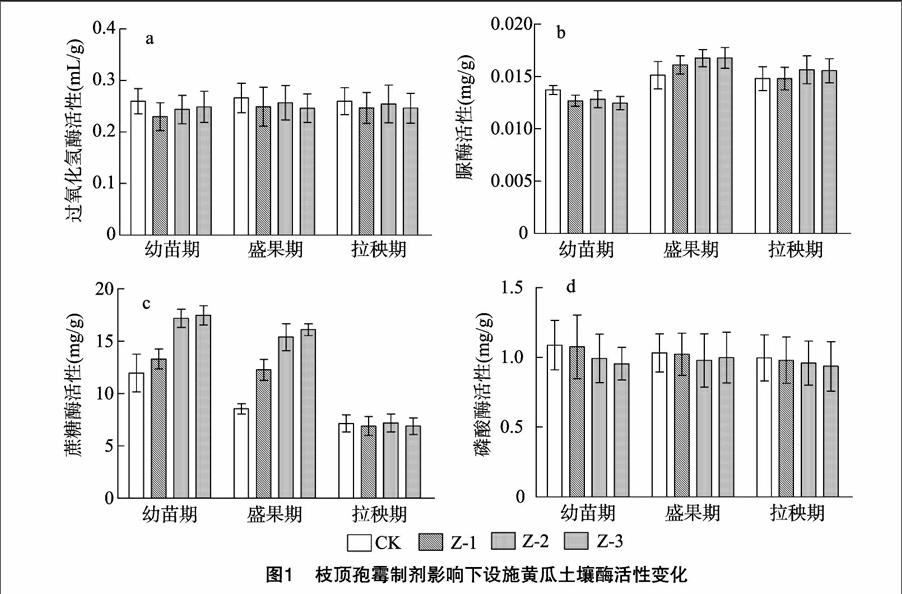
设施黄瓜土壤酶活性在枝顶孢霉制剂的影响下呈现不同的变化趋势,从幼苗期到拉秧期枝顶孢霉制剂对其影响逐渐减小,拉秧期各处理土壤酶活性基本恢复到与对照相同的水平(图1)。过氧化氢酶和磷酸酶活性随黄瓜生长期均有下降的趋势,与对照相比各时期酶活性没有显著差异,枝顶孢霉制剂施用量增加,2种酶活性没有显著增加,没有表现出剂量-效应关系(图1-a、图1-d)。脲酶活性在幼苗期和拉秧期較低,盛果期较高,与对照相比,幼苗期有下降的趋势,Z-1和Z-2条件下下降均不显著,Z-3时脲酶活性显著下降;盛果期和拉秧期脲酶活性受枝顶孢霉制剂影响不显著(图1-b)。蔗糖酶活性幼苗期最高,盛果期较低,拉秧期最低,与对照相比,幼苗期和盛果期枝顶孢霉制剂显著提高了蔗糖酶活性,剂量增加酶活性提高,剂量-效应关系显著。拉秧期枝顶孢霉对蔗糖酶活性影响不显著,剂量-效应关系不显著(图1-c)。
2.2枝顶孢霉制剂防治设施黄瓜根结线虫过程中土壤微生物数量变化
黄瓜生长期微生物数量呈增加趋势,枝顶孢霉制剂对微生物数量影响减弱(图2)。与对照相比,细菌在幼苗期受枝顶孢霉制剂影响,数量显著减少,剂量-效应不显著。盛果期和拉秧期细菌数量受枝顶孢霉制剂影响不显著,细菌数量恢复到与对照相同水平(图2-a)。放线菌受枝顶孢霉制剂影响数量有增长趋势,但没有达到显著水平(图2-b)。真菌受枝顶孢霉制剂影响数量增加,幼苗期数量增加均显著,剂量-效应关系显著;盛果期和拉秧期真菌数量受枝顶孢霉制剂的影响不显著,各处理基本与对照处于相同水平(图2-c)。
2.3土壤微生物数量和土壤酶活的相关性
随黄瓜生长期微生物数量和土壤酶活相关发生变化。幼苗期,细菌与真菌呈极显著负相关,与蔗糖酶呈极显著负相
关,与脲酶呈显著正相关;放线菌与脲酶呈极显著负相关;真菌和蔗糖酶呈显著正相关;过氧化氢酶和磷酸酶呈显著负相关(表1)。盛果期,放线菌和蔗糖酶呈显著正相关,脲酶和蔗糖酶呈显著正相关(表2)。拉秧期各变量相关性不显著(表3)。
3结论与讨论
土壤酶和土壤微生物是土壤的重要组成部分,是土壤代谢功能顺利完成的重要因素和主要推动力,在土壤物质能量循环、植物生长调节、抑制植物病害、有害物降解等方面均发挥着重要作用[7-8]。由于土壤微生物和土壤酶对外源物质高度敏感,所以常将其用于评价土壤生态环境,判断外源物质对土壤污染程度及可能对生态环境造成的影响[9-10]。土壤微生物代谢需求和营养的有效性能通过土壤酶活性直接表达,其区系变化能影响土壤酶活性[11],因此土壤酶和土壤微生物的相关性对土壤酶学的研究和发展具有重要的价值。
枝顶孢霉制剂对脲酶和蔗糖酶活性有显著影响,其影响随着黄瓜生长期减弱,对过氧化氢酶和磷酸酶影响不显著。脲酶是农作物生长重要氮肥尿素的专性水解酶,其酶促产物氨是农作物可吸收的重要氮源之一。脲酶能够在一定程度上反映土壤的供氮能力,其活性与有机质、全磷、速效磷含量呈显著正相关[12-13]。但是尿素在温度、水分适宜的条件下水解过快,使局部土壤pH值升高,造成氨态氮损失,降低了肥料的利用率;并在此过程中产生亚硝酸盐伤害发芽的幼苗和幼龄植株。所以控制脲酶活性减缓尿素转换成氨的速率,降低氮肥损失、提高尿素利用率,对农业生产具有重要的意义。枝顶孢霉制剂在幼苗期使脲酶活性下降,可以降低黄瓜幼苗受亚硝酸伤害的风险,有利于黄瓜的生长。而根结线虫防治的关键时期同样处于幼苗期,所以枝顶孢霉制剂的施用时间在黄瓜幼苗前期较为合理。蔗糖酶具有提高土壤中易溶性物质的能力,其酶促反应产物葡萄糖和果糖是植物和微生物的营养源,不仅能够表征土壤生物学活性强度,也可以作为评价土壤熟化程度和土壤肥力水平的一个指标[6]。枝顶孢霉制剂使蔗糖酶活性提高,且影响可以持续到盛果期,有利于黄瓜的生长,对制剂施用时期的要求与根结线虫防治时期相吻合。
土壤微生物数量受枝顶孢霉制剂影响会发生不同的变化趋势,土壤细菌数量减少,土壤放线菌数量变化较小,土壤真菌数量增加,但其变化随黄瓜生长期而减弱。有关研究显示,根结线虫侵染植株后根结成为植株的重要代谢场所,植株体内大量营养物质通过根结进入土壤[14]。许华等的研究显示土壤细菌数量与土壤pH值正相关,与真菌数量负相关,根结线虫侵染黄瓜后根系分泌物中酸性物质的种类或数量增加,导致土壤pH值显著降低[15-16]。本研究是在根结线虫病害严重的设施黄瓜地展开试验,设施大棚土壤pH值可能随黄瓜生长期降低,从而促使细菌数量减少真菌数量增多。表明设施大棚的土壤环境有利于真菌生长,这有利于提高真菌枝顶孢霉制剂对根结线虫的防治效果。
本研究中枝顶孢霉制剂对土壤酶和土壤微生物的影响均随黄瓜生长期而减弱。这可能主要是由于土壤对外源生防菌的抑制作用,也有可能是季节变化和植物生长周期的影响所致。刘丹等研究表明,生防细菌对土壤环境改变的时间为1个月左右,其施用后对根围微生物群落影响的持续时与对不同作物的影响持续时间基本相同,同时指出生防菌对土壤微生物群落的影响小于季节更替和植物生长期的变化[11]。
土壤微生物数量和土壤酶活性之间具有相关性,其相关性随黄瓜生长期发生变化。土壤细菌与真菌呈极显著负相关,表明枝顶孢霉制剂对土壤环境产生了有利于真菌生长的影响。土壤酶根据其在土壤中的存在形式和来源分为积累酶和增殖酶,积累酶属于稳定态胞外酶,而增殖酶易受外界环境条件干扰而钝化[6]。幼苗期枝顶孢霉对土壤微生物数量和土壤酶有显著影响,盛果期仅对蔗糖酶有显著影响,因此幼苗期与微生物数量相关性显著的土壤酶可能为微生物增殖酶,而盛果期与微生物数量相关性显著的酶可能易于跟土壤成分结合成为积累酶。
枝顶孢霉制剂对土壤酶活性和土壤微生物均有影响,通过对土壤酶和土壤微生物的影响,为黄瓜生长和根结线虫防治提供有利环境。其影响随着黄瓜生长期而减弱,表明其生长随黄瓜生长期受到限制,所以其对土壤生态环境的潜在风险较小;作为生防制剂同时要考虑适时补施,从而达到防治根结线虫的目的。
参考文献:
[1]邱德文. 生物农药的发展现状与趋势分析[J]. 中国生物防治学报,2015,31(5):679-84.
[2]Monreal C M,Bergstrom D W. Soil enzymatic factors expressing the influence of land use,tillage system and texture on soil biochemical quality[J]. Canadian Journal of Soil Science,2000,80(3):419-28.
[3]张志丹,赵兰坡. 土壤酶在土壤有机培肥研究中的意义[J]. 土壤通报,2006,37(2):362-368.
[4]陈雪丽,王光华,金剑,等. 两株芽孢杆菌对黄瓜和番茄根际土壤微生物群落结构影响[J]. 生态学杂志,2008,27(11):1895-1900.
[5]周礼恺. 土壤酶学[M]. 北京:科学出版社,1987.
[6]关松荫. 土壤酶及其研究法[M]. 北京:农业出版社,1986.
[7]Jeun Y C,Park K S,Kim C H,et al. Cytological observations of cucumber plants during induced resistance elicited by rhizobacteria[J]. Biological Control,2004,29(1):34-42.
[8]Gomes N C M,Olajire F,Rodrigo C,et al. Dynamics of fungal communities in bulk and maize rhizosphere soil in the tropics[J]. Applied & Environmental Microbiology,2003,69(7):3758-3766.
[9]楊青华,韩锦峰. 棉田不同覆盖方式对土壤微生物和酶活性的影响[J]. 土壤学报,2005,42(2):348-351.
[10]叶央芳,闵航,周湘池. 苯噻草胺对水田土壤呼吸强度和酶活性的影响[J]. 土壤学报,2004,41(1):93-96.
[11]刘丹,张丽萍,史延茂,等. 生防细菌对植物根围微生态效应的研究进展[J]. 中国农学通报,2014,30(7):260-265.
[12]刘善江,夏雪,陈桂梅,等. 土壤酶的研究进展[J]. 中国农学通报,2011,27(21):1-7.
[13]胡斌,张世彪. 植被恢复措施对退化生态系统土壤酶活性及肥力的影响[J]. 土壤学报,2002,39(4):604-608.
[14]Dicke M,Dijkman H. Within-plant circulation of systemic elicitor of induced defence and release from roots of elicitor that affects neighbouring plants[J]. Biochemical Systematics & Ecology,2001,29(10):1075-1087.
[15]许华,阮维斌,高玉葆,等. 根结线虫接种对黄瓜植株根际土壤pH和微生物的影响[J]. 中国生态农业学报,2010,18(5):1041-1045.
[16]Mashela P W. Ground wild cucumber fruits suppress numbers of Meloidogyne incognita on tomato in microplots[J]. Nematropica,2002,32(1):13-19.詹长根,邢玉玲,杨如军. 广西城市土地综合承载力时空差异分析[J]. 江苏农业科学,2017,45(6):281-285.
doi:10.15889/j.issn.1002-1302.2017.06.072
