雨生红球藻藻渣在成年虹鳟饲养中的应用
2017-05-11石焜苏芳郭文胡发文庞通
石焜++苏芳++郭文++胡发文++庞通++高振++刘建国
摘要:选用已喂食人工虾青素6个月的2年龄3倍体雌性虹鳟成鱼,分别继续投喂人工虾青素强化饲料(原有饲料,含40 mg/kg人工虾青素)、雨生红球藻藻渣强化饲料(替代饲料,含40 mg/kg天然虾青素)及无任何虾青素的基础饲料(空白对照组)。饲喂24 d后,对比研究了上述各组处理对虹鳟生长性能、肌肉品质、虾青素含量及抗氧化能力等指标的影响。结果表明,2种虾青素强化饲料在虹鳟生长性能、肌肉品质方面无显著差异(P>0.05),但较空白对照组有小幅改善;藻渣强化组虹鳟背肌的肉色比色卡值较人工虾青素强化组有一定提升,但差异不明显;藻渣强化组虹鳟背肌的总类胡萝卜素及虾青素含量显著高于人工虾青素组(P<0.05),表明藻渣中天然虾青素更易在虹鳟背肌中累积;藻渣强化组的T-AOC及MDA数据明显优于人工虾青素强化组,差异极显著(P<0.01),表明藻渣中天然虾青素对于虹鳟的抗氧化能力提升更明显,去除自由基能力更强。上述结果表明,雨生红球藻藻渣可以作为人工虾青素的有效着色替代品,在虹鳟饲料添加剂市场中具有开发潜力。
关键词:成年虹鳟;虾青素;雨生红球藻藻渣;饲料添加剂;抗氧化能力
中图分类号: S963.73+5文献标志码: A文章编号:1002-1302(2017)06-0153-04
虹鳟(Oncorhynchus mykiss)是一种鲑科类的高价值冷水性养殖鱼,其肌肉的色度是衡量肉质的重要指标[1],该指标主要受到所摄取虾青素、角黄素等类胡萝卜素的影响[2]。在实际养殖过程中,可通过在饲料中添加蝦青素的方法强化虹鳟的着色。市场上的饲料着色剂主要分为天然和人工2种虾青素,其中以人工虾青素为主[3]。然而,天然虾青素在安全性、结构和有效性上有诸多优势,近年来日益受到关注[4-5]。美国食品和药物管理局(FDA)评估只允许天然虾青素进入保健品市场,明确禁止人工虾青素的进入[6]。雨生红球藻(Haematococcus pluvialis)是规模生产天然虾青素的最主要来源,提取虾青素后的藻渣中仍含有大量多糖、丰富的蛋白质及残余的天然虾青素,具有较高的开发利用价值,尤其是在高价值饲料添加剂方面的应用潜力巨大。目前,国内外有关雨生红球藻藻渣在水产饲料应用方面的文献报道甚少,仅有Ju等将藻渣用作虾类养殖饲料中蛋白质源替代的报道[7],但对藻渣中虾青素组分的利用并未重点涉及。
在虹鳟养殖中,饲料中虾青素的添加成本占饲料总成本的10%~20%[8],为降低成本,实际生产中仅在养殖后期(即出池前3~6个月)投喂虾青素饲料进行着色,并在最后1个月饲喂高虾青素的饲料予以短期强化。在目前诸多虾青素强化虹鳟着色的研究中,多以200 g以下的早期幼年鱼体为试验材料[9-11],而与水产养殖更密切相关的成鱼着色却鲜有报道。幼鱼与成鱼在器官发育程度、摄食、消化和吸收能力以及肉质着色力存在一定的偏差甚至不同,为避免研究与实际应用出现明显错位。为此,本试验以着色6个月的2年龄虹鳟成鱼为对象,利用雨生红球藻藻渣作为饲料中虾青素的替代源,对比观察其着色饲喂过程中生长性能、肌肉品质、虾青素含量与组成、抗氧化能力等的可能变化,目的探讨雨生红球藻藻渣在高端水产饲料开发中应用的可能性。
1材料与方法
1.1试验饲料
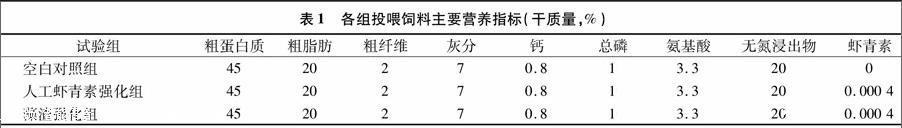
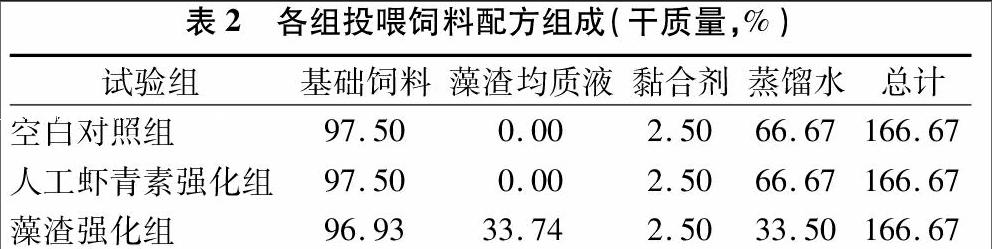
试验各组投喂饲料的主要营养指标见表1。人工虾青素组为含40 mg/kg人工合成虾青素的商业化强化饲料(ALLER SILVER),除虾青素外其他成分与基础饲料营养相同。本试验所用雨生红球藻藻渣由云南爱尔发公司提供,虾青素有效含量为0.5%。将藻渣加入适量蒸馏水,于130 MPa下高压均质1 min得到藻渣均质液。将基础饲料粉碎,40目过滤后,添加藻渣均质液、黏合剂及蒸馏水,重新制成直径小于1 cm的天然虾青素强化饲料颗粒(含40 mg/kg天然虾青素)。上述强化饲料于4 ℃避光保存,3 d内投喂。各组投喂饲料的配方组成详见表2。
1.2试验用鱼与试验设计
试验在山东省海洋生物研究院鳌山卫基地进行,试验用虹鳟由山东省海洋生物研究院提供的三倍体雌鱼。虹鳟体质
量为(1 047.1±288.3) g,2年龄,已喂食含有40 mg/kg人工虾青素饲料6个月。试验分3组,分别为基础饲料对照组,含有40 mg/kg人工虾青素组和含有40 mg/kg天然虾青素的藻渣强化组。每组1池,每池(180±20)尾虹鳟。池规格为 5.60 m×5.60 m×1.80 m,水深0.70 m。
1.3饲养管理
试验用水为地下咸水,盐度2.6%~2.7%,溶解氧6.0~7.0 mg/L,水温16.0~17.0 ℃,换水率5~7池/d,光照为自然漫散光。试验开始前,虹鳟预先在池中驯养3周以适应新环境。试验正式开始前,禁食24 h。每天分别于09:00和 15:00 各喂食1次,日饲喂量(干质量)约为2.0 g/尾。具体饲喂量随着水温、换水率、溶氧及进食状况相应微调,以无残饵为适宜。每天06:30捞取粪便查看进食的消化吸收情况。试验喂养从2015年5月22日开始到6月15日为止,共计 24 d。
1.4测定指标与方法
取样前停食饥饿24 h。每池随机取鱼3尾,以丁香油麻醉,小锤敲击头部致晕,采集样品。
1.4.1常规生长指标在试验结束时,分别测量各试验组虹鳟的体长度、体质量及肝脏质量,并按照下式计算肥满度、肝体比:
肥满度=体质量(g)/体长度(cm)3×100%;
肝体比=肝质量(g)/体质量(g)×100%。
1.4.2比色卡值取侧线与背脊之间白肌部分。4 ℃ 0.86% 生理盐水冲洗血污,滤纸吸干表面。使用SalmoFanTM Lineal比色卡尺测量朝向背脊的一面,每尾鱼的双侧测量各1次。
1.4.3滴水损失背部取肌肉约2 g。将肉样称质量(m1),用细铁丝钩住肉样一端,保持肉样垂直向下,悬吊于4 ℃,分别于12、24、36、48 h时,取出肉样,用滤纸拭去肉样表层的液体,然后称质量(m2),按下式计算:
滴水损失=[(m1-m2)/m1]×100%。
1.4.4含水率采用105 ℃恒重法(GB/T 6435—1986)。
1.4.5背肌的总类胡萝卜素分别取侧线以上的背脊白肌部约4 g的肉块2份,精确称量于冰盘上用眼科小剪剪碎,按质量体积比1 ∶1加入正己烷和95%乙醇混合试剂,组织采用12 000 r/min勻浆至悬浊液状。低速离心机3 500 r/min,4 ℃ 低温离心10 min。取上清液,于487 nm下测定吸光度值。根据标准曲线计算出含量。
1.4.6背肌虾青素含量及组成分析取侧线以上的背脊白肌部分取约4 g的肉块2份,依据“1.4.5”节方法,取上清液,下层肌肉组织继续加入正己烷和95%乙醇混合试剂,重复上述操作直至肌肉呈白色、上清无色为止。将多次萃取的上清液合并后定容,即为待测样品溶液。
虾青素几何及旋光异构体测定采用安捷伦1200高效液相色谱仪,以色谱柱Luna 3u Silica (2) 100 A 150 mm×4.60 mm(phenomenex)进行几何异构体测定,以CHIRALPAK IC 4.6×250 mm(Daicel)进行旋光异构体的分析。样品用流动相溶解,几何异构体测定和立体异构体测定的流动相分别为正己烷和丙酮(体积比83 ∶17),甲基叔丁基醚和乙腈(体积比36 ∶64),流速1.0 mL/min,检测波长为478、476 nm,进样量20、10 μL。虾青素含量采用单点外标法测定。
1.4.7抗氧化指标血清总抗氧化能力(T-AOC)测定:用一次性5 mL注射器和12号针头,取虹鳟尾部静脉血,转入 1.5 mL 离心管中,于4 ℃冰浴2~4 h。在4 ℃按8 000 r/min离心10 min,取上清液。测定采用南京建成试剂盒,具体方法依照其说明书进行。测定原理为抗氧化物质使Fe3+还原为Fe2+,后者与菲林类物质形成稳固络合物,经由比色测出高低。
肝脏总蛋白(TP)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、丙二醛(MDA)的测定:解剖取全部肝脏,置于 -80 ℃ 中保存。测定采用南京建成试剂盒,具体方法依照其说明书进行。TP采用考马斯亮兰法测定;T-SOD使用黄嘌呤氧化酶法测定;CAT采用可见光法测定;MDA使用TBA法测定。
1.4.8计算与统计分析试验数据采用(平均数±标准误)表示,使用SPSS 17.0进行单因素方差分析,结合Duncans法进行多重比较。
2结果与分析
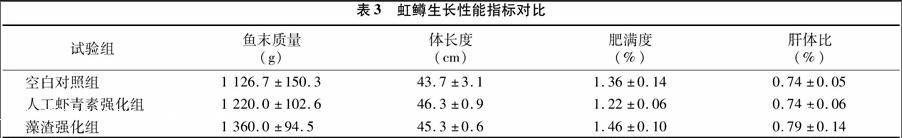
2.1不同来源虾青素对虹鳟生长性能的影响
各试验组鱼质量、体长度、丰满度、肝体比等生长指标(表3),与对照相比均无显著性差异(P>0.05)。该结果与Foss等、Thompson等所报道的虾青素对虹鳟鱼生长性能无显著影响的结论[12-13]相符。表3试验数据还显示,尽管鱼质量、体长度及肝体比未达到显著差异程度,但强化组较空白对照组均有小幅提升;藻渣强化组较人工虾青素强化组在鱼质量、肥满度及肝体比数据上也有小幅提升。这可能与雨生红球藻藻渣中所含的多糖及蛋白质等营养组分有关,文献报道红球藻可以显著提高太平洋白对虾(Penaeus vannamei)生长速率并降低饲料系数[7]。可能本试验中所添加的藻渣量较小,而未能获得明显促进生长的效果。
2.2不同来源虾青素对虹鳟背肌含水量及滴水损失的影响
鱼类肌肉含水量与肌肉品质存在显著相关性,对肌肉品质产生重要影响[14],Josephson等使用虹鳟的全鱼含水量作为
反映其能量贮存水平和脂质含量的替代指标[15]。表4对比了各组之间背肌含水量和0~72 h的滴水损失。不同处理组虹鳟背肌含水率并无显著性差距(P>0.05),表明不同来源的虾青素对背肌品质无明显影响。
滴水损失反映肌肉的保水性,也是反映肌肉品质的重要指标,滴水损失越低则肉质越佳。张娟娟研究表明,虾青素对于背肌的贮存性能有一定改善作用[16]。但在本试验的各个时间点上,无论藻渣强化组还是人工虾青素强化组,均与空白对照组没有显著性差异(P>0.05),即滴水损失数据并未呈现出与张娟娟的研究[16]相类似的结果。这可能与本试验所用成鱼已投喂含虾青素饲料6个月,肌肉已保有相当多的虾青素有关。之前有关虾青素在虹鳟体内降解代谢的研究表明,在停止喂食虾青素4周后,虹鳟肌肉中虾青素含量仍可保留50%以上[17]。因此,可以认为在停止摄取虾青素24 d后,虹鳟体内残留的虾青素仍具有较强改善肉质的能力,这可有效解释各试验组之间肉质差异不明显的原因。
2.3不同来源虾青素对虹鳟背肌肉色及对其积累总类胡萝卜素和虾青素的影响
由表5可见,各组间背肌比色卡值差异不明显(P>0.05),颜色均为橙红色。其中,藻渣强化组较空白对照组数据有一定提升(8.21%),而人工虾青素强化组与对照组几乎一致。藻渣天然虾青素较人工虾青素着色更佳,说明天然来源的雨生红球藻藻渣完全可以替代人工虾青素,提高虹鳟成鱼背肌着色,这与Bowen等的研究结果[18]也是一致的。
在虹鳟背肌的总胡萝卜素和虾青素含量方面,人工虾青素强化组与空白对照组并无明显差距(P>0.05),而藻渣强化组则有显著提高(P<0.05),这与比色卡值反映的趋势基本相同。说明较之人工虾青素,藻渣中天然虾青素更易于在虹鳟背肌中累积,促进鱼肉着色。Kurnia等对比了海洋细菌(marine bacteria)源天然虾青素与人工虾青素对于虹鳟的沉积效果,发现天然虾青素提高肉色效果更佳[9],这与本试验结果也是一致的。推测这可能与雨生红球藻所含虾青素及其脂类配比与动物体内的虾青素配比相似有关,雨生红球藻中的虾青素以3 S、3′ S构型为主,与动物体内的虾青素构型基本一致,可能有助于机体对虾青素的快速吸收[6,19],而人工虾青素不具备天然虾青素的上述特性。
由表6可知,在虹鳟肌肉中,尽管虾青素几何异构体没有明显差异(P>0.05),但立体异构体数据存在一定差异。藻渣强化组,其3S、3′ S虾青素异构体有所增加,表明红球藻天然虾青素有逐步替代虹鳟体内前期积累的人工虾青素的趋势。从空白对照组结果可以看出,随着停止摄取人工虾青素,背肌中虾青素含量及异构体组成的消退过程是缓慢的,从另一个角度也说明雨生红球藻藻渣可有效保持虹鳟肉色质量。此外,各组中左旋虾青素积累均大于右旋虾青素积累,这可能与虾青素立体异构体在鲑鳟鱼不同组织间的选择性积累有关[20],从另一侧面也再次为左旋结构虾青素更有利于鲑鳟鱼肌肉增色提供了數据支持[21]。
2.4不同来源虾青素对虹鳟血清及肝脏的抗氧化指标影响
鱼类机体的防御与酶促和非酶促2个体系有密切关系。其中,酶促体系包括SOD、CAT等内源酶,而非酶促体系则包
括各类具有抗氧化作用的维生素、类胡萝卜素等物质。本试验抗氧化指标中,T-AOC是机体淬灭自由基和抗氧化能力的总和,也是衡量整个机体酶促及非酶促2个体系抗氧化能力的综合指标。SOD和CAT活力高低,分别反映了体内防御体系清除超氧阴离子自由基及羟自由基的能力,2个指标间关系是明确的,SOD所催化的反应产物过氧化氢,也是CAT催化反应的底物。而MDA高低则反映机体内脂质过氧化的程度,能间接反映出细胞受到自由基攻击的损伤程度。MDA与CAT的测定是互相配合的。
根据表7数据比较可知,各处理组虹鳟血清的T-AOC,其中饲喂虾青素强化的2组均较空白对照组有所提升,特别是藻渣强化组差异极显著(P<0.01),是空白对照组的 302.08%,远远高于人工虾青素强化组的提升(19.6%)。这表明藻渣中的天然虾青素比人工虾青素对虹鳟机体综合抗氧化能力的提高更为有效。
进一步分析试验3组MDA含量发现:2种虾青素强化组较空白对照组都有极显著下降。其中藻渣强化组下降幅度更大,表明藻渣中所含天然虾青素较人工虾青素清除自由基的能力更强,这与血清T-AOC数据所反映的总体趋势也是相符的。
此外,对比3组肝脏T-SOD、CAT的活力,发现藻渣强化组和人工虾青素强化组相比空白对照组均有下降,但内部并无显著性差异。Pan等在斑点对虾Penaeus monodon的饲料中添加了虾青素,发现其血淋巴中T-AOC升高而SOD活力下降[22],本试验的数据趋势与之吻合。分析原因可能是虾青素对自由基的超强清除作用[23],使得机体内非酶促抗氧化体系极大增强,机体的总抗氧化能力随之提高。而随着体内的活性氧大量被虾青素猝灭,SOD与CAT的底物含量减少,导致二者酶活力的下降。
3结论
本试验条件下,在虹鳟成鱼饲养过程中使用雨生红球藻藻渣代替人工虾青素作为虾青素源着色添加剂。结果表明,藻渣强化组在生长性能及肌肉品质上的提升较小;肉色方面有一定改善。藻渣中天然虾青素在鱼体中更易累积,并极大提升了其抗氧化能力。在虹鳟成鱼的饲养应用中,雨生红球藻藻渣可作为人工虾青素的有效着色替代品。
致谢:本试验用虹鳟鱼由山东省海洋生物研究院提供,在养殖管理、样品采集和解剖过程中获得山东省海洋生物研究院高凤祥、李莉、菅玉霞、王雪、刘建盛等的热情帮助,在此一并表示衷心感谢。
参考文献:
[1]Storebakken T,Hong K N. Pigmentation of rainbow trout [J]. Aquaculture,1992,100:209-229.
[2]Bauernfeind J C. Carotenoids as colorants and vitamin A precursors. Technological and nutritional applications [M]. New York:Academic Press Inc,1981.
[3]胡金金,靳远祥,傅正伟. 天然虾青素在畜牧生产中的应用前景[J]. 浙江畜牧兽医,2007(1):8-9.
[4]王春明,徐英祺,杨雅,等. 全球虾青素研究专利计量分析[J]. 植物分类与资源学报,2015,37(2):221-232.
[5]An G H,Bielich J,Auerbach R,et al. Isolation and characterization of carotenoid hyperproducing mutants of yeast by flow cytometry and cell sorting[J]. Biotechnology,1991,9(1):70-73.
[6]张晓丽,刘建国. 虾青素的抗氧化性及其在营养和医药应用方面的研究[J]. 食品科学,2006,27(1):258-262.
[7]Ju Z Y,Deng D F,Dominy W. A defatted microalgae (Haematococcus pluvialis) meal as a protein ingredient to partially replace fishmeal in diets of Pacific white shrimp (Litopenaeus vannamei,Boone,1931)[J]. Aquaculture,2012,354:50-55.
[8]Baker R M,Pfeiffer A M,Schner F J,et al. Pigmenting efficacy of astaxanthin and canthaxanthin in fresh-water reared Atlantic salmon,Salmo salar[J]. Animal Feed Science & Technology,2002,99(1):97-106.
[9]Kurnia A,Satoh S,Haga Y,et al. Muscle coloration of rainbow trout with astaxanthin sources from marine bacteria and synthetic astaxanthin[J]. J Aquac Res Development,2015,337(6):2-9.
[10]Sheikhzadeh N,Tayefi-Nasrabadi H,Oushani A K,et al. Effects of haematococcus pluvialis supplementation on antioxidant system and metabolism in rainbow trout(Oncorhynchus mykiss)[J]. Fish Physiology and Biochemistry,2012,38(2):413-419.
[11]Yoshitomi B,Aoki M,Oshima S I. Effect of total replacement of dietary fish meal by low fluoride krill (Euphausia superba) meal on growth performance of rainbow trout (Oncorhynchus mykiss) in fresh water[J]. Aquaculture,2007,266(1/2/3/4):219-225.
[12]Foss P,Storebakken T,Austreng E,et al. Carotenoids in diets for salmonids:Ⅴ. Pigmentation of rainbow trout and sea trout with astaxanthin and astaxanthin dipalmitate in comparison with canthaxanthin[J]. Aquaculture,1987,65(87):293-305.
[13]Thompson I,Choubert G,Houlihan D F,et al. The effect of dietary vitamin A and astaxanthin on the immunocompetence of rainbow trout[J]. Aquaculture,1995,133(2):91-102.
[14]李乐. 不同贮藏温度下几种鱼的肉质品质变化对比[J]. 食品与发酵工业,2014,40(2):225-231.
[15]Josephson D C,Robinson J M,Jesse M L,et al. Rainbow trout performance in food-limited environments:implications for future assessment and management[J]. Journal of Freshwater Ecology,2012,27(2):159-170.
[16]張娟娟. 虾青素和蛋白酶在虹鳟饲料中的应用研究[D]. 上海:上海海洋大学,2012.
[17]张娟娟,李小勤,冷向军,等. 虾青素在虹鳟体内的沉积与降解研究[J]. 水产学报,2012,36(12):1872-1879.
[18]Bowen J,Soutar C,Serwata R D,et al. Utilization of(3S,3′S)-astaxanthin acyl esters in pigmentation of rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture Nutrition,2002,8(1):59-68.
[19]Renstrm B,Borch G,Skulberg O M,et al. Optical purity of(3S,3′S)-astaxanthin from Haematococcus pluvialis[J]. Phytochemistry,
1981,20(11):2561-2564.
[20]sterlie M,Bjerkeng B,Liaaen-Jensen S. Accumulation of astaxanthin all-E,9Z and 13Z geometrical isomers and 3 and 3′R/S optical isomers in rainbow trout(Oncorhynchus mykiss) is selective[J]. The Journal of Nutrition,1999,129(2):391-398.
[21]Schiedt K,Leuenberger F J,Vecchi M. Natural occurrence of enantiomeric and meso-astaxanthin.5.Ex wild salmon(Salmo salar and Oncorhynchus)[J]. Helvetica Chimica Acta,1981,64(2):449-457.
[22]Pan C H,Chien Y H,Hunter B. The resistance to ammonia stress of penaeus monodon fabricius juvenile fed diets supplemented with astaxanthin[J]. Journal of Experimental Marine Biology and Ecology,2003,297(1):107-118.
[23]Lee S H,Min D B. Effects,quenching mechanisms,and kinetics of carotenoids in chlorophyll-sensitized photooxidation of soybean oil[J]. Journal of Agricultural and Food Chemistry,1990,38(8):1630-1634.黄春红,罗玉双,韩庆,等. 人工养殖中华草龟的营养成分与食用价值[J]. 江苏农业科学,2017,45(6):157-161.
doi:10.15889/j.issn.1002-1302.2017.06.041
