住院Graves病患者骨代谢状况与131I治疗后转归分析
2017-05-10马文杰吕朝阳许桂平何顺梅薛孟娟于明香
马文杰 吕朝阳 张 尧 许桂平,5 何顺梅,6 薛孟娟,7 高 键 于明香△
(1复旦大学附属中山医院内分泌科 上海 200032;2复旦大学循证医学中心 上海 200032;3山东大学齐鲁医院内分泌科 青岛 266035;4郑州市第七人民医院内分泌老年病科 郑州 450000;5福建省立医院老年科 福州 350001;6遵义医学院附属医院内分泌科 遵义 563000;7郑州大学第一附属医院老年内分泌科 郑州 450052 )
住院Graves病患者骨代谢状况与131I治疗后转归分析
马文杰1,3吕朝阳1,4张 尧1许桂平1,5何顺梅1,6薛孟娟1,7高 键2于明香1△
(1复旦大学附属中山医院内分泌科 上海 200032;2复旦大学循证医学中心 上海 200032;3山东大学齐鲁医院内分泌科 青岛 266035;4郑州市第七人民医院内分泌老年病科 郑州 450000;5福建省立医院老年科 福州 350001;6遵义医学院附属医院内分泌科 遵义 563000;7郑州大学第一附属医院老年内分泌科 郑州 450052 )
目的 分析住院Graves病患者骨代谢状况及131I治疗后骨代谢指标的转归。方法 收集315例Graves病住院患者的临床资料,分析骨代谢特点,并与300例健康人群进行病例对照研究。随访131I治疗后1年的Graves病患者60例,分析治疗前后骨代谢指标的变化。结果 与健康对照人群相比,Graves病患者骨转化指标(OCN、P1NP、β-cTX、尿钙/肌酐)增高,骨密度(bone mineral density,BMD)降低,甲状腺激素水平与骨转化指标呈正性相关,与全髋BMD (Z值)呈负性相关,与腰椎、股骨颈BMD (Z值)则未见线性相关。131I治疗后1年的Graves病患者骨转化指标较治疗前明显下降,BMD部分上升。结论 Graves病患者骨转化增快,BMD下降,131I治疗后随着病情好转,高骨转化速率得到遏制,BMD部分恢复。
Graves病; 骨代谢;131I治疗
Graves病是临床常见内分泌疾病,它是引起甲状腺功能亢进症的最主要病因,约占所有甲亢的85%。在Graves病患者中,过多的甲状腺激素干扰了正常的骨代谢,导致高骨转化和负钙平衡[1],引起骨量流失甚至骨质疏松[2-3],严重影响患者的健康和生活质量。Graves病的主要治疗方法包括抗甲状腺药物治疗和131I治疗。131I治疗Graves病方法简便,疗效肯定,适应证广[4]。近年来,越来越多的Graves病患者接受了131I治疗,但Graves病患者131I治疗前骨代谢状况与治疗后骨代谢状况的转归情况目前尚不明确。本文通过调查复旦大学附属中山医院Graves病住院患者的相关资料,结合文献探讨Graves病患者的骨代谢特点,并对接受131I治疗的Graves病患者进行随访,分析131I治疗前后骨代谢状况的变化,以期为Graves病引起的骨代谢异常的临床诊疗提供依据。
资 料 和 方 法
研究对象 以2010年5月至2012年3月在我院内分泌科住院治疗的成年Graves病患者为研究对象,排除合并有原发性骨质疏松症或合并其他自身免疫性疾病、原发性甲状旁腺功能亢进症等影响骨代谢的患者;以同期在体检中心收集的健康体检人群作为对照组;并随访其中接受131I治疗后1年的患者。
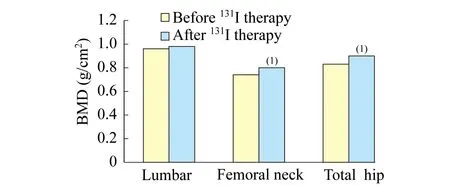
资料收集 收集Graves病患者(131I治疗前)与同期健康体检人群的一般资料:性别、年龄、身高、体重、体质指数(body mass index,BMI)、吸烟史、饮酒史、甲亢病程等;生化指标:血钙、血磷、尿钙与尿肌酐比值等;甲状腺功能相关指标:游离三碘甲状腺氨酸(free triiodothyronine,FT3)、游离甲状腺氨酸(free thyroxine,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH)等;骨代谢相关指标:甲状旁腺素(parathyroid hormone,PTH)、骨钙素(osteocalcin,OCN)、1型前胶原氨基末端前肽(procollagen type 1 amino-terminal propeptide,P1NP)、1型胶原羧基端肽(c-terminal telopeptide region of collagen type 1,β-cTX)等。骨密度(bone mineral density,BMD):由专人操作,使用美国Hologic公司的Discovery A型双能X线BMD测定仪(CV<1%),测定研究对象腰椎(包括L1~L4总和)、左侧股骨近端(包括全髋、股骨颈)BMD。根据1993年WHO骨质疏松诊断标准:T值≤-2.5为骨质疏松,-2.5 一般资料 Graves病患者(131I治疗前)与对照组的一般情况如表1所示,Graves病患者FT3、FT4水平显著高于对照组,TSH水平显著低于对照组,两组间其他资料(年龄、性别、身高、体重、BMI、吸烟史、饮酒史)差异无统计学意义。Graves病患者接受131I治疗后1年参与随访者共60例,其中男性24例,女性36例,年龄21~68岁,平均年龄(44.9±14.5)岁。 骨转化指标 与对照组相比,Graves病患者(131I治疗前)无论男性还是女性,血钙水平升高,PTH与25(OH)D水平下降,差异有统计学意义(P值分别为<0.001、0.003和<0.001);OCN、P1NP、β-cTX和尿钙/肌酐均升高,差异有统计学意义(P值均<0.001,表2),进一步采用多元线性回归分析校正年龄、BMI、吸烟史、饮酒史后,Graves病患者组(131I治疗前)与对照组骨代谢指标差异仍有统计学意义。以上结果均提示Graves病患者(131I治疗前)骨转化加速。 表1 Graves病患者(131I治疗前)与对照组的一般资料比较Tab 1 General data of Graves disease group (before 131I therapy) and control group (1)vs.control group,P<0.05. 表2 Graves病患者(131I治疗前)与健康对照组骨代谢指标比较Tab 2 Comparison of bone turnover markers between Graves disease group (before 131I therapy) and control group (1)vs.control group,P<0.05. BMD 如图1所示,与对照组相比,男性Graves病患者(131I治疗前)骨量减少及骨质疏松者比例升高,差异有统计学意义(P<0.001,P=0.001);女性Graves病患者(131I治疗前)骨量减少者比例升高,差异有统计学意义(P<0.001),骨质疏松者比例有所升高,但未达到统计学意义(P=0.1)。结果提示Graves病患者(131I治疗前)较对照组更易发生骨质疏松或骨量减少。 甲状腺激素水平与骨转化标志物的相关分析 如表3所示,血FT3、FT4水平与血钙呈正性相关(P<0.001),与PTH呈负性相关(P<0.001),与P1NP、OCN、β-cTX、尿钙/肌酐呈正性相关(P值均<0.001),与25 (OH)D未见线性相关。血TSH水平与β-cTX呈负性相关(P=0.022),其余指标未见线性相关。对年龄、性别、BMI、吸烟、饮酒史进行校正后,结果与校正前一致。 甲状腺激素水平与BMD的相关分析 因患者年龄跨度较大,故采用Z值(与同性别、同年龄、同种族人群BMD平均值相比较得到的BMD的相对值)进行分析。如表4所示,血FT3、FT4水平与全髋BMD(Z值)呈负性相关,与腰椎、股骨颈(Z值)则未见线性相关。对年龄、性别、BMI、吸烟、饮酒史进行校正后,结果与校正前一致。以上结果提示甲亢患者甲状腺激素水平升高引起甲状腺毒症,进一步引起骨转化加速、骨量流失,最终导致BMD下降,严重时可引起骨质疏松。 vs.control group,P<0.05. 表3 甲状腺激素水平与骨转化指标相关关系Tab 3 The relationship between thyroid hormone and bone turnover markers (n=315) (1)P<0.05;ra∶radjusted for gender,age,BMI,smoking and drinking. 表4 甲状腺激素水平与BMD相关关系Tab 4 The relationship between thyroid hormone and BMD (n=315) (1)P<0.05;ra∶radjusted for gender,age,BMI,smoking and drinking. Graves病患者131I治疗前后甲状腺激素、骨代谢指标、BMD的变化 甲状腺激素、骨代谢指标的变化 随访60例接受131I治疗1年的Graves病患者(随访期间均未接受抗骨质疏松治疗),与治疗前相比,FT3、FT4显著下降(P值均<0.001),TSH显著上升(P<0.001),血钙无明显改变,PTH上升(P<0.001),OCN、P1NP、β-CTX、尿钙/肌酐水平下降(P值均<0.001),25 (OH)D 无明显变化(表5)。 BMD的变化131I治疗1年后Graves病患者腰椎、股骨颈、全髋BMD均较治疗前呈上升趋势,其中股骨颈和全髋BMD的上升有统计学意义(P=0.036,P=0.027,图2)。另外,有8例骨量减少患者在131I治疗1年后骨量恢复正常。以上结果提示131I治疗后随着甲状腺激素水平的恢复,骨转化减慢,骨量流失减缓,BMD逐渐恢复。 表5 Graves病患者131I治疗前后甲状腺相关激素与骨转化指标变化Tab 5 Comparison of thyroid hormone and bone turnover markers before and after 131I therapy in Graves disease group (n=60) (1)vs.Before,P<0.05. (1)vs.Before 131I therapy,P<0.05;n=60. 骨形成与骨吸收的平衡对维持人体骨强度和完整性非常重要,甲状腺激素对于骨骼的正常生长是必需的,不仅影响骨的生长发育和成熟,还对成熟骨组织的重建有显著作用。在Graves病患者中由于循环血中过多的甲状腺激素干扰了正常的骨代谢,造成骨更新速率增加,骨吸收大于骨形成,导致负钙平衡和骨丢失,严重时发生继发性骨质疏松和骨折[5-7]。 既往研究表明,Graves病患者由于甲状腺激素的异常升高,导致成骨细胞和破骨细胞活性均增加,骨转化加速[8],血液循环中钙离子增加,抑制PTH分泌,尿钙排泄增多,导致负钙平衡。PTH水平下降还可影响维生素D向其活性形式转化,进一步影响消化道对钙的吸收。除此之外,研究显示骨转换标志物如OCN、P1NP、β-cTX等与甲亢严重程度相关[9]。OCN是体内最丰富的非胶原蛋白,它不仅能维持骨正常矿化的速度,还可反映成骨形成过程中的基质矿化期状态及骨形成率和转化率。P1NP是新骨形成敏感和特异的指标,其在血液循环中的水平可反映Ⅰ型胶原的合成速度,P1NP水平升高提示骨转换活跃。β-cTX是骨Ⅰ型胶原降解过程中被切断的端肽,可反映破骨细胞活性,是敏感性和特异性均较好的骨吸收指标。上述骨转换标志物在人体血液循环中的水平升高提示骨转换活跃。本研究中,无论单因素还是多因素分析均提示Graves病患者骨转化标志物(OCN、P1NP、β-cTX、尿钙/肌酐)较对照组明显升高,且血FT3、FT4水平与骨转化标志物(OCN、P1NP、β-cTX、尿钙/肌酐)呈明显的正性相关,说明随着甲状腺激素水平升高,成骨细胞和破骨细胞活性均增加。骨吸收的激活导致钙释放入血增多,血钙水平升高,血钙的升高则抑制了PTH和1,25(OH)2D3的合成及钙的吸收。本研究中Graves病患者血钙水平较对照组升高,PTH、25(OH)D水平下降,进一步证实了上述观点。 Graves病患者的BMD下降非常普遍,主要原因如下:(1)高骨转化。研究发现人类成骨细胞和破骨细胞表面均表达有甲状腺激素受体,过量甲状腺激素作用于骨细胞表面受体,成骨及破骨细胞活性均增强,导致骨吸收及转换加快,但破骨细胞活性增强占主导地位,骨转换处于负平衡状态,最终引起骨量丢失[10]。(2)负钙平衡。Graves病患者代谢亢进,钙、磷、镁等元素消耗增多,同时,肠钙吸收减少,粪钙、尿钙排出增多,造成机体内的钙元素处于负平衡状态[11]。(3)负氮平衡。Graves病患者高代谢状态促进蛋白质分解,导致负氮平衡,引起骨基质减少,从而加重骨量丢失。(4)促进骨吸收的细胞因子增加。Graves病时,多种促进骨吸收的细胞因子(如TNF-α、IL-1、IL-6等)表达增多,诱导破骨细胞的分化和成熟,造成骨吸收增加[12]。随着治疗后甲状腺功能的恢复,这些细胞因子可逐渐降至正常范围[13]。(5) TSH水平受抑制。有研究表明TSH可以抑制骨吸收[14-15],在骨重建的过程中可能发挥着负性调节作用,Graves病患者的骨质疏松可能与TSH水平受抑制有一定关系[16-17]。在本研究中,我们发现与健康对照人群相比,男性Graves病患者骨量减少及骨质疏松的比例升高,女性Graves病骨量减少者比例升高,差异均有统计学意义,与既往研究相符合。本研究中,男性Graves病患者发生骨量减少和骨质疏松的比例较女性Graves病患者更高,考虑可能与本研究中纳入的男性患者较女性患者病程更长、甲状腺激素水平更高以及既往吸烟史有关。在相关分析中,甲状腺激素水平与全髋BMD(Z值)呈负性相关,与腰椎、股骨颈(Z值)则未见线性相关,考虑与本研究中患者年龄分布较广、病程长短不一、治疗情况不一致有关;同时,本结果提示,较腰椎、股骨颈骨密度、全髋骨密度可能对甲状腺激素的影响更为敏感。 Graves病患者131I治疗有效者甲状腺激素水平可在短时间内降低,而骨密度升高速度较慢。甲状腺激素水平恢复正常后多长时间骨质才能恢复可能取决于骨量减少的程度。既往相关研究提示,经治疗后Graves病患者的骨丢失能够部分逆转[18-19],甲状腺激素水平恢复正常后,在1~5年的时间里,患者的BMD可有不同程度的回升[20]。本次研究对60例131I治疗后1年的Graves病患者进行了骨代谢指标的随访,结果提示骨转化指标OCN、P1NP、β-CTX、尿钙/肌酐水平均较治疗前下降。因骨转化速率下降,骨钙吸收入血减少,对PTH的抑制作用解除,PTH较治疗前上升。BMD较治疗前呈上升趋势,与文献报道相一致[21]。但值得引起重视的是,Graves病患者的骨丢失虽然在治疗后可部分逆转,但一般仍低于同年龄、同性别的正常人群[21-22],即使在甲状腺激素恢复正常多年以后,其骨折风险仍高于正常人群[23]。尤其对于行131I治疗的患者,治疗后半年甚至1年的时间内,多数患者的甲状腺激素水平仍不稳定,治疗后最初数周内甲状腺激素可能仍处于较高水平,导致骨量继续快速流失,随后可能出现的甲减如未及时发现并纠正则导致骨转化速率减慢,影响骨的修复。 总之,Graves病患者普遍存在骨转化加快、BMD下降,严重者可出现骨质疏松甚至骨折,应加大对Graves病患者骨代谢状况的重视程度,尤其对于已有骨量降低的患者应及时干预,必要时采用抗骨质疏松治疗,预防骨质疏松性骨折等严重不良事件的发生。 [1] GARNERO P,VASSY V,BERTHOLINA,etal.Markers of bone turnover in hyperthyroidism and the effects of treatment [J].JClinEndocrinolMetab,1994,78(4):955-959. [2] GOGAKOS AI,BASSETT JH,WILLIAMS GR,etal.Thyroid and bone [J].ArchBiochemBiophys,2010,503(1):129-136. [3] DHANWAL DK,KOCHUPILLAI N,GUPTA N,etal.Hypovitaminosis D and bone mineral metabolism and bone density in hyperthyroidism[J].JClinDensitom,2010,13(4):462-466. [4] LAGARU AN,MCDOTIGALL IR.Treatment of thyrotoxicosis [J].JNuclMed,2007,48(5):379-389. [5] VESTERGAARD P,MOSEKILDE L.Hyperthyroidism,bone mineral,and fracture risk-a-meta-analysis[J].Thyroid,2003,13(6):585-593. [6] GORKA J,TAYLO G,REGINA M.Metabolic and clinical consequences of hyperthyroidism on bone density[J].IntJEndocrinol,2013,14(3):1-11. [7] NICHOLLS J,BRASSILL,MARY J,etal.The skeletal consequences of thyrotoxicosis[J].JEndocrinol,2012,213(3):209-221. [8] MOSEKILDE L,ERIKSEN EF,CHARLES P.Effects of thyroid hormones on bone and mineral metabolism[J].EndocrinolMetabClinNorthAm,1990,19(1):35-63. [9] UDAYAKUMAR N,CHANDRASEKARAN M,RASHEED MH,etal.Evaluation of bone mineral density in thyrotoxicosis[J].SingaporeMedJ,2006,47(11):947-950. [10] FERRARI S,BIANCHI ML,EISMAN JA,etal.Osteoporosis in young adults:pathophysiology,diagnosis,and management [J].OsteoporosInt,2012,23(12):2735-2748. [11] 马文杰,易茜璐,于明香.甲状腺与骨质疏松关系的研究进展[J].复旦学报(医学版),2012,39(4):5-9. [12] MYSLIWIEC J,ZBUCKI R,WINNICKA MM,etal.A crucial role of interleukin-6 in the pathogenesis of thyrotoxicosis-related disturbances of bone turnover in mice [J].HormMetabRes,2007,39(12):884-888. [13] EMKEY GR,EPSTEIN S.Secondary osteoporosis:pathophysiology & diagnosis[J].BestPractResClinEndocrinolMetab,2014,28(6):911-935. [14] ABE E,MARIANS RC,YU W.etal.TSH is a negative regulator of skeletal remodeling [J].Cell,2003,115(2):151-162. [15] KARGA H,PAPAIOANNOU G,POLYMERIS A,etal.The effects of recombinant human TSH on bone turnover in patients after thyroidectomy [J].JBoneMinerMetab,2010,28(1):35-41. [16] SUN L,DAVIES TF,BLAIR HC,etal.TSH and bone loss [J].AnnNYAcadSci,2006,1068:309-318. [17] WILLIAMS GR.Does serum TSH level have thyroid hormone independent effects on bone turnover?[J].NatClinPractEndoc,2009,5(1) :10-11. [18] JODAR E,MUNOZ-TORRES M,ESCOBAR-JIMENEZ F,etal.Antiresorptive therapy in hyperthyroid patients:longitudinal changes in bone and mineral metabolism[J].JClinEndocrinolMetab,1997,82(6):1989-1994. [19] ACOTTO CG,NIEPOMNISZCZE H,VEGA E,etal.Thyrotoxic bone disease in women:a potentially reversible disorder [J].AnnInternMed,2004,7(3):201-208. [20] 陈家伦.临床内分泌学[M].上海:上海科学技术出版社,2011:338. [21] ROSEN CJ,ADLER RA.Longitudinal changes in lumbar bone density amongthyrotoxic patients after attainment of euthyroidism [J].JClinEndocrinolMetab,1992,75(6):1531-1534. [22] KARGA H,PAPAPETROU PD,KORAKOVOUNI A,etal.Bone mineral density in hyperthyroidism [J].ClinEndo,2004,61(4):466-472. [23] VESTERGAARD P,REJNMARK L,MOSEKILDE L.Influence of hyper- and hypothyroidism,and the effects of treatment with antithyroid drugs and levothyroxine on fracture risk [J].CalcifTissueInt,2005,77(3):139-144. The analysis of bone metabolism in hospitalized patients with Graves disease and the changes after131I therapy MA Wen-jie1,3, LYU Chao-yang1,4, ZHANG Yao1, XU Gui-ping1,5, HE Shun-mei1,6, XUE Meng-juan1,7, GAO Jian2, YU Ming-xiang1△ (1DepartmentofEndocrinology,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2CenterforEvidenceBasedMedicine,FudanUniversity,Shanghai200032,China;3DepartmentofEndocrinology,QiluHospital,ShandongUniversity,Qingdao266035,ShandongProvince,China;4DepartmentofEndocrinology,ZhengzhouSeventhPeople’sHospital,Zhengzhou450000,HenanProvince,China;5DepartmentofGerontism,FujianProvincialHospital,Fuzhou350001,FujianProvince,China;6DepartmentofEndocrinology,ZunyiMedicalCollegeAffiliatedHospital,Zunyi563000,GuizhouProvince,China;7DepartmentofElderlyEndocrinology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,HenanProvince,China) Objective To analyze the bone metabolism in hospitalized patients with Graves disease and the changes after131I therapy. Methods The differences of bone metabolism were analyzed between 315 patients with Graves disease and 300 normal controls in a case-control study.The changes in bone turnover markers and BMD levels before and one year after131I therapy were observed in 60 patients. Results Compared to normal control,bone turnover markers were markly higher and BMD levels were lower in patients with Graves disease.The level of thyroid hormones were positively related to bone turnover markers,while negatively related to total hip BMD (Z-score).But there was no linear relationship with lumbarand femoral neck BMD (Z-score).After one year of131I therapy,bone turnover markers were markly lower than that before treatment,while BMD levels were partly higher than that before treatment. Conclusions In Graves disease patients,bone turnover markers were generally increased,while BMD levels decreased compared with normal people.After131I therapy,along with the improvement of thyrotoxicosis,the high bone turnover rate can be suppressed,and BMD can partly recover. Graves disease; bone metabolism;131I therapy R581.5 A 10.3969/j.issn.1672-8467.2017.02.010 2016-04-24;编辑:沈玲) △Corresponding author E-mail:yu.mingxiang@zs-hospital.sh.cn结 果


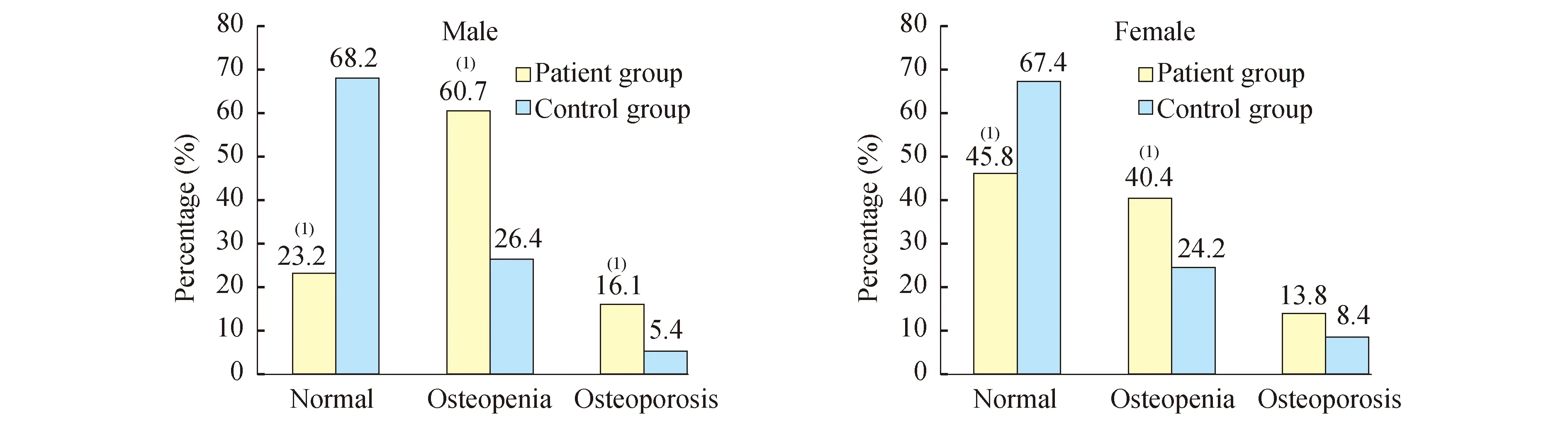
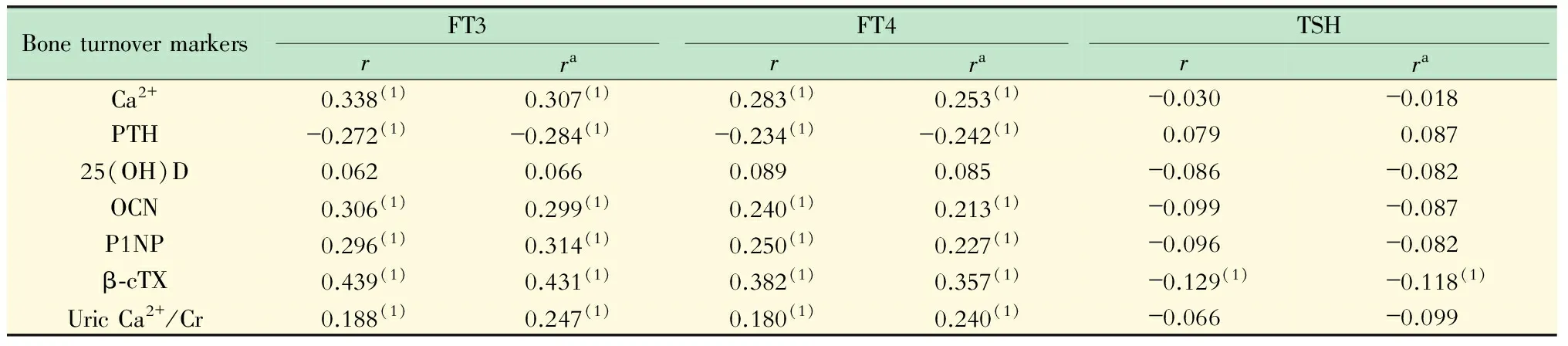
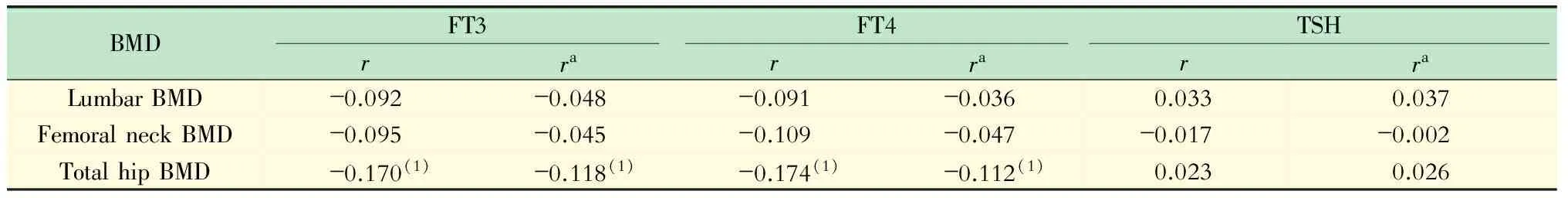
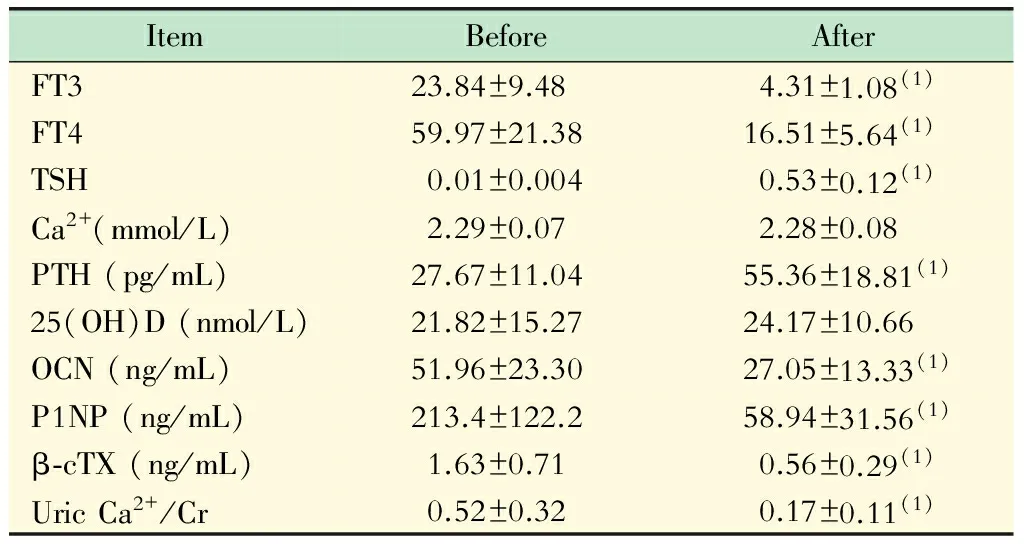
讨 论
