人源有机阴离子转运多肽1B1和多药耐药相关蛋白2双转MDCKⅡ细胞株的构建及其功能验证
2017-05-10胡楠马国杨青,3△
胡 楠 马 国 杨 青,3△
(1复旦大学生命科学学院生物化学系 上海 200438;2复旦大学药学院临床药学教研室 上海 201203;3云南天然产物与生物制药协同创新中心 昆明 650091)
人源有机阴离子转运多肽1B1和多药耐药相关蛋白2双转MDCKⅡ细胞株的构建及其功能验证
胡 楠1马 国2杨 青1,3△
(1复旦大学生命科学学院生物化学系 上海 200438;2复旦大学药学院临床药学教研室 上海 201203;3云南天然产物与生物制药协同创新中心 昆明 650091)
目的 构建人源有机阴离子转运多肽1B1 (human organic anion transporting polypeptide 1B1,hOATP1B1)和多药耐药相关蛋白2 (multidrug resistance-associated protein 2,hMRP2)双转MDCKⅡ细胞株,验证其功能,并应用其考察创新药物2,3-双加氧化酶 (indoleamine 2,3-dioxygenase,IDO)抑制剂1-甲基色氨酸(1-methyl-tryptophan,1-MT)的转运特性。方法 采用基因工程手段获得hOATP1B1和hMRP2表达真核载体pVITRO2-SLCO1B1-ABCC2,转染MDCKⅡ细胞,通过遗传霉素G418筛选得到稳定表达的细胞株;通过Real-time PCR、Western blot、免疫荧光共聚焦显微镜确认目的蛋白特异性;利用该双转模型考察普伐他汀(不同pH环境和不同底物浓度)和1-MT的转运。结果 经电泳分析、双酶切、DNA测序鉴定表明重组质粒构建成功;通过Real-time PCR、Western blot、免疫荧光共聚焦显微镜证明经遗传霉素筛选的MDCK-OATP1B1/MRP2细胞构建成功;pH=6.5时,普伐他汀在所构建双转细胞模型上转运最佳;在0~500 μmol/L的浓度范围内,普伐他汀在该模型上的转运呈现浓度依赖性。1-MT在该细胞模型上无明显转运。结论 成功构建人源MDCK-OATP1B1/MRP2双转细胞株,发现1-MT既不是OATP1B1蛋白也不是MRP2蛋白的底物,该细胞株可用于OATP1B1/MRP2介导的外源性物质(如药物)和内源性物质(如胆红素)的转运研究。
有机阴离子转运多肽1B1; 多药耐药相关蛋白2; MDCKⅡ; 普伐他汀; 1-甲基色氨酸; 转运
肝脏是许多内源性和外源性物质(如药物)代谢的重要场所。药物转运蛋白(drug transport)是完整的膜蛋白,广泛分布于肠道、肝脏、肾脏、脑等组织器官,可以介导药物在体内的吸收、分布和排泄[1]。根据功能不同,药物转运体可分为摄取转运体和外排转运体。摄取转运体如有机阴离子多肽1B1 (organic anion transporting polypeptide 1B1,OATP1B1),外排转运体如P-gp及多药耐药相关蛋白2 (multidrug resistance-associated protein 2,MRP2)等ABC转运体。
OATP1B1蛋白由SLCO1B1基因编码,主要位于肝细胞基底外侧膜。肝脏中的OATP1B1在mRNA和蛋白水平上均有表达[2-7],在小肠等组织中仅有少量在mRNA水平上的表达。在肝细胞中,OATP1B1主要介导外源性物质(他汀类药物、血管紧张素酶抑制剂、血管紧张素Ⅱ受体拮抗剂)和内源性物质(如非结合胆红素)的摄取[8]。
MRP2蛋白由ABCC2基因编码,主要位于肝细胞毛细胆管膜侧,主要介导与葡萄糖醛酸和谷胱甘肽结合的亲脂性物质(如他汀类药物)的外排(分泌),在药物的体内清除过程中发挥重要作用。临床上许多药物是OATP1B1和MRP2的底物和/或调控剂(抑制剂、诱导剂),其中一些是二者的共同底物和/或调控剂。因此,构建一种合适的细胞模型,用于研究这两种转运蛋白介导的药物转运、药物相互作用等具有重要的意义。为此,本研究构建了人源有机离子转运蛋白OATP1B1和MRP2共同转染的MDCK细胞株(MDCK-OATP1B1/MRP2),并以二者的特异性底物普伐他汀、专属性抑制剂MK-571和吉非贝齐对其进行功能验证,并考察了创新药物吲哚胺2,3-双加氧化酶(indoleamine 2,3-dioxygenase,IDO)抑制剂1-甲基色氨酸(1-methyltryprophan,1-MT)在该细胞上的转运。所构建细胞模型可为药物开发和药物相互作用研究提供有用的工具。
材 料 和 方 法
药品与试剂 人源SLCO1B1 cDNA、ABCC2 cDNA(长沙赢润生物技术有限公司),限制性内切酶(日本TaKaRa公司)、PrimeSTAR Max DNA聚合酶(日本TaKaRa公司),NovoRec重组酶(上海近岸科技有限公司),DH5α菌株(Biovector质粒载体菌种细胞基因保藏中心),Lip2000(美国Invitrogen公司);人源OATP1B1一抗(美国Abcam公司,ab15441),人源MRP2一抗(美国CST公司,4446S),Trizol试剂(日本TaKaRa公司);HRP标记二抗、ECL显色液、BCA法蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),普伐他汀钠(上海晶纯生化科技股份有限公司),MK571抑制剂(美国Sigma-Aldrich公司),吉非贝齐(上海晶纯生化科技股份有限公司),1-甲基色氨酸(美国Sigma-Aldrich公司)。
仪器与设备 Lengend Micro 17R高速离心机(美国Thermo Fisher公司);转膜仪、S1000TMPCR仪(美国BioRad公司);SW-CJ-1FD洁净工作台(苏州安泰空气技术有限公司);SCS-24恒温摇床(江苏太仓实验设备厂);垂直平板电泳仪(北京百晶生物技术有限公司);DNP型电热恒温培养箱(上海精宏实验设备有限公司);Clinx Chem Scope(上海勤翔科学仪器有限公司);超低温冰箱(美国Thermo Fisher公司);Zeiss Cell Observer SD (德国Zeiss公司);Agilent 1260高效液相色谱仪(美国安捷伦公司)。
重组质粒pVITRO2-SLCO1B1-ABCC2的构建
利用NovoRec重组酶及目的基因SLCO1B1(2076 bp)和ABCC2(4638 bp)构建质粒pVITRO2-SLCO1B1-ABCC2,引物序列及酶切位点信息见表1。
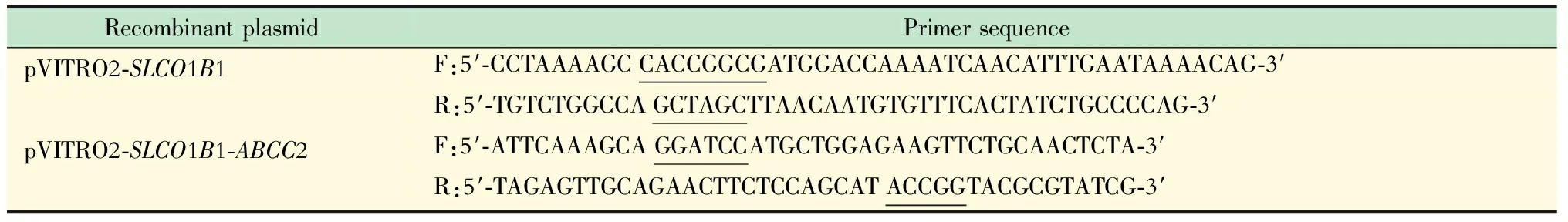
表1 pVITRO2-SLCO1B1及pVITRO2-SLCO1B1-ABCC2引物序列及酶切位点Tab 1 Primer sequence and endonuclease sites of pVITRO2-SLCO1B1 and pVITRO2-SLCO1B1-ABCC2
Endonuclease sites are emphasized with linear underline ;pVITRO2-SLCO1B1 was digested withSgrAI andNheI ; pVITRO2-SLCO1B1-ABCC2 was digested withBamHI andAgeI .
以上述SLCO1B1和ABCC2的cDNA (Genepharma)为PCR模板,利用PrimeSTAR Max DNA聚合酶进行PCR反应,获得目的片段。反应条件为:98 ℃预变性3 min;98 ℃、10 s,56 ℃、15 s,72 ℃、1.5 min,30个循环;72 ℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳鉴定并进行胶回收。利用酶切载体质粒pVITRO2,回收线性化片段将目的片段和线性化载体以8∶1的摩尔比例加到EP管中,利用NovoRec PCR一步定向克隆试剂盒进行重组反应;混匀后在37 ℃放置20 min;反应结束立即进行转化;收集菌体、抽提质粒,进行菌落PCR及质粒双酶切验证,并将鉴定正确的阳性克隆进行测序。
MDCK-OATP1B1/MRP2稳转细胞株筛选 取MDCK细胞置于37 ℃、5%CO2培养箱中培养,待细胞达到90%融合度时,使用Lip 2000进行转染。取适量转染细胞铺于10 cm 细胞培养板上,用1 mg/mL G418遗传霉素筛选至出现“细胞岛”;将“细胞岛”转移至6 孔板,继续用500 μg/mL G418遗传霉素筛选;待细胞长满后,取适量进行鉴定。
MDCK-OATP1B1/MRP2稳转细胞株鉴定
Real-time PCR鉴定 待六孔板中细胞长满后,使用Trizol(RNA iso plus)提取得到RNA,按照37 ℃连接15 min ,85 ℃ 15 s进行RT-PCR(逆转录PCR),得到cDNA。然后,按照95 ℃预变性5 min;95 ℃变性30 s;55 ℃复性30 s;72 ℃退火30 s;72 ℃延伸5 min,进行Real-time PCR。
Western blot鉴定 取MDCK稳转细胞裂解后的总蛋白30 μg,加入5×加样缓冲液中混匀,100 ℃干浴,得到变性蛋白,然后与蛋白Marker分别上样,进行SDS-PAGE电泳,电泳结束后利用转膜仪将凝胶中的蛋白转印到PVDF膜上,5% (质量浓度,PBS配制)的脱脂牛奶常温封闭1.5 h;加入适量人OATP1B1(鼠源,1∶2 000稀释)和MRP2 (兔源,1∶2 000稀释)抗体,4 ℃孵育过夜,PBST (含3‰ Tween20 的PBS溶液)溶液洗膜(洗3次,一次洗10 min),然后加入相对应的二抗(山羊抗小鼠,1∶2 000;山羊抗兔,1∶2 000),室温震摇孵育1.5 h,PBST再次洗膜后,使用ECL化学发光试剂盒在Clinx Chemi Scope仪器中显色。
共聚焦显微镜检测 将待测细胞铺于共聚焦皿(密度5×104个/孔),同时加入10 mmol/L丁酸钠刺激细胞24 h[9];两种一抗共同孵育[1%BSA 90 μL+OATP1B1 一抗 10 μL (1∶10,使用PBS稀释)+MRP2一抗 0.25 μL (1∶400)],4 ℃过夜;吸去一抗,使用PBS洗3次,每次10 min;室温避光孵育荧光二抗1 h[PBS 98 μL+OATP1B1荧光二抗1 μL (1∶100)+MRP2荧光二抗1μL(1∶100)];吸去二抗,使用PBS洗3次,每次10 min;DAPI (1 μg/mL)染色10 min,使用PBS洗3次,每次10 min,2 h内使用Zeiss Cell Observer SD进行检测。
MDCK-OATP1B1/MRP2稳转细胞株功能验证
不同pH值条件下普伐他汀的MDCK-OATP1B1/MRP2细胞转运 将MDCK-OATP1B1-MRP2细胞铺于12孔Transwell板,培养5天;实验前一天,在Apical室内加入终浓度为10 mmol/L的丁酸钠刺激24 h。Apical侧到Basolateral侧转运:将普伐他汀溶液加入到细胞Apical侧(供给室),调节细胞转运液pH值分别为6.0、6.5、7.0和7.5;在Basolateral侧加入pH值为7.5的Krebs-Henseleit缓冲液。Basolateral侧到Apical侧转运:普伐他汀溶液加入到Basolateral侧,按同法操作;分别在30 min、60 min、90 min吸取接收室溶液100 μL,13 000×g离心1 min,取上清液进行HPLC检测。
不同浓度普伐他汀的MDCK-OATP1B1/MRP2细胞转运 将终浓度分别为10、50、100、500、1 000、1 500、2 000和2 500 μmol/L的普伐他汀溶液加入到细胞Basolateral侧(供给室,细胞转运液pH值为6.5),按上法进行转运实验。
OATP1B1和MRP2抑制剂对普伐他汀转运的影响 分别将OATP1B1抑制剂吉非贝齐(终浓度8 μmol/L)和MRP2抑制剂MK-571 (终浓度40 nmol/L)加入到MDCK-OATP1B1/MRP2细胞的Basolateral侧和Apical侧,同时加入普伐他汀,同法研究普伐他汀在细胞上的转运。
IDO抑制剂1-MT在MDCK-OATP1B1/MRP2细胞上的转运 分别将OATP1B1的抑制剂吉非贝齐(终浓度8 μmol/L)和MRP2的抑制剂MK-571(终浓度40 nmol/L)加入到MDCK-OATP1B1/MRP2细胞的Basolateral侧和Apical侧,同时加入1-MT,同法研究1-MT在细胞上的转运。
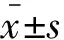
结 果
重组质粒pVITRO2-SLCO1B1-ABCC2的构建 pVITRO2-SLCO1B1和pVITRO2-SLCO1B1-ABCC2的凝胶电泳图分别见图1和2。可以定性得知pVITRO2-SLCO1B1-ABCC2质粒构建成功,后经测序公司验证,序列完全正确无突变,确认双转质粒构建成成功。
MDCK-OATP1B1/MRP2稳转细胞株鉴定
Real-time PCR鉴定 MDCK双转细胞中SLCO1B1(编码OATP1B1)和ABCC2 (编码 MRP2) mRNA表达分析结果见图3。在MDCK-OATP1B1/MRP2细胞的mRNA水平上,SLCO1B1基因表达量比对照组高72倍,ABCC2基因表达量比对照组高220倍。这说明MDCK-OATP1B1/MRP2细胞在RNA水平上显著表达SLCO1B1和ABCC2两个基因。
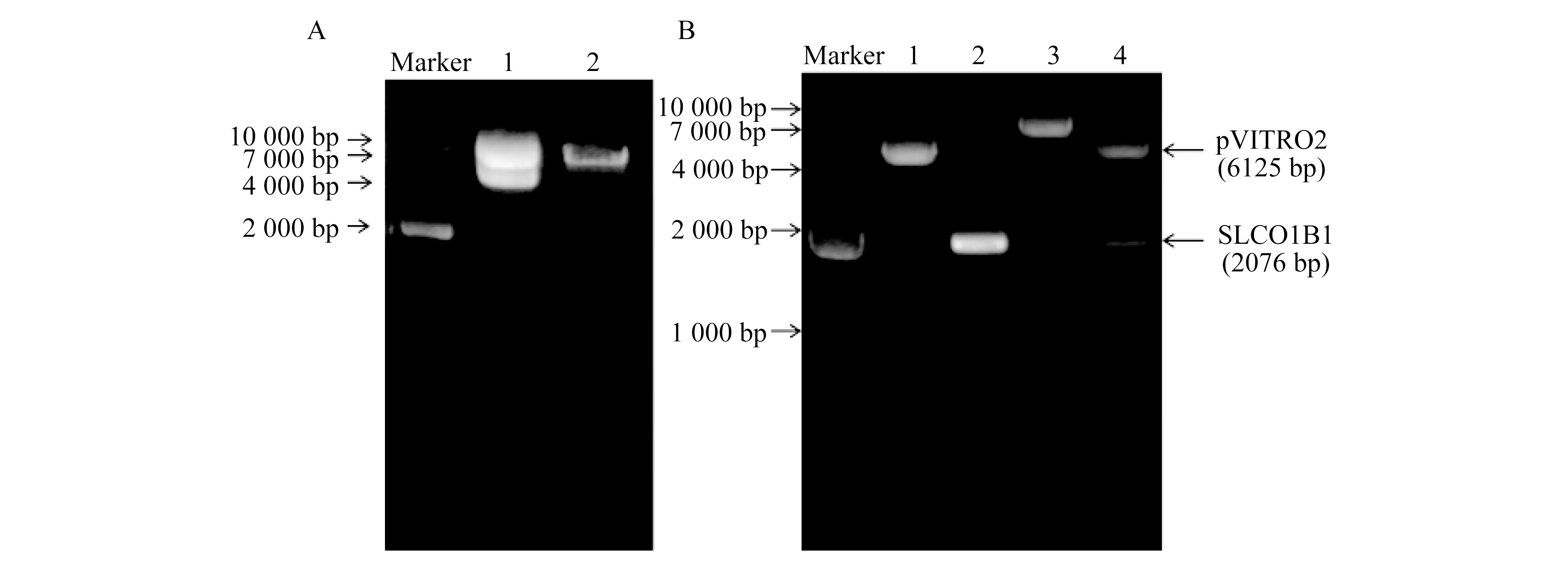
A:Lane 1:pVITRO2 plasmids;Lane 2:Double digested pVITRO2-SLCO1B1.B:Lane 1:The linear pVITRO2;Lane 2:Full-length SLCO1B1 fragments; Lane 3:pVITRO2-SLCO1B1 plasmid;Lane 4:Double digested pVITRO2-SLCO1B1.

Lane 1:The linear pVITRO2-SLCO1B1;Lane 2:Full-length ABCC2 fragments; Lane 3:pVITRO2-SLCO1B1-ABCC2 plasmid;Lane 4:Double digested pVITRO2-SLCO1B1-ABCC2.
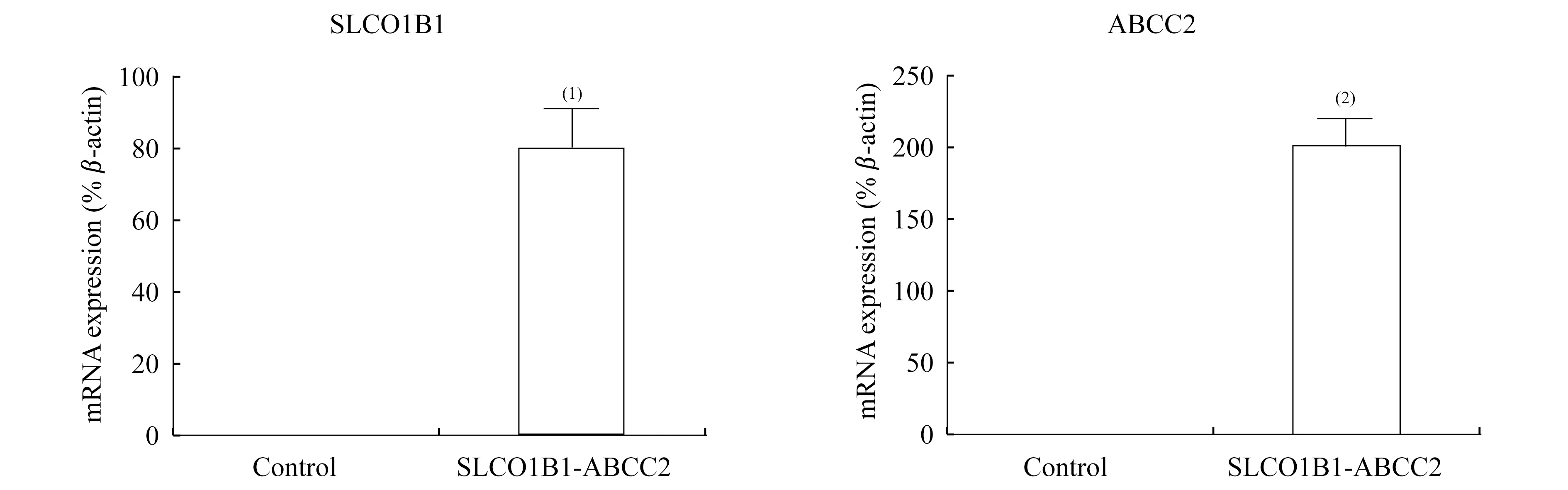
Control group vs.Wild type MDCK Ⅱ cells,(1)P<0.05,(2)P<0.01.
Western blot鉴定 MDCK-OATP1B1/MRP2的Western blot鉴定结果见图4。所构建的MDCK-OATP1B1/MRP2细胞在蛋白水平上都表达OATP1B1和MRP2蛋白,同时发现丁酸钠浓度为10 mmol/L时蛋白表达量显著,效果最佳。
共聚焦显微镜检测 MDCK-OATP1B1/MRP2细胞中OATP1B1和MRP2的免疫荧光分析结果见图5。较之野生型MDCK细胞,MDCK-OATP1B1/MRP2双转细胞的细胞膜上稳定表达OATP1B1 (绿色荧光)和MRP2 (红色荧光)两个蛋白。
上述Real-Time PCR、Western blot和共聚焦显微实验分别从RNA水平、蛋白水平、免疫荧光水平3个方面证明两种目的蛋白在MDCK-OATP1B1/MRP2细胞上均有表达。
MDCK-OATP1B1-MRP2稳转细胞株功能验证
不同pH值条件下普伐他汀的MDCK-OATP1B1/MRP2细胞转运 由图6可知,pH在6.0~7.5范围内,普伐他汀从Basal侧至Apical侧或者Apical至Basal侧转运量随时间的增加而增加;在pH为7.0 (中性)时,普伐他汀双向转运均高于pH为6.0和6.5 (弱酸性)时的转运。中性环境比弱酸性环境更有利于普伐他汀的转运(P<0.05)。pH为7.5 (弱碱性)时,普伐他汀Apical侧至Basal侧转运高于Basal侧至Apical侧转运,说明弱碱性条件利于普伐他汀从Apical侧至Basal侧转运,因而不利于其消除;pH为6.5时,普伐他汀转运的R值(R=b-a/a-b)为2.0,远高于其他组,说明在此条件下,该细胞模型符合体内实际情况。
不同浓度普伐他汀的MDCK-OATP1B1/MRP2细胞转运 由图7和图8可知,普伐他汀在MDCK-OATP1B1/MRP2细胞上的转运呈浓度依赖性。当底物浓度高于500 μmol/L,普伐他汀在细胞上的转运趋于饱和。普伐他汀在野生型细胞上几乎没有转运;当OATP1B1或MRP2任一蛋白被抑制,普伐他汀转运都大大降低。普伐他汀在OATP1B1/MRP2双转染细胞上的转运量显著高于OATP1B1抑制组(含gemfibrozil组)、MRP2抑制组(含MK571组)及野生型组(P<0.01)。
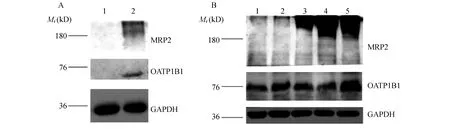
A:The expression analysis of OATP1B1 and MRP2 in MDCK and MDCK-OATP1B1/MRP2 cells by Western blot.B:The expression analysis of OATP1B1 and MRP2 in MDCK-OATP1B1/MRP2 cells by Western blot,after the stimulation of Na-butyrate ranging from 1 mmol/L to 15 mmol/L at 24 hours.A:Lane 1:MDCK cells; Lane 2:MDCK-OATP1B1/MRP2 cells.B:Lane1:MDCK-OATP1B1/MRP2 control;Lane 2:MDCK-OATP1B1/MRP2-1 mmol/L Na-butyrate;Lane 3:MDCK-OATP1B1/MRP2-5 mmol/L Na-butyrate;Lane 4:MDCK-OATP1B1/MRP2-10 mmol/L Na-butyrate;Lane 5:MDCK-OATP1B1/MRP2-15 mmol/L Na-butyrate.
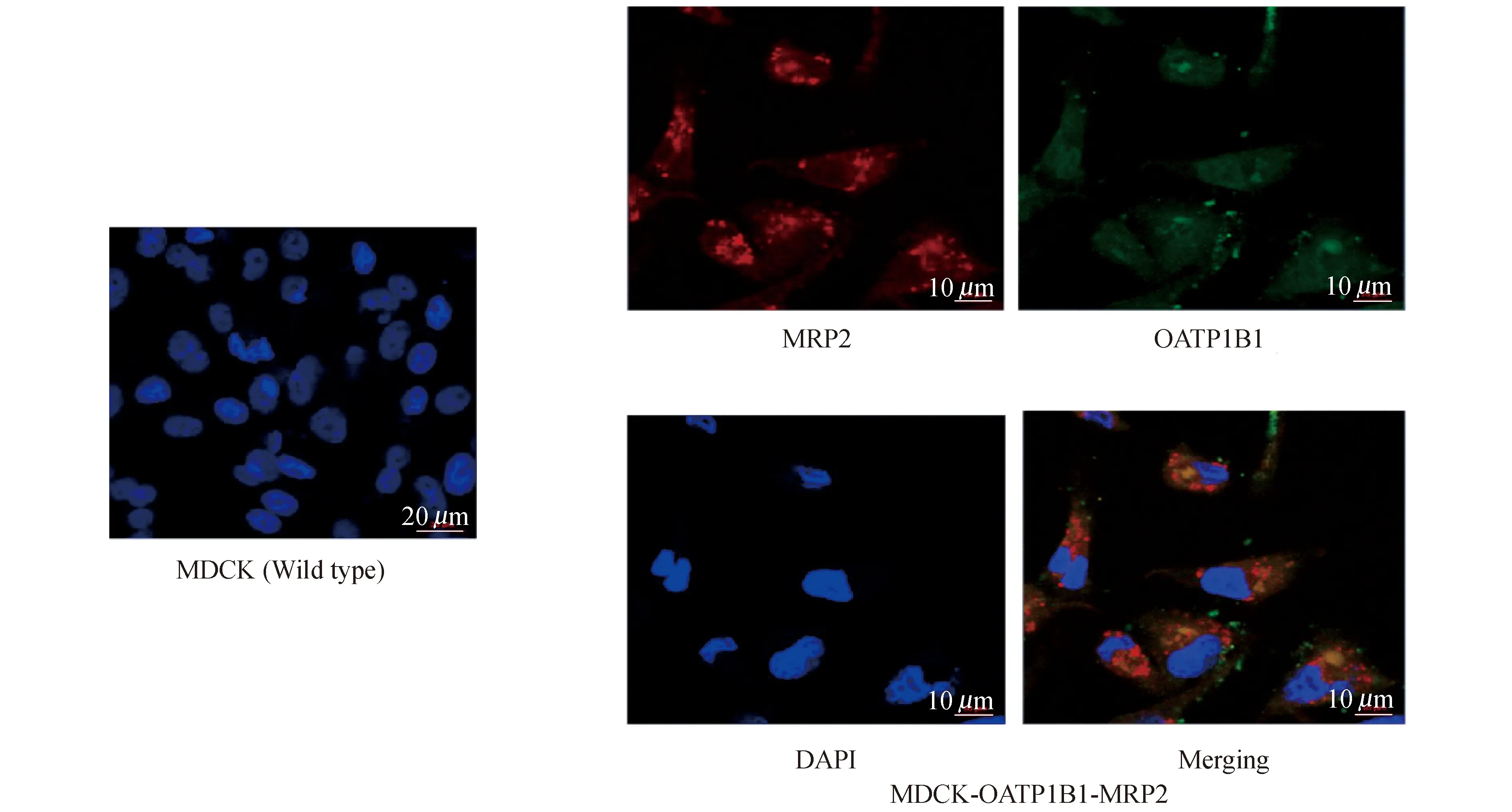
MDCK-OATP1B1/MRP2 cells were stained with the polyclonal antibody against humanOATP1B1 (green fluorescence) and the monoclonal antibody against human MRP2 (red fluorescence).Nuclei were stained with DAPI (blue fluorescence).
IDO抑制剂1-MT在MDCK-OATP1B1/MRP2细胞上的转运 由图9可知,1-MT (100 μmol/L)在MDCK-OATP1B1/MRP2细胞上的转运量与OATP1B1抑制组、MRP2抑制组及野生型组比较,差异无统计学意义(P> 0.05)。这说明1-MT既不是OATP1B1的底物,也不是MRP2的底物。
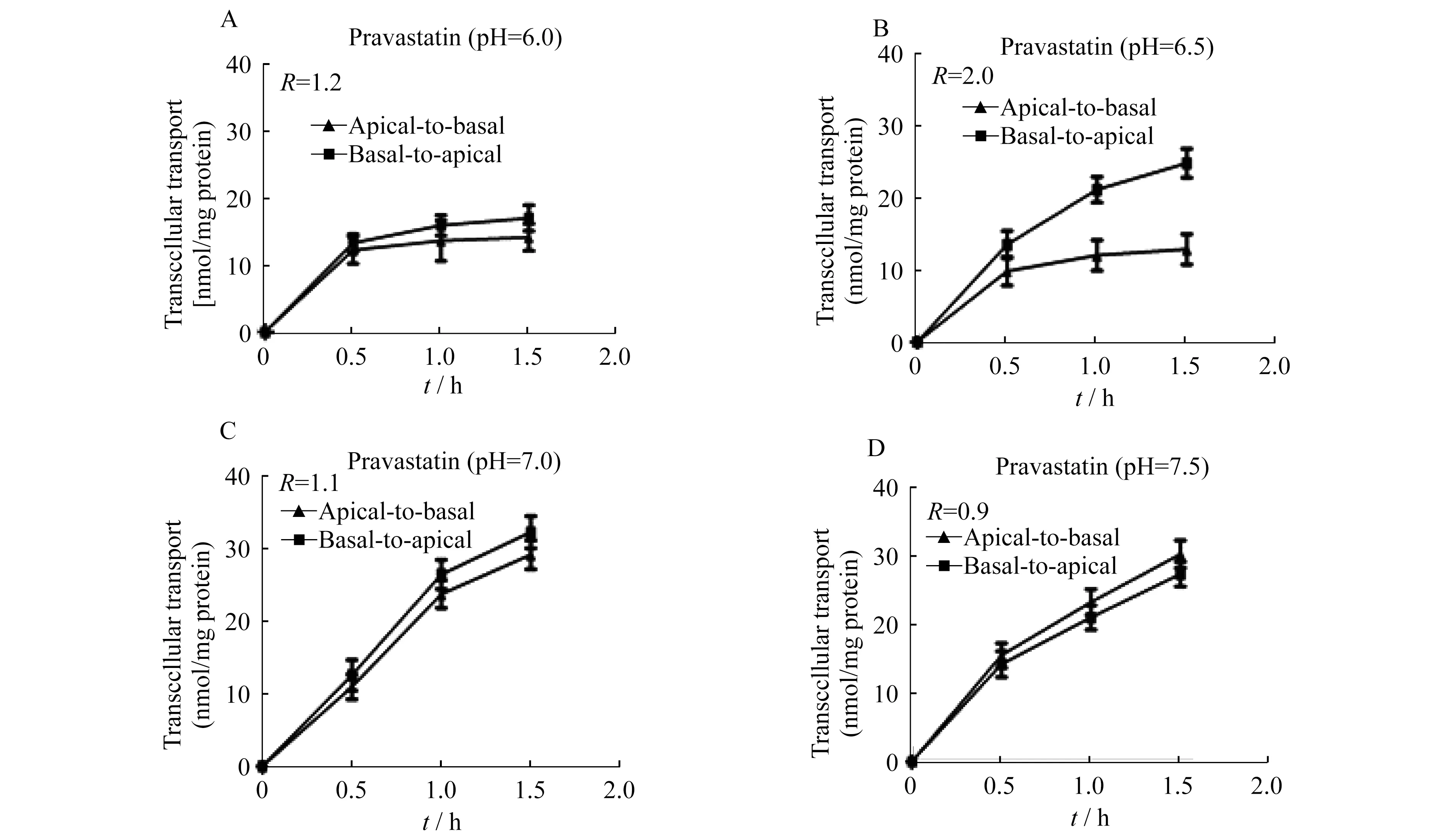
pH dependence of pravastatin (500 μmol/L) basal to apical (b-a) and apical to basal (a-b) transcellulartransportin monolayers of MDCK-OATP1B1-MRP2 cells after administration of pravastatin either the basal or the apical side of the cell monolayers.pH was 6.0(A),6.5(B),7.0(C),7.5(D).Data are shown as mean value± standard deviation.The transport ratio (R) was calculated as the quotient of the mean of the apically directed transport and the mean of the basally directed transport at 1.5 h.
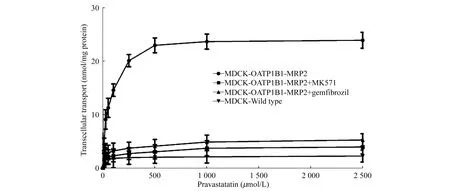
Concentration-dependent transcellular transport of pravastatin in monolayers of MDCK-wild type,MDCK-OATP1B1/MRP2 pretreated with MK571 (40 nmol/L),MDCK-OATP1B1/MRP2 pretreated with gemfibrozil (8 μmol/L),and MDCK-OATP1B1-MRP2 cells.Gemfibrozil is the specific inhibitor of OATP1B1 protein,and MK571 is the specific inhibitor of MRP2 protein.
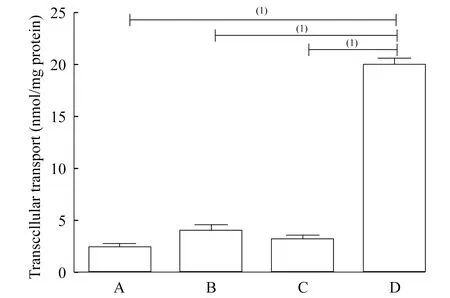
A:Transcellular transport of pravastatin (500 μmol/L) in monolayers of MDCK-Wild type;B:MDCK-OATP1B1/MRP2 pretreated with MK571 (40 nmol/L);C:MDCK-OATP1B1/MRP2 pretreated with gemfibrozil (8 μmol/L);D:MDCK-OATP1B1-MRP2 cells.Gemfibrozil is the specific inhibitor of OATP1B1 protein,and MK571 is the specific inhibitor of MRP2 protein.(1)P<0.01.
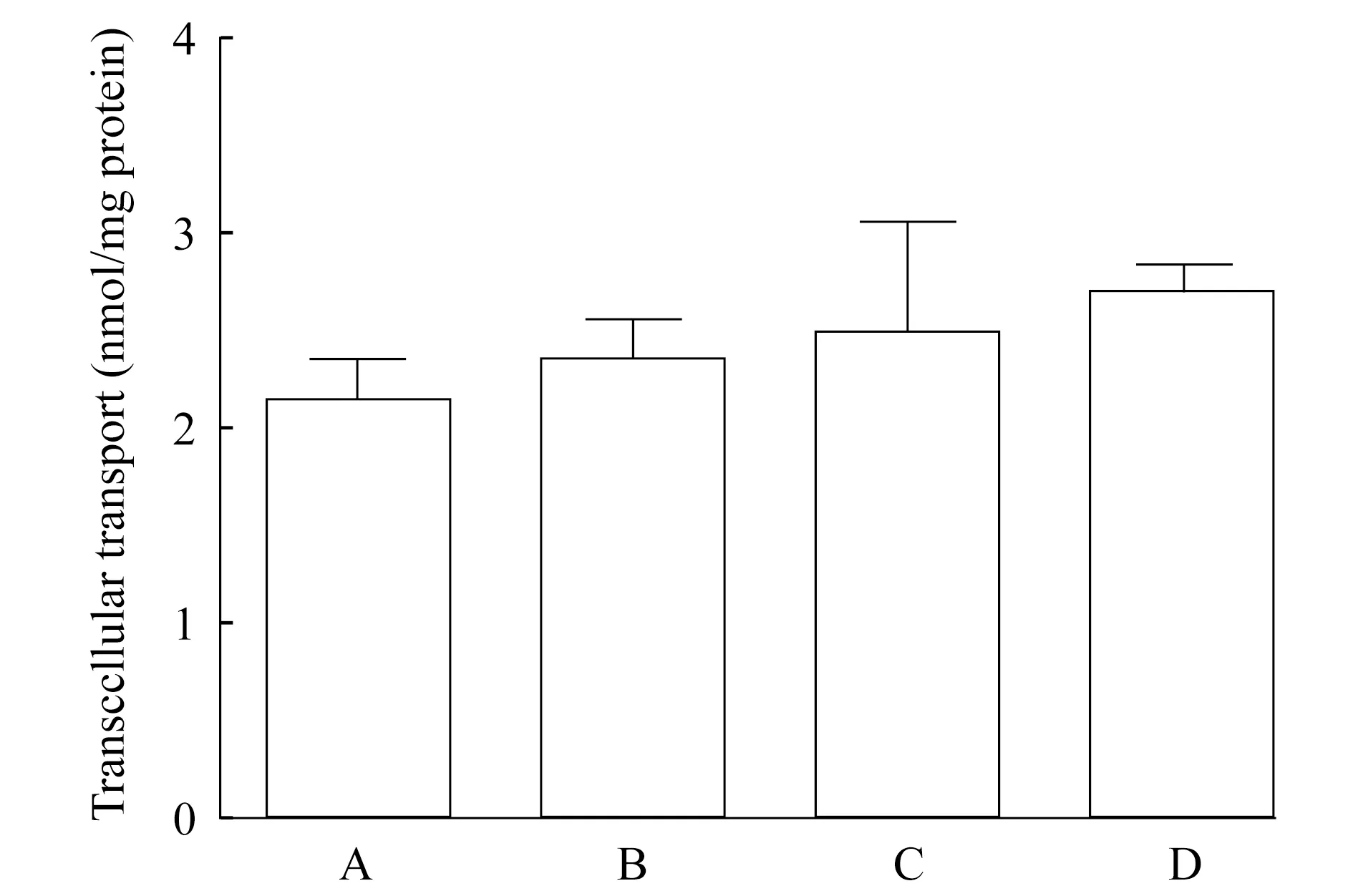
A:1-MT (100 μmol/L)was administered to the basal side of monolayers of MDCK wild type;B:MDCK-OATP1B1/MRP2 pretreated with MK-571 (40 nmol/L);C:MDCK-OATP1B1/MRP2 pretreated with gemfibrozil (8 μmol/L);D:MDCK-OATP1B1/MRP2 cells.
讨 论
本研究将SLCO1B1和ABCC2基因分别连接至pVITRO2质粒的2个多克隆位点上,构建得到pVITRO2-SLCO1B1-ABCC2重组质粒,然后通过Lip2000转染进MDCKⅡ细胞,使用遗传霉素筛选得到MDCK-OATP1B1/MRP2细胞株,相关方法未见文献报道。
本实验除了研究OATP1B1和MRP2转运蛋白共同介导的普伐他汀和1-MT转运外,同时也考察了单一转运蛋白OATP1B1或者MRP2对普伐他汀和1-MT转运的影响。对于后者的研究,常采用的方法有两种,一是分别构建单转的MDCK-OATP1B1和MDCK-MRP2细胞;二是分别使用2个转运蛋白的专属性抑制剂,即OATP1B1专属性抑制剂吉非贝齐[10]和MRP2专属性抑制剂MK571[11],本实验采用后一种方法。MDCK-OATP1B1/MRP2经相关特异性蛋白抑制剂预处理后,可以达到单转MDCK-OATP1B1和MDCK-MRP2细胞相同的研究效果(图8、9)。
普伐他汀在MDCK-OATP1B1/MRP2细胞上的转运量显著高于野生型组及加入OATP1B1抑制剂gemfibrozil组和MRP2抑制剂MK571组(P<0.01,图8)。这说明OATP1B1和MRP2均参与了普伐他汀的跨细胞转运,二者在普伐他汀的主动转运过程中均发挥重要作用。二者中任意一个蛋白被抑制,均可使普伐他汀的转运显著减少。IDO作为色氨酸经犬尿氨酸代谢途径代谢的限速酶[12-13],与肿瘤及阿尔茨海默症等疾病密切相关,是备受关注的药物作用靶点。1-MT是发现较早、与底物色氨酸结构最接近的竞争性IDO抑制剂,也是公认的IDO抑制剂[14-15],目前广泛应用于IDO抑制剂的抗肿瘤研究中。1-MT在MDCK-OATP1B1/MRP2细胞上的转运与野生型组比较差异无统计学意义,说明OATP1B1和MRP2未参与1-MT的跨细胞转运,据此推测1-MT的转运可能是被动转运和/或其他转运蛋白介导的转运。
综上所述,本研究成功构建了MDCK-OATP1B1/MRP2双转细胞模型,其可为OATP1B1/MRP2介导的外源性物质(如他汀类药物)和内源性物质(如结合胆红素)的转运研究提供一个良好的研究工具,并将在新药开发及药物相互作用研究中发挥重要作用。
[1] KLAASSEN CD,ALEKSUNES LM.Xenobiotic,bile acid,and cholesterol transporters:function and regulation [J].PharmacolRev,2010,62(1):1-96.
[2] KONIG J,CUI Y,NIES AT,etal.Localization and genomic organization of a new hepatocellular organic anion transporting polypeptide [J].JBiolChem,2000,275(30):23161-23168.
[3] KONIG J,CUI Y,NIES AT,etal.A novel human organic anion transporting polypeptide localized to the basolateral hepatocyte membrane [J].AmJPhysiolGastrointestLiverPhysiol,2000,278(1):G156-164.
[4] ABE T,KAKYO M,TOKUI T,etal.Identification of a novel gene family encoding human liver-specific organic anion transporter LST-1 [J].JBiolChem,1999,274(24):17159-17163.
[5] HSIANG B,ZHU Y,WANG Z,etal.A novel human hepatic organic anion transporting polypeptide (OATP2).Identification of a liver-specific human organic anion transporting polypeptide and identification of rat and human hydroxymethylglutaryl-CoA reductase inhibitor transporters [J].JBiolChem,1999,274(52):37161-37168.
[6] HO RH,TIRONA RG,LEAKE BF,etal.Drug and bile acid transporters in rosuvastatin hepatic uptake:function,expression,and pharmacogenetics[J].Gastroenterology,2006,130(6):1793-1806.
[7] KARTENBECK J,LEUSCHNER U,MAYER R,etal.Absence of the canalicular isoform of the MRP gene-encoded conjugate export pump from the hepatocytes in Dubin-Johnson syndrome [J].Hepatology,1996,23(5):1061-1066.
[8] 林佳媛,马国.胆红素的代谢及其调节研究进展[J].复旦学报(医学版),2014,41 (3):405-411.
[9] KONIG J,ZOLK O,SINGER K,etal.Double-transfected MDCK cells expressing human OCT1/MATE1 or OCT2/MATE1:determinants of uptake and transcellular translocation of organic cations[J].BrJPharmacol,2011,163(3):546-555.
[10] NAKAGOMI HR,NAKAI D,TOKUI T,etal.Gemfibrozil and its glucuronide inhibit the hepatic uptake of pravastatin mediated by OATP1B1[J].Xenobiotica,2007,37(5):474-486.
[11] YAMAZAKI M,LI B,LOUIE SW,etal.Effects of fibrates on human organic anion-transporting polypeptide 1B1-,multidrug resistance protein 2- and P-glycoprotein-mediated transport[J].Xenobiotica,2005,35(7):737-753.
[12] LOB S,KONIGSRAINER A,RAMMENSEE HG,etal.Inhibitors of indoleamine 2,3-dioxygenase for cancer therapy:can we see the wood for the trees?[J].NatRevCancer,2009,9(6):445-452.
[13] MOFFETT JR,NAMBOODIRI MA.Tryptophan and the immune response[J].ImmunolCellBiol,2003 ,81(4):247-265.
[14] CADY SG,SONO M.1-Methyl-DL-tryptophan,beta-(3-benzofuranyl)-DL-alanine (the oxygen analog of tryptophan),and beta-[3-benzo(b)thienyl]-DL-alanine (the sulfur analog of tryptophan) are competitive inhibitors for indoleamine 2,3-dioxygenase[J].ArchBiochemBiophys,1991,291(2):326-333.
[15] KATZ JB,MULLER AJ,PRENDERGAST GC.Indoleamine 2,3-dioxygenase in T-cell tolerance and tumoral immune escape[J].ImmunolRev,2008,222:206-221.
Establishment of double-transfected MDCK Ⅱ cells expressing human organic anion transporting polypeptide 1B1 and multidrug resistance-associated protein 2 and identification of its functions
HU Nan1, MA Guo2, YANG Qing1,3△
(1DepartmentofBiochemistry,SchoolofLifeSciences,FudanUniversity,Shanghai200438,China;2DepartmentofClinicalPharmacy,SchoolofPharmacy,FudanUniversity,Shanghai201203,China;3theCollaborativeInnovationCenterofYunnanNaturalProductsandBiologicalPharmacy,Kunming650091,YunnanProvince,China)
Objective To establish double-transfected Madin-Darby canine kidney (MDCK ) Ⅱ cells expressing human organic anion transporting polypeptide 1B1(hOATP1B1) and multidrug resistance-associated protein 2 (hMRP2)and to testify their functions,moreover,to study the transcellur transport of indoleamine 2,3-dioxygenase (IDO) inhibitor 1-methyltryptophan (1-MT) in the transfectants.Methods hOATP1B1/hMRP2 eukaryotic vectorspVITRO2-SLCO1B1-ABCC2 was obtained by genetic engineering method and then transfected into MDCK cells.Stably expressed MDCK cells were screened by using the geneticin G418.Real-time PCR,Western blot analysis and immuno fluorescent confocal microscopy were used to verify the proteins expression.Transport of the representative substrate pravastatin in different pH values and substrate concentrations and 1-MT were evaluated using the double transfectants. Results MDCK-OATP1B1/MRP2 was successfully established.Pravastatin displayed the optimal transcellular transport when pH value was 6.5.Transport of pravastatin demonstrated the concentration-dependent in the concertation range of 0 to 500 μmol/L.Transport of 1-MT showed no significant difference in MDCK cells and transfectants. Conclusions MDCK-OATP1B1/MRP2 was successful established;1-MT was not the substrate of OATP1B1 or MRP2 protein;and the eatablished double transfectant cell lines can be used to evaluate OATP1B1/MRP2-medicated transport of xenobiotics (e.g.new drug candidates) and endogenous compounds (e.g.bilirubin).
organic anion transporting polypeptide 1B1; multidrug resistance-associated protein 2;Madin-Darby canine kidney Ⅱ; pravastatin; 1-methyltryptophan; transport
国家自然科学基金面上项目(81573310,81374051);高等学校博士学科点专项科研基金(20130071110037)
R965.1,Q233
A
10.3969/j.issn.1672-8467.2017.02.002
2016-09-26;编辑:王蔚)
△Corresponding author E-mail:yangqing68@fudan.edu.cn
*This work was supported by the General Program of National Natural Science Foundation of China (81573310,81374051) and the Research Fund for the Doctoral Program of Higher Education of China (20130071110037).
