炎性因子与过敏性鼻炎鼻息肉复发的关系
2017-05-10李艳平张爱贤董金霞贾永亮宋金英
李艳平+张爱贤+董金霞+贾永亮+宋金英

(盐山县人民医院耳鼻喉科,河北盐山 061300)
[摘 要] 目的:探究炎性因子与过敏性鼻炎鼻息肉复发的关系,分析预防策略。方法:2014年1月—2016年1月期间来院就诊的92例过敏性鼻炎鼻息肉患者为观察组,按照其鼻息肉复发情况分为复发组、未复发组,并选取同期70例行鼻中隔偏曲手术患者为对照组,检测两组受试者血清白细胞介素-2(IL-2)、IL-4、IL-6、IL-8、IL-13、IL-17及观察组患者鼻息肉、对照组患者鼻黏膜组织组织炎性因子水平,分析炎性因子与鼻息肉复发的关系。结果:两组受试者血清IL-4、IL-5、IL-13、IL-17水平均高于黏膜组织,观察组息肉组织IL-6、IL-8水平高于同组血清及对照组黏膜组织,差异有统计学意义(P<0.05)。观察组92例患者中,共有21例患者复发,复发率为22.83%。复发组息肉组织IL-6、IL-8水平高于未复发组黏膜组织,差异有统计学意义(P<0.05),复发组、未复发组血清IL-6、IL-8水平比较,差异无统计学意义(P>0.05)。结论:过敏性鼻炎鼻息肉组织内IL-6、IL-8水平明显升高,且其升高程度与鼻息肉复发具有密切关联,应注重局部炎性反应的调控。
[关键词] 炎性因子;过敏性鼻炎;鼻息肉;复发
中图分类号:R765 文献标识码:A 文章编号:2095-5200(2017)04-087-03
DOI:10.11876/mimt201704035
鼻息肉是临床常见疾病,常继发于过敏性鼻炎,但其发病机制尚无明确阐释,多数学者认为,细菌、真菌、病毒及变应原等多种因素引发的鼻腔、鼻窦黏膜通透性增加是鼻息肉的病理生理基础[1]。鼻内窥镜手术、鼻喷激素是当前被证实治疗鼻息肉的有效方案,但患者治疗后复发率高达15%~40%[2]。最新研究发现,在鼻息肉的形成过程中,炎性因子扮演了重要角色,其介导的炎症反应可能是造成鼻腔局部微环境变化、增加鼻息肉复发风险的关键[3]。因此,探讨炎性因子与过敏性鼻炎鼻息肉复发的关系,不仅有助于预防策略的制定,还可进一步了解鼻息肉的发病机制。为此,本研究选取92例过敏性鼻炎鼻息肉患者及70例鼻中隔偏曲手术患者进行了对照分析,现作报道。
1 资料与方法
1.1 一般资料
2014年1月—2016年1月期间来院治疗的92例过敏性鼻炎鼻息肉患者,入组前1个月内无激素和抗组胺药物使用史,排除合并变应性鼻炎[4]、支气管哮喘及其他系统严重病变者,纳入观察组。选取同期70例行鼻中隔偏曲手术患者,均无过敏性鼻炎、鼻息肉、鼻窦炎病史,且鼻黏膜未见明显病变,纳入对照组。观察组男53例(57.61%),女39例(42.39%),年龄28~61岁,平均(43.65±7.26)岁;对照组男38例(54.29%),女32例(45.71%),年龄25~63歲,平均(44.19±7.73)岁。两组受试者年龄、性别比例比较,差异无统计学意义(P>0.05),具有可比性。本临床研究已征得我院医学伦理委员会批准,受试者均知情同意并签署知情同意书。
1.2 标本取材与检测
观察组患者均接受鼻内窥镜下鼻息肉切除术,保留息肉头端组织,对照组患者于鼻中隔矫正术中取中鼻甲头端距上缘约5 mm黏膜组织,将生理盐水冲洗后的息肉组织、黏膜组织分别研磨制成组织匀浆,以3000 r/min离心15 min,取上清,使用放射免疫法检测患者息肉/黏膜组织炎性因子水平[5],试剂盒均购自北京北方生物技术研究所。抽取两组患者术前空腹肘静脉血3 mL,3000 r/min离心5 min,同样采用放射免疫法检测组织标本、血清上清液IL-2、IL-4、IL-6、IL-8、IL-13、IL-17水平[6]。
1.3 分析方法
比较两组受试者息肉/黏膜组织、血清炎性因子表达情况。并按照观察组患者鼻息肉复发情况分为复发组、未复发组,比较患者息肉/黏膜组织、血清炎性因子表达情况,分析炎性因子与过敏性鼻炎鼻息肉复发的关系。
1.4 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别以(n/%)表示,并采用χ2检验,年龄、炎性因子水平计量资料以(x±s)表示,并采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 观察组与对照组炎性因子检测结果
两组受试者血清IL-4、IL-5、IL-13、IL-17水平均高于息肉/黏膜组织,观察组息肉组织IL-6、IL-8水平高于同组血清及对照组黏膜组织,差异有统计学意义(P<0.05)。见表1。
2.2 复发组与未复发组炎性因子检测结果
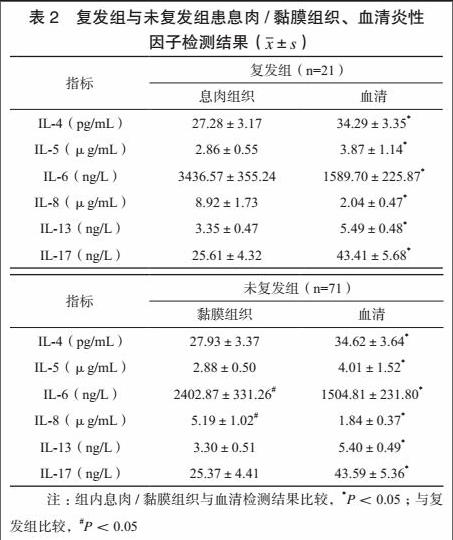
观察组92例患者中,共有21例患者复发,复发率为22.83%。复发组黏膜组织IL-6、IL-8水平高于未复发组黏膜组织,差异有统计学意义(P<0.05),复发组、未复发组血清IL-6、IL-8水平比较,差异无统计学意义(P>0.05)。见表2。
3 讨论
过敏性鼻炎鼻息肉的病理改变包括血管通透性增加、组织间质水肿、张力增高等,是一种慢性炎症过程[7]。大量研究认为,以炎性因子趋化、移行和凋亡调控为代表的变态反应所致微环境改变,在鼻息肉发生发展过程中发挥了重要作用[8-9],因此,近年来越来越多的学者将研究方向着重于炎性因子与鼻息肉发病机理的探讨。
既往研究发现,鼻息肉的形成与多种介质有关,包括组胺、嗜酸性粒细胞趋化因子、白三烯B4等[10],最新报道指出,以白细胞介素为代表的细胞因子也可能参与了过敏性鼻炎鼻息肉的形成与发展[11]。本研究选取IL-4、IL-5、IL-6、IL-8、IL-13及IL-17,就其与过敏性鼻炎鼻息肉复发的关系进行了分析,结果表明,鼻息肉组织IL-6、IL-8表达水平显著高于血清表达,且高于相同年龄、性别的非鼻部炎性病变人群,说明鼻息肉组织存在IL-6、IL-8大量聚集状态。与此同时,与未复发患者相比,鼻息肉复发者黏膜组织IL-6、IL-8表达水平更高,说明上述炎性因子导致的炎性反应是导致鼻息肉复发的重要原因。
IL-6是由184个氨基酸构成的糖蛋白,可由纤维母细胞、内皮细胞、单核吞噬细胞等多种细胞分泌,是炎性反应起始阶段的重要因子,其功能包括诱导急性期蛋白合成与分泌、促进中性粒细胞产生与活化、上调B细胞增殖能力等[12-13],其中,IL-6增强中性粒细胞功能和延长中性粒细胞功能性生命期限作用被认为是加剧炎性反应的主要原因[14]。鼻息肉黏膜组织IL-6高水平表达意味着局部免疫反应活性较强、基质合成速度较快,而单纯息肉组织切除无法完全缓解这一状态,故术后呼吸道黏膜重建后,局部慢性炎性反应仍持续存在,此时感染、窦内缺氧等一系列生化改变均可再次诱发鼻息肉形成[15]。
IL-8是反映感染狀态的重要炎性因子,与此同时,局部炎性反应所致IL-8分泌增加还可直接作用于鼻黏膜,加重鼻黏膜损伤、诱导鼻息肉发展,形成恶性循环[16]。作为一种最强的趋化因子,IL-8可趋化淋巴细胞与嗜酸粒细胞,加剧嗜酸性粒细胞阳离子蛋白、白三烯、血小板激活因子等炎性递质的释放,在加剧局部炎性损伤的同时,还可上调中性粒细胞与粘附分子表达,进而诱导单核细胞聚集、组织胺大量释放[17]。可以认为,趋化因子IL-8水平的升高,在鼻息肉复发过程中也发挥了关键作用。有学者发现,口服大环内酯类抗生素联合局部应用激素,能够降低黏膜组织IL-6、IL-8水平[18],有望预防过敏性鼻炎鼻息肉的复发,关于这一方案的具体效果,有待日后临床实践加以证实。
综上所述,IL-6、IL-8与过敏性鼻炎鼻息肉复发具有密切关联,通过应用抗生素、激素等一系列治疗措施抑制IL-6、IL-8活性,有望预防鼻息肉的反复发作,值得进一步关注。
参 考 文 献
[1] Bachert C, Mannent L, Naclerio R M, et al. Effect of subcutaneous dupilumab on nasal polyp burden in patients with chronic sinusitis and nasal polyposis: a randomized clinical trial[J]. JAMA, 2016, 315(5): 469-479.
[2] Lou H, Meng Y, Piao Y, et al. Predictive significance of tissue eosinophilia for nasal polyp recurrence in the Chinese population[J]. Am J Rhinol Allergy, 2015, 29(5): 350-356.
[3] 陈建文, 孙敬武, 汪银凤. 变应性因素与慢性鼻窦炎及鼻息肉的相关性研究[J]. 安徽医科大学学报, 2015, 50(1): 122-124.
[4] ?im?ek E, Erel O, Bicer C K, et al. A novel method for determining the relation between nasal polyposis and oxidative stress: the thiol/disulphide homeostasis[J]. Acta Otolaryngol, 2016, 136(11): 1180-1183.
[5] 亢丽芳. P38、INF-γ及IL-4在慢性鼻—鼻窦炎和鼻息肉中的表达及意义[D]. 太原:山西医科大学, 2009.
[6] 杜志宏, 于亚峰. NLRP3炎性小体在嗜酸粒细胞性鼻息肉发病及复发中的作用[J]. 山东大学耳鼻喉眼学报, 2016, 30(1): 31-35.
[7] Levy J M, Rudmik L, Peters A T, et al. Contemporary management of chronic rhinosinusitis with nasal polyposis in aspirin‐exacerbated respiratory disease: an evidence‐based review with recommendations[C]//Int Forum Allergy Rhinol. 2016, 6(12): 1273-1283.
[8] Tomassen P, Vandeplas G, Van Zele T, et al. Inflammatory endotypes of chronic rhinosinusitis based on cluster analysis of biomarkers[J]. J Allergy Clin Immunol, 2016, 137(5): 1449-1456.
[9] Bachert C, Zhang L, Gevaert P. Current and future treatment options for adult chronic rhinosinusitis: focus on nasal polyposis[J]. J Allergy Clin Immunol, 2015, 136(6): 1431-1440.
[10] 吴敏曼, 陈婷, 熊巍, 等. 垂体腺苷酸环化酶激活肽蛋白与慢性鼻-鼻窦炎和鼻息肉发病和预后的相关研究[J]. 临床耳鼻咽喉头颈外科杂志, 2016, 30(20): 1608-1611.
[11] Ho J, Bailey M, Zaunders J, et al. Group 2 innate lymphoid cells (ILC2s) are increased in chronic rhinosinusitis with nasal polyps or eosinophilia[J]. Clin Exp Allergy, 2015, 45(2): 394-403.
[12] 王成硕, 娄鸿飞, 孟一帆, 等. 组织嗜酸粒细胞增多对慢性鼻-鼻窦炎伴鼻息肉复发的预测价值研究[J]. 中华耳鼻咽喉头颈外科杂志, 2016, 51(4): 268-272.
[13] Wei Y, Han M, Wen W, et al. Differential short palate, lung, and nasal epithelial clone 1 suppression in eosinophilic and noneosinophilic chronic rhinosinusitis with nasal polyps: implications for pathogenesis and treatment[J]. Curr Opin Allergy Clin Immunol, 2016, 16(1): 31-38.
[14] Perez-Novo C, Pezato R. Dendritic cell subset expression in severe chronic rhinosinusitis with nasal polyps[J]. Curr Opin Allergy Clin Immunol, 2017, 17(1): 1-4.
[15] 李小敏, 樊韻平, 江广理,等. 复发性鼻息肉的复发原因和治疗方式探讨[J]. 临床耳鼻咽喉头颈外科杂志, 2006, 20(11):517-518.
[16] Venkatesan N, Lavigne P, Lavigne F, et al. Effects of Fluticasone Furoate on Clinical and Immunological Outcomes (IL-17) for Patients With Nasal Polyposis Naive to Steroid Treatment[J]. Ann Otol Rhinol Laryngol, 2016, 125(3): 213-218.
[17] Mahdavinia M, Suh L A, Carter R G, et al. Increased non-eosinophilic nasal polyps in chronic rhinosinusitis in US second-generation Asians suggests genetic regulation of eosinophilia[J]. J Allergy Clin Immunol, 2015, 135(2): 576.
[18] Wang L F, Chien C Y, Tai C F, et al. Vitamin D decreases the secretion of eotaxin and RANTES in nasal polyp fibroblasts derived from Taiwanese patients with chronic rhinosinusitis with nasal polyps[J]. Kaohsiung J Med Sci 2015, 31(2): 63-69.
基金项目:沧州市科学技术局,项目编号:162302186。
第一作者:李艳平,本科,主治医师,研究方向:耳鼻喉科临床,Email:yanshanzhangl@sina.com。
