响应面优化油茶叶黄酮提取工艺及抑菌活性研究
2017-05-10王宗成龙燕萍彭延波赵石乔罗小芳
王宗成,龙燕萍,彭延波,盘 雪,赵石乔,周 勇,罗小芳
(1.湖南科技学院 化学与生物工程学院,湖南 永州 425199;2.湖南科技学院 湖南省银杏工程技术研究中心,湖南 永州 425199;3.湖南科技学院 湘南优势植物资源综合利用湖南省重点实验室,湖南 永州 425199;4.西安源森生物科技有限公司,西安 710075)
综合利用
响应面优化油茶叶黄酮提取工艺及抑菌活性研究
王宗成1,2,3,龙燕萍1,彭延波1,盘 雪1,赵石乔1,周 勇4,罗小芳1,2,3
(1.湖南科技学院 化学与生物工程学院,湖南 永州 425199;2.湖南科技学院 湖南省银杏工程技术研究中心,湖南 永州 425199;3.湖南科技学院 湘南优势植物资源综合利用湖南省重点实验室,湖南 永州 425199;4.西安源森生物科技有限公司,西安 710075)
采用乙醇回流提取油茶叶中黄酮,通过单因素试验分别考察提取温度、乙醇体积分数、提取时间、提取次数和料液比对黄酮得率的影响,在此基础上采用响应面法优化分析确定最佳工艺条件,并比较了油茶叶黄酮、油茶籽黄酮、油茶籽壳黄酮的抑菌活性。结果表明:油茶叶黄酮的最佳提取条件为提取温度78℃、乙醇体积分数60%、提取时间90 min、提取2次和料液比1∶22,在此条件下油茶叶黄酮的得率可达到49.42 mg/g;油茶叶黄酮的抑菌活性高于油茶籽壳黄酮的抑菌活性,但低于油茶籽黄酮的抑菌活性。
响应面分析法;油茶叶;黄酮;提取;抑菌活性
油茶树为山茶科,属常绿小乔木,主要分布于我国湖南丘陵地带以及其他亚热带地区,油茶的种子油茶籽为大众提供优质的食用油[1],而油茶叶资源并未得到利用[2-3]。油茶叶中含有多种黄酮类化合物,具有良好的抗氧化性能、抗菌生理活性和治疗无名肿毒、犬咬及火烧成疮等作用[4-5]。油茶叶中黄酮类化合物含量相对较高,且容易大规模采集,再加上油茶树近年的大力种植,开发油茶叶综合利用蕴涵了较大经济效益[6]。目前油茶叶黄酮类化合物的提取方法主要有溶剂提取法、微波辅助提取法、超声波辅助提取法等[7-8],但基于响应面法的优化方法,以及比较油茶叶、油茶籽和油茶籽壳中黄酮类化合物的抗菌活性差异报道很少,因此本文通过响应面法设计优化油茶叶黄酮提取工艺,获得油茶叶黄酮的最佳提取工艺条件,并比较了油茶叶黄酮、油茶籽黄酮、油茶籽壳黄酮的抑菌活性,对油茶叶的开发利用具有一定的应用价值。
1 材料与方法
1.1 试验材料
油茶叶,2015年9月上旬采摘自永州零陵朝阳公园,选择绿色无虫害叶片,经清洗、烘干和粉碎处理后,于干燥箱中保存备用;芦丁标准品,中国药品生物制品检定所生产(批号:100080-200707);95%乙醇、Al(NO3)3、NaNO2、NaOH等均为分析纯;大肠杆菌、金黄色葡萄球菌、黑曲霉均为湖南科技学院微生物实验室提供。
UV-1750型紫外可见分光光度计,RE-52B旋转蒸发仪,SHB-Ⅲ循环水式多用真空泵,TE124S电子天平,LD4-2A离心机,中兴FW-200高速万能粉碎机,集热式磁力搅拌器,YXQ-SG46-280SA手提式灭菌器,SW-CJ-2F超净工作台,HWS-270恒温恒湿培养箱。
1.2 试验方法
1.2.1 油茶叶黄酮的提取
称取油茶叶干燥粉末5.0 g,采用乙醇回流提取法,在一定温度下提取一定时间,收集提取液,用蒸馏水稀释定容至500 mL,作为油茶叶黄酮待测溶液。采用单因素试验分别考察提取温度50~90℃、乙醇体积分数40%~80%、提取时间30~150 min、提取次数1~3次、料液比1∶10~1∶30对黄酮得率的影响。采用响应面法进行工艺优化。
1.2.2 油茶叶黄酮含量的测定
参照课题组已有经验[9],配制0.15 mg/mL芦丁标准溶液,以不加入芦丁标准溶液为空白对照,在波长510 nm下分别测定0.015~0.075 mg/mL芦丁标准溶液的吸光度,以吸光度(A)为纵坐标,芦丁标准溶液质量浓度(C)为横坐标绘制标准曲线,获得回归方程为:A=10.863C+0.026 4,R2=0.995 4,说明在0.015~0.075 mg/mL质量浓度范围内有良好的线性关系。将上述油茶叶黄酮待测溶液按照绘制芦丁标准曲线方法测定吸光度,计算提取液中油茶叶黄酮含量及黄酮得率。
1.2.3 抑菌活性研究
将油茶叶黄酮提取液分别浓缩后再稀释至以总黄酮计25、5 mg/mL和1 mg/mL作为供试样品溶液。将灭菌的马铃薯葡萄糖琼脂加至直径为9 cm的培养皿中,在超净工作台中紫外灭菌下冷却,吸取浓度为105~108cfu/mL供试菌种菌悬液20 μL加至培养基上,并用无菌涂布棒涂布均匀,采用滤纸片法用无菌镊子将浸有样品溶液的8 mm滤纸片放到培养皿中,每个试验设置3次重复,最后将所有培养皿放置恒温恒湿培养箱中培养24 h后,测量油茶叶黄酮抑菌圈直径[5,10],求平均值作为试验结果,抑菌圈直径越大则抑菌活性越强。同时采用相同方法测定油茶籽黄酮、油茶籽壳黄酮提取液抑菌活性,进行对比。
2 结果与讨论
2.1 单因素试验
2.1.1 提取温度的影响
按料液比1∶15加入70%的乙醇溶液,分别于50、60、70、80、90℃回流提取100 min,提取2次,合并提取液定容测定吸光度,计算黄酮得率,结果如图1所示。

图1 提取温度对得率的影响
由图1可知,在提取温度达到80℃之前,得率与提取温度呈正相关;当提取温度达到80℃时,黄酮得率达到最大值;超过80℃时,得率随着提取温度升高反而下降,说明温度过高可能破坏黄酮类化合物导致得率下降[11-12]。因此,选择80℃为最佳提取温度。
2.1.2 乙醇体积分数的影响
按料液比1∶15分别加入乙醇体积分数为40%、50%、60%、70%、80%的乙醇溶液,于80℃回流提取100 min,提取2次,合并提取液定容测定吸光度,计算黄酮得率,结果如图2所示。

图2 乙醇体积分数对得率的影响
由图2可知,随乙醇体积分数的增大,得率先增后减,在60%时得率最高。可能是由于随着乙醇体积分数增大,黄酮类化合物提取达到饱和,同时一些醇溶性杂质、色素、亲脂性强的成分溶出量增加,这些成分与黄酮类化合物竞争同乙醇-水分子结合,从而导致黄酮类化合物的提取率下降[11-12]。因此,选择60%为乙醇溶液最佳体积分数。
2.1.3 提取时间的影响
按料液比1∶15加入60%的乙醇溶液,分别在80℃回流提取30、60、90、120、150 min,提取2次,合并提取液定容测定吸光度,计算黄酮得率,结果如图3所示。

图3 提取时间对得率的影响
由图3可知,在提取时间达到90 min之前,随着提取时间的延长黄酮得率逐渐升高,当提取时间超过90 min以后,黄酮得率随提取时间的延长基本不变,说明继续延长提取时间对提高得率没有意义。因此,选择90 min为最佳提取时间。
2.1.4 提取次数的影响
按料液比1∶15加入60%的乙醇溶液,分别在80℃回流提取90 min,分别提取1、2、3次,合并提取液定容测定吸光度,计算黄酮得率,结果如图4所示。由图4可知,提取2次时得率比提取1次时的明显增加,而提取3次时得率比提取2次时的增加不明显,从实际考虑,一般提取2次就可以提取较完全了。因此,选择2次为最佳提取次数。

图4 提取次数对得率的影响
2.1.5 料液比的影响
分别按料液比1∶10、1∶15、1∶20、1∶25、1∶30加入60%的乙醇溶液,分别在80℃回流提取90 min,提取2次,合并提取液定容测定吸光度,计算黄酮得率,结果如图5所示。

图5 料液比对得率的影响
由图5可知,在料液比达到1∶20之前,得率随料液比的增大逐渐升高,当料液比为1∶20时,得率达到最大,之后随料液比的增大,得率基本保持不变。因此,选择1∶20为最佳料液比。
2.2 响应面优化试验
2.2.1 Box-Behnken设计方案及结果
通过对单因素试验数据结果分析,乙醇体积分数、料液比、提取温度对油茶叶黄酮得率的影响较大,故在固定提取时间90 min,提取2次的条件下,采用响应面分析软件建立三因素三水平的Box-Behnken中心组合设计模型进行优化设计[13-14],响应面试验设计及结果如表1所示。

表1 响应面试验设计及结果
续表1

试验号A乙醇体积分数/%B料液比C提取温度/℃Y得率/(mg/g)12701∶158039.2213601∶157037.5914601∶208048.7515501∶209039.6316601∶208048.4217601∶257044.83
采用Design Expert 8.0.6软件对表1中试验数据进行多项拟合回归,得到油茶叶黄酮得率(Y)对乙醇体积分数(A)、料液比(B)、提取温度(C)的二次多项回归模型方程为:
Y=48.60+0.068A+2.51B-1.87C-0.033AB-0.12AC-1.34BC-2.34A2-4.42B2-4.77C2
2.2.2 响应面回归模型的方差分析
为了检验回归方程的有效性,进一步确定各因素对黄酮得率的影响程度,对回归模型进行了方差分析,结果见表2。


表2 响应面回归方程的方差分析
注:**(P<0.01)为极显著;*(P<0.05)为显著。
2.2.3 最佳工艺条件
用Design-Expert 8.0.6软件设计优化得出最佳的提取条件为乙醇体积分数60.19%、料液比1∶21.60、提取温度77.60℃。但考虑到实际操作的局限性,乙醇回流提取油茶叶黄酮的提取工艺条件调整为提取温度78℃、乙醇体积分数60%、提取时间90 min、提取2次和料液比1∶22,在此条件下油茶叶黄酮的得率可达到49.42 mg/g。
2.3 抑菌活性
试验通过测定抑菌圈的直径,比较了油茶叶黄酮、油茶籽黄酮、油茶籽壳黄酮不同质量浓度下的抑菌活性,结果如表3所示。
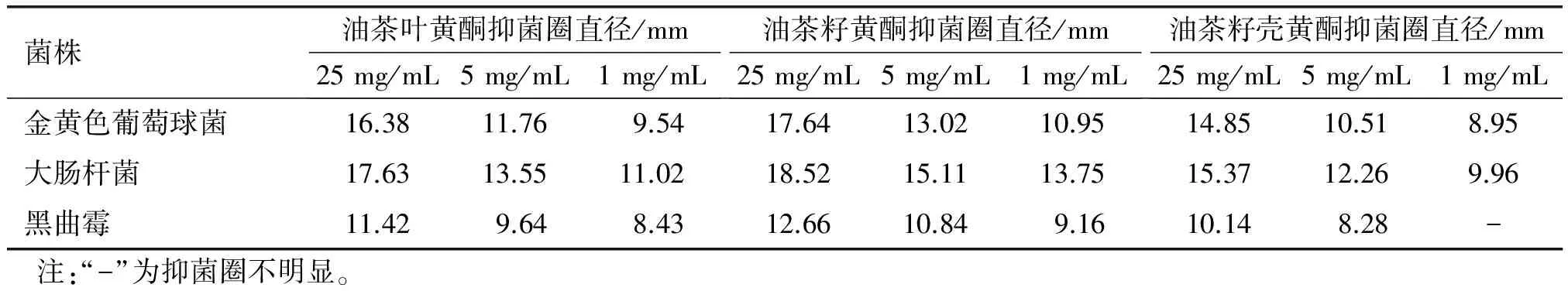
表3 油茶叶黄酮、油茶籽黄酮、油茶籽壳黄酮不同质量浓度下的抑菌活性
由表3可以看出,油茶叶黄酮对金黄色葡萄球菌、大肠杆菌和黑曲霉均表现出较好的抑制作用,且随着黄酮质量浓度的增加抑制作用增强,且抑制作用大肠杆菌>金黄色葡萄球菌>黑曲霉;在相同质量浓度下,油茶叶黄酮的抑菌活性高于油茶籽壳黄酮的抑菌活性,但低于油茶籽黄酮的抑菌活性,由此可看出,油茶叶黄酮的抗菌活性较高,可作为天然抗菌剂进一步开发。
3 结 论
在单因素试验的基础上,对油茶叶黄酮提取工艺进行了优化,采用Box-Behnken设计方案建立的二次多项数学模型能较准确地预测乙醇回流提取油茶叶黄酮的得率。通过响应面分析得出了乙醇回流提取油茶叶黄酮的最佳工艺条件为提取温度78℃、乙醇体积分数60%、提取时间90 min、提取2次和料液比1∶22。在最佳工艺条件下,油茶叶黄酮的得率可达到49.42 mg/g。
抑菌活性表明,油茶叶黄酮对金黄色葡萄球菌、大肠杆菌和黑曲霉均表现出较好的抑制作用,在相同质量浓度下,油茶叶黄酮的抑菌活性高于油茶籽壳黄酮的抑菌活性,但低于油茶籽黄酮的抑菌活性。该研究为油茶叶开发利用提供一定理论依据。
[1] 朱俊朋, 王超, 罗凡, 等. 水酶法提取油茶籽油的工艺研究[J]. 中国油脂, 2016, 41(3):12-15.
[2] 邬靖宇, 曹清明, 钟海雁. 油茶叶黄酮类化合物研究进展[J]. 食品与机械, 2014, 30(6):243-246.
[3] 李姣娟, 黄克瀛, 龚建良, 等. 油茶叶乙醇提取物清除 DPPH 自由基作用的研究[J]. 林产化学与工业,2008,28(2):82-86.
[4] 李姣娟, 龚建良, 周尽花, 等. 大孔树脂对油茶叶黄酮的吸附分离特性研究[J]. 离子交换与吸附, 2010, 26(4):353-361.
[5] 黄陈陈,丁之恩,杨松,等. 油茶叶黄酮类化合物清除自由基及抑菌作用研究[J]. 粮食与油脂, 2011(12):12-15.
[6] 李姣娟, 龚建良, 周尽花, 等. 油茶叶总黄酮的提取及其抗氧化活性研究[J]. 食品研究与开发, 2008, 29(12):93-96.
[7] 龚建良,李姣娟,陈丛谨. 微波法提取油茶叶总黄酮的工艺研究[J]. 安徽农业科学, 2007, 35(35):11372-11374.
[8] 肖新生, 张敏, 袁先友, 等. 油茶叶中黄酮类物质的提取及纯化工艺研究[J]. 中国食品添加剂, 2012(4):93-97.
[9] 王宗成, 蒋玉仁, 刘小文, 等. 响应面优化生姜茎叶总黄酮提取工艺及其抗氧化活性研究[J]. 天然产物研究与开发, 2015, 27(9):1582-1588.
[10] 赵强, 吕伟, 赵二劳, 等. 黄芥籽粕中多酚超声辅助提取工艺优化及其抑菌活性[J]. 中国油脂, 2015, 40(10):64-67.
[11] 张红玉, 王成章, 张宇思, 等. 超声波提取牡丹籽壳多酚工艺响应面法优化及抗氧化性研究[J]. 中国油脂, 2015, 40(6):90-94.
[12] 王宗成, 王多, 王凯, 等. 响应面法优化喜树叶总黄酮提取工艺的研究[J]. 食品工业, 2014, 35(2):79-82.
[13] 原姣姣, 王成章, 张红玉, 等. 超声辅助酶法提取橄榄油的研究[J]. 中国油脂, 2016, 41(7):10-14.
[14] 刘普, 李小方, 刘一琼, 等. 超声辅助水代法提取芍药籽油工艺条件优化[J]. 中国油脂, 2016, 41(5):1-5.
Optimization of extraction of flavonoids from oil-tea camellia leaves using response surface methodology and evaluation of its antibacterial activity
WANG Zongcheng1,2,3, LONG Yanping1, PENG Yanbo1, PAN Xue1, ZHAO Shiqiao1, ZHOU Yong4, LUO Xiaofang1,2,3
(1.College of Chemical and Biological Engineering, Hunan University of Science and Engineering, Yongzhou 425199, Hunan, China; 2.Hunan Provincial Engineering Research Center for Ginkgo Biloba, Hunan University of Science and Engineering, Yongzhou 425199, Hunan, China; 3.Hunan Key Laboratory of Comprehensive Utilization of Advantage Plants Resources of Southern Hunan, Hunan University of Science and Engineering, Yongzhou 425199, Hunan, China; 4.Xi’an Yuensun Biological Technology Co., Ltd., Xi’an 710075, China)
Flavonoids was extracted from oil-tea camellia leaves by ethanol reflux extraction method, and the effects of extraction temperature, volume fraction of ethanol, extraction time, extraction times and ratio of solid to liquid on yield of flavonoids were studied by single factor experiment. Based on this, the extraction conditions were optimized by response surface methodology,and the antibacterial activities of flavonoids from oil-tea camellia leaves, oil-tea camellia seeds and oil-tea camellia seed shell were compared. The results showed that the optimal extraction conditions were obtained as follows:extraction temperature 78℃, volume fraction of ethanol 60%, extraction time 90 min, extraction times twice and ratio of solid to liquid 1∶22. Under these conditions, the yield of flavonoids was 49.42 mg/g. The antibacterial activity of flavonoids from oil-tea camellia leaves was higher than that of flavonoids from oil-tea camellia seed shell, but lower than that of flavonoids from oil-tea camellia seeds.
response surface methodology; oil-tea camellia leaves; flavonoids; extraction; antibacterial activity
2016-06-24;
2016-12-23
湖南省高校科技创新团队支持计划资助(2012-318);湖南省教育厅资助科研项目(15C0587);湖南科技学院生物工程重点学科资助
王宗成(1983),男,讲师,硕士,研究方向为药物合成及天然产物开发(E-mail)wangzongche@163.com。
罗小芳,讲师,硕士(E-mail)kong870122wxfx@163.com。
TS202;R284.2
A
1003-7969(2017)04-0123-05
