响应面试验优化藻类来源磷脂型DHA的提取工艺
2017-05-10李翔宇陆姝欢汪志明
李翔宇,田 勇,陆姝欢,周 强,汪志明
(1.嘉必优生物技术(武汉)股份有限公司,武汉 430073; 2.湖北省营养化学品生物合成工程技术研究中心,武汉 430073)
响应面试验优化藻类来源磷脂型DHA的提取工艺
李翔宇1,2,田 勇1,2,陆姝欢1,2,周 强1,2,汪志明1,2
(1.嘉必优生物技术(武汉)股份有限公司,武汉 430073; 2.湖北省营养化学品生物合成工程技术研究中心,武汉 430073)
采用低温脱胶法和膜分离技术提取DHA藻油中磷脂型DHA。在单因素试验的基础上,利用响应面试验优化磷脂型DHA提取工艺,得到最佳提取工艺条件为过膜压力0.29 MPa、膜孔径1.0 μm、溶料比6∶1、过膜温度50℃。在最佳提取工艺条件下,制备的磷脂型DHA产品正己烷不溶物为0.028%,可以稳定地控制在0.03%以下;丙酮不溶物含量可达到61.3%;磷脂型DHA产品得率为80.8%,且磷脂中DHA含量在44%以上。
DHA;磷脂型DHA;提取;藻类;响应面法
磷脂(PL)是细胞膜的主要组成成分,在细胞的生化、生理学上都起着非常重要的作用[1]。磷脂的生理活性与其脂肪酸、极性末端的组成密切相关,不同种类的脂肪酸起到的生理作用也各不相同[2]。有科学家指出ω-3系列的磷脂型多不饱和脂肪酸(PUFA)具有磷脂和PUFA共同的生理功能[3-4]。大量试验表明,磷脂型PUFA相对于甘油酯型PUFA而言,不仅氧化稳定性更好,且消化吸收速度更快[5]。研究表明,磷脂型DHA形态可以原封不动地由细胞摄取,在细胞内分解成DHA和磷脂,显示出增效作用[6]。
磷脂型DHA,即DHA作为磷脂分子中的主要脂肪酸,是磷脂型PUFA中的一种,近年来受到了越来越多的关注。目前,磷脂型PUFA产品主要来源于海洋产物(如太平洋虾和海洋动物卵等)的提取,以及通过生物酶法合成、改性的技术得到[7-8]。然而提取海洋产物中天然磷脂型PUFA受原料限制、工艺不稳定等影响,产量远不能满足人们的需求。为了提高磷脂中PUFA的含量,自20世纪90年代以来,不断有研究者尝试采用化学法和酶法制备富含ω-3 PUFA磷脂产品[9-13]。然而化学法因催化剂非专一性和试剂毒性,会造成副产物多且影响产品安全性。酶法虽然具有位置特异性、可以选择特定位点进行反应、反应副产物少、反应条件温和、环境友好的优点[14],但是由于酶制剂的应用,制备的终端产品仍然存在一定的食品安全风险。
本研究以裂殖壶藻来源的DHA毛油为原料,制备天然的磷脂型DHA产品。磷脂型DHA产品中DHA、EPA含量高,且原料不受限制,一方面弥补了目前市场上磷脂型PUFA的产能不足;另一方面磷脂型DHA产品具有DHA与磷脂的双重作用,可作为保健食品、化妆品、药品来利用。因此,开发制备天然的磷脂型DHA产品具有非常广泛的应用前景。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
DHA毛油(磷脂型DHA含量3.5%~4.3%),嘉必优生物技术(武汉)股份有限公司;正己烷、丙酮,食品级。
1.1.2 仪器与设备
高速台式离心机;MS4002SDR电子天平;SHB-III A循环水式多用真空泵;ZDF-6真空干燥箱;膜分离设备,上海过滤器公司;DEA-BML-10薄膜蒸发器,上海德大天壹化工设备有限公司;7820A气相色谱仪,安捷伦科技有限公司。
1.2 试验方法
1.2.1 磷脂型DHA产品的制备
低温脱胶是指不添加脱胶剂,利用低温来促使胶体杂质凝聚析出,再使用过滤法或离心的方法将其从油中分离出来[15]。本文利用低温脱胶的原理来分离DHA毛油中的油脂和粗磷脂型DHA,得到的粗磷脂型DHA与正己烷混合后,采用膜分离技术[16]制备磷脂型DHA产品。具体方法:将2 kg DHA毛油置于-10℃环境中冷冻4 h,经室温解冻后,5 000 r/min离心10 min得到油相和沉淀,即粗磷脂型DHA。取100 g粗磷脂型DHA与正己烷按预定质量体积比混合均匀,在预定的温度下加热后,按预定过膜压力,经预定膜孔径膜过滤,滤液经薄膜蒸发脱溶,即得到磷脂型DHA产品。
1.2.2 磷脂型DHA产品指标测定
酸值:AOCS Ja6-55;正己烷不溶物含量:AOCS Ja3-87;丙酮不溶物含量:AOCS Ja4-46。脂肪酸组成:取一定量的磷脂型DHA产品于离心管中,加入20 mL的冷丙酮,混合均匀后,用低温高速离心机离心5 min分离出沉淀,将沉淀反复用10 mL的丙酮洗涤,直到上清液滴于洁净玻璃片挥发无油迹为止,沉淀低温真空干燥。称取一定量干燥样品溶于正己烷,以C13∶0甲酯为内标物,参考Hong等[14]方法进行甲酯化后,参照马彦庆等[17]气相色谱条件测定磷脂型DHA中的脂肪酸组成及含量。
1.2.3 磷脂型DHA产品得率的测定

式中:m1为得到的磷脂型DHA产品质量,g;m2为离心后所取沉淀质量,g。
2 结果与分析
2.1 单因素试验
2.1.1 过膜压力的选择
在溶料比3∶1、过膜温度45℃、不同过膜压力(0.05、0.1、0.15、0.2、0.25、0.3、0.35 MPa)条件下,用0.1、0.45、0.8、1.2、2 μm孔径的膜进行过滤,考察过膜压力对膜通量的影响,如图1所示。

图1 过膜压力对膜通量的影响
由图1可知,当过膜压力一定时,膜通量随膜孔径增大而增大;膜孔径一定时,膜通量随压力增大而增加。当过膜压力大于0.2 MPa时,在相同膜孔径下,膜通量随压力增大而增加缓慢。分析可能是由于凝胶层加厚,流体阻力增大,从而使总阻力不断增加,导致膜通量随压力增加而增大的趋势变缓[18]。因此,确定以0.2 MPa的过膜压力为宜。
2.1.2 膜孔径的选择
在溶料比3∶1、过膜压力0.2 MPa、过膜温度45℃条件下改变膜孔经(0.1、0.45、0.8、1.2、2 μm),考察膜孔径对磷脂型DHA的影响,结果如图2所示。
由图2可知,随着膜孔径的增大,膜通量和磷脂型DHA产品的得率也相应增大,但随膜孔径增大,产品中正己烷不溶物的含量也增大,产品的质量将会受到影响。当膜孔径为1.2 μm时,正己烷不溶物含量为0.033%,已超过AOCS规定的食品级浓缩磷脂标准中正己烷不溶物含量不超过0.03%的要求。因此,综合考虑选择膜孔径为0.8 μm。
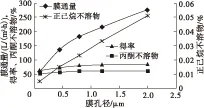
图2 膜孔径对磷脂型DHA的影响
2.1.3 溶料比的选择
在过膜压力0.2 MPa、膜孔径0.8 μm、过膜温度45℃条件下改变溶料比(1∶1、3∶1、5∶1、8∶1),考察溶料比对磷脂型DHA的影响,结果如图3所示。
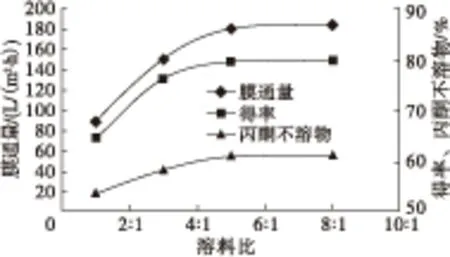
图3 溶料比对磷脂型DHA的影响
由图3可知,随着溶料比的增加,膜通量、磷脂型DHA产品得率和丙酮不溶物含量急剧增加,这是由于添加正己烷可明显降低体系黏度,使得膜通量和丙酮不溶物含量增加。当溶料比大于5∶1时,膜通量、丙酮不溶物含量和磷脂型DHA产品得率变化均不明显,同时工时和能耗大大增加。因此,选择溶料比为5∶1较适宜。
2.1.4 过膜温度的选择
在溶料比5∶1、过膜压力0.2 MPa、膜孔径0.8 μm条件下改变过膜温度(25、35、45、55℃),考察过膜温度对磷脂型DHA的影响,结果如图4所示。

图4 过膜温度对磷脂型DHA的影响
由图4可知,膜通量、磷脂型DHA产品得率和丙酮不溶物含量随着过膜温度的升高而增加。因为升高温度有利于降低料液的黏度,有利于料液的过滤。当过膜温度升至45℃后,三者升高变缓。又由于磷脂型DHA产品是热敏物质,长时间过高的温度会使其变性,颜色大大加深,品质变差。同时,过高的温度会使正己烷大量挥发,不利于操作。因此,综合考虑选取45℃作为过膜温度较为合适。
2.2 响应面试验
基于单因素试验结果,以过膜压力(X1)、膜孔径(X2)、溶料比(X3)和过膜温度(X4)为考察因素,以膜通量(Y1)、丙酮不溶物含量(Y2)及磷脂型DHA产品得率(Y3)为响应值,采用四因素三水平的Box-Behnken Design(BBD)设计响应面试验,试验因素水平见表1,试验设计及结果见表2,方差分析见表3。

表1 试验因素水平

表2 试验设计及结果
采用Design Expert软件,对表2中膜通量(Y1)、丙酮不溶物含量(Y2)、磷脂型DHA产品得率(Y3)试验数据进行回归拟合,得到多项回归方程:
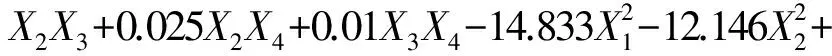
从表3可以看出,Y1、Y2、Y3方程的决定系数R2分别为0.991 8、0.960 3、0.973 4,表明上述回归方程描述各因素时,各响应值和各因素间关系显著。同时表3中模型的P均小于0.000 1,说明模型显著。失拟项P均大于0.05,不显著,说明该模型拟合程度良好,误差小,因此可用此模型对Y1、Y2、Y3进行分析和预测。
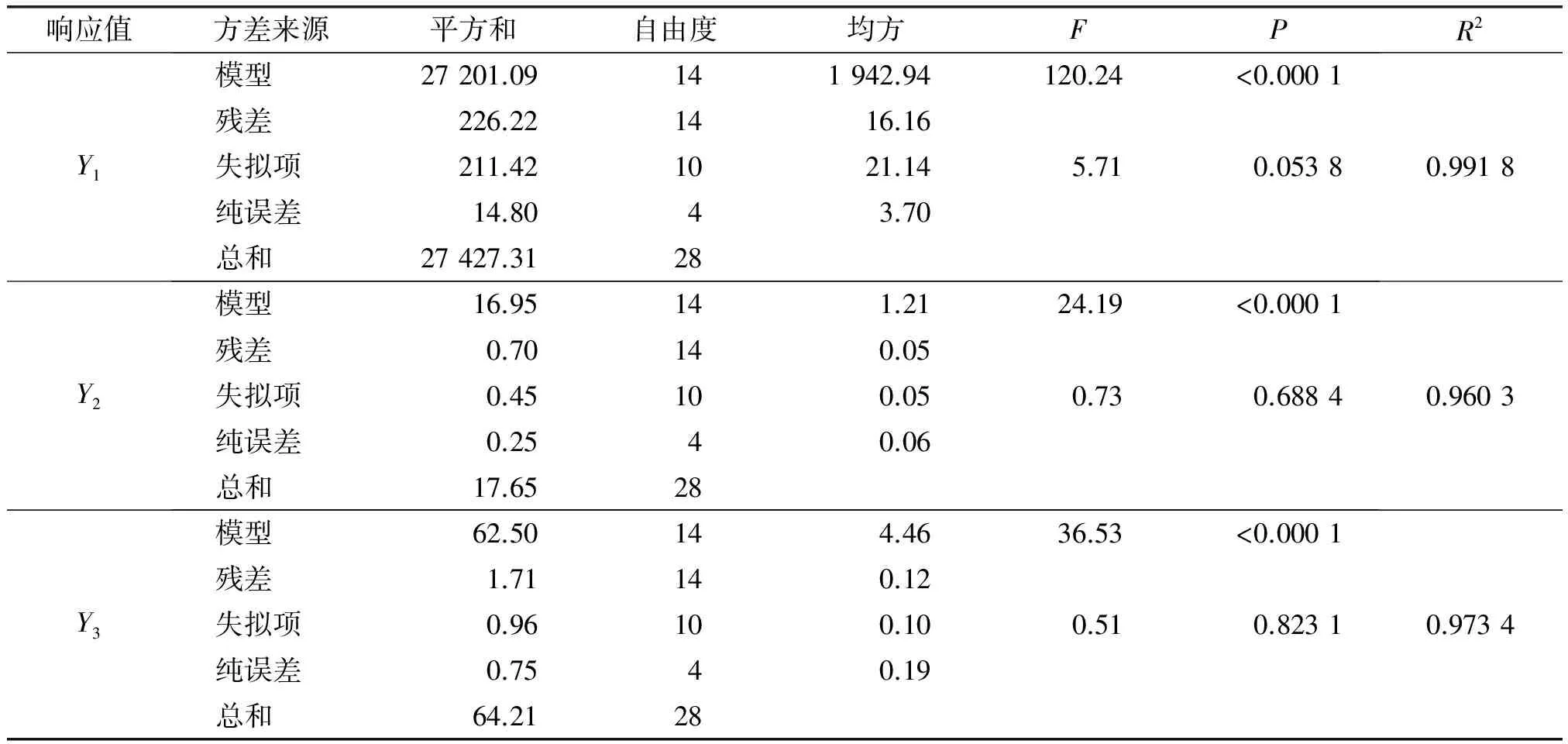
表3 方差分析
注:差异显著(P<0.05)。
用Design-expert 8.0.6软件进行试验优化,将Y1、Y2、Y3均取最大值设置为提取优化分析的限定条件,且设置三者的影响顺序为:Y2>Y3>Y1。得到最佳提取条件为:过膜压力0.29 MPa,膜孔径 1.0 μm,溶料比6∶1,过膜温度50℃。在最佳提取条件下,膜通量、丙酮不溶物含量和磷脂型DHA产品得率的预测值分别为:215.1 L/(m2·h)、61.8%、81.1%。
经3次试验验证,实际得到的膜通量为213.7 L/(m2·h),丙酮不溶物含量为61.3%,磷脂型DHA产品得率为80.8%,均与预测值相差不大;且其正己烷不溶物含量为0.028%,酸值(KOH)在16.3~17.1 mg/g之间,外观透明,符合美国AOCS规定的浓缩磷脂指标。
2.3 磷脂型DHA产品中脂肪酸组成的检测
取3批制备的磷脂型DHA产品各10 g,经丙酮脱油、低温真空干燥后,测定磷脂型DHA产品中脂肪酸的组成,结果见表4。

表4 磷脂型DHA产品脂肪酸组成 %
由表4可知,制备的3批磷脂型DHA产品中,磷脂脂肪酸组成中DHA含量均大于44%。高于杨文鸽等[19]报道的贻贝磷脂中EPA+DHA含量(24.88%),庆宁等[20]报道的华贵栉孔扇贝、合浦珠母贝、翡翠贻贝磷脂中EPA+DHA含量(27.21%、25.26%、26.95%),张苓花等[10]用产酶菌体催化合成EPA/DHA结合率为12.11%的卵磷脂及潘丽等[12]通过酶法制备ω-3 PUFA磷脂中DHA+EPA含量(21.56%)。说明采用本方法制备的磷脂型DHA产品优于海洋产物提取和酶法合成产品。
3 结 论
以裂殖壶藻来源的DHA毛油为原料,经-10℃ 冷冻处理后再解冻离心,制备粗磷脂型DHA。制备的粗磷脂型DHA在正己烷体系下,采用无机膜过滤方式制备食品级磷脂型DHA产品的最佳工艺条件为:过膜压力0.29 MPa,膜孔径1.0 μm,溶料比 6∶1,过膜温度50℃。在最佳工艺条件下,制备的磷脂型DHA产品中正己烷不溶物可以稳定地控制在0.03%以下,丙酮不溶物含量可达到60%以上,磷脂型DHA产品得率为80.8%,磷脂中DHA含量达44%以上。
[1] 朱志伟. 第三营养素——卵磷脂[J]. 大学化学,2010,25(增刊):77-80.
[2] MURAKAMI M. Lipid mediators in life science[J]. Exp Anim,2011,60(1):7-20.
[3] HOSSAIN Z,KURIHARA H,HOSOKAWA M,et al. Docosahexaenoic acid and eicosapentaenoic acid-enriched phosphatidylcholine liposomes enhance the permeability,transportation and uptake of phospholipids in Caco-2 cells[J]. Mol Cell Biochem,2006,285(2):155-163.
[4] SCHARITER J A,PACHUSKI J,FRIED B,et al. Determination of neutral lipids and phospholipids in the cercariae ofSchistosomamansoniby high performance thin layer chromatography[J]. J Liquid Chromatogr Related Technol,2002,25(10/11):1615-1622.
[5] 孙兆敏,李金章,丛海花,等. 酶法制备n-3多不饱和脂肪酸型磷脂的工艺[J]. 中国油脂,2010,35(4):33-36.
[6] 王琦. 海产动物来源n-3 PUFA磷脂的提取及生物活性研究[D]. 山东 青岛:中国海洋大学,2008.
[7] SHVETS V I,KUBATIEV A A,SHOBOLOV D L,et al. Biopharmaceutical technologies based on phospholipids[J]. J Chem,2013,3(3):179-206.
[8] 周佳佳,李桂华,韦利革,等. 大豆浓缩磷脂的酶法改性研究[J]. 河南工业大学学报,2013,34(1):37-40.
[9] PENG L F,XU X B,MU H L,et al. Production of structured phospholipids by lipase-catalyzedacidolysis:optimization using response surface methodology[J]. Enzyme Microbial Technol,2002,31(4):523-532.
[10] 张苓花,叶淑红,王晨祥. 酶法合成DHA/EPA型卵磷脂的研究[J]. 大连轻工业学院学报,2000,19(1):45-47.
[11] 秦德元,张鹏. 酶法合成EPA/DHA型卵磷脂[J]. 中国油脂,2004,29(9):45-47.
[12] 潘丽,谷克仁,杨壮. 制备富含n-3多不饱和脂肪酸的磷脂[J]. 粮油加工,2006(12):57-61.
[13] GARCIA H S,KIM I H,LOPEI-HERNANDEI A,et al. Enrichment of lecithin withn-3 fatty acids by acidolysis using immobilized phospholipase A1[J]. Grasas Y Aceites,2008,59(4):368-374.
[14] HONG S I,KIM Y,KIM C J,et al. Enzymatic synthesis of lysophosphatidylcholine containing CLA from sn-glycero-3-phosphatidylcholine(GPC) under vacuum [J]. Food Chem,2011,129(1):1-6.
[15] 王道波,马云肖,周龙长. 低温脱胶法及其工艺优化[J]. 粮油加工,2008(10):42-43.
[16] 汪勇,赵谋明,肖陈贵,等. 无机陶瓷膜微滤制备食品级大豆浓缩磷脂的研究[J]. 中国粮油学报,2007,22(3):51-53.
[17] 马彦庆,陈斌斌,郑妍,等. 固定化磷脂酶A1催化制备DHA型磷脂[J]. 中国粮油学报,2015,30(3):75-78.
[18] 刘方波,刘元法,宗可宝,等. 膜过滤法制备食品级浓缩磷脂[J]. 中国油脂,2008,33(11):51-53.
[19] 杨文鸽,张芝芬. 贻贝Mytilusedulis磷脂成分的分析[J]. 浙江海洋学院学报,2000,19(1):47-50.
[20] 庆宁,林岳光,沈琪. 3种海洋养殖贝类体内的脂肪酸组成[J]. 热带海洋,1999,18(1):79-82.
Optimization of extraction of phospholipid containing DHA from algae source using response surface methodology
LI Xiangyu1,2, TIAN Yong1,2, LU Shuhuan1,2, ZHOU Qiang1,2, WANG Zhiming1,2
(1.CABIO Bioengineering (Wuhan) Co., Ltd., Wuhan 430073, China; 2.Hubei Province Nutrition Chemicals Biosynthetic Engineering Technology Research Center, Wuhan 430073, China)
Phospholipid containing DHA was extracted from DHA algae oil by low temperature degumming and membrane separation technology. Based on single factor experiment, the extraction conditions of phospholipid containing DHA were optimized by response surface methodology. And the optimal extraction conditions were obtained as follows:transmembrane pressure 0.29 MPa, membrane pore size 1.0 μm, ratio of solvent to material 6∶1, transmembrane temperature 50℃. Under the optimal conditions, the content of acetone-insoluble substance in phospholipid containing DHA product was 61.3% and the content of hexane-insoluble substance could be steadily controlled below 0.03%, which was 0.028%. The yield and DHA content of the product were 80.8% and above 44%, respectively.
DHA; phospholipid containing DHA; extraction; algae; response surface methodology
2016-07-12;
2016-12-07
国家高技术研究发展计划(863计划)项目(2014AA021701)
李翔宇(1979),男,在职研究生,主要从事微生物发酵等方面的研究工作(E-mail)xiangyu_lee@cabio.cn。
汪志明(E-mail)Jimmy_wang@cabio.cn。
TS225.6;TQ028.8
A
1003-7969(2017)04-0118-05
