大豆7S球蛋白结构特性与表面疏水性相关性研究
2017-05-10魏冬旭刘春雷江连洲
李 丹,魏冬旭,贾 烨,刘春雷,江连洲
(1.宁德师范学院,福建 宁德 352100; 2.黑龙江出入境检验检疫局,哈尔滨 150001;3.杭州娃哈哈集团有限公司,杭州310018; 4.东北农业大学 食品学院,哈尔滨 150030)
大豆7S球蛋白结构特性与表面疏水性相关性研究
李 丹1,魏冬旭2,贾 烨3,刘春雷1,江连洲4
(1.宁德师范学院,福建 宁德 352100; 2.黑龙江出入境检验检疫局,哈尔滨 150001;3.杭州娃哈哈集团有限公司,杭州310018; 4.东北农业大学 食品学院,哈尔滨 150030)
以具有代表性的6个大豆品种制备的大豆7S球蛋白为研究对象,采用ANS荧光探针法测定表面疏水性,Ellman试剂分析法测定巯基和二硫键含量,激光拉曼光谱和荧光光谱分析空间构象,探讨大豆7S球蛋白结构特性与表面疏水性的相关性。结果表明:大豆7S球蛋白的表面疏水性与二级结构的α-螺旋含量和β-折叠含量呈负相关,与二级结构的β-转角含量和无规则卷曲含量呈正相关;与色氨酸残基荧光峰λmax呈正相关,与拉曼光谱色氨酸费米共振I1 360/I1 340值呈负相关,与拉曼光谱酪氨酸费米共振I850/I830值呈正相关,与暴露的酪氨酸残基克分子数呈正相关,与N暴露和N包埋的比值呈正相关;与暴露巯基含量、巯基暴露程度呈正相关,与游离巯基含量、二硫键含量、二硫键构象的相关性均不显著。
大豆7S球蛋白;拉曼光谱;荧光光谱;巯基;二硫键;表面疏水性
蛋白质的表面疏水性是由于部分疏水基团暴露于蛋白质表面引起的,是衡量分子间相互作用强弱的重要参数。与整体疏水性相比,表面疏水性对蛋白质功能性质的影响更大。研究表明,蛋白质的表面疏水性与其结构特性密切相关,大豆蛋白的结构特性又随大豆品种和产地的不同而有所差异[1-3]。本研究为避免大豆蛋白7S组分与11S组分的协同作用对表面疏水性的影响,故选择6个我国具有区域代表性的大豆品种,以其制备的7S球蛋白纯品为研究对象,通过对表面疏水性、巯基基团组成及蛋白质空间构象的分析,研究大豆7S球蛋白结构特性与表面疏水性的关系。明确大豆7S球蛋白表面疏水性与蛋白质组成及空间构象的构效关系,有助于更好地理解和预测大豆蛋白的功能性质,为今后开发大豆分离蛋白特定功能性产品而进行的分子设计和重组提供重要的理论参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大豆7S球蛋白,实验室自制,分别来自于东农42、黑农46、合丰55、冀豆12、皖豆28、福豆234大豆品种,纯度均在90%以上[4]。
1-苯胺基-8-萘磺酸(ANS)、Na2EDTA、5,5′-二硫双-2-硝基苯甲酸(DTNB)、甘氨酸、三羟甲基氨基甲烷(Tris)均为Sigma公司,β-巯基乙醇为国产优级纯,其余试剂为国产分析纯。
1.1.2 仪器与设备
Allegra64R台式高速冷冻离心机,美国贝克曼公司;F-4500荧光分光光度计,日本HITACHI公司;PerkinElmer Raman Station 400拉曼光谱仪,美国PE公司;722型可见分光光度计,上海光谱仪器有限公司。
1.2 实验方法
1.2.1 表面疏水性测定
采用ANS荧光探针法[5-6]。
1.2.2 巯基和二硫键含量测定
采用Ellman试剂分析方法,即DTNB比色法[7]。
1.2.3 拉曼光谱(Raman)分析
参考张萍等[8]的方法。将样品粉末均匀平铺于洁净干燥的载玻片上,采用785 nm的激发光波长、300 mW的激光功率,对400~2 000 cm-1范围进行扫描,每次扫描60 s,积分10次,4次扫描进行累加。拉曼光谱谱图的基线校正及谱峰归属的查找采用ACD Labs V12软件进行。同时,以苯丙氨酸谱峰(1 003 cm-1±1 cm-1)强度作为归一化因子,采用Origin8.0软件绘制不同品种大豆7S球蛋白拉曼光谱。
1.2.4 荧光光谱分析
参考王中江等[9]的方法。样品用磷酸盐缓冲溶液(pH 7.6)配制,蛋白质溶液质量浓度为0.4 mg/mL。为降低酪氨酸残基干扰,荧光发射光谱分析采用290 nm的激发光波长,扫描范围300~400 nm,激发狭缝宽5 nm,发射狭缝宽5 nm。
1.2.5 数据处理
单项实验重复3次,实验结果以“均值±标准差”表示。实验数据的统计分析包括单因素方差分析和相关性分析,均采用SPSS V18.0软件,方差分析差异性显著(P<0.05)时采用Duncan方法进行多重比较。图谱的分析处理和图表的制作采用Origin8.0软件进行。
2 结果与讨论
2.1 表面疏水性分析(见图1)

图1 不同品种大豆7S球蛋白的表面疏水性
由图1可知,品种差异对大豆7S球蛋白的表面疏水性影响极显著(P<0.01),表面疏水性指数在707.14~868.54之间,合丰55(868.54)>福豆234(832.51)>黑农46(816.98)>冀豆12(749.06)>皖豆28(729.02)>东农42(707.14)。这可能与不同品种大豆7S球蛋白的结构特性差异有关。
2.2 拉曼光谱分析
采用激光拉曼光谱对大豆7S球蛋白的主链构象、酪氨酸和色氨酸侧链构象及其微环境情况、二硫键构象进行分析,不同品种大豆7S球蛋白的拉曼光谱如图2所示,不同品种大豆7S球蛋白的拉曼光谱及特征频率归属见表1。
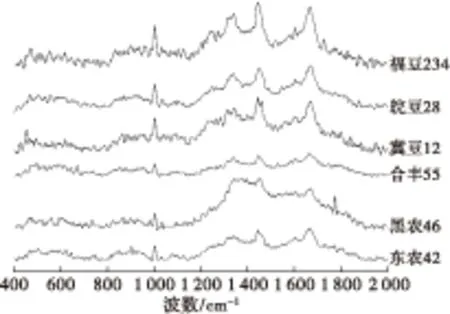
图2 不同品种大豆7S球蛋白的拉曼光谱

峰位归属特征峰位/cm-1东农42黑农46合丰55冀豆12皖豆28福豆234二硫键506507512507510508二硫键525525525526525524二硫键539536542540539540酪氨酸829834830830834830酪氨酸848846852852846852苯丙氨酸100210041004100310031003色氨酸133913411340133613401342色氨酸135813611360136213581362酰胺I带(β-转角)1641- 1642164216441644酰胺I带(α-螺旋)164616461647164816491649酰胺I带(α-螺旋)165016521654165616541654酰胺I带(无规则卷曲)166316601661166416641663酰胺I带(β-折叠)1669166616691669- 1670酰胺I带(β-折叠)167316721671167516721674酰胺I带(β-折叠)16801679167716791680- 酰胺I带(β-转角)168916891688168916871686
2.3 主链构象与表面疏水性关系

表2 不同品种大豆7S球蛋白的拉曼光谱酰胺I带拟合结果 %
注:表中同列数据肩标字母表示不同样品P<0.01水平的差异显著性,字母相同表示差异不显著,字母不同表示差异极显著。
由表2可知,品种差异对大豆7S球蛋白的二级结构4种类型α-螺旋、β-折叠、β-转角和无规则卷曲的含量影响极显著(P<0.01)。相关性分析表明:大豆7S球蛋白的表面疏水性与α-螺旋含量呈显著负相关(P=0.012),相关性系数为-0.910;与β-折叠含量呈显著负相关(P=0.015),相关性系数为-0.898;与β-转角含量呈显著正相关(P=0.030),相关性系数为0.855;与无规则卷曲含量呈显著(P=0.018)正相关,相关性系数为0.889。分析其原因可能与α-螺旋、β-折叠、β-转角和无规则卷曲自身结构特点,以及它们对大豆7S球蛋白三级结构形成的影响有关。
2.4 侧链芳香氨基酸残基微环境与表面疏水性关系
2.4.1 拉曼光谱酪氨酸费米共振分析结果
蛋白质拉曼光谱的830 cm-1和850 cm-1谱峰是酪氨酸残基的对位取代苯的有关振动,可用两谱峰的强度比I850/I830来表征酪氨酸残基的包埋与暴露情况。当I850/I830的值在0.5~1.25之间时,可根据方程式(0.5N包埋+1.25N暴露=I850/I830,N包埋+N暴露=1)计算包埋在分子内部和暴露在分子表面的酪氨酸残基的克分子数N[15]。 结果见表3。

表3 不同品种大豆7S球蛋白的I850/I830及酪氨酸残基分析结果
由表3可知,6个品种大豆7S球蛋白的酪氨酸残基均较多暴露于分子表面,且品种差异对暴露程度影响显著。相关性分析表明:大豆7S球蛋白的表面疏水性与拉曼光谱酪氨酸费米共振I850/I830的值呈显著正相关(P=0.020),相关性系数为0.883;与暴露的酪氨酸残基克分子数呈显著正相关(P=0.019),相关性系数为0.886;与N暴露和N包埋的比值呈显著正相关(P=0.017),相关性系数为0.891。说明酪氨酸残基暴露于分子表面的数量越多,大豆7S球蛋白的表面疏水性越高。可见,大豆7S球蛋白的表面疏水性与酪氨酸残基暴露程度密切相关。
2.4.2 拉曼光谱色氨酸费米共振分析结果
蛋白质拉曼光谱的1 360 cm-1和1 340 cm-1附近的色氨酸双线是环境疏水性的标志,吲哚环的亲脂反应会使1 340 cm-1附近的谱峰减弱,而使1 360 cm-1附近的谱峰增强,可用拉曼光谱色氨酸费米共振I1 360/I1 340的值来反映色氨酸残基微环境的情况[16]。结果见图3。
由图3可知,6个品种大豆7S球蛋白的拉曼光谱色氨酸费米共振I1 360/I1 340的值差异较大,说明品种差异对大豆7S球蛋白的色氨酸残基微环境影响较大。相关性分析表明:大豆7S球蛋白的表面疏水性与拉曼光谱色氨酸费米共振I1 360/I1 340的值呈显著负相关(P=0.014),相关性系数为-0.902。说明拉曼光谱色氨酸费米共振I1 360/I1 340的值越大,色氨酸吲哚环与环境中的脂肪类基团之间的亲脂反应越强,表示色氨酸所处微环境的极性越弱,即色氨酸残基的暴露程度越小,暴露数量越少,其表面疏水性越低。可见,大豆7S球蛋白的表面疏水性与色氨酸残基的暴露情况密切相关。

图3 不同品种大豆7S球蛋白的拉曼光谱色氨酸费米共振I1 360/I1 340
2.4.3 荧光光谱分析结果
由于酪氨酸残基的荧光熄灭及色氨酸残基的荧光增加,大豆7S球蛋白的荧光发射光谱实际上是色氨酸残基的荧光光谱。不同品种大豆7S球蛋白的荧光光谱见图4。
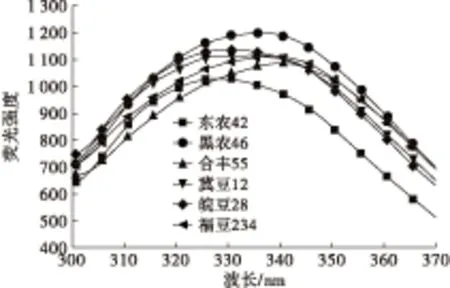
图4 不同品种大豆7S球蛋白的荧光光谱
由图4可知,6个品种大豆7S球蛋白的λmax分布在327.60~340.60 nm。皖豆28、东农42的λmax小于330 nm,其余品种的λmax大于330 nm,说明皖豆28和东农42的色氨酸残基位于蛋白质分子内部非极性环境中,其余品种的色氨酸残基暴露于分子外部极性环境中[17]。6个品种大豆7S球蛋白的色氨酸残基微环境极性,即色氨酸残基暴露程度为合丰55>福豆234>黑农46>冀豆12>皖豆28>东农42。相关性分析表明:大豆7S球蛋白的表面疏水性与色氨酸残基荧光峰λmax呈极显著正相关(r=0.987,P=0.000)。说明λmax越大,色氨酸残基微环境极性越强,即色氨酸残基暴露程度越大,其表面疏水性越高。
拉曼光谱和荧光光谱的分析结果一致表明:疏水性氨基酸残基暴露程度越大,暴露数量越多,大豆7S球蛋白的表面疏水性越大。可见,疏水性基团的暴露程度是决定其表面疏水性强弱的主要原因,而不同品种的大豆7S球蛋白疏水性基团暴露程度的差异,正是由于其氨基酸组成、亚基组成和空间构象等结构特性的不同而导致的。
2.5 巯基基团组成与表面疏水性关系
2.5.1 巯基和二硫键含量与表面疏水性关系(见图5)

图5 不同品种大豆7S球蛋白的巯基基团含量
由图5可知,6个品种大豆7S球蛋白的巯基基团主要以二硫键的形式存在,以游离巯基形式存在的巯基基团一部分包埋在蛋白质疏水基团内部,一部分暴露于蛋白质分子表面(即暴露巯基)。并且,品种差异对大豆7S球蛋白的暴露巯基含量、游离巯基含量和二硫键含量的影响极显著(P<0.01)。相关性分析表明:大豆7S球蛋白的表面疏水性与游离巯基含量相关性不显著(P=0.053),与二硫键含量相关性也不显著(P=0.746)。
2.5.2 巯基暴露程度与表面疏水性关系
由于不同品种大豆7S球蛋白的游离巯基含量存在极显著差异,因此只考虑暴露巯基含量对表面疏水性的影响还不够严谨,巯基的暴露程度(即暴露巯基含量占游离巯基含量的百分比)可能更能说明问题。相关性分析表明:大豆7S球蛋白的表面疏水性与暴露巯基含量呈显著正相关(P=0.026),相关性系数为0.866;与巯基暴露程度呈显著正相关(P=0.031),相关性系数为0.851。分析其原因:大豆7S球蛋白的巯基暴露程度越大,说明其结构越伸展,疏水性基团暴露于蛋白质表面的概率越大,其表面疏水性越高。
2.5.3 二硫键构象与表面疏水性关系
蛋白质拉曼光谱500~550 cm-1是二硫键伸缩振动的特征频率。两个半胱氨酸形成的二硫桥结构单元(C—C—S—S—C—C)有3种构型,通常将510 cm-1附近谱峰归属为g-g-g构型,即扭曲-扭曲-扭曲构型;525 cm-1附近谱峰归属为g-g-t构型,即扭曲-扭曲-反式构型;540 cm-1附近谱峰归属为t-g-t构型,即反式-扭曲-反式构型[16]。不同品种大豆7S球蛋白的二硫键构象分析结果见表4。

表4 不同品种大豆7S球蛋白的二硫键构象分析结果
由表4可知,不同品种大豆7S球蛋白的二硫键构型模式不同,差别较大,说明品种差异对大豆7S球蛋白的二硫键构象影响较大。相关性分析表明:大豆7S球蛋白的表面疏水性与二硫键g-g-g构型模式含量相关性不显著(P=0.780),与g-g-t构型模式含量相关性不显著(P=0.891),与t-g-t构型模式含量相关性也不显著(P=0.970)。
以上分析结果表明,大豆7S球蛋白的表面疏水性与其巯基和二硫键含量相关性不显著,与巯基暴露程度显著正相关,与二硫键构象相关性不显著。
3 结 论
(1)大豆7S球蛋白的表面疏水性与其主链构象α-螺旋含量的相关性系数为-0.910,与β-折叠含量的相关性系数为-0.898,与β-转角含量的相关性系数为0.855,与无规则卷曲含量的相关性系数为0.889。
(2)疏水性氨基酸残基的暴露程度越大,大豆7S球蛋白的表面疏水性越高,其与拉曼光谱酪氨酸费米共振I850/I830值的相关性系数为0.883,与暴露的酪氨酸残基克分子数的相关性系数为0.886,与N暴露和N包埋的比值的相关性系数为0.891,与拉曼光谱色氨酸费米共振I1 360/I1 340值的相关性系数为-0.902,与荧光光谱色氨酸残基荧光峰λmax的相关性系数为0.987。
(3)巯基暴露程度越大,大豆7S球蛋白的表面疏水性越强,其与暴露巯基含量的相关性系数为0.866,与巯基暴露程度的相关性系数为0.851,而与游离巯基含量、二硫键含量、二硫键构象的相关性均不显著。
[1] WANG W Y, BRINGE N A, BERHOW M A, et al.β-conglycinins among sources of bioactives in hydrolysates of different soybean varieties that inhibit leukemia cells in vitro[J]. J Agric Food Chem, 2008, 56(11): 4012-4020.
[2] HUANG W N, SUN X Z. Adhesive properties of soy protein modified by sodium dodecyl sulfate and sodium dodecyl benzenz sulfonate[J]. J Am Oil Chem Soc, 2000, 77(7):705-708.
[3] NATARAJAN S, XU C P, BAE H, et al. Proteomic and genetic analysis of glycinin subunits of sixteen soybean genotypes[J]. Plant Physio Biochem, 2007, 45(6/7): 436-444.
[4] 李丹, 刘春雷, 江连洲. 纯品7S和11S蛋白结构与表面疏水性的相关性研究[J]. 食品研究与开发, 2015, 36(7):5-9, 22.
[5] 刘春雷, 孙立斌, 李相昕, 等. 大豆7S和11S蛋白二级结构与表面疏水性相关性的研究[J]. 食品科学, 2015, 36(17):28-32.
[6] 李丹, 江连洲. 大豆7S和11S蛋白中氨基酸组成与表面疏水性的相关性研究[J]. 中国油脂, 2015, 40(3):25-29.
[7] 李丹, 刘春雷, 江连洲. 不同大豆品种11S球蛋白结构特性与表面疏水性关系研究[J]. 东北农业大学学报, 2016, 47(7):32-39.
[8] 张萍,郑大威,刘晶,等.基于表面增强拉曼光谱技术的豆芽6-BA残留快速检测方法[J].光谱学与光谱分析,2012(5):1266-1269.
[9] 王中江,江连洲,魏冬旭,等.pH值对大豆分离蛋白构象及表面疏水性的影响[J].食品与生物技术学报,2012,33(11):47-51.
[10] 邓乾春.银杏种仁清蛋白功能因子GAP2a活性构象的微环境效应及一级结构研究[D].武汉:华中农业大学,2007.
[11] 张莉莉.高温(100~120℃)处理对鱼糜及其复合凝胶热稳定性的影响[D].山东 青岛:中国海洋大学,2013.
[12] 孙为正.广式腊肠加工过程中脂质水解、蛋白质降解及风味成分变化研究[D].广州:华南理工大学,2011.
[13] 刘海梅.鳞鱼糜凝胶及形成机理的研究[D].武汉:华中农业大学,2007.
[14] 杨芳.豆腐凝胶形成机理及水分状态与品质关系研究[D].武汉:华中农业大学,2009.
[15] LI-CHAN E C Y.The applications of Raman spectroscopy in food science[J].Trends Food Sci Technol,1996,7(11):361-370.
[16] 赵伟.高压脉冲电场在液态蛋杀菌中的应用及其对微生物和蛋白质的作用机制[D].江苏 无锡:江南大学,2009.
[17] VIVIAN J T,CALLIS P R.Mechanisms of tryptophan fluorescence shifts in proteins[J].Biophys J,2001,80(5):2093-2109.
Correlation between structure characteristics and surface hydrophobicity ofβ-conglycinin(7S)
LI Dan1, WEI Dongxu2, JIA Ye3, LIU Chunlei1, JIANG Lianzhou4
(1.Ningde Normal University, Ningde 352100, Fujian,China; 2.Heilongjiang Entry-Exit Inspection and Quarantine Bureau, Harbin 150001, China; 3. Hangzhou Wahaha Group Co., Ltd., Hangzhou 310018, Chian; 4.College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Withβ-conglycinin (7S) prepared from six representative soybean varieties as raw material, the correlation between the structure characteristics and surface hydrophobicity of 7S was studied. The surface hydrophobicity of 7S was determined by ANS fluorescent probe method, the content of sulfhydryl and disulfide bond was determined by Ellman reagent analysis method, and conformation was analyzed by Raman spectroscopy and fluorescence spectroscopy. The results showed that there were negative correlations between surface hydrophobicity and the content ofα-helix,β-sheet and Fermi resonance Raman spectra of tryptophanI1 360/I1 340ratio. There were positive correlations between surface hydrophobicity andβ-turn, random coil,λmaxof tryptophan residues, Fermi resonance Raman spectra of tryptophanI850/I830ratio, the number of exposed tyrosine residues, the value ofNexposure∶Nembeddingand the content and degree of exposed sulfhydryl. There was not correlation between the surface hydrophobicity and the content of free sulfhydryl, the content of disulfide bond and disulfide bond conformation.
β-conglycinin(7S); Raman spectroscopy;fluorescence spectroscopy;sulfhydryl; disulfide bond;surface hydrophobicity
2016-10-09;
2017-01-17
国家863高技术研究发展计划项目(2013AA102104);国家自然科学基金面上项目(31071493);宁德师范学院服务闽东项目(2012H314);宁德师范学院6.18项目(2012H213)
李 丹(1983),女,讲师,博士,研究方向为粮食、油脂及植物蛋白工程(E-mail)116127847@qq.com。
江连洲,教授,博士生导师(E-mail)501342131@qq.com。
TS201.2;TQ937
A
1003-7969(2017)04-0093-06
