DNA甲基结合蛋白2调节少突胶质前体细胞终末分化的作用及机制
2017-05-10孙龙云
孙龙云
(张家口学院医学系,河北 张家口 075000)
DNA甲基结合蛋白2调节少突胶质前体细胞终末分化的作用及机制
孙龙云
(张家口学院医学系,河北 张家口 075000)
目的 探究DNA甲基结合蛋白(MeCP)2调节少突胶质前体细胞(OPCs)终末分化的作用及机制。方法 ①采用Western印迹方法观察MeCP2沉默对OPCs分化成熟的影响;②运用甲基特异性聚合酶链反应(PCR)(BSP)和定量实时PCR(qRT-PCR)探究少突终末标志物内转录因子Sry相关Box17因子(SOX)10、DNA甲基结合蛋白(MBP)、髓鞘相关糖蛋白(MAG)、髓鞘脂蛋白(PLP)甲基化和表达变化。结果 与正常细胞相比,在MeCP2沉默的OPCs中,与OPCs分化成熟相关2',3'-环核苷酸3'-磷酸二酯酶(CNP)重组蛋白表达明显上调,同时SOX10、MBP、MAG、PLP表达均明显上调;但呈现低甲基化水平。结论 MeCP2沉默可促进OPCs终末分化标志物的表达及甲基化水平的降低,从而促进OPCs成熟分化。
DNA甲基结合蛋白(MeCP)2;少突胶质前体细胞;终末分化
髓鞘异常是导致老年脑组织退行性病变的主要元素,不可避免的脱髓鞘直接导致脑神经功能退化,最终引起老年痴呆。少突胶质细胞的主要功能是在中枢神经系统中包绕轴突、形成绝缘的髓鞘结构、维持和保护神经元的正常功能。少突胶质前体细胞(OPCs)分化成熟异常是导致髓鞘异常的直接原因,OPCs分化成熟是中枢神经髓鞘形成的关键环节,但其调控机制不清。OPCs分化成熟受遗传和环境因素共同调控,DNA甲基化是最早被发现的一种表观遗传修饰,其不涉及DNA序列的改变,但可调节基因的表达。研究显示DNA甲基化在OPCs分化成熟和髄鞘再生障碍中发挥了重要作用〔1〕。DNA甲基化的主要途径是在DNA甲基化转移酶的作用下,通过DNA甲基结合蛋白(MBP)募集相关分子形成复合物,抑制基因表达〔2〕。DNA甲基化可以使DNA在甲基转移酶的作用下,碱基C(胞嘧啶)的5号碳原子上添加一个甲基的变化。在少突胶质细胞终末分化阶段中特异敲除DNA甲基结合蛋白(MeCP)2,髓鞘厚度明显变薄,并且有研究提示MeCP2可能在少突胶质细胞(OLs)的分化成熟和髓鞘形成中发挥了关键作用〔3〕。本研究拟阐明MeCP2在OPCs分化成熟和髓鞘形成过程中的作用和机制。
1 材料与方法
1.1 细胞、培养基与试剂 大鼠OPCs系QLN-9细胞(美国模式生物库ATCC),培养基DMEM,0.25%胰蛋白酶(Hyclone公司),胎牛血清(FBS)(Gibco公司)。主要试剂:阿司匹林,顺铂,双抗-青链霉素,Trizol核酸裂解液,逆转录试剂盒,定量聚合酶链反应(qPCR)试剂盒(碧云天公司)。其中shRNA-MeCP2的模板序列如下:正义链:5'-GACTGGACCTGAGTTACGTCATTCAATAAAVCTGAAGTTCCTTACTATATGTCCTTTTTTG-3';反义链:5'-CTGACTATAAAGAAGCCAAGGAAGTTGTTCTCTCTTCAAGGAATGACGTACACGTGGCTCC-3',过程中所使用的克隆载体是pGPU5/GFP/Neo(美国Santa Cruz公司)。
1.2 细胞培养 培养箱二氧化碳浓度为5%、温度37℃条件下,分别用DMEM(含10%FBS及双抗)完全培养基培养大鼠OPCs系QLN-9细胞。
1.3 提取RNA 0.25%胰蛋白酶收集对数期细胞,加入适量Trizol,冰上孵育15 min、12 000 r/min离心10 min,75%乙醇清洗沉淀,沉淀溶于焦碳酸二乙酯(DEPC)水,存于-70℃。
1.4 Western印迹检测 一抗:tubulin配置比例为1∶10 000,MeCP2为1∶200,2'-3'-环核苷酸3'-磷酸二酯酶(CNP)为1∶200;二抗,Tubulin配置比例为1∶10 000,MeCP2,CNP为1∶5 000。
1.5 甲基特异性PCR 提取总RNA反转录成cDNA,进行甲基特异性PCR反应。反应条件:95℃预变性10 min(95℃变性15 s,60℃退火30 s,72℃延伸30 s)×40循环,72℃末次延伸5 min。取PCR结果行琼脂糖凝胶电泳。若目的基因启动子CPG岛完全发生甲基化,则仅在完全甲基化引物下出现条带;若目的基因启动子CPG岛完全不发生甲基化,则仅在无甲基化引物下出现条带;若目的基因启动子CPG岛不完全发生甲基化,则两个引物下均可出现条带。
1.6 实时qPCR 提取总RNA反转录成cDNA,进行荧光qPCR反应。反应条件:95℃预变性10 min(95℃变性15 s,60℃退火30 s,72℃延伸30 s)×40循环,72℃末次延伸5 min。采用2-ΔCT法进行相对定量分析。
1.7 统计学方法 采用GRAPH PAD6.0统计软件进行t检验。
2 结 果
2.1 MeCP2沉默可促进OPCs成熟分化 体外培养OPCs 1 w后,细胞逐渐由纤维状、螺旋生长形态转为上皮形态。与正常细胞相比,在MeCP2沉默的OPCs中,CNP蛋白的表达明显上调,提示MeCP2沉默可促进OPCs成熟分化。见图1。
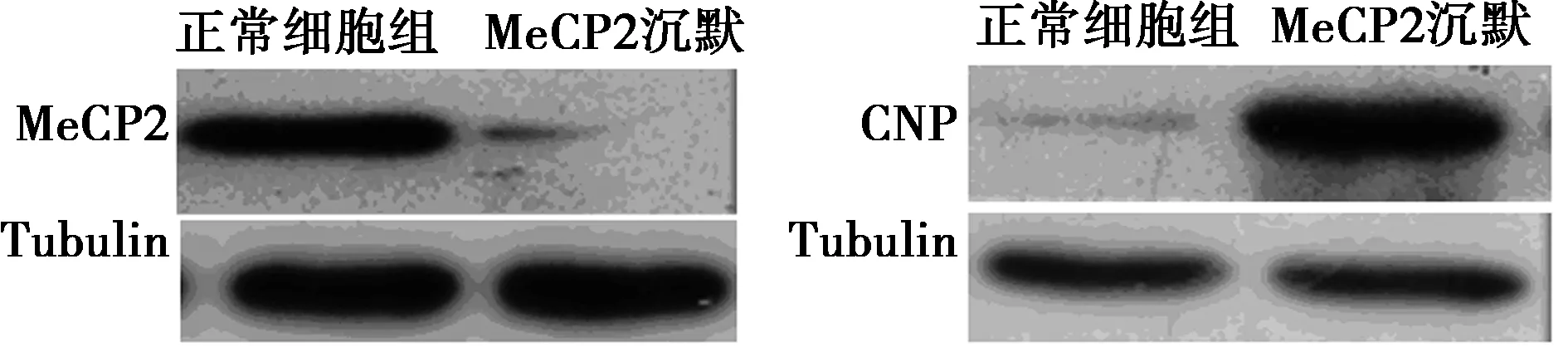
图1 MeCP2沉默可促进OPCs成熟分化(Western印迹)
2.2 MeCP2沉默可促进OPCs终末分化标志物表达及甲基化水平降低 MeCP2沉默促进SOX10、MBP、MAG、PLP表达均明显上调(P<0.05);SOX10、MBP、MAG、PLP均呈现低甲基化水平,除SOX10外,其他均差异显著(P<0.05)。见表1,表2。
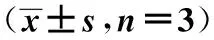
表1 OPCs终末分化标志物mRNA相对表达量
与对照组比较:1)P<0.05
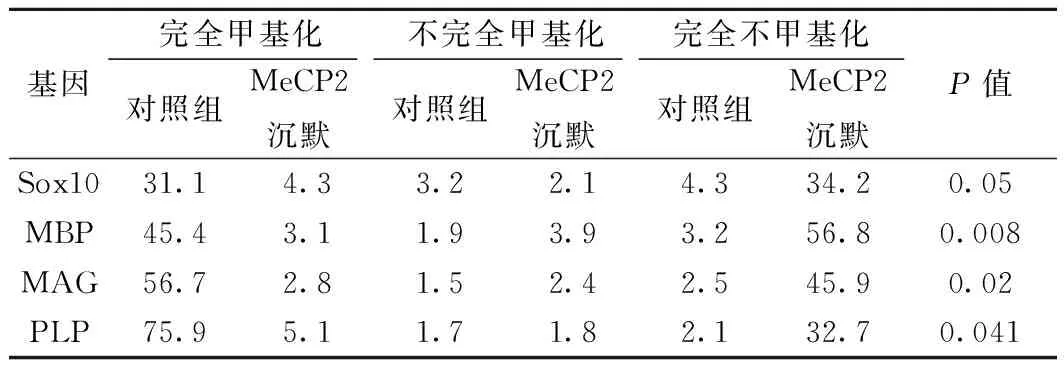
表2 甲基特异性PCR示OPCs终末分化 标志物甲基化水平
3 讨 论
OLs是中枢神经系统(CNS)髓鞘形成细胞。中枢神经髓鞘的完整性保证了神经信息精确、高效传递,对中枢信息整合发挥重要作用,多种神经精神疾病如Pett综合征(RTT)、多发性硬化症、精神分裂症等都有髓鞘的异常,特别是随着年纪的增长,髓鞘的脱失与老年痴呆密切相关。OPCs分化成熟异常是导致髓鞘异常的直接原因。
DNA甲基化是最早被发现的一种表观遗传修饰,是指在DNA甲基转移酶的催化下,利用S-腺苷甲硫氨酸提供的甲基,将胞嘧啶的第5 位碳原子甲基化,使之转化为5-甲基胞嘧啶(5mC)的过程,常见于基因的CG序列。一般认为甲基化程度高,基因的表达则低。DNA甲基转移酶包括Dnmt1,Dnmt3a和Dnmt3b。Dnmt1,Dnmt3b对早期的神经系统发育有重要作用。Dnmt1的缺失会导致基因的大面积低甲基化。在Dnmt3a缺失的神经干细胞系中,OLs相关基因比如血小板衍生生长因子受体(PDGFR)α,Olig1,SOX10,MBP,Id2/4,Nkx 2.2等表达有明显的降低,研究发现〔4〕在少突胶质谱系中Dnmt3a,Dnmt1和Dnmt3b主要在神经元中表达。MAG基因的两个Hpa2位点随OLs分化的过程逐渐发生去甲基化。OLs分化特异的转录因子SOX10在精神分裂症患者的大脑高度甲基化,SOX10低表达。从多发性硬化症患者脑白质分离的DNA中,发现OLs相关基因PAD2存在高甲基化现象,表达下调,以上结果显示DNA甲基化调控了OLs分化成熟和髓鞘再生障碍。
DNA甲基化的主要作用途径是:在DNA甲基化转移酶的作用下,通过MBP募集组蛋白去乙酰化酶(HDACs)、共抑制子等形成抑制复合物,阻止转录因子与其特定DNA序列结合,从而抑制基因的表达。MBP主要有MBP1~4、MeCP2和Kaiso。MeCP2位于染色体Xq28,包含4个外显子和3个内含子,MeCP2转录后形成 MeCP2-e1和MeCP2-e2两种剪切体。两种剪切体分别从外显子1和2开始转录,产生的蛋白整体结构差异微小。MeCP2外显子1突变可导致典型的RTT。MeCP2蛋白有3个主要的功能域:CpG结合域、转录抑制域和C-末端域,MeCP2介导的转录抑制主要通过与甲基化的DNA相互作用产生,由MBP区识别位于基因启动子区的甲基化CpG双核苷,通过转录抑制区(TRD)募集转录抑制因子Sin3A和组蛋白去乙酰化酶共同组成转录抑制复合物,从而抑制下游基因表达〔5〕。
MeCP2的缺失可导致RTT。RTT是一种X连锁的疾病,主要累及女孩,导致智力低下、类似自闭症等神经系统异常,晚期还会出现骨骼病变,脊柱强直等症状〔6〕,临床上尚无有效治疗药物。RTT综合征在发病的早期即有白质的病变,白质主要为神经纤维〔7〕,而OLs正是形成神经纤维的细胞,OLs异常是该病的重要发病机制之一。研究显示,MeCP2敲除小鼠表现出与RTT相似的症状,MeCP2基因在OLs中恢复表达后,小鼠运动能力明显提升,同时相比较于MeCP2在星形胶质细胞和小胶质细胞中恢复表达,能够更多延长小鼠的寿命〔8~10〕。
研究发现MeCP2敲除小鼠的大脑胼胝体中,髓鞘厚度明显下降〔11〕。课题组在北京师范大学章晓辉教授实验室引进MeCP2敲除小鼠(B6.129P2-MeCP2tm1Bird/J),成功进行了培育并得到了MeCP2敲除的小鼠,发现MeCP2敲除的小鼠髓鞘厚度显著下降。提示MeCP2可能影响OPCs的终末分化成熟和髓鞘的形成〔12~14〕。综上,MeCP2可能在OPCs分化的终末阶段发挥了重要作用,通过调控少突终末分化相关基因的甲基化来调控OLs终末分化和髓鞘的形成。MeCP2沉默可促进OPCs终末分化标志物的表达及甲基化水平的降低,从而促进OPCs成熟分化。
1 谭卫星.miR-126-3p在少突胶质前体细胞分化和髓鞘再生中的作用及机制研究〔D〕.上海:第二军医大学,2015.
2 Kulis M,Esteller M.DNA methylation and cancer〔J〕.Adv Genetics,2010;70:27-56.
3 翁 超,卢祖能,符 辉.少突胶质细胞分化发育与髓鞘形成的研究进展〔J〕.中华神经医学杂志,2016;15(5):524-8.
4 Sheikh MA.DNA甲基转移酶3b新靶点的鉴定及其在神经元分化中表达的调节及功能研究〔D〕.长春:东北师范大学,2013.
5 Cheng PY,Lin YP,Chen YL,etal.Interplay between SIN3A and STAT3 mediates chromatin conformational changes and GFAP expression during cellular differentiation〔J〕.PLoS One,2011;6:e22018.
6 Amir RE,Van den Veyver IB,Wan M,etal.Rett syndrome is caused by mutations in X-linked MeCP2,encoding methyl-CpG-binding protein 2〔J〕.Nat Genet,1999;23:185-8.
7 Durand T,De Felice C,Signorini C,etal.F2-Dihomo-isoprostanes and brain white matter damage in stage 1 Rett syndrome〔J〕.Biochimie,2013;95(1):86-90.
8 Wu W,Gu W,Xu X,etal.Downregulation of CNPase in a MeCP2 deficient mouse model of Rett syndrome〔J〕.Neurol Res,2012;34(2):107-13.
9 Vora P,Mina R,Namaka M,etal.A novel transcriptional regulator of myelin gene expression:implications for neurodevelopmental disorders〔J〕.Neur Rep,2010;21(14):917-21.
10 Nguyen MV,Felice CA,Du F,etal.Oligodendrocyte lineage cells contribute unique features to Rett syndrome neuropathology〔J〕.J Neurosci,2013;33(48):18764-74.
11 邓医宇,朱高峰,曾红科,等.G蛋白偶联受体56对小鼠脑胼胝体轴突髓鞘化的影响〔J〕.临床神经病学杂志,2014;27(6):437-41.
12 Forbes-Lorman RM,Kurian JR.MeCP2 regulates GFAP expression within the developing brain〔J〕.Brain Res,2014;1543(2):151.
13 Singleton MK,Gonzales ML,Leung KN,etal.MeCP2 is required for global heterochromatic and nucleolar changes during activity-dependent neuronal maturation〔J〕.Neurobiol Dis,2011;43(1):190-200.
14 Nguyen MV,Du F,Felice CA,etal.MeCP2 is critical for maintaining mature neuronal networks and global brain anatomy during late stages of postnatal brain development and in the mature adult brain〔J〕.J Neurosci,2012;32(29):10021-34.
〔2015-05-27修回〕
(编辑 苑云杰)
孙龙云(1981-),男,讲师,医学硕士,主要从事人体解剖与组织胚胎学研究。
R329
A
1005-9202(2017)08-1886-03;
10.3969/j.issn.1005-9202.2017.08.027
