Hep2-exo负载树突细胞诱导抗喉癌免疫效应的机制
2017-05-10张琼宇胡晓军孙远东
张琼宇 李 培 葵 旭 胡晓军 孙远东
(永州职业技术学院基础医学部,湖南 永州 425100)
Hep2-exo负载树突细胞诱导抗喉癌免疫效应的机制
张琼宇 李 培 葵 旭 胡晓军 孙远东1
(永州职业技术学院基础医学部,湖南 永州 425100)
目的 探讨人喉癌细胞Hep2细胞来源外泌体(Hep2-exo)负载树突细胞(DC)后体外刺激细胞毒T细胞对Hep2细胞的杀伤作用。方法 利用蔗糖密度梯度超速离心法从Hep2细胞培养上清液中分离Hep2-exo。透射电子显微镜鉴定Hep2-exo形态,Western印迹分析Hep2-exo表面CD9分子表达。分离培养喉癌患者外周血单个核细胞诱导的DC,流式细胞术鉴定细胞表型。用MTT法检测负载Hep2-exo的DC刺激T淋巴细胞增殖情况及细胞毒T细胞对Hep2细胞的杀伤作用。结果 透射电镜下见Hep2-exo呈典型的杯状,大小相对均一,平均直径30~100 nm。Hep2-exo表面有CD9CD63分子表达。单个核细胞DC有CD1a分子表达说明诱导成功,边缘有绒毛样突起,呈典型的PC形态。负载Hep2-exo的DC刺激T细胞增殖能力及T细胞对靶细胞的杀伤效应明显强于未负载Hep2-exo的DC(P<0.05)。结论 负载Hep2-exo的DC 能促进T细胞增殖,可体外诱导细胞毒T细胞应答抑制喉癌细胞生长。
喉癌;外泌体;Hep2细胞裂解物;树突细胞;T细胞
外泌体是一种小型的细胞膜包裹的结构,是细胞分泌到细胞外的纳米级小囊泡,为脂质双层膜包裹的扁平球体,呈杯状,直径约在30~100 nm。多种类型细胞均能以这种胞外分泌的方式释放外泌体(Exo)〔1〕。肿瘤细胞来源外泌体(Texo)富含主要组织相容性复合体(MHC)分子、肿瘤相关抗原(TAA)、共刺激分子等分子,能够诱导抗肿瘤相关的细胞毒性 T 细胞(CTL)应答反应〔2〕,但是效率较低,难以达到治疗和预防肿瘤的效果。所以,增强Texo诱导的抗肿瘤效应是开发以Texo为基础的高效肿瘤疫苗的关键。来源于抗原提呈细胞(APC)的Exo能够有效刺激 T淋巴细胞的体外增殖,并且可以诱导机体内的抗肿瘤免疫反应。包含肿瘤抗原的Texo可以通过 APC 交叉呈递给CTL,使其产生肿瘤杀伤CTL反应。研究显示,Texo能够在体内靶向结合树突细胞(DC),靶向结合的DC可诱导较肿瘤裂解物负载DC更强的免疫应答反应〔3〕。从人喉癌细胞株Hep2细胞分离Hep2-exo,体外与DC共同培养,使之负载。本文主要探讨Hep2-exo负载DC后诱导CTL,从而对Hep2细胞生长产生抑制的作用机制。
1 材料与方法
1.1 实验相关细胞 Hep2购自中科院肿瘤细胞库。新鲜喉癌患者全血由中国医科大学附属盛京医院提供。
1.2 试剂与仪器 胎牛血清购自杭州四季青公司;Ficoll淋巴细胞分离液购于北京鼎国生物科技有限公司;重组人白细胞介素(rhIL)-4、重组人粒细胞集落刺激因子(rhGM-CSF)、肿瘤坏死因子(TNF)-α细胞因子购于派普泰克公司;辣根过氧化物酶标记二抗购自Sigma公司;人-CD1a-APC,人-IgG1-APC抗体和人-CD14 磁珠均购自德国美天旎公司;人CD9单克隆抗体购自武汉博士德公司;
1.3 Hep2-exo的分离 将Hep2细胞用含 10% 胎牛血清的二甲基亚砜(DMEM)培养液于37℃、5%二氧化碳条件下培养。选取对数生长期细胞,收集细胞培养上清液10 ml,3 000 r/min离心15 min,去除细胞或细胞碎片。将上清液转移至另一干净的灭菌管中加入2 ml ExoQuick试剂,上下颠倒离心管混匀。4℃孵育过夜(12 h)后,1 500 r/min离心30 min,管底可见米白色沉淀,去除上清后,1 500 r/min继续离心5 min,小心再次去除上清。取适量磷酸盐缓冲液(PBS)重悬,通过二喹啉甲酸(BCA)法测定蛋白含量,后用0.22 μm滤器进行过滤除菌,然后进行分装,进行功能实验。
1.4 利用透射电镜研究Hep2-exo 形态特征 将获得样品用超速离心机10 000 r/min离心10 min,弃掉上清,用2.5%戊二醛固定。经过PBS漂洗;1%四氧化锇(OsO4)固定;PBS漂洗,酒精丙酮梯度脱水,浸透,包埋聚合,然后制备70 nm超薄切片,醋酸铀-柠檬酸铅染色,JEM-1200EX(日本JEOL公司)镜下观察,拍片。
1.5 Western印迹分析CD9分子表达 首先进行Hep2细胞计数,然后取1×108/ml个Hep2细胞,液氮反复快速冻融4次,然后1 000 r/min离心30 min,所获得的上清液即为细胞裂解物抗原,通过BCA法进行蛋白定量。按40 μg蛋白上样量,取Hep2-exo及Hep2细胞裂解物,将样品加入上样缓冲液进行煮沸变性,12%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶进行电泳分离,将目的蛋白转移至醋酸纤维膜上,在室温下经过5% 脱脂奶粉封闭2 h后,加入一抗(1∶1 000)4℃ 过夜,PBS洗涤3次,每次10 min,加入辣根过氧化物酶标记的二抗(1∶5 000),37℃孵育1 h,PBS洗涤3次,每次10 min,加入化学发光液(美国赛默飞公司)曝光显影。
1.6 单核细胞来源DC的诱导培养 取喉癌患者新鲜抗凝人外周血加入PBS,混匀后在离心管底部加入Ficoll淋巴细胞分离液,首先300 r/min离心30 min,收集乳白色细胞层,适量PBS洗涤后,300 r/min离心25 min,收集细胞。PBS重复洗涤,计数后备用,此为外周血单个核细胞。利用CD14细胞磁珠分选系统分离CD14+细胞,然后进行冻存同一样本的CD14-细胞。将收集的CD14+细胞用进行细胞计数。加入细胞因子rhGM-CSF 1 000 IU/ml,rhIL-4 1 000 IU/ml,TNF-α 1 000 IU/ml。将CD14+细胞(1×106/ml/孔)接种于12孔细胞培养板中。在培养的第3天补加相同浓度细胞因子,第7天时,取其中一个孔中1×105个细胞进行流式细胞术检测表达CD1a,鉴定细胞为DCs。其中另两孔用Hep2-exo(10 μg)负载DC培养48 h,使之成为Hep2-exo-DC。
1.7 T淋巴细胞增殖实验 将对应同一个体CD14-细胞复苏,并且用含有10%胎牛血清DMEM培养液重悬细胞,进行细胞计数后加入尼龙毛柱中。经过常规细胞培养 1 h后,收集 T 淋巴细胞,计数并进行增殖实验。实验分为3组,将DC与T淋巴细胞(T)按1∶3(105/孔∶3×105/孔)比例混合培养,A组:Hep2-exo-DC + T;B组:DC+T;C组:T。96 孔培养板(100 μl/孔)中接种各组细胞,设置3个复孔,37℃、5% CO2培养72 h每孔加入20 μl噻唑蓝(MTT),孵育4 h后,每孔再加入150 μl DMSO,混匀后,通过酶标仪(Thermo Scientific Varioskan Flash)于波长570 nm测定吸光度值。
1.8 细胞毒性实验 设实验组、效应细胞对照组、Hep2靶细胞对照组、DC对照组和阴性对照组,实验组为Hep2-exo-DC + T (比例为1∶3),T淋巴细胞为效应T细胞,实验组按效靶比12.5∶1,25∶1,50∶1,加入已铺好靶细胞的Hep2细胞(1×104/孔)的96孔培养板,每孔100 μl,每组设5个复孔。所有孔在IL-2(400 U/ml)条件下,37℃、5% CO2培养箱中培养48 h,加入MTT溶液20 μl,继续培养4 h后加入DMEM 150 μl,于波长490 nm测定A值,计算杀伤活性:CTL杀伤活性(%)=〔靶细胞对照组A值-(实验组A值-效应细胞对照组A值)〕/靶细胞对照组A值× 100%。
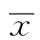
2 结 果
2.1 Hep2-exo的鉴定结果 Hep2细胞分泌的Exo呈圆形或椭圆形,大小相对均一,其外可见有脂质膜包裹,内部为低电子密度物质,平均直径30~100 nm,同国外文献报道〔1,2〕一致。Hep2细胞裂解物和Hep2-exo均表达CD9和CD63分子,Hep2-exo表达CD9和CD63灰度值比Hep2细胞裂解物高。见图1,图2。
2.2 DC表型分析 来源于PBMC的CD14+经过细胞因子(rhGM-CSF,rhIL-4,TNF-α)诱导培养至第7天,显微镜见大部分细胞贴壁生长,出现毛刺样突起,呈现典型的树枝状突样。通过流式细胞仪分析显示DCs表面高表达CD1a分子,则证明DC诱导成功。见图3。

图1 Hep2细胞来源Exo电镜图(×20 000)
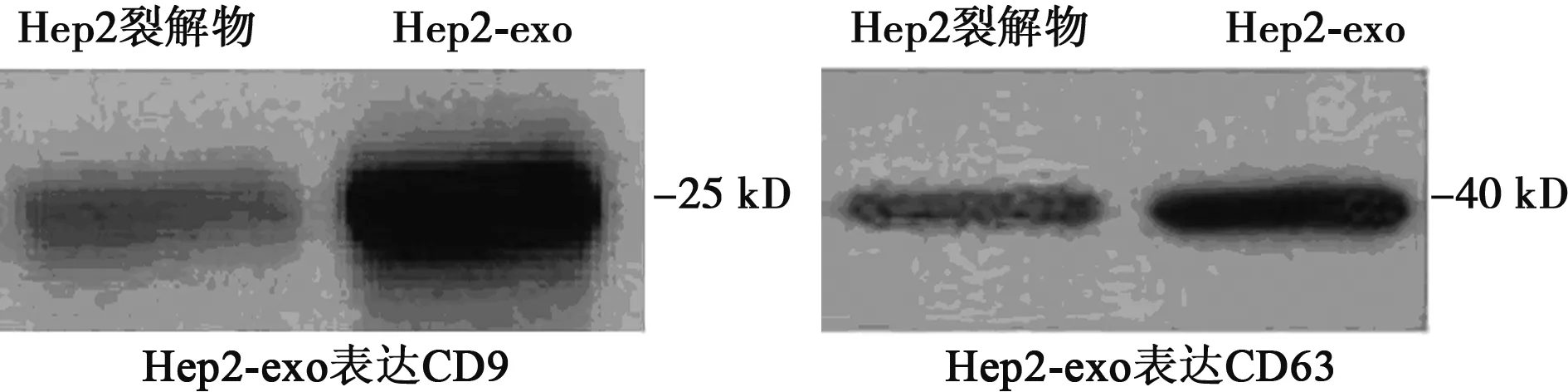
图2 Western印迹结果分析
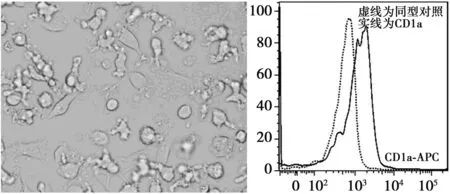
图3 DC的形态与表型鉴定
2.3 Hep2-exo负载DC刺激T淋巴细胞增殖 相比仅有T细胞的对照组(0.26±0.14),Hep2-DC + T组(1.76±0.17)和DC+T组(7.20±0.17)的T淋巴细胞数量明显增加(P<0.05)。此结果说明负载Hep2-exo的DC和未负载Hep2-exo的DC具有刺激T 细胞活化增殖能力。而且Hep-exo-DC + T组同DC + T 组相比,Hep-exo-DC + T组具有更强的增殖能力,说明负载Hep2-exo的 DC 与未负载 Hep2-exo的DC相比,刺激 T 细胞活化的能力更强(P<0.05)。
2.4 Hep2-exo致敏DC诱导CTL的特异性杀伤作用 负载Hep2-exo的 DC 在效靶比为12.5∶1时,其抗Hep2细胞能力与未负载Hep2-exo的 DC、Hep2-exo、 T 细胞对照组相比差异无统计学意义;但是在效靶比25∶1,50∶1时,负载Hep2-exo的DC 诱导 CTL 抗Hep2细胞能力明显高于其他三组。在效靶比50∶1时,抗Hep2细胞活力能力最高。见图4。
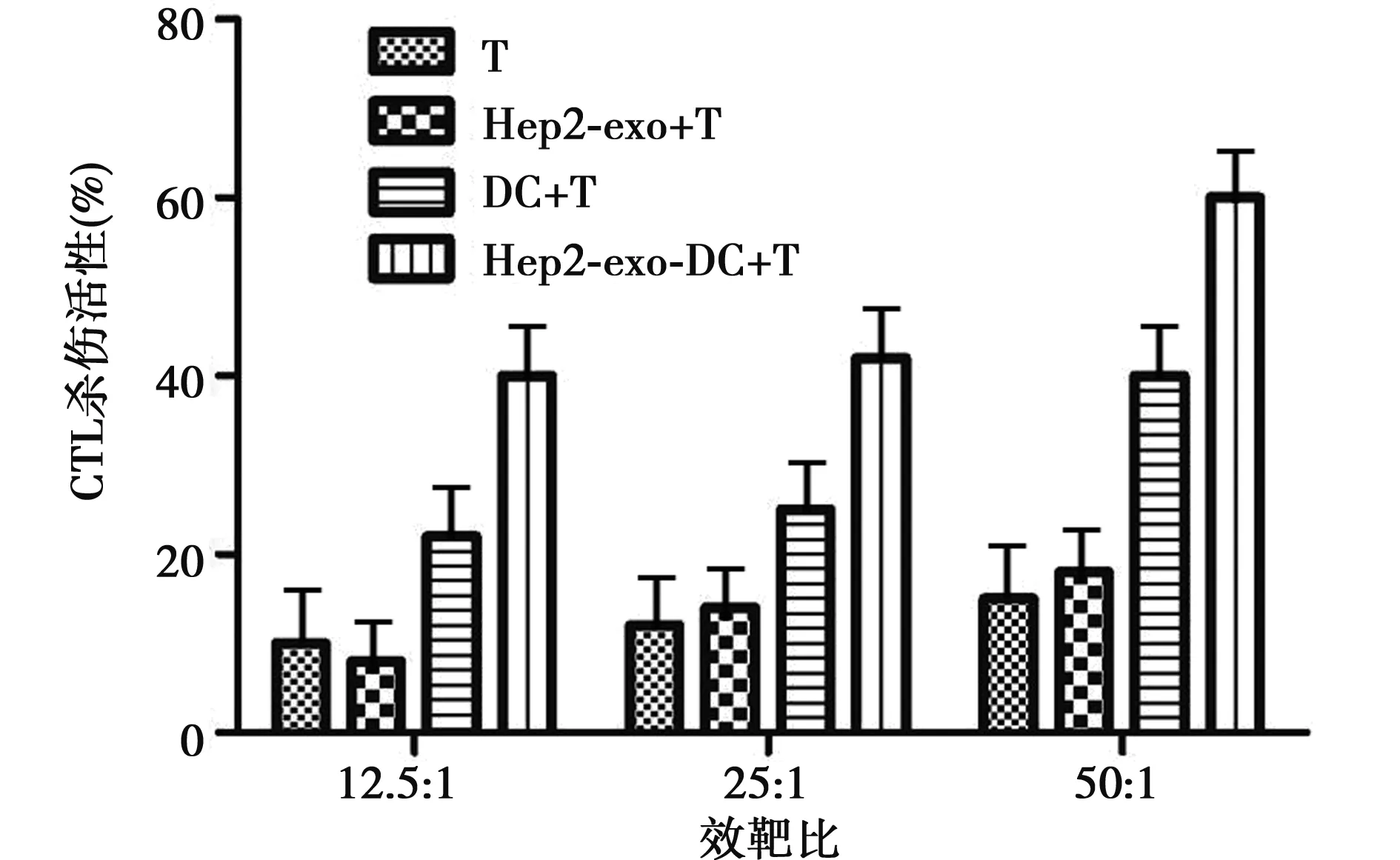
图4 Hep2-exo负载 DC 诱导特异性CTL活性
3 讨 论
作为生长在人头颈部的恶性肿瘤,根据我国数据统计,喉癌发病率占全身恶性肿瘤的1%~2%,然而其占耳鼻喉科恶性肿瘤的发病率达到了10%~12%,并且出现逐年增高的趋势〔4〕。在目前的技术下,主要以手术临床治疗喉癌,并且以放疗和化疗进行辅助治疗。但是这有许多缺点,由于肿瘤易复发和转移,最主要的是放疗和化疗缺乏针对性的治疗,并且不能明显提高喉癌患者的生存率和生活质量。在国内外,生物免疫治疗已经成为肿瘤的第四种治疗模式,并且已经在进行临床试验。例如利用 DC能够有效特异性递呈抗原的生物学特性,激活初始型T淋巴细胞,使其活化为抗原特异的CTL诱导患者机体产生肿瘤特异性的持久免疫应答。
Texo作为多种活细胞分泌的囊泡圆形或者椭圆形球体结构,但是其最终发挥的功能会因为细胞来源的不同而不同〔5~7〕。研究显示,Texo含有MHC-Ⅰ类分子、热休克蛋白、肿瘤相关抗原等〔8,9〕,并且存在肿瘤抗原运载系统(HSPs)以及与细胞靶向性有关的蛋白(CD9 和 CD63)。说明肿瘤Texo也是一种抗原传递系统,能够将肿瘤抗原转移到抗原递呈细胞,能够激活T淋巴细胞增殖和CTL反应,但是效率较低,难以达到治疗肿瘤的效果。但是经DC摄取后,进而进行递呈抗原,因此而激活 T 淋巴细胞反应,从而能够表现出较强的抗肿瘤免疫效应〔10〕。本次研究中采用SBI公司ExoQuick试剂盒从Hep2细胞上清液提取外泌体,电镜下见Hep2细胞分泌的呈圆形或椭圆,大小相对均一,其外可见有脂质膜包裹,内部为低电子密度物质,平均直径30~100 nm,表面有CD9CD63分子表达,与国外文献报道一致〔11〕。喉癌患者外周血单个核细胞经过细胞因子成功诱导成DCs后,然后用Hep2-exo进行体外刺激,研究负载Hep2-exo的DC激活T淋巴细胞增殖反应并且激活对喉癌细胞的杀伤效应。本研究结果Hep2-exo致敏DC能够有效诱导T淋巴细胞活化增殖,CTL 被激活以后抑制Hep2细胞生长,发挥抗肿瘤作用。虽然Hep2-exo能够继承肿瘤细胞中的 MHC-Ⅰ类分子和肿瘤抗原,然而并不能有效激活诱导 CTL 反应,虽然目前研究用肿瘤抗原刺激DC后的外泌体诱导CTL抗肿瘤,但是因为其抗肿瘤效率不及DC〔12〕。因此选择利用Texo负载DC,抑制肿瘤细胞增殖。因此通过研究结果推测,首先,T 淋巴细胞的活化增殖需要肿瘤抗原、MHC 分子的刺激,第二还需要 DC 等抗原提呈细胞提供共刺激信号。当这两项条件满足时,Hep2-exo负载到DC上时,才能高效诱导 CTL 反应,发挥抗肿瘤作用。本研究利用最新的试剂盒方法成功地从分离了Hep2-exo,更有临床意义的是证实了Hep2-exo负载DC可诱导 CTL反应,引起有效的抗肿瘤免疫效应,从而为喉癌的生物免疫治疗提供临床治疗的基础数据。
1 Damo M,Wilson DS,Simeoni E,etal.TLR-3 stimulation improves anti-tumor immunity elicited by dendritic cell exosome-based vaccines in a murine model of melanoma〔J〕.Sci Rep,2015;(5):17622.
2 Tauro BJ,Greening DW,Mathias RA,etal.Two distinct populations of exosomes are released from LIM1863 colon carcinoma cell-derived organoids〔J〕.Mol Cell Proteomics,2013;12(3):587-98.
3 Gu X,Erb U,Büchler MW,etal.Improved vaccine efficacy of tumor exosome compared to tumor lysate loaded dendritic cells in mice〔J〕.Int J Cancer,2015;136(4):E74-84.
4 Zhang Y,Wu K,Shao Y,etal.Decreased 5-Hydroxymethylcytosine(5-hmC)predicts poor prognosis in early-stage laryngeal squamous cell carcinoma〔J〕.Am J Cancer Res,2016;6(5):1089-98.
5 Iorgulescu JB,Ivan ME,Safaee M,etal.The limited capacity of malignant glioma-derived exosomes to suppress peripheral immune effectors〔J〕.J Neuroimmunol,2016;(290):103-8.
6 Kunigelis KE,Graner MW.The dichotomy of tumor exosomes(TEX)in cancer immunity:is it all in the conTEXt〔J〕?Vaccines(Basel),2015;3(4):1019-51.
7 Ding G,Zhou L,Qian Y,etal.Pancreatic cancer-derived exosomes transfer miRNAs to dendritic cells and inhibit RFXAP expression via miR-212-3p〔J〕.Oncotarget,2015;6(30):29877-88.
8 Hayoun D,Kapp T,Edri-Brami M,etal.HSP60 is transported through the secretory pathway of 3-MCA-induced fibrosarcoma tumour cells and undergoes N-glycosylation〔J〕.FEBS J,2012;279(12):2083-95.
9 Hartman ZC,Wei J,Glass OK,etal.Increasing vaccine potency through exosome antigen targeting〔J〕.Vaccine,2011;29(50):9361-7.
10 Marton A,Vizler C,Kusz E,etal.Melanoma cell-derived exosomes alter macrophage and dendritic cell functions in vitro〔J〕.Immunol Lett,2012;148(1):34-8.
11 del Cacho E,Gallego M,Lillehoj HS,etal.Tetraspanin-3 regulates protective immunity against Eimeria tenella infection following immunization with dendritic cell-derived exosomes〔J〕.Vaccine,2013;31(41):4668-74.
12 Quah BJ,O'Neill HC.The immunogenicity of dendritic cell-derived exosomes〔J〕.Blood Cells Mol Dis,2005;35(2):94-110.
〔2016-12-19修回〕
(编辑 袁左鸣)
永州市2015年度第二批指导性科技计划项目(永科发〔2015〕10号)
孙远东(1975-),男,博士,副教授,主要从事细胞生物学领域研究。
张琼宇(1982-),男,博士,讲师,主要从事发育生物学研究。
R73
A
1005-9202(2017)08-1827-04;
10.3969/j.issn.1005-9202.2017.08.003
1 湖南科技大学生命科学学院
