H2S对碳钢在模拟罐底水中腐蚀行为的影响
2017-05-09李广州陈林华孟宪虎
李广州,陈林华,张 尧,常 辉,丁 毅,孟宪虎
(1. 南京工业大学 材料科学与工程学院,南京 210009; 2. 扬子石化-巴斯夫有限责任公司,南京 210048;3. 江苏众信绿色管业科技有限公司,南京 210041)
H2S对碳钢在模拟罐底水中腐蚀行为的影响
李广州1,陈林华2,张 尧1,常 辉1,丁 毅1,孟宪虎3
(1. 南京工业大学 材料科学与工程学院,南京 210009; 2. 扬子石化-巴斯夫有限责任公司,南京 210048;3. 江苏众信绿色管业科技有限公司,南京 210041)
利用腐蚀失重法、电化学测试、扫描电镜(SEM)和X射线衍射(XRD)研究了Q235碳钢在含H2S的模拟罐底水中的腐蚀行为。结果表明:增加H2S含量,可以促进碳钢表面的析氢反应,从而增大了碳钢的腐蚀速率;碳钢表面形成由四方硫化亚铁组成的疏松、多孔的腐蚀产物膜;碳钢先后在含H2S溶液、无H2S且含溶解氧的溶液中进行二次腐蚀后,其腐蚀产物分为两层,内层主要组成依然是四方硫化亚铁,外层为氧化产物,其中氧化产物的生成导致硫化亚铁膜的破裂与脱落;硫化亚铁膜的存在,对碳钢在含H2S溶液中的保护性大于其在含溶解氧溶液中的。
H2S腐蚀;碳钢;硫化亚铁;储罐罐底水
近年来,随着石油与天然气工业飞速发展,油罐底部的腐蚀已成为行业内最为严峻的问题之一。由于沉积盐水(含Cl-、Ca2+和Mg2+等)、溶解氧、硫酸盐还原菌、H2S和CO2等酸性介质以及沉积物等导致罐底腐蚀严重[1-2]。原油品质日益劣化,尤其是中东的原油,呈高酸、高硫、高含水量的变化趋势[3]。储罐一般采用耐蚀性不是特别好的碳钢和低合金钢[4],因此H2S的腐蚀日益突出。
目前,关于钢铁在H2S溶液中腐蚀行为的研究较多[5-9]。H2S会加速阳极的溶解与阴极的析氢反应,但在特定的环境中,H2S的存在还会抑制铁的腐蚀[5,10-11]。铁在含H2S的环境中产生的硫化产物膜主要有立方FeS、FeS2和FeS1-x等[12],其中FeS1-x保护性最差,甚至会提高腐蚀速率[13-15]。硫化亚铁在基体表面沉积,会导致腐蚀加速,同时发生严重的点蚀现象[16]。
本工作主要研究H2S含量对碳钢在模拟罐底水中腐蚀行为的影响,由于原油及其产品的不断消耗和储存及罐底沉积水的排出,导致油罐底部的腐蚀因素不断变换,因此分别在含H2S和溶解氧的环境中进行腐蚀模拟试验。
1 试验
1.1 材料及试样的制备
试验材料是Q235碳钢,其化学成分(质量分数)为:0.12%~0.2% C,0.3%~0.7% Mn,≤0.3% Si,≤0.045% P,≤0.045% S,余量Fe。腐蚀失重试样尺寸为40 mm×12 mm×3 mm。电化学试样(工作面积为1 cm2)与导线相连,镶嵌于环氧树脂中。在试验之前,所有试样表面使用SiC砂纸逐级抛光,然后用丙酮超声除油,再用乙醇和蒸馏水清洗,冷风吹干。
1.2 腐蚀溶液
选用分析纯试剂和蒸馏水配制模拟罐底水溶液,其化学组成(g/L)为:27.7 NaCl,0.2 NaHCO3,3.4 Na2SO4,1.1 CaCl2,2.4 MgCl2。这些电解质在海水,土壤和油罐沉积水中能产生最具腐蚀性的环境[17]。以此模拟罐底水溶液为基液,试验前,向基液中通入高纯氩气除氧8 h,再通入H2S气体配制成H2S质量浓度分别为100,200,350,500 mg/L的腐蚀溶液(分别标记为Ⅰ,Ⅱ,Ⅲ,Ⅳ)。H2S的质量浓度由碘滴定法重复三次确定。另外,向基液中通入空气8 h,将此溶液标记为Ⅴ。
1.3 电化学试验
电化学试验在上海辰华仪器有限公司生产的 CHI660D型电化学工作站上进行,试验采用三电极体系,辅助电极为表面积大于4 cm2的铂片,参比电极为饱和甘汞电极(SCE),工作电极为Q235碳钢试样。用恒温水浴控制试验溶液温度为30 ℃。动电位极化曲线测量是在电位扫描速率为0. 5 mV·s-1下进行,扫描范围为-0.30~0. 30 V (相对于开路电位)。所有的电位均相对于SCE。
1.4 腐蚀失重试验
腐蚀失重试验分一次腐蚀(一次浸泡)和二次腐蚀(分两次浸泡)。
一次腐蚀:腐蚀失重试样分别在H2S质量浓度为100,200,350,500 mg/L的Ⅰ,Ⅱ,Ⅲ,Ⅳ腐蚀溶液中浸泡48 h,在不含H2S但含溶解氧的Ⅴ腐蚀溶液中浸泡96 h。
二次腐蚀:(1) 腐蚀失重试样先在Ⅱ腐蚀溶液中浸泡48 h,然后再次在该腐蚀溶液中浸泡48 h;(2) 腐蚀失重试样先在Ⅱ腐蚀溶液中浸泡48 h,然后在Ⅴ腐蚀溶液中浸泡96 h。
在同一试验条件下用三个平行试样,试验温度均为30 ℃。参考GB/T 16545-1996标准,用化学清除法去除试样表面的腐蚀产物,根据腐蚀前后质量差计算平均腐蚀速率。采用DX-1000型X线衍射仪(XRD,铜靶Kα线)和VEGAⅡXMH型扫描电子显微镜(SEM)分别对试验的腐蚀产物成分与表面形貌进行分析。
2 结果与讨论
2.1 电化学试验
由图1可以看出,随着腐蚀溶液中H2S含量的增加,阴极极化曲线中碳钢的电流密度不断增加,而阳极极化曲线中碳钢的电流密度非常接近。
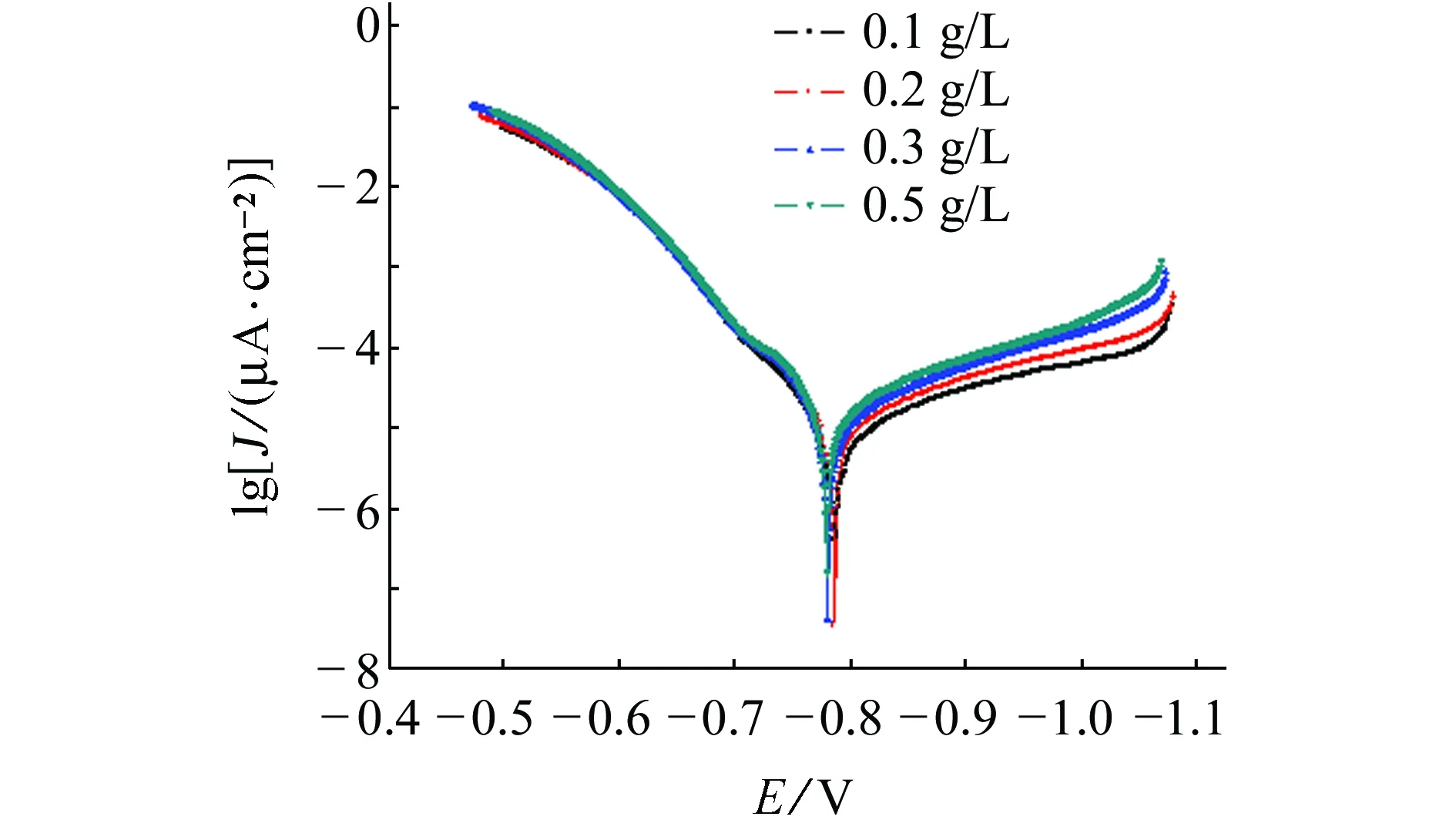
图1 碳钢在H2S含量不同的腐蚀溶液中的 动电位极化曲线Fig. 1 Potentiodynamic polarization curves of carbon steel in solutions with different concentrations of H2S
表1为通过极化曲线得到的腐蚀电化学参数。由表1可以看出,随着溶液中H2S含量的增加,碳钢的自腐蚀电流密度Jcorr不断增加,同时极化电阻Rp依次降低,说明腐蚀速率不断增大。所有的阳极塔菲尔斜率ba非常接近,而阴极塔菲尔斜率bc都比阳极塔菲尔斜率大。以上试验结果表明,H2S含量的增加对阳极反应影响很小,但是会促进碳钢表面上的阴极析氢过程,从而使腐蚀电位正移,但变化不断,与文献[7]的结果基本一致。阴极的还原过程较复杂,其中S2-离子对阴极塔菲尔斜率有很大的影响[7,18-19]。
2.2 腐蚀失重试验
2.2.1 腐蚀速率
由图2可知,随着H2S含量的增加,腐蚀速率不断增大。这与动电位极化曲线测量的结果是一致的。
根据表2可知,硫化亚铁膜使碳钢在Ⅱ溶液中的腐蚀速率下降30.76%,而硫化亚铁膜使碳钢在Ⅴ溶液中的腐蚀速率下降了11.86%。
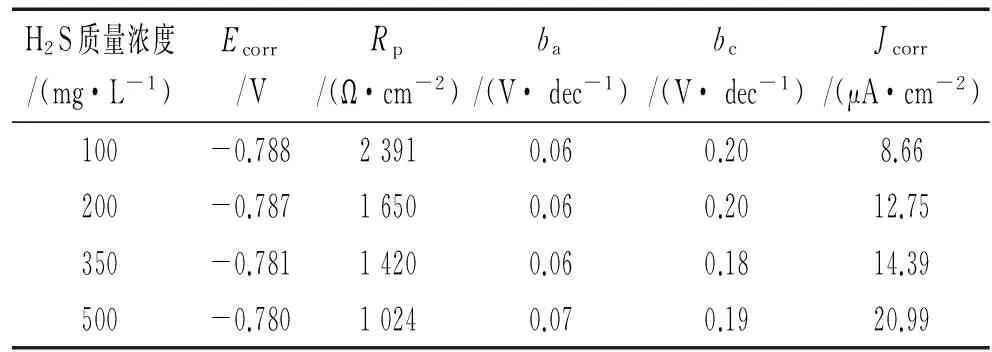
表1 碳钢在H2S含量不同的腐蚀溶液中 动电位极化曲线的拟合参数Tab. 1 Fitted parameters from potentiodynamic polarization curves for carbon steel in solutions with different concentrations of H2S
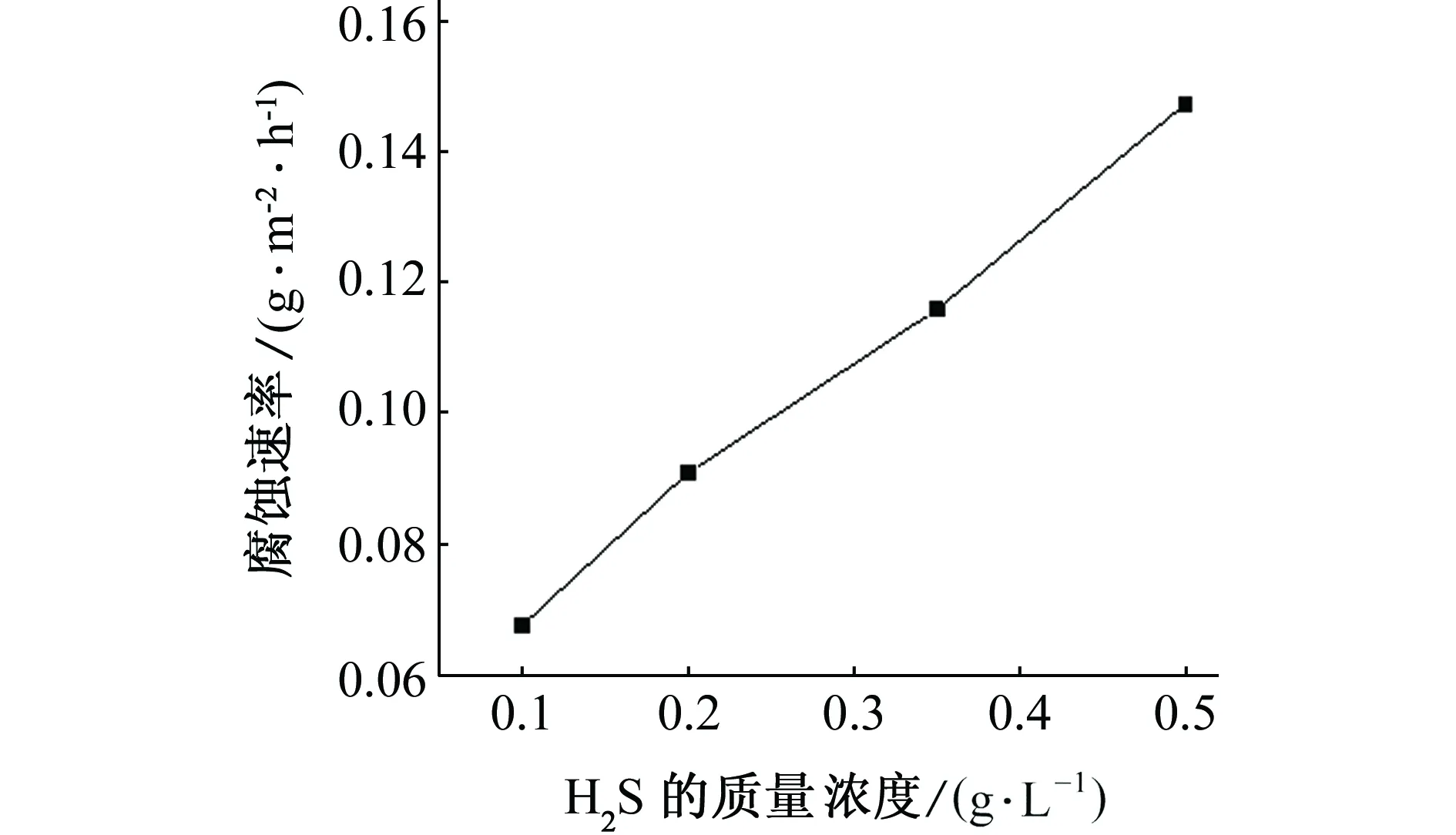
图2 碳钢的腐蚀速率与H2S含量的关系Fig. 2 Corrosion rate of carbon steel vs H2S concentration表2 硫化亚铁膜对不同腐蚀条件下 碳钢腐蚀速率的影响Tab. 2 Influence of ferrous sulfide film on the corrosion rate of carbon steel in different corrosion conditions
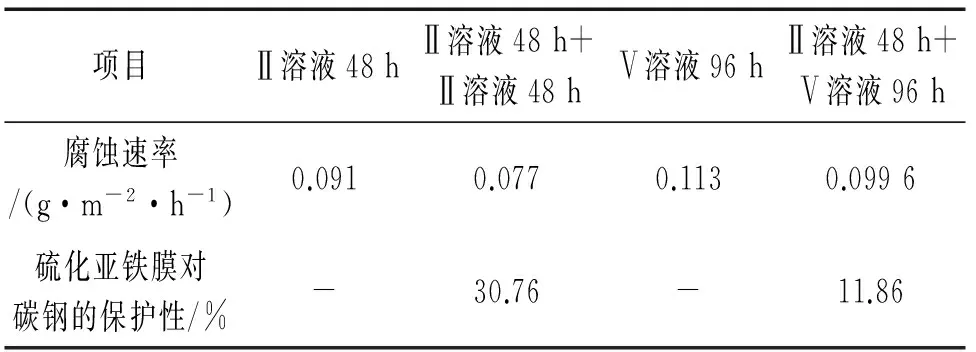
项目Ⅱ溶液48hⅡ溶液48h+Ⅱ溶液48hⅤ溶液96hⅡ溶液48h+Ⅴ溶液96h腐蚀速率/(g·m-2·h-1)0.0910.0770.1130.0996硫化亚铁膜对碳钢的保护性/%-30.76-11.86
2.2.2 腐蚀产物及形貌分析
由图3可以看出,碳钢在Ⅱ溶液中一次腐蚀的腐蚀产物和依次在Ⅱ溶液与Ⅴ溶液中二次腐蚀后内层主要腐蚀产物都主要为四方硫化亚铁(mackinawite),其化学式为FeS1-x(x=0.054~0.061)[15],它是硫化铁产物中的一个普遍类型[7,13-14],同时也是其他硫化产物的前期形态[20-21]。在Ⅴ溶液中碳钢主要发生吸氧腐蚀,腐蚀产物主要为γ-FeOOH和α-FeOOH等氧化产物。结果表明,碳钢在含H2S溶液中腐蚀时,腐蚀产物为硫化物,然后在不含H2S但含溶解氧的Ⅴ溶液中进行二次腐蚀时,产生的氧化产物积累在外层或者脱落。
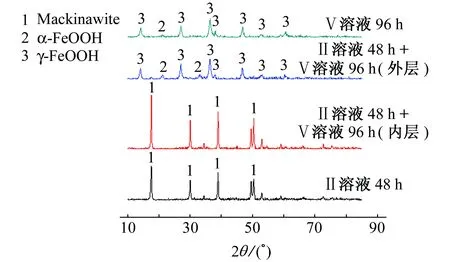
图3 碳钢在不同溶液中表面腐蚀产物的XRD谱Fig. 3 XRD patterns of corrosion products on the surface of carbon steel in different solutions
由图4(a)可以看到,碳钢在II溶液中腐蚀48 h后形成了疏松多孔、有裂纹、不均匀的腐蚀产物膜。这种膜很难对碳钢腐蚀具有保护作用。腐蚀初期,在非常短的时间里,铁与H2S通过化学反应形成离散的FeS1-x产物,阻碍离子的扩散,导致腐蚀速率下降。硫化物膜在基体表面有一个极限厚度[8,22],随着腐蚀产物不断生长,当硫化物膜超过临界值后,会发生破裂、脱落,腐蚀速率有所增大,而后腐蚀产物膜再生长和修复[23],最终形成的腐蚀产物疏松多孔,有裂纹、不均匀的腐蚀产物膜。文献[13-15]指出,Mackinawite产物膜在一定条件下不仅不具备保护作用,甚至会导致腐蚀速率的增大。根据表2可知,虽然形成的腐蚀产物膜具有很大的缺陷,但是腐蚀产物降低碳钢表面的阳极活性区域面积,最终腐蚀速率下降了30.76%。而溶液中的HS-和Cl-易渗透入包覆阳极活性点的闭塞环境,会导致点蚀的发生[10]。
由图4(b)可以看到,碳钢在Ⅱ溶液中腐蚀48 h+Ⅴ溶液中腐蚀96 h后,其内层腐蚀产物膜出现凹坑。碳钢预腐蚀产生的硫化亚铁膜疏松多孔,为铁离子与水中的溶解氧提供了扩散通道,得到的氧化产物也为疏松多孔结构[24],且不断地产生与脱落,导致原有的硫化物膜发生破裂而无法修复,因此出现了凹坑。文献[16]指出,在酸性(CO2/H2S)环境中,沉积在基体表面的Mackinawite产物膜具有电子导电性,会导致腐蚀速率的增大,同时发生严重的点蚀现象。根据表2可知,在Ⅴ溶液中,碳钢表面硫化亚铁膜的存在并没有增大腐蚀速率。这可能是因为溶液中存在氧气,导致硫化亚铁表面被氧化,使其活性下降[16],同时预腐蚀时形成的硫化亚铁膜比沉积的Mackinawite产物膜与基体的接触更紧密,阻碍离子的扩散。另外,由于疏松的氧化产物导致预腐蚀时形成的硫化亚铁膜发生破裂,增加阳极活性区域,可能诱发局部腐蚀,因此相对于预腐蚀碳钢在含H2S溶液的腐蚀,其腐蚀速率仅下降了11.86%。

(a) Ⅱ溶液48 h

(b) Ⅱ溶液48 h+Ⅴ溶液96 h图4 碳钢在不同条件下腐蚀后的表面SEM形貌Fig. 4 SEM morphology of surface of carbon steel corroded in different conditions
3 结论
(1) 罐底模拟溶液中H2S含量的增加,促进了碳钢的阴极析氢反应,同时增加了碳钢的腐蚀速率。
(2) 碳钢在含H2S腐蚀溶液中的腐蚀产物为疏松多孔的四方硫化亚铁(Mackinawite)。经含H2S腐蚀溶液预腐蚀的碳钢在含溶解氧的模拟溶液中在主要发生的是吸氧腐蚀,内层主要腐蚀产物依然为Mackinawite,外层为疏松且易于脱落的氧化产物。
(3) 硫化亚铁膜在含H2S腐蚀溶液中对碳钢的保护性大于在含溶解氧腐蚀溶液中的。虽然硫化亚铁膜的存在,使得碳钢分别在含H2S和含溶解氧腐蚀溶液中的腐蚀速率有所下降,但都发生了局部腐蚀。
[1] FOROULIS Z A. Causes,mechanisms and prevention of internal corrosion in storage tanks for crude oil and distillates[J]. Anti-Corrosion Methods and Materials,1981,28(9):4-9.
[2] GROYSMAN A. Corrosion in systems for storage and transportation of petroleum products and biofuels:identification,monitoring and solutions[M]. [S.l.]:Springer Science & Business Media,2014:65-107.
[3] 董娇,李青蕊. 储罐底板的腐蚀与防护[J]. 广东化工,2013,40:129-130.
[4] 王菁辉. 钢质石油储罐防腐蚀工程[M]. 北京:中国石化出版社,2011:6-9.
[5] MA H,CHENG X,LI G,et al. The influence of hydrogen sulfide on corrosion of iron under different conditions[J]. Corrosion Science,2000,42(10):1669-1683.
[6] ARZOLA S,GENESCJ. The effect of H2S concentration on the corrosion behavior of API 5L X-70 steel[J]. Journal of Solid State Electrochemistry,2005,9(4):197-200.
[7] TANG J W,SHAO Y W,GUO J B,et al. The effect of H2S concentration on the corrosion behavior of carbon steel at 90 ℃[J]. Corrosion Science,2010,52(6):2050-2058.
[8] TAHERI H,KAKOOEI S,ISMAIL M C,et al. The effect of H2S concentration and temperature on corrosion behavior of pipeline steel A516-Gr70[J]. Caspian Journal of Applied Sciences Research,2012,1(5):41-47.
[9] QI Y,LUO H,ZHENG S,et al. Effect of temperature on the corrosion behavior of carbon steel in hydrogen sulphide environments[J]. International Journal of Electrochemical Science,2014,9(4):2101-2112.
[10] LI D,ZHANG L,YANG J,et al. Effect of H2S concentration on the corrosion behavior of pipeline steel under the coexistence of H2S and CO2[J]. International Journal of Minerals,Metallurgy,and Materials,2014,21(4):388-394.
[11] ABELEV E,RAMANARAYANAN T A,BERNASEK S L. Iron corrosion in CO2/brine at low H2S concentrations:an electrochemical and surface science study[J]. Journal of the Electrochemical Society,2009,156(9):331-339.
[12] SMITH S N,JOOSTEN M W. Corrosion of carbon steel by H2S in CO2containing oilfield environments[C]//Corrosion 2006. [S.l.]:NACE International,2006.
[13] MORRIS D R,SAMPALEANU L P,VEYSEY D N. The corrosion of steel by aqueous solutions of hydrogen sulfide[J]. Journal of the Electrochemical Society,1980,127(6):1228-1235.
[14] MEYER F H,RIGGS O L,MCGLASSON R L,et al. Corrosion products of mild steel in hydrogen sulfide environments[J]. Corrosion,1958,14(2):69-75.
[15] SMITH J S,MILLER J D A. Nature of sulphides and their corrosive effect on ferrous metals:a review[J]. British Corrosion Journal,1975,10(3):136-143.
[16] MENENDEZ C M,JOVANCICEVIC V,RAMACHANDRAN S,et al. Assessment of corrosion under iron sulfide deposits and CO2/H2S conditions[J]. Corrosion,2012,69(2):145-156.
[17] LYUBLINSKI E,KUZNETSOV Y I,SCHULTZ M,et al. Corrosion protection of tank product side bottoms[J]. International Journal of Corrosion and Scale Inhibition,2013,2(2):150-161.
[18] VELOZ M A,GONZALEZ I. Electrochemical study of carbon steel corrosion in buffered acetic acid solutions with chlorides and H2S[J]. Electrochimica Acta,2002,48(2):135-144.
[19] FATAH M C,ISMAIL M C,ARI-WAHJOEDI B,et al. Effects of sulphide ion on the corrosion behaviour of X52 steel in a carbon dioxide environment at temperature 40 ℃[J]. Materials Chemistry and Physics,2011,127(1):347-352.
[20] SHOESMITH D W,TAYLOR P,BAILEY M G,et al. The formation of ferrous monosulfide polymorphs during the corrosion of iron by aqueous hydrogen sulfide at 21 ℃[J]. Journal of the Electrochemical Society,1980,127(5):1007-1015.
[22] VEDAGE H,RAMANARAYANAN T A,MUMFORD J D,et al. Electrochemical growth of iron sulfide films in H2S-saturated chloride media[J]. Corrosion,1993,49(2):114-121.
[23] 杨怀玉,陈家坚. H2S水溶液中的腐蚀与缓蚀作用机理的研究:Ⅰ. 酸性H2S溶液中碳钢的腐蚀行为及硫化物膜的生长[J]. 中国腐蚀与防护学报,2000,20(1):1-7.
[24] 邹妍. 海水中锈层覆盖碳钢的腐蚀电化学行为研究[D]. 青岛:中国海洋大学,2010:15-17.
Effects of H2S on Corrosion Behavior of Carbon Steel in Simulated Oil Storage Tank Bottom Solution
LI Guang-zhou1, CHEN Lin-hua2, ZHANG Yao1, CHANG Hui1, DING Yi1, MENG Xian-hu3
(1. College of Material Science and Engineering, Nanjing University of Technology, Nanjing 210009, China;2. BASF-YPC Co., Ltd., Nanjing 210048, China; 3. Jiangsu Zhongxin Pipe Sci-tec Co., Ltd., Nanjing 210041, China)
The corrosion behavior of Q235 carbon steel in simulated solution containing H2S was investigated using the methods of weight loss, electrochemical measurement, scanning electron microscopy (SEM) and X-ray diffraction (XRD). The results show that the increase of H2S concentration promoted hydrogen evolution reaction, so the corrosion rate of carbon steel increased. The loose and porous corrosion products formed on the steel surface were composed of mackinawite. The corrosion products of carbon steel, which was corroded in sequence in the solution containing H2S and in the solution containing dissolved oxygen but without H2S, were divided into two layers. The inner layer was still mainly composed of mackinawite and the outer layer was oxidation product. The oxidation product led to the rupture and shedding of ferrous sulfide film. The existence of ferrous sulfide film provided more protection to carbon steel in the solution containing H2S than in the solution containing oxygen.
hydrogen sulfide corrosion; carbon steel; ferrous sulfide; oil storage tank bottom solution
10.11973/fsyfh-201702009
2015-10-08
丁 毅(1965-),副教授,博士,从事金属腐蚀与防护研究,13814072311,dingyi1107@163.com
TG172
A
1005-748X(2017)02-0129-05
