胸部放疗过程中胸肌体积的变化及其临床意义
2017-05-09王骁踊张俊红周福祥谢丛华
程 静 陈 纪 王骁踊 张俊红 周福祥 谢丛华
·临床研究·
胸部放疗过程中胸肌体积的变化及其临床意义
程 静 陈 纪 王骁踊 张俊红 周福祥 谢丛华
目的 通过营养相关实验室检查与胸部肌肉的变化分析肺癌患者在放疗前、中、后的营养状况,指导临床对患者的营养状况及时评估并给予针对性营养支持。方法 选取于2012年3月—2015年11月到我科行胸部放疗的肺癌患者160例,对放疗不同时间相关实验室检查指标数据进行营养评估,并选取放疗前后有完整CT资料的14例患者,在CT图像的基础上对其胸部肌肉体积变化进行统计与分析。结果 放疗中及放疗结束后血红蛋白、淋巴细胞、总蛋白及白蛋白均有不同程度的下降(P<0.05),与放疗次数和剂量呈正相关,其中血红蛋白和淋巴细胞的变化更为明显,这些指标在放疗5周后才逐渐开始恢复;胸部肌肉体积也有相同的变化趋势(P>0.05)。结论 放疗期间患者易出现营养不良。患者的能量和蛋白质摄入均低于机体需要量,应当关注肺癌患者在放疗过程的营养状况,做好及时评估、给予针对性营养支持工作,提高患者的治疗耐受和生活质量。
肺癌;放疗;胸部肌肉;营养
营养不良是恶性肿瘤患者常见而且难以处理的难题,大量研究表明,恶性肿瘤患者营养不足发生率高达40%~80%[1]。肺癌患者接受不同治疗方法以及处于不同阶段时,营养不良的发生率高达45%~69%[2]。营养不良不仅降低患者免疫能力,影响患者的治疗依从性,也会改变疾病的治疗疗效,增加发病率、死亡率等,大约20%~50%的肿瘤患者死于营养不良或恶液质,非肿瘤本身[3]。放射治疗(RT)是肺癌综合治疗的重要手段之一,除了杀灭生长旺盛的肿瘤细胞外,其对正常组织的损伤也很明显,如显著急性毒性反应,包括食管炎、吞咽困难、食欲减退及疲劳;并且和正常健康人相比,多数肿瘤患者本身已存在营养状况不佳的情况,因此放疗也是患者营养风险增加、营养不足加重的重要因素[4-6]。因而本研究动态监测放疗过程中肺癌患者的营养状况,从血液学营养相关指标及胸部肌肉组织体积变化情况两方面综合评估放疗患者的营养状况,以期早期予以干预,确保患者营养供给充足以及改善患者的预后。
1 资料与方法
1.1 病人选择
收集本院放化疗科于2012年3月—2015年11月收治并经临床病理确认肺癌患者160例;年龄18~75岁;KPS评分大于70分;无其他恶性肿瘤和精神病病史;患者有完整的病例资料及随访资料;治疗依从性较好。有结缔组织疾病、糖尿病、胸部再程放疗等可能会导致肌肉萎缩和影响放疗诱发肌肉萎缩的情况排除在外[7-8],并排除心、肺、肝、肾功能明显异常。其中14例有完整的放疗前、放疗中及放疗5周后CT资料,用于统计以胸部肌肉为指标时的营养变化。所有的160例患者在治疗前有完整的病史,均经签署放疗知情同意书;全面的体格检查、血液生化检验,并排除心、肺、肝、肾功能明显异常。所有病人经AJCC第七版进行分期。
1.2 收集参数
1.2.1 临床参数 包括性别、年龄、肺癌分型分期、有无合并症,有无同步放化疗等。
1.2.2 放疗物理参数 包括平均肺受量、左右肺及全肺V5~V50(接受5、10、20、30、50 Gy照射肺体积占总肺体积的百分比)、脊髓最大受量。
1.3 治疗方法
1.3.1 放疗 采用体模固定后CT模拟机下扫描定位,以统一的标准勾画放射治疗靶区;放射治疗皆使用15 MV直线加速器实施三维适形放射治疗;在肺窗下勾画大体肿瘤体积(GTV),肺部病变部分按鳞癌外放6 mm、腺癌外放8 mm的标准生成临床靶区体积(CTV),纵隔如有淋巴结转移,则根据转移淋巴结的部分进行照射;根据呼吸程度及摆位误差外放1 cm,左右、上下、前后方向各自确定范围。方案为200 ccy/(次/d),每周5天,总剂量范围为40~68 Gy/20-34F。
1.3.2 化疗 同步放化疗共50例,其中47例以铂类为基础的方案联合化疗1~6个周期,3例联合紫杉醇同步化疗3周期。
1.4 评价参数
1.4.1 血液指标 分别收集患者于放射治疗前、放射治疗中(完成2/3×放疗计划±4 Gy)、放射治疗结束当天以及放疗结束后5周的相关实验室指标:血清总白蛋白(g/L)、白蛋白(g/L)、总淋巴细胞计数(109/L)、血红蛋白(g/L)。
1.4.2 扫描参数 使用西门子64排CT机进行螺旋扫描;扫描条件为120 kV、125 mAs,使用标准体部重建为层厚为5 mm的薄层Volume数据。
1.4.3 胸肌体积勾画 肌肉体积的勾画在已有的胸部CT扫描图像上进行。上下界:以第二胸肋关节最明显处以及第八胸肋关节最明显处为胸肌上下界;内外界以及前后界:均以胸大肌、胸小肌固定范围和方向为界。为了计算方便,所有的患者都在统一的纵隔窗(窗宽350,窗位0)识别并手动勾画每个轴向图像上胸肌的轮廓,由TPS计划系统自动计算其体积。在勾画过程中,以胸大肌、胸小肌为一个整体进行勾画,勾画过程中如遇到肌肉与肋软骨、肋间肌区分困难时,参考《影像解剖学》(丹麦P Fleckenstein著)或者以胸廓走形进行区分。
1.5 统计学处理
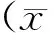
2 结果
2.1 病人的基本特征
有完整的放疗前、放疗中及放疗5周后CT资料的14例患者基本资料见表1。其中男女比例为5∶2;主要以Ⅲ~Ⅳ期NSCLC为主。患者中4例有高血压。所有患者均行右肺门/纵隔放疗。
2.2 14例患者放疗相关物理学指数
左肺、右肺及全肺放疗物理指数V5、V10、V20、V30、V50均控制在标准限量以内。左、右及全肺的平均射线受量分别是(631.67±269.74)cGy、(2 648.08±417.61)cGy及(1618.64±163.38)cGy。脊髓最大受量是(4231.58±551.30)cGy。所有参数均在规定范围内(表2)。

表1 肺癌患者的基本资料(n=14)
2.3 治疗前后各项血液检查情况
在放疗过程中总蛋白、白蛋白、血红蛋白及淋巴细胞均有不同程度的下降,具有统计学差异(P<0.05),其中以血红蛋白及淋巴细胞的变化最明显(表3,图1)。
2.4 放疗对不同年龄患者营养状况的影响
将所有患者分为三个组:青年组(≤45岁)、中年组(45~65岁)以及老年组(≥65岁)。分析发现,放疗对老年组的营养状况的影响明显大于青年组和中年组,尤其是血红蛋白和总蛋白,放疗对淋巴细胞的影响三组类似(P>0.05)。
2.5 不同治疗方式对实验室检查的影响
在160例患者中,单纯放疗组110例,同步放化疗组50例。分析发现单纯放疗组与同步放化疗组治疗前后血清学营养相关指标均有所下降,血红蛋白及淋巴细胞的变化最为显著,并且同步放化疗组放疗期间各指标变化更为明显(表4,图3)。
2.6 放疗期间胸部肌肉组织体积变化
对14例CT资料完整患者的肌肉组织进行分析发现,与放疗前相比,放疗中、放疗后肌肉体积均减少,放疗过程中变化更明显。单纯放疗组与同步放化疗组患者肌肉体积均减少,且同步放化疗组减少稍明显(表5,图4-5)。

表2 放疗相关物理参数±s)

表3 各指标不同时间数值情况±s)

图1 放疗期间营养相关指标变化情况Figure 1 The change of nutrition related indicators during radiotherapyNote:* P<0.05;**P<0.01;***P<0.005.

图2 放疗对不同年龄段营养状况的影响Figure 2 Radiation on the nutritional status of patients with different ages
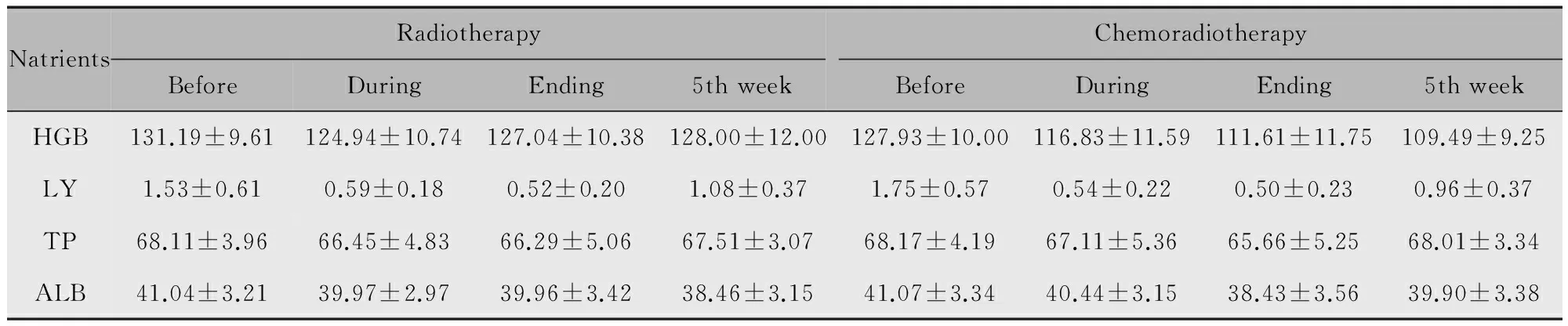
NatrientsRadiotherapyBeforeDuringEnding5thweekChemoradiotherapyBeforeDuringEnding5thweekHGB131.19±9.61124.94±10.74127.04±10.38128.00±12.00127.93±10.00116.83±11.59111.61±11.75109.49±9.25LY1.53±0.610.59±0.180.52±0.201.08±0.371.75±0.570.54±0.220.50±0.230.96±0.37TP68.11±3.9666.45±4.8366.29±5.0667.51±3.0768.17±4.1967.11±5.3665.66±5.2568.01±3.34ALB41.04±3.2139.97±2.9739.96±3.4238.46±3.1541.07±3.3440.44±3.1538.43±3.5639.90±3.38

图3 不同治疗方式时各指标趋势Figure 3 The trend of each index of different treatments

ChestwallBeforeRTDuringRT5thweekafterRTRight161.75±54.41149.19±49.67144.62±46.94Left144.74±49.06134.39±44.94126.78±43.27Whole153.25±51.56141.79±47.09135.70±45.2215

图4 不同时间点肌肉体积变化 Figure 4 Changes in the volume of chest muscles at different time-point
2.7 不同时间点营养不良人数所占比例
以各血液学检查单独为营养不良评估指标分析不同时间点营养不良发生率,具体结果见表6。

表6 不同营养评价指标评价营养不良发生率
Note:QTY:quantity;PP:percent point.
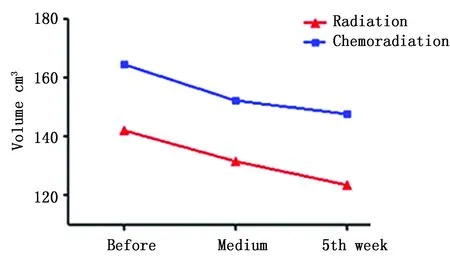
图5 不同治疗方式对肌肉体积的影响Figure 5 Effects of different treatment methods on muscles
3 讨论
肺癌是癌症中发病率较高和最主要的死亡原因,严重威胁人类的健康和生命[9-10]。营养不良是包括肺癌在内的肿瘤患者不良预后因素[12-14]。对于肺癌来讲,营养治疗可以明显改善化疗和/或放疗肺癌患者的营养状况[15-16]。不幸的是,营养不良通常无法识别,体重减少是营养状态下降的一个早期信号。如果患者的体重在1个月内下降超过5%,或在1周内下降超过2%,是营养不良的可靠指标[11]。然而已证明依靠病人主观叙述和目前的体重下降来评估营养不良是不充分的。事实上,单纯体重改变并不能证明重要的疾病或与治疗相关的热量摄入和代谢的变化[17]。因此本研究从目前比较常见的血液相关营养指标和身体组分的变化来评估营养状态。
实验室检测是传统的营养评价指标之一。本研究通过对放疗过程中160例肺癌患者营养相关指标动态监测发现,血红蛋白、淋巴细胞、总蛋白及白蛋白均有不同程度的下降,与放疗次数和剂量呈正相关,其中血红蛋白和淋巴细胞的变化更为明显,说明血红蛋白和淋巴细胞对射线的影响较蛋白敏感。放疗反应一般会从治疗的2~3周开始,在完成计划的2/3时处于高峰阶段,持续到放疗结束后的2~3周[18]。本研究分析发现,在放疗前2/3阶段放疗患者的营养比放疗后1/3时期下降更快,并且持续到放疗结束后5周,这与放疗反应发生的时间相一致,这可以由于放疗引起食管黏膜受损引起的放射性食管炎、吞咽困难、胃胀不适等消化道反应等造成食欲下降、进食减少、能量消耗增加以及免疫力下降有关。放疗后某些神经功能的损伤也影响患者的进食,如迷走神经[15]。并且分层分析发现,放疗患者的营养状况还与年龄和性别有关,即:年龄越大,放疗对营养状况的影响越大;相比于男性患者,女性患者的营养更容易受到放疗的影响。
以单独血液学检查为营养不良评估指标分析不同时间点营养不良发生率时分析,随着放疗次数的增加,血红蛋白值、总蛋白、淋巴细胞低于正常值下限的患者所占的比例逐渐增多,放疗结束5周后才开始减少,此时血红蛋白和淋巴细胞值低于正常范围下限的患者所占的比例仍高达41%。不同的营养评价指标得出的营养不良发生率存在一定差异,这可能是由于各营养评价指标分别反映机体各种不同的成分,不同疾病和不同个体在患病后机体各组织并非按比例消耗,而且各指标敏感性不同,所以出现个体监测结果的差异。但是对放疗整个过程中各指标评价营养不良的发生率说明放疗对肺癌患者的营养状况影响不仅发生于放疗中,甚至会持续到放疗后1个月,甚至更长时间。此外,与单纯放疗的方式相比,放化疗同步组营养相关指标数值下降更明显,对营养状况影响更大。化疗为全身治疗方式,与放疗发挥空间协作作用,但化疗可能会增加急性副作用的发生率,可能是放化疗同步治疗时营养不良更严重的一个原因。
影像学方法是评价肌肉含量的重要手段。目前应用较多的有双能X线吸收测定法(DXA)、CT、MRI等,通过评估肌肉截面积或体积进行评估[19-20]。与DXA相比,CT与MRI除了可以有选择性地对某一区域肌肉组织的维度进行测量之外,还可在肿瘤患者的诊治过程中获得,因此提供了在标准临床路径中评价身体组分的机会,便于指导合适的支持治疗来改善临床结局。目前已经有大量实验证明通过CT测得肌肉含量可以作为评估全身营养状态的一种有效方式[20-21],应用较多的是通过腹部L3水平的面积进行评估,而通过胸部肌肉的测量评估营养状况应用较少。在此基础上,本文通过对CT资料回顾性分析发现,放疗过程中随着照射次数的增加,患者胸部肌肉体积呈下降趋势,虽然无统计学差异,但从趋势上看直接照射侧胸部肌肉体积下降更明显,可能是由于射线损伤一部分肌肉细胞,造成细胞修复困难。除此之外还有多种因素可能会对肌肉体积造成影响,如放疗、体位、年龄、运动等,其中又以放射线和手动勾画为主要的影响因素。目前有研究[22]表明成人骨骼肌对电离辐射是抵抗的,射线引起的肌肉损伤属于晚期反应毒性,在放射治疗多年后或者大剂量长时间照射时才显现,因此认为常规放疗时可以忽略射线对肌肉组织本身的影响,近期内肌肉的变化主要来自营养状况的改变。结合患者实验室检查,患者各营养供给不足,造成肌肉体积合成较慢,从CT扫描上即表现为肌肉体积减少,这也说明肌肉体积的变化可以做为评估营养状况的一种补充。
综上所述,放疗对营养的影响是一个早期的、缓慢发展的、持续性的过程,放疗结束后这种影响仍然存在。因此,建议在治疗过程中注意观察由于放疗引起的不适,及时评估并适当给予患者一定的营养支持,尤其是女性和体质瘦弱患者,保证治疗期间患者营养摄入与消耗的动态平衡,提高患者的治疗耐受性和生活质量。而且淋巴细胞还是了解机体免疫功能的一个相关指标,其下降说明放化疗还对患者的免疫功能带来的影响,在治疗过程也应当给予重视。
本研究也有自身存在的不足之处。本文在临床资料收集中存在一定程度的数量缺失,而且随访时间较短,只观察到放疗结束一个月后,病例数也较少,再加上一些其他客观存在的不可控制因素,使得各指标变化趋势不明显,并导致分析结果存在一定偏差。而且本文研究对象是肺癌患者,而不是正常人群,因而影响肌肉密度的因素过多,可能会部分掩盖肌肉密度和放疗的关系。此外本研究是在CT图像的基础上手动勾画肌肉轮廓,样本量也较少,因此可能在计算结果上存在一定偏差,因此需要在后期的工作中加大样本量、完善勾画标准及计算软件的使用,从而使得分析结果更好地指导临床工作。
1 Hopkinson JB.Nutritional support of the elderly cancer patient:the role of the nurse[J].Nutrition,2015,31(4):598-602.
2 Uster A,Ruefenacht U,Ruehlin M,et al.Influence of a nutritional intervention on dietary intake and quality of life in cancer patients:a randomized controlled trial[J].Nutrition,2013,29(11/12):1342-1349.
3 胡雁,陆箴琦.实用肿瘤护理[M].第2版.上海:上海科学技术出版社,2013:10-25.
4 Merlano MC,Monteverde M,Colantonio I,et al.Impact of age on acute toxicity induced by bio-or chemo-radiotherapy in patients with head and neck cancer[J].Oral Oncol,2012,48(10):1051-1057.
5 Sheth CH,Sharp S,Walters ER.Enteral feeding in head and neck cancer patients at a UK cancer centre[J].J Hum Nutr Diet,2013,26(5):421-428.
6 Schwegler I,von Holzen A,Gutzwiller JP,et al.Nutritional risk is a clinical predictor of postoperative mortality and morbidity in surgery for colorectal cancer[J].Br J Surg,2010,97(1):92-97.
7 Cuccia G,Shelley OP,d′Alcontres FS,et al.Evidence of significant sternocleidomastoid atrophy following modified radical neck dissection type III[J].Plast Reconstr Surg,2006,117(1):227-232.
8 Delanian S1,Lefaix JL.The radiation-induced fibroatrophic process:therapeutic perspective via the antioxidant pathway[J].Radiother Oncol,2004,73(2):119-131.
9 Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:Sources,methods and major patterns in GLOBOCAN,2012[J].Int J Cancer,2015,136(5):359-358.
10 Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
11 Beaver ME,Matheny KE,Roberts DB,et al.Predictors of weight loss during radiation therapy[J].Otolaryngol Head Neck Surg,2001,125(6):645-648.
12 Cacicedo J,Casquero F,Martinez-Indart L,et al.A prospective analysis of factors that influence weight loss in patients undergoing radiotherapy[J].Chin J Cancer,2014,33(4):204-210.
13 Yip C,Dinkel C,Mahajan A,et al.Imaging body composition in cancer patients:Visceral obesity,sarcopenia and sarcopenic obesity may impact on clinical outcome[J].Insights Imaging,2015,6(4):489-497.
14 Kazemi-Bajestani SM,Mazurak VC,Baracos V.Computed tomography-defined muscle and fat wasting are associated with cancer clinical outcomes[J].Semin Cell Dev Biol,2016,54:2-10.
16 Luo Y,Zhu J.Research progress of nutrition support for patients with lung cancer during chemotherapy[J].Zhongguo Fei Ai Za Zhi,2014,17(12):865-869.
17 Delmore G.Assessment of nutritional status in cancer patients:widely neglected?[J].Support Care Cancer,1997,5(5):376-380.
18 Donaldson SS,Lenon RA.Alterations of nutritional status:impact of chemotherapy and radiation therapy[J].Cancer,1979,43(5 Suppl):2036-2052.
19 Lim HK,Hong SH,Yoo HJ,et al.Visual MRI grading system to evaluate atrophy of the supraspinatus muscle[J].Korean J Radiol,2014,15(4):501-507.
20 Rier HN,Jager A,Sleijfer S,et al.The prevalence and prognostic value of low muscle mass in cancer patients:A review of the literature[J].Oncologist,2016,21(11):1396-1409.
21 Kilgour RD,Cardiff K,Rosenthall L,et al.Use of prediction equations to determine the accuracy of whole-body fat and fat-free mass and appendicular skeletal muscle mass measurements from a single abdominal image using computed tomography in advanced cancer patients[J].Appl Physiol Nutr Metab,2016,41(1):70-75.
22 Zhang LL,Mao YP,Zhou GQ,et al.The Evolution of and risk factors for neck muscle atrophy and weakness in nasopharyngeal carcinoma treated with intensity-modulated radiotherapy:a retrospective study in an endemic area[J].Medicine(Baltimore),2015,94(31):e1294.
23 Nichol AM,Smith SL,D′yachkova Y,et al.Quantification of masticatory muscle atrophy after high-dose radiotherapy[J].Int J Radiat Oncol Biol Phys,2003,56(4):1170-1179.
(收稿:2016-08-10)
Changes in the volume of chest muscles and its clinical significance in thoracic radiotherapy
CHENGJing,CHENJi,WANGXiaoyong,ZHANGJunhong,ZHOUFuxiang,XIEConghua
Department of Radiation and Medical Oncology,Zhongnan Hospital,Wuhan University,Wuhan 430071,China;Hubei Cancer Clinical Study Center,Hubei Key Laboratory of Tumor Biological Behaviors,Zhongnan Hospital,Wuhan University
Objective The objective of this study was to provide a way to assess the nutritional status of patients and to afford targeted nutritional supports during the radiotherapy on the basis of the laboratory parameters related to nutrition and chest muscle size in lung cancer patients at the different time.Methods The laboratory parameters were obtained in a cohort of 160 lung cancer patients who received thoracic radiotherapy in our department from March 2012 to November 2015.Fourteen patients who had complete chest CT scan images during radiotherapy were selected to evaluate chest muscles volume.The Chest muscles and its volume were delineated and calculated by CT scan images.Results The levels of(Hemoglobin)HGB,lymphocyte,total protein and albumin were decreased in different degrees during and after radiotherapy,which had the positive correlation with the number and doses of radiotherapy(P<0.05).The changes of hemoglobin and lymphocyte were more obviously among them;these indicators began to recover after 5 weeks of radiotherapy.Chest muscle volume was also the same as the trend of hematological indicators(P>0.05).Conclusion Cancer patients were prone to suffer from malnutrition during radiotherapy.The intake of energy and protein was less than the requirements.We should always take the nutritional status of patients into account and provide targeted nutritional support to improve treatment tolerance and quality of life of patients during radiotherapy.
Lung cancer;Radiotherapy;Chest muscles;Nutrition
国家自然科学基金(81572967)
武汉大学中南医院放化疗科;湖北省肿瘤学临床研究中心;湖北省肿瘤生物学行为重点实验室(武汉 430071)
程静,女,(1990-),硕士研究生,从事肺癌放射治疗的研究。
谢丛华,E-mail:chxie_65@whu.edu.cn
R734.2
A
10.11904/j.issn.1002-3070.2017.02.006
